Fallbeschreibung
Ein 83jähriger Mann kommt notfallmässig wegen Retrosternalschmerzen ins Spital. Im EKG zeigt sich eine ausgedehnte Vorderwandischämie, weshalb eine Akutkoronarangiographie durchgeführt wird, die eine koronare 3-Gefäss-Erkrankung zeigt (Abb. 1A, 1B). Der stenosierte RIVA als Culprit-Läsion wird dilatiert und gestentet. Die ACD ist hochgradig stenosiert, hat aber einen guten Fluss, und der RCX ist chronisch verschlossen, so dass man die anderen zwei Gefässe belässt. Einen Tag später tritt ein Lungenödem mit Hypoxämie, Tachypnoe und Orthopnoe auf, begleitet von dynamischen ST-Senkungen und einem Anstieg der Nekrosemarker. Man entschliesst sich zur Reintervention. Da der Patient schwer dyspnoeisch ist und nicht flach liegen kann, wird eine nichtinvasive Beatmung mit einem BiPAP/CPAP-Helm (StarMed, Mirandola, Italy) durchgeführt (Abb. 2). Die zweite Koronarangiographie (Abb. 3A, 3B) zeigt ein gutes Resultat im gestenteten RIVA sowie weiterhin die hochgradige ACD-Stenose. Nach Dilatation und Stenting der ACD stabilisiert sich der Patient sehr rasch und bleibt im Verlauf beschwerdefrei.
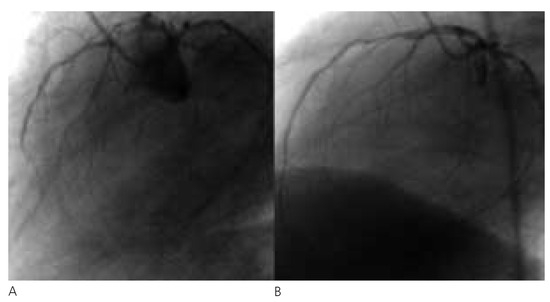
Abbildung 1.
Der Linksherzkatheter zeigt eine koronare 3-Ast-Erkrankung mit einem totalen RIVAVerschluss apikal und einem subtotalen Verschluss von RIVA-Mitte (A). Zudem zeigen sich ein chronisch verschlossener RCX und hochgradige ACD-Stenosen mit gutem Fluss. Die RIVA-Mitte wird dilatiert und gestentet (B).
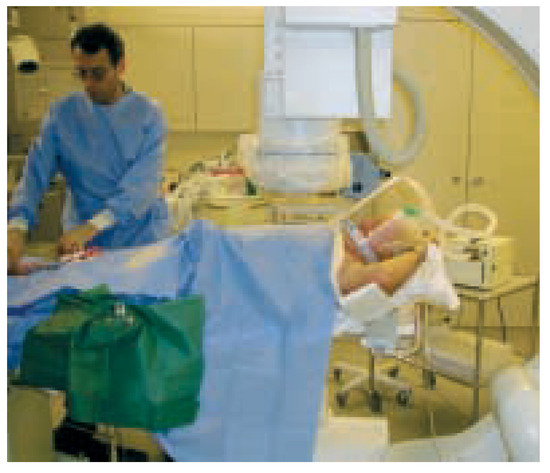
Abbildung 2.
Akutintervention im Lungenödem. Die nichtinvasive Ventilation erfolgt mit einem transportablen BiPAP-Gerät und mit Helm-Beatmung.
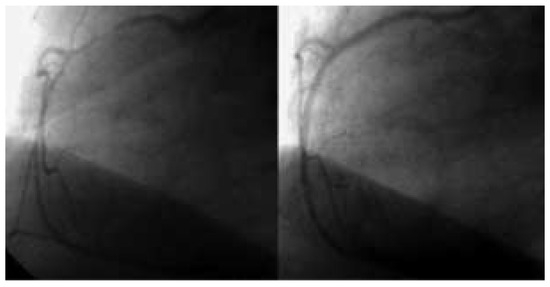
Abbildung 3.
Die RIVA-Mitte zeigt nach Stent-Einlage eine <50%-Stenose, der RCX ist proximal 100% verschlossen. Die ACD ist proximal und in der Mitte 75–95% stenosiert (A) und wird erfolgreich gestentet (B).
Diskussion
Gemäss Daten des Schweizerischen AMISHerzinfarktregisters werden Patienten mit akutem Koronarsyndrom, das von einem Lungenödem (Killip-Klasse III) begleitet ist, im Vergleich zu Patienten in den Killip-Klassen I und II, aber auch im Vergleich zu schokkierten Patienten (Killip-Klasse IV) signifikant seltener akut revaskularisiert [1]. Dies ist ein alarmierender Befund, da Patienten mit Lungenödem in der Akutsituation in der Regel eine sehr ausgedehnte Ischämie und damit ein hohes Risiko haben [2]. Mögliche Ursachen dafür dürften einerseits das Unvermögen des Patienten sein, flach zu liegen, und andererseits die Zurückhaltung des Kardiologen, für die Angiographie eine manchmal zeitraubende und zur weiteren Kreislaufinstabilität führende Intubation veranlassen zu müssen.
Entsprechend einer kürzlich erschienenen Metaanalyse, in welcher 23 Studien mit insgesamt 7739 Patienten mit akutem Myokardinfarkt berücksichtigt wurden, ist die primäre PTCA der intravenösen Thrombolyse bezüglich Mortalität und Reinfarktrate überlegen [3]. Dies gilt sowohl für den kurzzeitigen (4–6 Wochen) wie für den langzeitigen (6–18 Monate) Verlauf. Dass die Intervention auch für hämodynamisch stark beeinträchtigte Patienten günstig ist, zeigte neben Subgruppenanalysen obengenannter Studie auch der SHOCK-Trial, eine randomisierte Studie mit 302 Patienten im kardiogenen Schock, welche eine medikamentöse Therapie (Thrombolyse) oder eine Akutkoronarographie mit Revaskularisation erhielten. Die interventionell behandelten Patienten hatten bezüglich Mortalität nach 12 Monaten einen signifikanten Benefit [4,5].
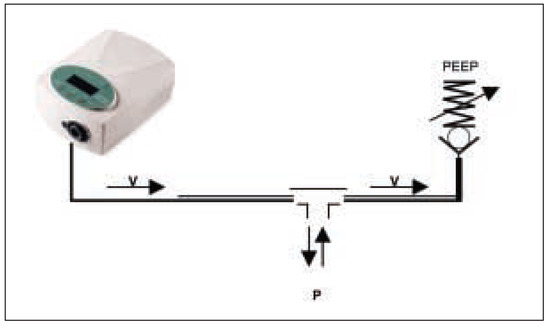
Abbildung 4.
Das BiPAP-Gerät gewährleistet während des ganzen Atemzyklus einen kontinuierlichen positiven Druck in den Atemwegen. Im Gerät befindet sich ein Druckregelventil, welches Veränderungen vom eingestellten Druck registriert und den Fluss (V) im Schlauchsystem so anpasst, dass der eingestellte Druck in Inund Expiration stabil bleibt. Das heisst, dass bei Inspiration durch den Patienten (P) der Flow erhöht werden muss. Unter Helmbeatmung erfolgt die Exspiration durch ein PEEP-Ventil (PEEP), das einen zu raschen Druckabfall verhindert.
Wie können wir die Revaskularisationsrate bei Patienten mit akutem Koronarsyndrom und Lungenödem erhöhen? Die Therapie des akuten Lungenödems mittels CPAP wurde schon 1938 beschrieben und wird seit Jahren bei Patienten im kardiogenen Lungenödem angewendet [6]. In zwei randomisierten Studien mit Patienten im kardiogenen Lungenödem konnte ein Benefit bezüglich Oxygenierung, Atemfrequenz, Intubationsrate und Hospitalisationsdauer für die mit CPAP behandelten Patienten gegenüber der Gruppe mit konventioneller Sauerstofftherapie gezeigt werden [7, 8]. Ein wichtiges Problem bei CPAP und nichtinvasiver Beatmung sind die dafür notwendigen eng sitzenden Beatmungsmasken, die Angstreaktionen auslösen können und wegen Druckstellen und Lecks nicht unproblematisch in der Anwendung sind. Die neuen Beatmungs-«Helme» (Abb. 2) erlauben eine unkomplizierte und für die meisten Patienten sehr gut verträgliche Anwendung eines kontinuierlichen positiven Luftwegsdruckes (CPAP). Die Funktionsweise einer CPAP-Beatmung ist im Schema dargestellt. Der intrathorakale Überdruck reduziert das beim Lungenödem erhöhte Lungenwasser, verbessert die Oxygenierung und reduziert die massiv erhöhte Atemarbeit, was eine wesentliche Kreislaufentlastung darstellt. Es entsteht somit ein Zeitfenster, in dem eine Koronarintervention früh und unter Vermeidung einer Intubation durchgeführt werden kann. Da bei CPAP-Beatmung der Patient im Gegensatz zum frisch Intubierten selber atmet, kann auf den schweren Intensivstation-Ventilator verzichtet werden, der den Patiententransport wesentlich kompliziert. Stattdessen verwenden wir bevorzugt einen kleinen Transport-Ventilator oder ein BiPAP-Gerät, wie es auch zur Heimventilation verwendet wird und welches innert Minuten auch im Katheterlabor verfügbar ist. Natürlich kann bei Versagen dieser Therapie jederzeit auf die Intubation und maschinelle Beatmung umgestiegen werden, was den Sauerstoffverbrauch und damit die kardiale Belastung zwar weiter senken kann, aber in der Regel mit einem erheblichen Zeitverlust und nicht selten mit einer deutlichen, sedationsbedingten Kreislaufinstabilität erkauft werden muss.
Zusammenfassend ermöglicht die Anwendung von Beatmungshelmen für die nichtinvasive Beatmung eine koronare Frühintervention auch bei Patienten im Lungenödem, womit die beste Behandlung des akuten Koronarsyndroms, nämlich die frühzeitige Gefässwiedereröffnung, auch dieser hoch gefährdeten Patientengruppe zugute kommt.
References
- Urban, P.; Erne, P.; Bertel, O.; et al. Prise en charge de l'infarctus compliqué du choc cardiogène: expérience du registre AMIS 1997—2002. Kardiovaskuläre Medizin 2003, 6 (Suppl. 5), 615. [Google Scholar]
- Eagle, K.A.; Gore, J.M.; Goldberg, R.J.; et al. Estimating risk of adverse outcomes in the “average patient” with acute coronary syndromes: comparing a risk model from a clinical trial to that developed in an unselected cohort of the GRACE registry. Eur. Heart J. 2001, 22 (suppl), 524. [Google Scholar]
- Keeley, E.C.; Boura, J.A.; Grines, C.L. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003, 361, 13–20. [Google Scholar] [CrossRef] [PubMed]
- Hochman, J.S.; Sleeper, L.A.; Webb, J.G.; et al. Early revascularisation in acute myocardial infarction complicated by cardiogenic shock. N. Engl. J. Med. 1999, 341, 625–634. [Google Scholar] [CrossRef] [PubMed]
- Hochman, J.S.; Sleeper, L.A.; White, H.D.; et al. One-year survival following early revascularisation for cardiogenic shock. JAMA 2001, 285, 190–192. [Google Scholar] [CrossRef] [PubMed]
- Barach, A.L.; Martin, J.; Eckmann, M. Positive pressure respiration and its application to the treatment of acute pulmonary edema. Ann. Intern. Med. 1938, 12, 754–795. [Google Scholar] [CrossRef]
- Bersten, A.D.; Holt, A.W.; Vedig, A.E.; et al. Treatment of severe cardiogenic pulmonary edema with continuous positive airway pressure delivered by face-mask. N. Engl. J. Med. 1991, 325, 1825–1830. [Google Scholar] [PubMed]
- Lin, M.; Yang, Y.F.; Chiang, H.T.; et al. Reappraisal of continuous positive airway pressure therapy in acute cardiogenic pulmonary edema: short-term and long-term follow-up. Chest 1995, 107, 229–231. [Google Scholar]
© 2004 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.