Abstract
Silent coronary artery disease is frequently encountered in diabetic patients. In general, the prevalence of silent myocardial ischaemia varies depending on the test used for patient screening and on the patient population screened. However, incidence rates up to 65% have been reported. The evidence is growing that silent coronary artery disease is not different from symptomatic disease with respect to prognosis. Asymptomatic high-risk diabetic patients therefore might benefit from routine screening for silent coronary artery disease. Although specific data regarding cardiac treatment of asymptomatic diabetic patients is lacking, patients with evidence of silent coronary artery disease probably should be treated irrespective of symptomatic status.
Zusammenfassung
Die stumme koronare Herzkrankheit und im besonderen die stumme Ischämie stellen bei Typ-2-Diabetikern ein häufiges Problem dar. Je nach Vorliegen zusätzlicher kardiovaskulärer Risikofaktoren werden in der Literatur Inzidenzen von bis zu 65% beschrieben. Die koronare Herzkrankheit hat prognostische Auswirkungen für die betroffenen Patienten unabhängig von deren Symptomatik. Ausgewählte asymptomatische diabetische Patienten können somit wahrscheinlich von einem routinemässig durchgeführten IschämieScreening profitieren. Obwohl dahingehende Studienergebnisse weitgehend fehlen, erscheint es sinnvoll, dass eine Ischämie oder koronare Herzkrankheit unabhängig vom symptomatischen Status der Patienten therapiert wird.
Key words: stumme Ischämie; Diabetes mellitus; koronare Herzkrankheit
Definition und Mechanismen der stummen Ischämie
Eine stumme Ischämie liegt dann vor, wenn eine Ischämie bei asymptomatischen Patienten objektiv nachgewiesen wird. Die Angina pectoris als Symptom stellt lediglich die Spitze des Eisbergs in der ischämischen Kaskade dar (Figure 1). Vorab findet sich bei einer hämodynamisch relevanten Koronarstenose eine Minderperfusion des Myokards. Diese bewirkt nach metabolischen Veränderungen eine Beeinträchtigung der diastolischen und systolischen Funktion. Im weiteren zeitlichen Ablauf können EKG-Veränderungen und zuletzt dann eine Angina-pectoris-Symptomatik auftreten. Die Suche der stummen Ischämie kann mittels verschiedener Tests erfolgen (Ergometrie, myokardiale Perfusionsszintigraphie [MPS], Stress-Echokardiographie, Magnetresonanz-Tomographie [MRI], Positron-Emissions-Tomographie [PET], Radionuklidventrikulographie [RNV]) (Figure 1).
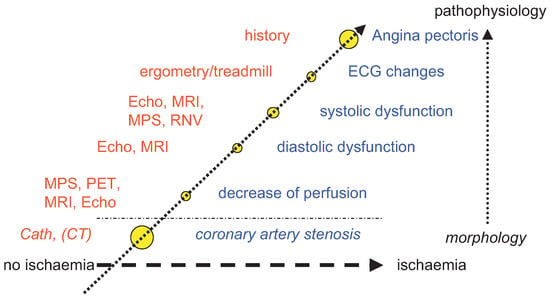
Figure 1.
Ischämische Kaskade.
Diverse Mechanismen werden als Ursache der stummen Ischämie diskutiert [1]. Einerseits zeigte sich, dass eine kurzdauernde, eine kleine Region betreffende Ischämie eher stumm, eine länger dauernde Ischämie einer grösseren Myokardregion eher symptomatisch verläuft. Patienten mit durchgemachtem Myokardinfarkt haben häufiger eine stumme Ischämie. Diabetiker und insbesondere Diabetiker mit einer autonomen kardialen Neuropathie stellen eine Risikopopulation für das Vorliegen einer stummen koronaren Herzkrankheit dar. Zudem wird postuliert, dass bei Patienten mit stummer Ischämie eine vermehrte Endorphin-Ausschüttung zur verminderten Wahrnehmung des Schmerzes beitragen und auch unterschiedliche Verarbeitungsprozesse zentral vorliegen könnten.
Prävalenz und Prognose der stummen koronaren Herzkrankheit
Die Prävalenz der stummen koronaren Herzkrankheit hängt stark von der Population ab, bei der man nach einer solchen sucht. Zudem spielt die Testmethode dabei auch eine wichtige Rolle (Holter-EKG, Ergometrie, bildgebende Ischämiediagnostik). Dementsprechend erstaunt es nicht, dass je nach Studie stark unterschiedliche Inzidenzraten der stummen Ischämie beschrieben wurden. So zeigten 2,5—11% nicht-diabetischer Patienten eine stumme Ischämie, bei «niedrig-Risiko»Diabetikern fanden sich deutlich höhere Werte (6,4—22%) [1]. Wackers et al. führten die erste grosse prospektive diagnostische Studie bei 1123 asymptomatischen Typ-2-Diabetikern durch, die noch keine vorbekannte koronare Herzkrankheit (KHK) hatten [2]. Die Patienten wurden in eine Gruppe randomisiert, die mittels MPS weiter abgeklärt wurden (n = 522) und in eine zweite Gruppe, bei denen lediglich Nachkontrollen erfolgten. Von den 522 Patienten, die mittels MPS weiter abgeklärt wurden, wiesen 22% ein abnormes MPS auf. Bei 88% der Patienten wurde eine stumme Ischämie, bei 8% eine Narbe plus Ischämie und bei 4% lediglich eine Narbe diagnostiziert. Interessanterweise waren weder die üblichen kardiovaskulären Risikofaktoren noch neuere Labormarker wie das hochsensitive CRP, Homocystein noch die Lipid-Subfraktionen hinsichtlich pathologischem MPS prädiktiv. Als einziger unabhängiger Prädiktor erwies sich die kardiale autonome Neuropathie.
Der Nachweis einer stummen koronaren Herzkrankheit hat nicht nur diagnostische, sondern auch prognostische Bedeutung. Wir untersuchten 1430 diabetische Patienten ohne vorbekannte KHK und verglichen die Prognose asymptomatischer Patienten mit der von Patienten, die sich mit Angina pectoris oder Dyspnoe präsentierten [3]. Wie Abbildung 2 zeigt, hatten Patienten mit einem normalen MPS eine relativ gute Prognose unabhängig vom symptomatischen Status. Patienten mit einem pathologischen MPS hingegen hatten in allen Patientengruppen eine signifikant schlechtere Prognose als Patienten mit normalem MPS, was zeigt, dass diese Patienten nur schon mit dieser einfachen Unterscheidung effizient risikostratifiziert werden können. Asymptomatische Patienten und Patienten mit Angina pectoris mit pathologischem MPS unterschieden sich hinsichtlich Prognose nicht signifikant, wogegen Patienten mit Dyspnoe ein signifikant schlechteres Überleben aufwiesen (Figure 3). Dies ist zum Teil mit der Tatsache zu erklären, dass letztere eine schlechtere linksventrikuläre Pumpfunktion aufwiesen und somit mehr stumme Infarkte erlitten hatten. Diese Ergebnisse unterstreichen, dass das Fehlen einer kardialen Symptomatik bei Diabetikern nicht mit «keine KHK» gleichgesetzt werden darf und in der Risikostratifikation solcher Patienten berücksichtigt werden muss.
Diabetiker mit einem hohen Risiko für eine stumme KHK
Es gibt verschiedene Studien, die bei Diabetikern zusätzliche Risikofaktoren für das Auftreten einer stummen Ischämie identifiziert haben. Patienten mit Endorganschäden (periphere arterielle Verschlusskrankheit [4], zerebrovaskuläre Problematik, Retinopathie [5], Nephropathie [Mikroalbuminurie] [6, 7]), autonomer kardialer Neuropathie [8] und mehr als einem zusätzlichen kardiovaskulären Risikofaktor weisen höhere Raten stummer Ischämien auf.
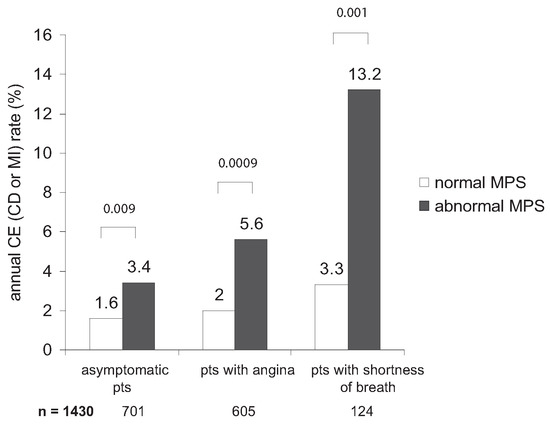
Figure 2.
Jährliche Ereignisraten (Tod oder Myokardinfarkt) als Funk tion der Symptomatik und der MPS (myokardiale Perfusions szintigraphie)-Resultate (modifiziert nach [3]).
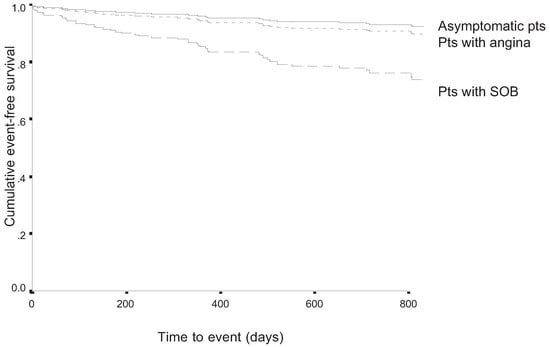
Figure 3.
Ereignisfreies Überleben (Tod oder Myokardinfarkt) als Funktion der Symptomatik bei Patienten mit pathologischem MPS (myokardiale Perfusionsszintigraphie ; modifiziert nach [3]). Asymptomatische Patienten und Patienten mit Angina pectoris hatten kein unterschiedliches ereignisfreies Überleben, wohingegen Patienten mit Dyspnoe einen signifikant schlechteren Verlauf zeigten.
Dies sei bei Patienten mit Mikroalbuminurie exemplarisch beschrieben: Rutter et al. untersuchten 86 Diabetiker mit versus ohne Mikroalbuminurie [6, 7]. Er zeigte, dass Patienten mit Mikroalbuminurie während des Belastungstests häufiger (65%) eine stumme Ischämie aufwiesen als Patienten ohne Mikroalbuminurie (40%), p = 0,016. Das Vorliegen der Mikroalbuminurie hatte prognostische Implikationen. Patienten ohne Mikroalbuminurie wiesen ein ähnliches ereignisfreies Überleben auf wie Patienten ohne Ischämie, und Patienten mit Mikroalbuminurie hatten praktisch deckungsgleiche ereignisfreie Überlebenskurven wie Patienten mit einer nachgewiesenen stummen Ischämie.
Patienten mit bereits vorbekannter KHK
Bei Patienten mit bekannter KHK und objektivierter Ischämie wurde untersucht, ob Diabetiker häufiger eine stumme Ischämie aufweisen als Nicht-Diabetiker [9]. Es zeigte sich, dass bei mehr als 2/3 der Diabetiker eine stumme Ischämie vorlag im Vergleich zu knapp 1/3 der Patienten bei Nicht-Diabetikern. Myokardinfarkte laufen bei Diabetikern häufiger stumm oder mit atypischen Beschwerden ab als bei Nicht-Diabetikern (32—42% bei Diabetikern vs. 6—15% bei Nicht-Diabetikern).
Therapie der stummen koronaren KHK
Lange Zeit wurde heftig über den Nutzen einer Therapie bei stummer KHK diskutiert.
Studien, die die Therapie der stummen KHK bei Patienten ohne vorbekannte kardiale Problematik untersuchen, existieren bis heute keine. Es gibt lediglich einige Studien, die die Therapie der stummen Ischämie bei vorbekannter KHK untersuchten.
In den Guidelines für die Behandlung von Patienten mit chronischer stabiler Angina pectoris [10] wird bei asymptomatischen Patienten mit St.n. Myokardinfarkt die Gabe von Aspirin, Betablockern und bei erhöhtem Cholesterin ein Lipidsenker empfohlen (Klasse I Indikation — es besteht klare Evidenz und Übereinstimmung, dass diese Massnahmen nützlich und effektiv sind). Bei Patienten ohne durchgemachten Myokardinfarkt wird bei nachgewiesener koronarer Herzkrankheit (mittels nicht-invasivem Test oder Koronarangiographie) ebenfalls die Gabe von Aspirin, Betablocker und bei erhöhten Lipidwerten ein Lipidsenker empfohlen (allerdings mit niedrigerer Evidenzklasse IIa — Evidenz oder Expertenmeinungen erachten es als nützlich und effizient).
Verschiedene kleinere Studien haben die Wirkung von Betablockern bei Patienten mit stummer Ischämie ohne durchgemachten Myokardinfarkt geprüft. Die Daten zeigen prinzipiell einen Benefit dieser Therapie, obwohl auch hier Studien fehlen, die Patienten ohne vorbestehende KHK untersucht haben.
In der «total ischaemic burden bisoprolol»Studie (TIBBS) konnte von von Armin et al. gezeigt werden, dass Patienten, bei denen die Episoden mit stummer Ischämie medikamentös komplett eliminiert werden konnten, ein signifikant besseres ereignisfreies Überleben aufwiesen als Patienten, bei denen dies nicht gelang [11, 12].
Bei der «asymptomatic cardiac ischemia pilot»-Studie (ACIP) [13] wurden 558 Patienten in 3 therapeutische Gruppen randomisiert: Eine erste Gruppe, die «Angina-gesteuert», eine zweite Gruppe, die «Ischämie-gesteuert» therapiert und eine dritte Gruppe, die revaskularisiert wurde. In der 2-Jahres-Kontrolle hatten die konservativ therapierten Patienten eine signifikant höhere Mortalitätsrate (Angina-gesteuert therapierte Patienten 6,6%, Ischämie-gesteuerte 4,4%) als die revaskularisierten Patienten. Diese wiesen eine Mortalitätsrate von lediglich 1,1% auf.
Ausblick
Die American Diabetes Association hat 1998 Richtlinien für das KHK-Screening von asymptomatischen Diabetikern herausgegeben [14], die allerdings mehr auf einem Expertenkonsens als auf Studienergebnissen beruhen [15]. Um die optimale Screening-Strategie bei asymptomatischen Typ-2-Diabetikern und bei Bedarf deren Therapie besser definieren zu können, haben wir am Universitätsspital Basel im Juni die TIME-DM-Studie (Trial of Invasive versus Medical therapy of Early coronary disease in Diabetes Mellitus) gestartet. Im Rahmen dieser vom Nationalfonds und der Industrie unterstützten randomisierten Multizenter-Studie sollen 400 Diabetiker ohne vorbekannte KHK hinsichtlich einer solchen mittels MPS gescreent werden. Patienten mit objektiver Evidenz für eine stumme KHK werden in einem weiteren Schritt in eine konservative und in eine invasive Gruppe randomisiert und hinsichtlich verschiedener Endpunkte verglichen. Patienten ohne Hinweise für eine KHK werden ebenfalls, wie die therapierten Patienten, nachkonrolliert und im Verlauf auf ein Neuauftreten einer KHK gescreent. Mit der TIME-DM-Studie können Erkenntnisse darüber gewonnen werden, ob es sich lohnt, asymptomatische Diabetiker zu screenen und wie häufig ein solches Screening erfolgen sollte. Des weiteren erhoffen wir uns Aussagen über die optimale Therapiestrategie bei diesen Patienten.
Schlussfolgerungen
Die stumme Ischämie stellt bei Typ-2-Diabetikern ein häufiges Problem dar. Eine KHK und insbesondere eine Ischämie hat prognostische Auswirkungen unabhängig vom symptomatischen Status diabetischer Patienten. Ausgewählte diabetische Patienten können wahrscheinlich von einem routinemässig durchgeführten Ischämie-Screening profitieren. Obwohl dahingehende Studienergebnisse weitgehend fehlen ist anzunehmen, dass die KHK, und im besonderen eine Ischämie, unabhängig vom symptomatischen Status der Patienten therapiert werden sollte.
References
- Zellweger, M.J.; Pfisterer, M.E. Silent coronary artery disease in patients with diabetes mellitus. Swiss Med Wkly 2001, 131, 427—32. [Google Scholar] [CrossRef] [PubMed]
- Wackers, F.J.; Young, L.H.; Inzucchi, S.E.; et al. Detection of silent myocardial ischemia in asymptomatic diabetic subjects: the DIAD study. Diabetes Care 2004, 27, 1954—61. [Google Scholar] [CrossRef] [PubMed]
- Zellweger, M.J.; Hachamovitch, R.; Kang, X.; et al. Prognostic relevance of symptoms versus objective evidence of coronary artery disease in diabetic patients. Eur Heart J 2004, 25, 543—50. [Google Scholar] [CrossRef] [PubMed]
- Nesto, R.W.; Watson, F.S.; Kowalchuk, G.J.; et al. Silent myocardial ischemia and infarction in diabetics with peripheral vascular disease: assessment by dipyridamole thallium-201 scintigraphy. Am Heart J 1990, 120, 1073—7. [Google Scholar] [CrossRef] [PubMed]
- Janand-Delenne, B.; Savin, B.; Habib, G.; Bory, M.; Vague, P.; Lassmann-Vague, V. Silent myocardial ischemia in patients with diabetes: who to screen. Diabetes Care 1999, 22, 1396— 400. [Google Scholar] [CrossRef] [PubMed]
- Rutter, M.K.; Wahid, S.T.; McComb, J.M.; Marshall, S.M. Significance of silent ischemia and microalbuminuria in predicting coronary events in asymptomatic patients with type 2 diabetes. J Am Coll Cardiol 2002, 40, 56—61. [Google Scholar] [CrossRef] [PubMed]
- Rutter, M.K.; McComb, J.M.; Brady, S.; Marshall, S.M. Silent myocardial ischemia and microalbuminuria in asymptomatic subjects with non-insulin-dependent diabetes mellitus. Am J Cardiol 1999, 83, 27—31. [Google Scholar] [CrossRef] [PubMed]
- Langer, A.; Freeman, M.R.; Josse, R.G.; Steiner, G.; Armstrong, P.W. Detection of silent myocardial ischemia in diabetes mellitus. Am J Cardiol 1991, 67, 1073—8. [Google Scholar] [CrossRef] [PubMed]
- Nesto, R.W.; Phillips, R.T.; Kett, K.G.; et al. Angina and exertional myocardial ischemia in diabetic and nondiabetic patients: assessment by exercise thallium scintigraphy. Ann Intern Med 1988, 108, 170—5. [Google Scholar] [CrossRef] [PubMed]
- Gibbons, R.J.; Abrams, J.; Chatterjee, K.; et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina-summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (committee on the management of patients with chronic stable angina). Circulation 2003, 107, 149—58. [Google Scholar] [PubMed]
- Von Arnim, T. Prognostic significance of transient ischemic episodes: response to treatment shows improved prognosis. Results of the Total Ischemic Burden Bisoprolol study (TIBBS) follow-up. J Am Coll Cardiol 1996, 28, 20—4. [Google Scholar] [PubMed]
- von, A.r.n.i. m T. Medical treatment to reduce total ischemic burden: total ischemic burden bisoprolol study (TIBBS), a multicenter trial comparing bisoprolol and nifedipine. The TIBBS Investigators. J Am Coll Cardiol 1995, 25, 231—8. [Google Scholar]
- Davies, R.F.; Goldberg, A.D.; Forman, S.; et al. Asymptomatic Cardiac Ischemia Pilot (ACIP) study two-year follow-up: outcomes of patients randomized to initial strategies of medical therapy versus revascularization. Circulation 1997, 95, 2037—43. [Google Scholar] [CrossRef] [PubMed]
- ADA Consensus development conference on the diagnosis of coronary heart disease in people with diabetes: 10—11 February 1998, Miami, Florida. American Diabetes Association. Diabetes Care 1998, 21, 1551—9.
- Wackers, F.J.; Zaret, B.L. Detection of myocardial ischemia in patients with diabetes mellitus. Circulation 2002, 105, 5—7. [Google Scholar] [CrossRef] [PubMed]
© 2004 by the author. Attribution Non-Commercial NoDerivatives 4.0.