Abstract
We report the case of a 76-year-old woman with palpitations and chest discomfort, who presented with elevated concentrations of cardiac biomarkers (Troponin T and creatine kinase CK) but no ST elevation. A coronary angiogram showed no evidence of obstructive coronary artery disease, an echocardiography was normal. Myocarditis was suspected, and treatment with a non-steroidal anti-inflammatory drug was initiated. After three as well as after six months cardiac bio markers continued to be elevated; a repeat echocardiography remained normal without signs of regional wall motion abnormalities. Given the clinical course as well as the unchanged echocardiogram a non-cardiac cause of the elevated cardiac biomarkers appeared most likely. Troponin-I was taken and turned out negative. Hence, the elevated cardiac Troponin T and CK were unrelated to myocardial ischaemia, but instead were due to a rheumatic disease.
Fallbeschreibung 1
Eine 76-jährige Frau stellt sich mit retrosternalem Druckgefühl und Palpitationen in der hausärztlichen Praxis vor. Bei positivem Troponin-T und erhöhter Kreatinkinase (CK) wird uns die Patientin mit Verdacht auf einen Myokardinfarkt zugewiesen. Zum Zeitpunkt der Notfallkonsultation ist sie bereits beschwerdefrei.
Die Patientin beschreibt eine normale Belastbarkeit im Alltag ohne Dyspnoe. Als kardiovaskuläre Risikofaktoren sind eine arterielle Hypertonie, die mit Indapamid behandelt wird, und eine Dyslipidämie (unbehandelt) bekannt. Die persönliche Anamnese ist bis auf eine Dyskinesie des oberen Ösophagussphinkters und eine Penicillin-Allergie bland.
Klinisch präsentiert sich eine kardiopulmonal kompensierte, schmerzfreie Patientin mit hypertensiven Blutdruckwerten systolisch um 190 mm Hg. Im EKG ist eine muldenförmige ST-Strecke von V2–V6 nachweisbar, signifikante ST-Hebungen oder -senkungen zeigen sich nicht. Labortechnisch können die vom Hausarzt beschriebenen erhöhten Herzenzyme (Troponin T 0.24 µg/l [Referenzbereich <0.03 µg/l], CK 845 U/l [Referenzbereich <190 U/l], CKMB 88 U/l [Referenzbereich <8 U/l]) bestätigt werden, weitere Normabweichungen von Laborparametern sind nicht zu verzeichnen (inklusive Kreatinin, CRP, TSH, NTproBNP, ANA, ANCA). Thoraxröntgen und Echokardiographie (LVEF 71%) sind normal, in der Koronarangiographie ist lediglich eine diskrete Koronarsklerose ohne signifikante Stenosen nachweisbar. So werden die Befunde im Rahmen einer Perimyokarditis interpretiert. Unter Ausbau der antihypertensiven Therapie und Analgesie mit Ibuprofen bleibt die Patientin beschwerdefrei. CK, CK-MB und Troponin T sind im Verlauf der Hospitalisation leicht regredient. Nach fünf Tagen wird die Patientin mit der Empfehlung einer Labor- und echokardiographischen Kontrolle nach Hause entlassen.
In der Kontrolle drei Wochen nach Entlassung findet sich echokardiographisch weiterhin ein Normalbefund bei kontinuierlich erhöhten CK- und Troponin-TWerten. Die Patientin ist kardial komplett asymptomatisch. In der erweiterten Anamnese gibt sie jetzt jedoch an, seit Jahren an intermittierenden rheumatischen Beschwerden im Sinne von Myalgien und Arthralgien im Schulter-, Knie- und Hüftbereich sowie an einer Lumbago, an Müdigkeit und Nachtschweiss zu leiden. Klinische Hinweise auf eine Myositis wie heliotroper Rash, Gottron-Knoten, «Mechanic hands», Hautfibrose, Teleangiektasien, Raynaud oder Fotosensitivität bestehen nicht. In der Annahme einer chronischen Myokarditis werden weitere Serummarker abgenommen, die allesamt negativ bleiben (Serologien auf HIV, Borrelien, Herpes-simplex-Virus, humanes Herpesvirus Typ-6, Zytomegalievirus, Lues sowie Antistreptolysin-Antikörper, Rheumafaktoren, anti-mitochondriale Antikörper). Die Patientin wird mit der Empfehlung, Labor und Echokardiographie erneut zu kontrollieren, beschwerdefrei nach Hause entlassen.
Sechs Monate später weist der Hausarzt die Patientin wiederum zu, da die CK- und Troponin-T-Werte unverändert stark erhöht sind. Die Patientin ist seit ihrem Spitalaustritt kardial immer noch beschwerdefrei und hat keine Herzinsuffizienzzeichen. Auch die in der letzten Konsultation beschriebenen rheumatischen Symptome sind weniger ausgeprägt. Wieder sind Troponin T und Kreatinkinase deutlich positiv (CK 659 U/l, CK-MB 69 U/l, Troponin T 0.22 µg/l). Die Echokardiographie ist weiterhin unauffällig.
Als Ursache der erhöhten Troponin-T- und CKWerte wurde initial eine chronische Myokarditis angenommen. Diese würde allerdings mit einer progredienten Herzinsuffizienz einhergehen, die jedoch bei stets negativem NTproBNP, einer kardial asymptomatischer Patientin und wiederholt normalen Echokardiographien nicht verifizierbar war. Aufgrund des klinischen Verlaufes musste daher eine nichtkardiale Genese des erhöhten Troponin T angenommen werden.
Weiteren Aufschluss ergab ein Troponin-I-Test, der sich als negativ erwies, so dass eine kardiale Ursache der CK- und Troponin-T-Erhöhung praktisch ausgeschlossen und die klinische Beurteilung bestätigt werden konnte.
Da die Patientin weiterhin subjektiv beschwerdefrei blieb, wurde auf weitere Abklärungen verzichtet und eine Erkrankung aus dem rheumatischen Formenkreis angenommen, wobei hierfür leider kein laborchemischer Beweis (siehe oben) erbracht werden konnte.
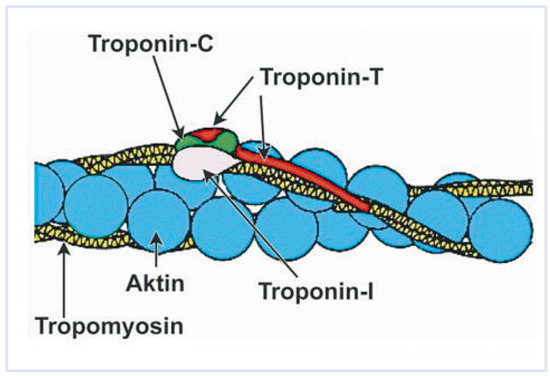
Abbildung 1.
Troponin-Komplex mit den drei Untereinheiten: Troponin T, Troponin I, Troponin C. (Copyright mit freundlicher Genehmigung von Univ.-Prof. Dr. med. Michael M. Hirschl, Landesklinikum, St. Pölten, Österreich.).
Fallbeschreibung 2
Kurze Zeit später wird ein 61-jähriger Patient mit bekannter koronarer Herzkrankheit (Status nach PTCA/Stenting des RIVA vor 10 Jahren) von seinem Hausarzt zugewiesen, nachdem im Rahmen eines RoutineCheck-up eine deutlich erhöhte Kreatinkinase von 1608 U/l bei asymptomatischem Patienten aufgefallen war. Die vor 10 Jahren begonnene Statintherapie wurde bereits abgesetzt, die CK ist jedoch nicht rückläufig. Das Eintrittslabor bestätigt die Parameter des Hausarztes, zudem fällt ein Troponin T von 0.12 µg und eine CK-MB von 53 U/l auf. Eine daraufhin veranlasste Ergometrie bei kardial beschwerdefreiem Patienten sowie die nachfolgende Myokardperfusionsszintigraphie und Echokardiographie zeigen keine Anhaltspunkte für ein erneutes akutes koronarischämisches Geschehen oder eine entzündliche Herzerkrankung. Bei vorbestehend bekannter koronarer Herzkrankheit sind echokardiographisch Hypokinesien apikal, septal und lateral nachweisbar, die zu einer leichten Einschränkung der systolischen Pumpfunktion (EF 46%) geführt haben. CRP und Kreatinin sind ebenfalls im Normbereich.
Auch hier war Troponin I negativ, was eine kardiale Ursache der Enzymerhöhung ausschloss. Nach eingehender neurologischer Untersuchung des Patienten wurde eine Late-onset, axonale und sensomotorische Polyneuropathie mit Hyper-CK-ämie (Makro-CK) postuliert und der Verdacht auf eine Charcot-MarieTooth-Erkrankung Typ 2 geäussert (noch ohne weiterführende Abklärungen).
Diskussion
Troponine sind Regulatorproteine, die die kalziumvermittelte Interaktion von Actin und Myosin des Herzmuskels kontrollieren [1]. Der Troponin-Komplex besteht aus drei Untereinheiten—TnT (Troponin T), TnI (Troponin I) und Troponin C (Abb. 1), wobei nur die kardialen Isoformen des TnT (cTNT) und des TnI (cTNI) in der kardialen Diagnostik relevant sind. Molekularbiologisch sind TNT1 (ssTNT) als Variante der langsamen Skelettmuskulatur auf Chromosom 19q13.4, TNT2 als kardiale Isoform auf Chromosom 1q32 und TNT3 (fsTNT) als Variante der schnellen Skelettmuskulatur auf Chromosom 19q13.4 charakterisiert. Beim cTNT sind zudem mehrere Splicevarianten beschrieben, die unter unterschiedlichen Stimuli in Kardiomyozyten [1] wie auch in Skelettmuskelzellen exprimiert werden [2]. Sowohl cTnT wie cTnI im Blutkompartiment sind hochsensitive Marker für eine kardiale Muskelschädigung. Auch nichtkardiale Erkrankungen wie Lungenembolien, Niereninsuffizienz, Subarachnoidalblutungen, Sepsis, Eklampsie, Chemotherapie und entzündliche Muskelerkrankungen wie Dermatomyositis und Polymyositis [3] können zu erhöhten Serum-Troponin-Konzentrationen führen (Table 1). Im vorliegenden Fall ist jedoch lediglich eine cTnT-Erhöhung nachweisbar, vermutlich weil kardiales Troponin T als Splicevarianten in bestimmten Situationen auch in Myozyten nichtkardialer Differenzierung (Skelett-/glatte Muskulatur) exprimiert werden kann [4,5,6]. cTnI ist bei den obengenannten Erkrankungen nicht erhöht, da es nur im Herzmuskel nachweisbar ist [7]. Es muss daraus geschlossen werden, dass cTnI ein Biomarker für eine kardiale Muskelschädigung mit etwas höherer Spezifität als cTnT ist [5,6]. In dieser Aussage muss sicher auch die analytische Sensitivität und Spezifität der Assays sowie die Entwicklung der Assays berücksichtigt werden.

Table 1.
Nichtkardiale Ursachen eines erhöhten Troponins.
Table 1.
Nichtkardiale Ursachen eines erhöhten Troponins.
 |

Table 2.
Analytische Parameter der verwendeten Assays, gemäss Packungsbeilagen [8,9,10].
Table 2.
Analytische Parameter der verwendeten Assays, gemäss Packungsbeilagen [8,9,10].
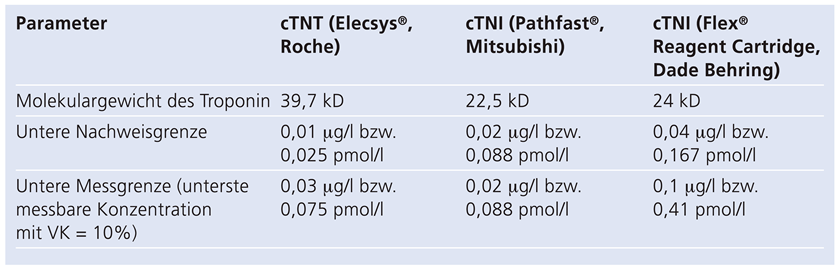 |

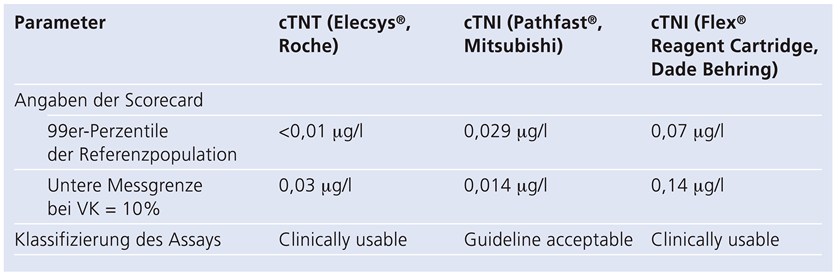
Table 3.
Analytische Parameter der verwendeten Assays, gemäss Scorecard [11].
Table 3.
Analytische Parameter der verwendeten Assays, gemäss Scorecard [11].
 |
Gemäss Angaben der Hersteller liegen die unteren Messgrenzen des verwendeten cTnT-Assays (Elecsys®, Fa. Roche Diagnostics, Rotkreuz, Schweiz) bei 0.075 pmol/l (0.03 μg/l bei MG des cTNT von 39.7 kD), diejenige des im Rahmen einer internen Evaluation verwendeten cTnI-Assays liegt bei 0.088 pmol/l (0.02 μg/l bei einem MG des cTNI von 22.5 kD; PathFast®, Mitsubishi, Tokyo, Japan) [8,9]. Die meisten etablierten cTnI-Assays haben eine etwas geringere analytische Sensitivität: Der im Rahmen dieser Untersuchung ebenfalls verwendete, routinemässige Assay cTnI (Flex® Reagent Cartridge, Dade Behring, Schweiz) zeigt eine untere Messgrenze von 0.04 μg/l, was einer Konzentration von 0.167 pmol/l entspricht [10]. Dieser Unterschied in der analytischen Sensitivität könnte die leicht höhere diagnostische Spezifität der cTnI-Assays teilweise erklären. In unseren Untersuchungen wurde jedoch der cTnI-Test mit der höchsten analytischen Sensitivität (Pathfast®, Mitsubishi, Tokyo, Japan) verwendet, so dass in der Tat ein falsch negatives Ergebnis unwahrscheinlich ist.
Es konnte hiermit gezeigt werden, dass der verwendete cTnI-Test (Pathfast, Mitsubishi, Japan) zur Differenzierung zwischen kardial und nichtkardial bedingter Troponinerhöhung gegenüber dem aktuellen cTnT-Test (Elecsys®, 4. Generation cTNT-Assay, Roche Diagnostics, Schweiz) in den geschilderten Fällen eine höhere diagnostische Spezifität aufweist. In welchen Muskelzellen allerdings die im Blutkompartiment gemessenen cTNT-Werte exprimiert werden, kann aufgrund unserer Datenlage nicht beantwortet werden. Dass die diagnostische Performance der klinischen Entscheidung stark vom verwendeten cTn-Assay abhängt, ist unbestritten. Apple et al. schlagen deshalb auf Basis der aktuellen Datenlage eine Scorecard vor, nach der die Assays für den Kliniker klassifiziert werden sollen [11]. Die vorgeschlagene Scorecard beinhaltet eine objektive analytische und klinische Wertung der verschiedenen cTn-Assays nach diagnostischer Spezifität (evaluiert anhand eines definierten Kollektivs von Herzgesunden) sowie nach der Impräzision an der 99er-Perzentile des herzgesunden Kollektivs. Eine Zusammenstellung der verschiedenen cTn-Assays findet sich auf der IFCC-Website [12]. Auf diese Weise kann trotz mangelnder Standardisierung der verschiedenen cTn-Assays die diagnostische Performance abgeschätzt werden.
Im ersten Fall liegt als Ursache der cTnT- und CKErhöhung vermutlich eine Erkrankung aus dem rheumatologischen Formenkreis mit Skelettmuskelbeteiligung bei typischer Klinik vor. Ein genauer Nachweis der Expression des cTnT im Skelettmuskel konnte leider nicht erbracht werden, da die Patientin eine Muskelbiopsie ablehnte.
Auch im zweiten Fall waren die kardialen Abklärungen unauffällig und cTnI negativ, gemessen mit dem cTnI-Assay mit der aktuell besten analytischen Sensitivität (Pathfast®, Mitsubishi, Tokyo, Japan). Hier wurde als Ursache der Enzymerhöhung eine neuromuskuläre Pathologie postuliert.
Acknowledgments
Wir danken den Herren Paul Hasler und Andreas Thueler ganz herzlich für die kritische Durchsicht des Manuskriptes und die zahlreichenAnregungen und Verbesserungsvorschläge. Herrn M. Schaub, Institut für Pharmakologie und Toxikologie der Universität Zürich, möchten wir für die wertvollen Informationen zur Molekularbiologie von Myofibrillen danken.
Conflicts of Interest
Es besteht kein Interessenkonflikt.
References
- Schaub, M.; et al. Modulation of contractility in human cardiac hypertrophy by myosin essential light chain isoforms. Cardiovasc Res. 1998, 37, 381–404. [Google Scholar] [CrossRef]
- Bodor, G.S.; Survant, L.; et al. Cardiac troponin T composition in normal and regenerating human skeletal muscle. Clin Chem. 1997, 43, 476–484. [Google Scholar] [CrossRef]
- Erlacher, P.; et al. Cardiac troponin-I and beta-type myosin heavy chain concentration in patients with polymyositis or dermatomyositis. Clin Chim Acta. 2001, 306, 27–33. [Google Scholar] [CrossRef] [PubMed]
- Moran, C.M.; Garriock, R.J.; et al. Expression of the fast twitch troponin complex, fTnT, fTnI and fTnC, in vascular smooth muscle. Cell Motil Cytoskeleton. 2008, 65, 652–661. [Google Scholar] [CrossRef] [PubMed]
- Schwarzmeier, J.D.; Hamwi, A.; Preisel, M.; Resl, C.; Preusser, M.; Sluga, E.; et al. Positive troponin T without cardiac involvement in inclusion body myositis. Hum Pathol. 2006, 37, 1367–1368, author reply 1368. [Google Scholar] [CrossRef] [PubMed]
- Ricchiuti, V.; Apple, F.S. RNA Expression of cardiac troponin T isoforms in diseased human skeletal muscle. Clin Chem. 2000, 46, 437. [Google Scholar] [CrossRef]
- Bodor, G.S.; et al. Cardiac troponin-I is not expressed in fetal and healthy or diseased adult human skeletal muscle tissue. Clin Chem. 1995, 41 12 Pt 1, 1710–1715. [Google Scholar] [CrossRef] [PubMed]
- Packungsbeilage Troponin T 4. Gen., Elecsys, Roche Diagnostics, CH (Cat No 04660307190).
- Packungsbeilage Troponin I, Pathfast, Mitsubishi JP (Ref No PF1011–K).
- Packungsbeilage Troponin I, Dade Behring, CH (Ref No RF421C).
- Apple, F.S. A new Season for Troponin assays: it’s time to keep a scorecard. Clin Chem. 2009, 55, 7. [Google Scholar] [CrossRef] [PubMed]
- Website. Available online: www.ifcc.org/PDF/IFCC_Troponin_Web_Page_Table_of_As says_Oct_2008.
© 2010 by the authors. Attribution-Non-Commercial-NoDerivatives 4.0.