Abstract
Already in the ancient world, clinical pictures were described that can be clearly recognised as heart failure nowadays. However not until the 17th century, the first anatomic descriptions of heart failure were published. Another 200 years later, the physiology of the circulation was discovered and in the 20th century, haemodynamic alterations in heart failure were described as well as insights in the cellular biochemistry and biophysics and finally in molecular-biological coherences. These six paradigms of the development of the understanding of heart failure have formed our thinking and acting in heart failure and have helped to develop countless diagnostic and therapeutic tools. The present article summarises where we are now and how we have achieved this. Then, it dares to give an outlook on what we will possibly have to expect in the coming years and decades. This will not only include the development and investigation of new diagnostics and therapeutics, but also additional tasks such as the implementation and transfer of knowledge, the selection of the best options from an increasing number of possibilities and the optimal distribution of the limited resources.
Zusammenfassung
Bereits in der Antike wurden Krankheitsbilder beschrieben, die heute als Herzinsuffizienz erkannt werden. Im 17. Jahrhundert wurden erste anatomische Zusammenhänge bei Herzinsuffizienz beschrieben, weitere 200 Jahre später die Physiologie der Zirkulation, im 20. Jahrhundert hämodynamische Veränderungen, Erkenntnisse der Zellbiochemie und der Zellphysik und schliesslich molekularbiologische Zusammenhänge. Diese 6 Paradigmen der Entwicklung des Verständnisses der Herzinsuffizienz prägen heute unser Denken und Handeln und haben geholfen, unzählige diagnostische und therapeutische Massnahmen zu entwickeln. Der vorliegende Artikel gibt einen kurzen Überblick darüber, wo wir heute stehen und wie wir dazu gekommen sind. Er wagt dann einen Ausblick darauf, was wir in den nächsten Jahren und Jahrzehnten (möglicherweise) zu erwarten haben. Dies wird nicht nur Entwicklung und Prüfung einzelner diagnostischer und therapeutischer Prozesse betreffen, sondern weitere Aufgaben, wie die Umsetzung gewonnener Erkenntnisse, Wissenstransfer, die Auswahl der besten Optionen aus unzähligen Möglichkeiten und die optimale Verteilung der limitierten Ressourcen.
Schlüsselwörter: Herzinsuffizienz; Therapie; Diagnostik; zukünftige Entwicklungen
Einleitung
Bereits in der Antike wurden Krankheitsbilder beschrieben, die heute eindeutig als Herzinsuffizienz erkannt werden []. Allerdings fehlte damals das Verständnis für die den Symptomen zugrunde liegende Dysfunktion des Herzens noch vollständig. Erst im 17. Jahrhundert wurden erste anatomische Zusammenhänge bei insuffizienten Herzen beschrieben. Weitere 200 Jahre später wurden die Physiologie der Zirkulation, Anfang des 20. Jahrhunderts die hämodynamischen Veränderungen, vor 60–70 Jahren erste Erkenntnisse der Zellbiochemie und der Zellphysik und schliesslich vor etwas mehr als 20 Jahren die ersten molekularbiologischen Zusammenhänge bei Herzinsuffizienz entdeckt []. Diese 6 Paradigmen in der Entwicklung des Verständnisses der Herzinsuffizienz prägen heute unser Denken und Handeln wesentlich und haben geholfen, unzählige diagnostische und therapeutische Massnahmen zu entwickeln und anzuwenden. Dadurch hat sich das Krankheitsbild der Herzinsuffizienz wesentlich verändert. Während diese noch vor 30 Jahren eine schlecht verstandene und kaum zu behandelnde Erkrankung war, stehen uns heute Möglichkeiten zur Verfügung, welche eine effektive Abklärung und Behandlung dieser Patienten zulassen. Der vorliegende Artikel möchte einen kurzen Überblick darüber vermitteln, wo wir heute stehen und wie wir dazu gekommen sind. Er wagt dann einen Ausblick darauf, was wir in den nächsten Jahren und Jahrzehnten (möglicherweise) zu erwarten haben. Dies betrifft nicht nur Entwicklung und Prüfung einzelner diagnostischer und therapeutischer Prozesse, sondern weitere Aufgaben, wie die Umsetzung gewonnener Erkenntnisse, Wissenstransfer, die Auswahl der besten Optionen aus unzähligen Möglichkeiten und die optimale Verteilung der limitierten Ressourcen. Der vorliegende Artikel erhebt keinerlei Ansprüche auf Vollständigkeit und stellt die subjektive Meinung der Autoren dar.
Diagnostik
Anamnese und klinische Untersuchung haben eine jahrhundertealte Tradition, doch wurde deren Wertigkeit lange Zeit nicht systematisch untersucht. Erst in der letzten Zeit, oft im Zusammenhang mit andern diagnostischen Tests, wurde untersucht, welche Aussage aufgrund von Anamnese und klinischer Untersuchung bezüglich Diagnosestellung der Herzinsuffizienz möglich ist []. Es zeigte sich, dass ohne weitere diagnostische Tests zwar keine endgültige Diagnose möglich ist, dass Anamnese und klinische Untersuchung hinsichtlich diagnostischer Wertigkeit aber durchaus mit andern technischen Untersuchungen zu vergleichen sind, weshalb sie auch heute noch von zentraler Bedeutung bei der Diagnostik der Herzinsuffizienz sind.
Revolutioniert aber wurde die Diagnostik der Herzinsuffizienz durch die Echokardiographie, die erstmals in den 1970er Jahren eine breitere klinische Anwendung fand (Figure 1). Während die Rechtherzkatheteruntersuchung vor allem zum pathophysiologischen Verständnis der Herzinsuffizienz beitrug, erlaubte die Echokardiographie erstmals die direkte Darstellung des insuffizienten Herzens in vivo und lieferte damit nicht nur einen Beweis für das Vorliegen der Dysfunktion des Herzens, sondern auch wichtige Informationen über mögliche zugrunde liegende Ursachen []. Die (technischen) Möglichkeiten der Echokardiographie scheinen aber noch lange nicht ausgeschöpft zu sein, auch wenn kürzliche Neuerungen wie «strain» und «strain rate» durch Gewebe-Doppler nicht den anfänglich erhofften Erfolg brachten. Die 3D-Darstellung des Herzens wird eine bessere Quantifizierung des Herzens, insbesondere des rechten Ventrikels, erlauben. Allerdings ist die Technik noch nicht so weit ausgereift, dass sie im klinischen Alltag bereits heute breite Anwendung findet. Eine Technik, welche die Limitationen des Gewebe-Dopplers beheben könnte, ist das sog. «tissue tracking». Dabei werden die Pixel über den Herzzyklus verfolgt. Damit lässt sich, unabhängig vom Winkel der Aufnahme, die Bewegung des Myokards darstellen, was beispielsweise bei Dyssynchronie wichtige Information liefern könnte. Auch hier sind die technischen Möglichkeiten noch nicht so weit ausgereift, dass eine klinische Anwendung möglich wäre.
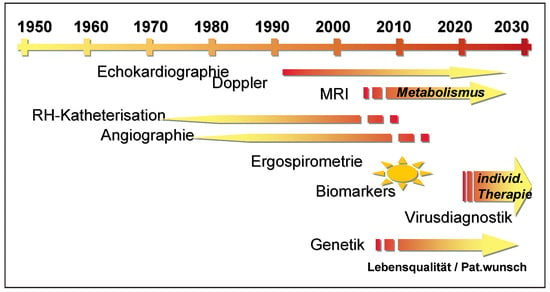
Figure 1.
Auswahl an diagnostischen Möglichkeiten, die bei Herzinsuffizienz wichtig sind, in der Vergangenheit, der Gegenwart und der Zukunft. Zeitachse semiquantitativ.
Mittels Echokontrast kann nicht nur eine Verbesserung der Darstellung der Herzhöhlen erreicht werden, sondern auch die Durchblutung im Myokard quantifiziert werden. Es ist zu erwarten, dass sich damit die Diagnostik der Herzinsuffizienz, insbesondere bei koronarer Herzkrankheit, verbessern lässt. Durch die Verwendung von Kontrastmitteln, die an bestimmte Moleküle anhaften, werden sich möglicherweise regionale myokardiale Prozesse wie Entzündungen gezielt darstellen lassen []. Schliesslich zeichnen sich für die Echokardiographie nicht nur diagnostische, sondern auch therapeutische Möglichkeiten ab. So können mikroskopisch kleine (Luft-) Bläschen mit Therapeutika beladen werden und dann mittels Ultraschall zerstört werden, was den Transport des Therapeutikums an den gewünschten Wirkort erlaubt, ohne eine systemische Wirkung zu verursachen (vgl. weiter unten).
In den letzten Jahren hat die Diagnostik der Herzinsuffizienz durch das Magnet-Resonanz-Imaging (MRI) des Herzens, neben andern etablierten Methoden wie die Echokardiographie, Szintigraphie oder auch Positronen-Emissions-Tomographie (PET), eine wesentliche Erweiterung erfahren []. Während diese Methode durch die enormen Ansprüche an die Rechenleistung lange Zeit limitiert war, erlaubt die rasante Verbesserung in diesem Bereich nun eine Darstellung der Anatomie und Funktion des Herzens in genügender zeitlicher und räumlicher Auflösung. Hinsichtlich Genauigkeit bei der Darstellung der Anatomie des Herzens ist das MRI zum Standard geworden. Abgesehen davon sowie der Möglichkeit der nichtinvasiven Suche nach Ischämie (unter Belastung) und Narbe (late enhancement) verspricht das MRI weitere interessante Methoden. So dürfte die Diagnose einer Myokarditis durch das MRI in Zukunft einfacher werden []. Zusammen mit verbesserter Virusdiagnostik und sich daraus ergebenden potentiellen therapeutischen Ansätzen scheint eine ursächliche Behandlung, zumindest eines Teils dieser Patienten, in der Zukunft im Bereich des Möglichen. Schliesslich kann das MRI Information über den Metabolismus im Herzen liefern []. Dies wird nicht nur in der Forschung bei Herzinsuffizienz eine Rolle spielen, sondern eine gezieltere Behandlung von Patienten (vgl. unten) ermöglichen. Die bildgebenden Verfahren werden zudem helfen, die Herzinsuffizienz bei erhaltener systolischer Funktion des linken Ventrikels besser verstehen und diagnostizieren zu können. Dies ist angesichts der Häufigkeit dieses Krankheitsbildes, insbesondere in der steigenden Zahl älterer Personen, von eminenter Bedeutung.
Ergospirometrie und Biomarker, v.a. Btype natriuretic peptide (BNP), sind aktuell gut etabliert, nicht nur in der diagnostischen Abklärung der Dyspnoe, sondern auch zur Abschätzung der Prognose bei Herzinsuffizienz []. Mit BNP wird auch versucht, die Therapie der Herzinsuffizienz besser steuern zu können. Erste Resultate sind zwar vielversprechend [], doch ist die BNP-Steuerung noch keineswegs etabliert und laufende Studien müssen abgewartet werden []. Zudem wird diese Steuerung immer noch nicht eine individualisierte Therapie des einzelnen Patienten erlauben. Bisher wurden neue Medikamente oder andere Therapien (z.B. kardiale Resynchronisationstherapie [CRT] mittels biventrikulärem Pacing) immer als «Add-on»-Therapie verstanden, das heisst sie wurden zusätzlich zur bisher etablierten Therapie hinzu gegeben. Dies hat dazu geführt, dass die einzelnen Patienten mit einer grossen Anzahl verschiedener Medikamente behandelt werden, ohne dass bekannt ist, welche dem individuellen Patienten tatsächlich etwas bringen. Bei der Behandlung mit CRT-Devices wurde, insbesondere wegen der hohen Kosten, diese Frage erstmals in breitem Masse aktuell. Es wird versucht, diejenigen Patienten zu identifizieren, welche von einem Device profitieren können [,]. Grundsätzlich stellt sich aber diese Frage für jede neue Massnahme in der Herzinsuffizienz-Therapie eines Patienten. Obschon Ansätze wie die BNP-gesteuerte Therapie in die Richtung einer individualisierten Behandlung gehen, bedarf es eines noch besseren Verständnisses der Pathophysiologie, um eine wirklich individualisierte Therapie anwenden zu können. Es darf bezweifelt werden, ob die alleinige Bestimmung zirkulierender Neurohormone (z.B. BNP) genügend exakt ist, um dieses Ziel zu erreichen. Die oben erwähnte echokardiographische Darstellung regionaler Prozesse, die Bildgebung kardialer metabolischer Prozesse mittels MRI und genetische Bestimmungen, insbesondere in Kombination, lassen es aber durchaus im Bereich des Möglichen erscheinen, dass eine individualisierte Therapie unter Einbezug verschiedener diagnostischer Modalitäten Realität werden könnte.
Das Verständnis des genetischen Hintergrundes wird, abgesehen von genetisch bedingten Erkrankungen wie der hypertrophen oder einem Teil der dilatativen Kardiomyopathien, zu verstehen helfen, wieso einzelne Personen für gewisse Erkrankungen prädisponiert sind und wie sie, bzw. ihre Herzen, auf bestimmte schädigende Einflüsse (z.B. Ischämie, Noxen, virale Erkrankungen), aber auch Therapien reagieren []. Allerdings stehen wir diesbezüglich erst am Anfang und es ist, bedingt durch die Komplexität, nicht zu erwarten, dass in den nächsten Jahren auf diesem Gebiet entscheidende Durchbrüche erzielt werden. Der potentielle Nutzen davon wäre aber enorm gross.
Therapie
Auch die Therapie der Herzinsuffizienz hat eine enorme Entwicklung durchgemacht. Vor 30 Jahren standen neben Digoxin lediglich Diuretika und allenfalls Nitrate zur Verfügung (Figure 2). Entsprechend schlecht waren Befinden und Prognose der Patienten. Andere Mittel gab es nicht, und nach Irrwegen (z.B. positiv inotrop wirkende Substanzen in der chronischen Behandlung) wurde schliesslich entdeckt, dass durch die Blockade der aktivierten Neurohormone, insbesondere des Renin-Angiotensin-Aldosteron-Systems [] und des sympathischen Nervensystems [], eine wesentliche Verbesserung der Therapie der chronischen Herzinsuffizienz erreicht werden kann. Dieses Konzept wurde bereits in den 1970er Jahren angedacht (Betablockade []), jedoch vom Gros verworfen. In den letzten Jahren hat man allerdings entdeckt, dass weitere Verbesserungen bei chronischer Herzinsuffizienz durch zusätzliche Blockade der neurohumoralen Stimulation limitiert zu sein scheinen []. Dafür haben die zusätzliche Verwendung von implantierbaren Devices, insbesondere der CRT, zu einer weiteren, deutlichen Verbesserung hinsichtlich Symptomen und Prognose geführt []. Auch implantierbare Defibrillatoren (ICD) haben die Prognose deutlich verbessert []. Es bleibt allerdings zu definieren, welche Patienten von diesen Möglichkeiten am meisten profitieren, was aktuell intensiv, wenn auch noch nicht mit durchschlagendem Erfolg, erforscht wird.
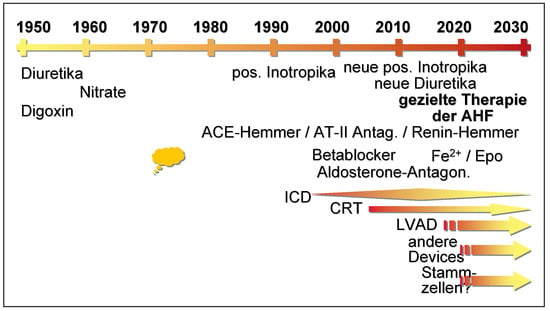
Figure 2.
Auswahl an therapeutischen Möglichkeiten, die bei Herzinsuffizienz wichtig sind, in der Vergangenheit, der Gegenwart und der Zukunft. Zeitachse semiquantitativ.
Table 1 gibt einen (unvollständigen) Überblick über mögliche zukünftige Richtungen bei der Therapie der Herzinsuffizienz. Nachdem, wie oben dargelegt, das bisherige Konzept der Blockade der neurohumoralen Stimulation an gewisse Grenzen stösst, wurde nach alternativen Konzepten gesucht. Dies führte einerseits dazu, dass die Herzinsuffizienz als Systemerkrankung erkannt und entsprechend Begleiterkrankungen als Therapieziele Beachtung fanden. Die systemische Anwendung von (allzu) vielen Medikamenten hat aber nicht nur positive, sondern auch negative Wirkungen und es ist denkbar, dass die medikamentöse Therapie deshalb an gewisse Grenzen stösst. Die eher enttäuschenden Resultate der ersten prospektiven Studie zum Einsatz von Statinen bei Herzinsuffizienz [] könnten einen gewissen Hinweis in diese Richtung geben. Mit der lokalen Applikation von Medika-menten mit genügender Halbwertszeit, z.B. mittels durch Ultraschall lokal zerstörbaren Trägern (vgl. oben), könnten vielleicht Fortschritte diesbezüglich erzielt werden. Diese Technik scheint zudem vielversprechend zu sein, um Gentherapien anwenden zu können.

Table 1.
Mögliche zukünftige Therapien bei Herzinsuffizienz.
Anderseits widmete man sich vermehrt den mechanischen Aspekten. Letzteres führte nicht nur zum Einsatz der CRT, sondern auch zur Suche nach dem Ersatz des Herzens per se. Die allogene Herztransplantation ist dabei durch den Spendermangel und die Komplikationen der Immunsuppression limitiert. Der rein mechanische Ersatz durch eine künstliche Pumpe (sogenanntes Assist Device, entweder linksventrikulär oder gesamtes Herz) ist die Alternative dazu [] und dürfte vor der breiten Anwendung stehen. Die bisherigen Systeme waren durch die möglichen Komplikationen (v.a. Thromboembolien und Infekte) limitiert [] und dienten oft lediglich der Überbrückung bis zur Transplantation. Dies wird sich wahrscheinlich ändern. Es bleibt aber zu zeigen, welche Patienten davon profitieren können. Es dürfte aber kaum möglich sein, das Herz durch eine Mechanik vollständig komplikationslos zu ersetzen. Der Ersatz durch eine Art fremdes Herz (Xenotransplantation) ist prinzipiell möglich, doch sind wichtige immunologische Probleme zu lösen []. Sobald aber genetische Manipulationen möglich sind, stehen dem breiten Einsatz nur noch ethische Probleme und möglicherweise prohibitive Kosten im Wege. Schliesslich wird es vielleicht möglich werden, Myozyten z.B. durch Stammzellen zumindest teilweise zu ersetzen. Allerdings ist nach der initialen Euphorie eine gewisse Ernüchterung eingekehrt, indem aktuell nicht einmal klar ist, ob diese Zellen überhaupt überleben oder ob lediglich parakrine Mechanismen für die (bisher bescheidenen) Effekte verantwortlich sind []. Entsprechend besteht hier zwar ein grosses Potential, aber auch das Risiko, auf eine zum Scheitern verurteilte Technik zu setzen.
Daneben gibt es auch weniger ambitionierte mechanische Therapieziele wie das Angehen einer sekundären Mitralinsuffizienz. Neben der chirurgischen Rekonstruktion ist die interventionelle Mitralanuloplastie vielversprechend [], auch wenn noch nicht klar ist, welche Technik sich hier durchsetzen wird.
Begleiterkrankungen sind häufig bei Herzinsuffizienz, auch wenn es gelegentlich schwierig ist zu unterscheiden, was direkte Folge der Herzinsuffizienz und was eine eigenständige Erkrankung ist. Unabhängig davon hat diese Erkenntnis dazu geführt, dass man sich über die optimale Behandlung dieser Begleiterkrankungen Gedanken machte. Ein aktuell führendes Beispiel ist die Behandlung von Patienten mit Herzinsuffizienz mit Erythropoietin (und Eisen). Grössere Studien fehlen zwar noch, doch stimmen die bisherigen kleineren Studien beschränkt optimistisch [,]. Daneben gibt es noch weitere Ansätze, die in diese Richtung gehen; zukünftige Studien werden zeigen müssen, welche sich tatsächlich für verfolgungswürdig erweisen werden.
Ein aktuell immer noch kaum gelöstes Problem ist die Behandlung (und Abklärung) der akuten Herzinsuffizienz. Lange Jahre wurden dazu, sicher auch wegen der Schwierigkeiten bei der Durchführung von Studien bei akut, teilweise schwer kranken Patienten, kaum Untersuchungen publiziert. In den letzten Jahren hat sich dies zwar etwas geändert, doch sind die bisherigen Resultate insgesamt eher enttäuschend. Ein wesentlicher Grund dafür dürfte darin liegen, dass es sich, im Gegensatz zur chronischen Herzinsuffizienz mit reduzierter systolischer Funktion des linken Ventrikels, bei der akuten Herzinsuffizienz nicht um ein einheitliches Krankheitsbild handelt. Die ersten dazu publizierten Richtlinien versuchen diesem Umstand Rechnung zu tragen [], doch haben bisherige TherapieStudien dies kaum berücksichtigt. Es darf erwartet werden, dass die Berücksichtigung der unterschiedlichen Entitäten bei der akuten Herzinsuffizienz nicht nur das Verständnis verbessern, sondern eine gezieltere und damit viel effektivere Therapie erlauben wird. Aktuelle grössere Therapie-Studien berücksichtigen diesen Umstand allerdings immer noch viel zu wenig.
Weitere Aufgaben
Leider hat sich gezeigt, dass der Weg zwischen dem Erlangen des Wissens einer effektiven Therapie und deren Umsetzung lang und beschwerlich sein kann. So hat sich die Prognose der Herzinsuffizienz in den letzten Jahren und Jahrzehnten zwar signifikant verbessert, doch bei weitem nicht in dem Masse, wie es von den Effekten der grossen Therapie-Studien her zu erwarten wäre []. Es stellt sich deshalb die Frage, wie das aus den Studien gewonnene Wissen in den klinischen Alltag umgesetzt werden kann.
In den letzten Jahren haben multidisziplinäre Ansätze gezeigt, dass diesbezüglich eine Verbesserung möglich ist []. Allerdings be stehen enorme Unterschiede zwischen den Programmen und insbesondere den verschiedenen Ländern, die nur beschränkt auf die unterschiedlichen Gesundheitssysteme zurückzuführen sind. Es fehlt zudem am Verständnis, welche der Massnahmen einer multidisziplinären Behandlung tatsächlich effektiv sind (Compliance, körperliches Training, psychosomatische Effekte usw.). Hier sind noch grosse Anstrengungen nötig; der mögliche Nutzen wäre aber entsprechend gross.
Daneben ist eine deutliche Verbesserung des Transfers von Wissen notwendig, was über das Konzept der «Evidence-based medicine» hinausgehen muss. Letzteres fasst das verfügbare Wissen zwar gut zusammen und bewertet es auch, doch wird den individuellen Umständen der einzelnen Patienten zu wenig Bedeutung beigemessen. Studien, die sich mehr mit Therapiekonzepten als mit einzelnen Therapien befassen wie beispielsweise die TIMECHF-Studie [], können dazu wichtige Informationen liefern. Vernetzung, Zusammenarbeit zwischen verschiedenen Gruppen und die Nutzung der Möglichkeiten der modernen Kommunikation sind Voraussetzungen für den erfolgreichen Wissenstransfer, doch müssen die entsprechenden Pfade erst geschaffen und dann getestet werden. Die Herzinsuffizienz als komplexe Systemerkrankung wird davon profitieren, doch stehen wir immer noch in den Anfängen, auch wenn bereits vor 10 Jahren auf dieses Problem aufmerksam gemacht wurde [].
Aus Gründen der beschränkten Ressourcen, aber auch der zukünftigen Vielfalt an therapeutischen Möglichkeiten wird es zudem nicht mehr möglich sein, die Patienten mit allen zur Verfügung stehenden Therapieoptionen zu behandeln, was einen grundlegenden Wechsel des bisherigen Therapiekonzeptes darstellen wird. Wie bereits weiter oben dargestellt, muss es ein Ziel sein, die für den individuellen Patienten beste Therapie definieren zu können. Neben der Verbesserung der diagnostischen Möglichkeiten wird dabei das «Modelling» der besten Therapieoption eine wichtige Rolle spielen. In diesem Bereich sind allerdings unseres Wissens bei der Herzinsuffizienz noch keine Anstrengungen im Gange.
Schliesslich werden die zur Verfügung stehenden (finanziellen) Ressourcen knapper werden []; dies insbesondere vor dem Hintergrund, dass zukünftige Therapien teurer sein werden und die Anzahl an herzinsuffizienten Patienten weiter steigen wird. Ökonomische Aspekte wurden aber erst in den letzten 10 Jahren bewusst wahrgenommen und entsprechend untersucht. Eine Umsetzung in den klinischen Alltag hat zudem nur insofern stattgefunden, als dass beschränkte Ressourcen den Zugang zu einer adäquaten Therapie für Patienten, die sich die Behandlung nicht leisten können, in einzelnen Ländern verhindern. Diese Auswahl findet aber in keiner Weise auf der Basis von Kosten-Nutzen-Analysen statt. Eine Beschränkung auf dieser Basis wird gemeinhin zwar als unethisch angesehen. Eine sorgfältige Kosten-Nutzen-Analyse wäre aber Voraussetzung für eine gerechtere Verteilung der medizinischen Versorgung. Ein wesentlicher limitierender Faktor ist die Tatsache, dass bisher noch wenig darüber bekannt ist, wie die entstehenden Kosten umfassend beurteilt werden können. Entsprechend berücksichtigen sie nur einen Teil der Kosten (Medikamente und Devices, aber kaum Arztbesuche, Spitex und Arbeitsausfall von Verwandten und Bekannten), was Berechnungen zur Kosten-Effektivität ungenau werden lässt. Um eine bessere Akzeptanz zu erzielen, ist es also nötig, Modelle zu entwickeln, die so weit ausgereift sind, dass sie die Aktualität auch tatsächlich abbilden. Um einen Kollaps unseres Systems zu vermeiden, wäre dies dringend notwendig. Damit liessen sich in Übereinstimmung mit der oben dargelegten individualisierten Therapie individuelle Betreuungskonzepte aufstellen, die nicht nur effektiv, sondern auch bezahlbar wären. Wir sind davon aber noch weit entfernt, doch wir erachten dies als eine der ganz grossen Herausforderungen bei der Behandlung der Herzinsuffizienz, die vielleicht noch wichtiger ist als die Entwicklung neuer Therapien. In diesem Zusammenhang darf die Prävention der Herzinsuffizienz nicht vergessen werden, die potentiell ebenfalls kosteneffektiv ist. Da die Herzinsuffizienz die «Endstrecke» der meisten kardialen Erkrankungen ist, bedeutet Prävention der Herzinsuffizienz Prävention von Herzerkrankungen. Die Entwicklung hinsichtlich kardiovaskulärer Risikofaktoren in unserer Gesellschaft mit zunehmendem Übergewicht, Bewegungsmangel und beschränktem Gesundheitsbewusstsein geht diesbezüglich leider in eine falsche Richtung. Wir werden jedoch nicht umhinkommen, uns hier vermehrt zu engagieren. Verschiedenes weist darauf hin, dass diese Anstrengungen bereits in der Kindheit beginnen sollten [].
References
- Katz, A.M. Heart Failure: Pathophysiology, Molecular Biology, Clinical Management; Lippincott/Williams & Wilkins: Philadelphia, 2000. [Google Scholar]
- Wang, C.S.; FitzGerald, J.M.; Schulzer, M.; Mak, E.; Ayas, N.T. Does this dyspneic patient in the emergency department have congestive heart failure? JAMA. 2005, 294, 1944–1956. [Google Scholar] [CrossRef]
- Kirkpatrick, J.N.; Vannan, M.A.; Narula, J.; Lang, R.M. Echocardiography in heart failure: applications, utility, and new horizons. J Am Coll Cardiol. 2007, 50, 381–396. [Google Scholar] [CrossRef] [PubMed]
- Kaufmann, B.A.; Sanders, J.M.; Davis, C.; et al. Molecular imaging of inflammation in atherosclerosis with targeted ultrasound detection of vascular cell adhesion molecule-1. Circulation. 2007, 116, 276–284. [Google Scholar] [CrossRef] [PubMed]
- Prasad, S.K.; Kotwinski, P.; Assomul, R. The role of cardiovascular magnetic resonance in the evaluation of patients with heart failure. Expert Rev Cardiovasc Ther. 2004, 2, 53–59. [Google Scholar] [CrossRef] [PubMed]
- Assomull, R.G.; Pennell, D.J.; Prasad, S.K. Cardiovascular magnetic resonance in the evaluation of heart failure. Heart. 2007, 93, 985–992. [Google Scholar] [CrossRef]
- Flogel, U.; Jacoby, C.; Godecke, A.; Schrader, J. In vivo 2D mapping of impaired murine cardiac energetics in NO-induced heart failure. Magn Reson Med. 2007, 57, 50–58. [Google Scholar] [CrossRef]
- Florea, V.G.; Anand, I.S. Predicting survival in heart failure. Curr Cardiol Rep. 2007, 9, 209–217. [Google Scholar] [CrossRef]
- Troughton, R.W.; Frampton, C.M.; Yandle, T.G.; et al. Treatment of heart failure guided by plasma aminoterminal brain natriuretic peptide (N-BNP) concentrations. Lancet. 2000, 355, 1126–1130. [Google Scholar] [CrossRef]
- Brunner-La Rocca, H.P.; Buser, P.T.; Schindler, R.; et al. Management of elderly patients with congestive heart failure – design of the Trial of Intensified versus standard Medical therapy in Elderly patients with Congestive Heart Failure (TIME-CHF). Am Heart J. 2006, 151, 949–955. [Google Scholar] [CrossRef] [PubMed]
- McAlister, F.A.; Ezekowitz, J.; Hooton, N.; et al. Cardiac resynchronization therapy for patients with left ventricular systolic dysfunction: a systematic review. JAMA. 2007, 297, 2502–2514. [Google Scholar] [CrossRef]
- Yu, C.M.; Abraham, W.T.; Bax, J.; et al. Predictors of response to cardiac resynchronization therapy (PROSPECT) – study design. Am Heart J. 2005, 149, 600–605. [Google Scholar] [CrossRef]
- de Boer, R.A.; Van Den Berg, M.P.; van Veldhuisen, D.J. Genetics in heart failure: where are we headed? Congest Heart Fail. 2006, 12, 329–332. [Google Scholar] [CrossRef]
- The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med. 1987, 316, 1429–1435. [Google Scholar] [CrossRef] [PubMed]
- Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999, 353, 2001–2007. [CrossRef]
- Swedberg, K.; Hjalmarson, A.; Waagstein, F.; Wallentin, I. Prolongation of survival in congestive cardiomyopathy by betareceptor blockade. Lancet. 1979, 1, 1374–1376. [Google Scholar] [CrossRef]
- Packer, M.; Califf, R.M.; Konstam, M.A.; et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: the Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE). Circulation. 2002, 106, 920–926. [Google Scholar] [CrossRef]
- Bardy, G.H.; Lee, K.L.; Mark, D.B.; et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med. 2005, 352, 225–237. [Google Scholar] [CrossRef]
- Kjekshus, J.; Apetrei, E.; Barrios, V.; et al. Rosuvastatin in older patients with systolic heart failure. N Engl J Med. 2007, 357, 2248–2261. [Google Scholar] [CrossRef] [PubMed]
- Rose, E.A.; Gelijns, A.C.; Moskowitz, A.J.; et al. Long-term mechanical left ventricular assistance for end-stage heart failure. N Engl J Med 2001, 345, 1435–1443. [Google Scholar] [CrossRef]
- Ogata, K.; Platt, J.L. Cardiac xenotransplantation: future and limitations. Cardiology. 2004, 101, 144–155. [Google Scholar] [CrossRef]
- Pfister, O.; Jain, M.; Liao, R. Cell therapy in heart failure. Heart Fail Clin. 2005, 1, 303–312. [Google Scholar] [CrossRef]
- Kaye, D.M.; Byrne, M.; Alferness, C.; Power, J. Feasibility and short-term efficacy of percutaneous mitral annular reduction for the therapy of heart failure-induced mitral regurgitation. Circulation. 2003, 108, 1795–1797. [Google Scholar] [CrossRef][Green Version]
- Ponikowski, P.; Anker, S.D.; Szachniewicz, J.; et al. Effect of darbepoetin alfa on exercise tolerance in anemic patients with symptomatic chronic heart failure: a randomized, doubleblind, placebo-controlled trial. J Am Coll Cardiol. 2007, 49, 753–762. [Google Scholar] [CrossRef]
- Ghali, J.K.; Anand, I.S.; Abraham, W.T.; et al. Randomized double-blind trial of darbepoetin alfa in patients with symptomatic heart failure and anemia. Circulation. 2008, 117, 526–535. [Google Scholar] [CrossRef]
- Nieminen, M.S.; Bohm, M.; Cowie, M.R.; et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J. 2005, 26, 384–416. [Google Scholar]
- Roger, V.L.; Weston, S.A.; Redfield, M.M.; et al. Trends in heart failure incidence and survival in a community-based population. JAMA. 2004, 292, 344–350. [Google Scholar] [CrossRef]
- Holland, R.; Battersby, J.; Harvey, I.; et al. Systematic review of multidisciplinary interventions in heart failure. Heart. 2005, 91, 899–906. [Google Scholar] [CrossRef] [PubMed]
- Smith, J.J.; Konstam, M.A. Heart failure: A case for subspecialized care management. Am Heart J. 1999, 138, 14–16. [Google Scholar] [CrossRef] [PubMed]
- Lee, W.C.; Chavez, Y.E.; Baker, T.; Luce, B.R. Economic burden of heart failure: a summary of recent literature. Heart Lung. 2004, 33, 362–371. [Google Scholar] [CrossRef] [PubMed]
- Baker, J.L.; Olsen, L.W.; Sorensen, T.I. Childhood body-mass index and the risk of coronary heart disease in adulthood. N Engl J Med. 2007, 357, 2329–2337. [Google Scholar] [CrossRef]
© 2008 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.