Abstract
B-type natriuretic peptide (BNP) and NTproBNP are currently the most prominent members of the natriuretic peptide family. These markers are reliably elevated in patients with congestive heart failure (CHF). Accordingly, they are used increasingly in the diagnosis of patients with acute dyspnea, for risk stratification and therapeutic monitoring in patients with established CHF, as well as in patients with acute coronary syndrome.
1. Zusammenfassung
Aus der Familie der natriuretischen Peptide haben sich in den letzten Jahren das B-Typ natriuretische Peptid (BNP) und das NT-proBNP als diagnostisch besonders wertvoll herausgestellt. Beide werden als Herzinsuffizienz-Marker erfolgreich in der Differentialdiagnose der akuten Atemnot, zur Risikostratifizierung und Therapieoptimierung bei bekannter Herzinsuffizienz und zur Abschätzung der Prognose beim akuten Koronarsyndrom eingesetzt.
Key words: natriuretrische Peptide; Diagnose; Dyspnoe; Herzinsuffizienz
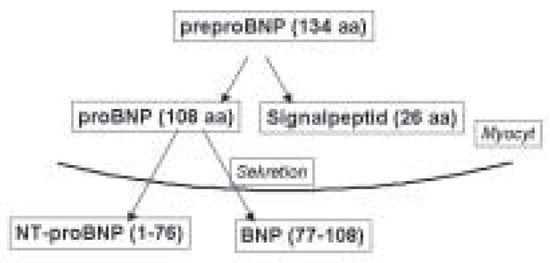
Abbildung 1.
BNP wird von den kardialen Myozyten als Prä-Pro-Hormon aus 134 Aminosäuren (aa) produziert, welches in ein proBNP gespalten wird. Bei entsprechendem Stimulus für die Sekretion wird das biologisch inaktive Fragment N-terminales proBNP (76 aa) und das BNPMolekül (32 aa) selbst freigesetzt.
2. Grundlagen
Das B-Typ natriuretische Peptid (BNP) ist ein 32-Aminosäuren-Neurohormon, das bei erhöhter Wandspannung durch Volumen- oder Drucküberlastung aus dem linken und rechten Ventrikel des Herzens freigesetzt wird [1,2,3]. Zudem spielen für die Freisetzung andere Neurohormone und das sympathische Nervensystem eine Rolle. Wie aus Abbildung 1 hervorgeht, wird BNP von den kardialen Myozyten als Prä-Pro-Hormon aus 134 Aminosäuren produziert, welches in Pro-BNPgespalten wird. Bei entsprechendem Stimulus für die Sekretion wird das biologisch inaktive Fragment NT-proBNPund das BNP-Molekül selbst freigesetzt. Sowohl für BNP als auch für das NT-proBNP stehen gut etablierte Assays zur
Verfügung. Einsatzspektrum, als auch der Nutzen in den jeweiligen klinischen Situationen erscheinen aufgrund der bisherigen Daten im wesentlichen vergleichbar. Da aber zum jetzigen Zeitpunkt das BNP studienmässig umfangreicher dokumentiert ist, soll für diese Übersicht der Begriff «BNP» synonym für BNP und NT-proBNP verwendet werden. BNP ist erhöht bei symptomatischer linksventrikulärer Dysfunktion, und die Höhe korreliert mit dem Schweregrad der Symptome und der Prognose (Abb. 2).
3. BNP bei akuter Atemnot
Kurz zum Umfang des klinischen Problems: Allein in Europa werden pro Jahr über eine Millionen Patienten wegen akuter Atemnot hospitalisiert. Bei mehr als der Hälfte dieser Patienten ist eine Herzinsuffizienz Ursache der Atemnot. Eine gründliche Anamnese, körperliche Untersuchung, das EKG, das ThoraxRöntgenbild und die Sauerstoffsättigung stehen uns auf der Notfall- oder Intensivstation für eine schnelle Differentialdiagnose zur Verfügung. Trotz dieser Methoden ist es jedoch zum Teil sehr schwierig, eine Herzinsuffizienz von anderen in Frage kommenden Erkrankungen (Exazerbation einer COPD / Asthma, Lungenembolie, Pneumonie, Pneumothorax, Hyperventilation usw.) abzugrenzen [4, 5]. Die Symptome der Herzinsuffizienz (z.B. Belastungsdyspnoe, paroxysmale nächtliche Dyspnoe, Orthopnoe, Müdigkeit) überlappen deutlich mit denen von u.a. Lungenerkrankungen; sie sind also nicht spezifisch genug. Die Zeichen der Herzinsuffizienz bei der körperlichen Untersuchung (z.B. Halsvenenstau, positiver hepatojugulärer Reflux, verbreiteter, oft hebender und lateralisierter Herzspitzenstoss, 3. Herzton, Hepatomegalie, Unterschenkelödeme, feinblasige Rasselgeräusche) sind zwar relativ spezifisch, aber nicht sensitiv genug. Dies unterstreicht die Notwendigkeit für zusätzliche diagnostische Hilfsmittel. Die Herzinsuffizienz ist nicht nur häufig, sondern auch mit einem hohen Risiko verbunden, daran zu versterben, oder wegen immer wieder auftretender starker Atemnot in die Klinik eingewiesen zu werden. Die damit verbundenen Kosten sind enorm, ein kosteneffektives Management obligat. Dafür ist jedoch eine schnelle und genaue Diagnose unerlässlich.
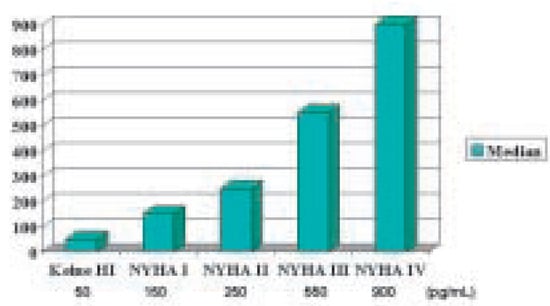
Abbildung 2.
Korrelation zwischen dem Schweregrad der Herzin-suffizienz und BNP in der «Breathing Not Properly»-Studie. HI = Herzinsuffizienz.
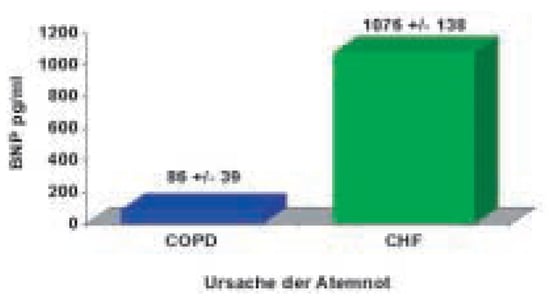
Abbildung 3.
Patienten mit akuter Herzinsuffizienz haben ein deutlich höheres BNP als Patienten mit exazerbierter COPD [8].
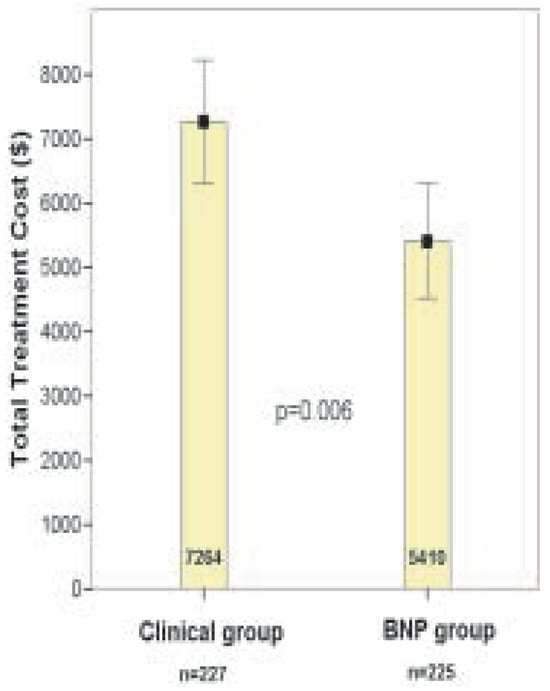
Abbildung 4.
BASEL-Studie: Durch die Verwendung von BNP werden die gesamten Behandlungskosten um 26% reduziert.
Wie könnte BNP hilfreich sein? BNP ist ein quantitativer Herzinsuffizienzmarker. Je schwerer die Herzinsuffizienz, desto höher das BNP. Umgekehrt gilt für den diagnostischen Einsatz, je höher das BNP, desto höher die Wahrscheinlichkeit, dass die Herzinsuffizienz Ursache der akuten Atemnot ist. Mehrere prospektive Beobachtungsstudien konnten in den letzten Jahren zeigen, dass der Miteinbezug von BNP bei der Beurteilung von Patienten mit akuter Atemnot die diagnostische Genauigkeit signifikant erhöht [6,7,8,9]. BNP wird vom Myokard bei erhöhten intrakardialen Drukken und Volumen freigesetzt. Der BNP-Wert ist bei Patienten mit Herzinsuffizienz deutlich höher als bei Patienten, bei denen die Atemnot z.B. aufgrund einer Lungenerkrankung basiert (Abb. 3). Ein niedriger BNP-Wert bei einem Patienten mit akuter Atemnot macht somit die Diagnose «Herzinsuffizienz» sehr unwahrscheinlich und hilft uns Ärzten, zügig eine andere Ursache zu suchen. Umgekehrt erlaubt ein hoher BNP-Wert oft sehr schnell die Diagnose «Herzinsuffizienz» zu stellen, und umgehend mit der adäquaten Behandlung zu beginnen. Der unmittelbare Beginn der richtigen Behandlung wiederum beschleunigt den Erholungsprozess des Patienten und verkürzt die Dauer der Atemnot. Die BASELStudie war nun die erste randomisierte Studie, die zeigte, dass durch die schnelle und genauere Diagnostik auf der Notfallstation tatsächlich die Patientenbehandlung verbessert werden kann. Die Ergebnisse zeigen, dass die Verwendung des BNP-Wertes das Zeitintervall bis zur Verabreichung der adäquaten Therapie von 90 auf 63 Minuten reduzierte, die Notwendigkeit zur stationären Behandlung wurde von 85% auf 75%, die Notwendigkeit zur Behandlung auf der Intensivstation von 24% auf 15% reduziert [10]. Zusätzlich konnte die gesamte Behandlungsdauer von 11 auf 8 Tage reduziert werden (Abb. 4). Dies ging mit einer Kostenreduktion von ca. 1800 Euro pro Patient einher. Zusammenfassend unterstützen die Daten der BASEL-Studie die Empfehlung der Europäischen Gesellschaft für Kardiologie, die Bestimmung von BNP sehr früh in der Abklärung von Patienten mit Atemnot einzusetzen. Die aktuellen Empfehlungen zur Interpretation von BNP-Werten bei Patienten mit akuter Atemnot sind in Abbildung 5 zusammengefasst.
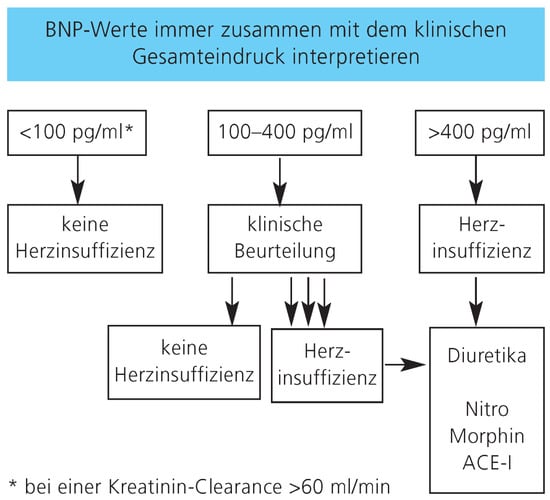
Abbildung 5.
BNP-Werte sollten immer zusammen mit dem klinischen Eindruck interpretiertwerden. Bei einem Patienten mit akuter Atemnot spricht ein BNP-Wert unter 100 pg/ml klar gegen die Ursache Herzinsuffizienz. Bei Patienten mit einge schränkter Nierenfunktion sollte 200 pg/ml als unterer Cut-off-Wert verwendet werden. Bei sehr adipösen Patienten muss ein niedriger Wert (z.B. 70 pg/ml) verwendet werden. Bei Verwendung von NT-proBNP scheint als unterer Cut-off 300 pg/ml die besten Ergebnisse bezüglich Sensitivität und Spezifität zu ergeben. Der obere Cut-off ist abhängig vom Alter: <50 Jahre: 450 pg/ml, 50–75 Jahre: 900 pg/ml, >75 Jahre: 1800 pg/ml.
Aufgrund dieser eindrücklichen Daten bemühen sich mehrere Arbeitsgruppen, einschliesslich der unseren zu überprüfen, ob die exzellenten Ergebnisse der BNP-Bestimmung u.a. auch auf Patienten übertragen werden können, die sich mit Atemnot beim niedergelassenen Arzt vorstellen. Durch die Verwendung eines «point of care»-Testes ist es möglich, die BNP-Bestimmung mit sehr geringem Aufwand direkt in der Praxis selbst durchzuführen und so den BNP-Wert schon innerhalb von 15 Minuten zur Verfügung zu haben. Die bisherigen Erfahrungen sind auch bei den Niedergelassenen sehr ermutigend [9].
4. Prognose und Therapie-optimierung bei chronischer Herzinsuffizienz
BNP ist ein quantitativer HerzinsuffizienzMarker. Je schwerer die Herzinsuffizienz, desto höher das BNP. Wenn ein Patient mit einer dekompensierten Herzinsuffizienz hospitalisiert wird, erlaubt das kurz vor Entlassung bestimmte «Rekompensations-BNP» eine Aussage über die Wahrscheinlichkeit, dass dieser Patient während der nächsten 6 Monate verstirbt oder wegen kardialer Dekompensation erneut hospitalisiert werden muss. Die eindrücklichsten Daten dazu wurden von einer französischen Arbeitsgruppe publiziert. Ein BNP-Wert von über 350 pg/ml vor Entlassung erhöhte das Risiko um den Faktor 5, ein BNP über 700 pg/ml sogar um den Faktor 15 [11]! Mit anderen Worten, fast alle Patienten mit einem Entlass-BNP von über 700 pg/ml erlitten innerhalb der nächsten 6 Monate ein schwerwiegendes Ereignis: Tod oder Rehospitalisation wegen Herzinsuffizienz. Wenn ein niedriges Entlass-BNP mit einem sehr günstigen Langzeitverlauf verbunden ist, erscheint es folgerichtig zu versuchen, durch die uns zu Verfügung stehenden Therapien, eine maximale Suppression des BNP zu erreichen. Dieses Konzept wurde bereits in einer ersten randomisierten Studie mit 69 Patienten in Christchurch (Neuseeland) untersucht [12]. Während 10 Monaten Follow-up ereigneten sich signifikant weniger Ereignisse (Tod, Hospitalisation wegen Herzinsuffizienz oder erneuter Dekompensation, 19 versus 54, p = 0,02) bei Patienten mit Therapieoptimierung nach BNP-Werten. Anscheinend kann durch eine präventive Strategie, bei der Patienten mit hohen BNP-Werten besonders intensiv behandelt und nachkontrolliert werden, eine klinische Verschlechterung deutlich effektiver verhindert werden als eine konventionelle, nach Symptomen und Befunden (Körpergewicht, körperlichen Untersuchung ...) ausgerichteten Therapie. Mehrere Multicenter-Studien laufen aktuell, um diese Hypothese zu bestätigen.
5. Prädiktor für Morbidität und Mortalität nach akutem Koronarsyndrom
Schon vor mehreren Jahren dokumentierten die ersten Arbeiten, das BNP nach einem akuten Myokardinfarkt (AMI) wichtige prognostische Informationen liefern kann, z.T. sogar zusätzlich zur linksventrikulären Auswurffraktion (LVEF) [13, 14]. Diese Beobachtung wurde nun kürzlich für das gesamte Spektrum des akuten Koronarsyndroms erweitert (STHebungs-AMI, AMI ohne ST-Hebung, instabile Angina pectoris). Bei 2525 Patienten korrelierte die Mortalität während der nächsten 10 Monate sehr eng mit der Höhe des BNP. Patienten mit einem BNP in der 4. Quartile hatten eine fast 10fach höhere Mortalität als Patienten in der 1. BNP-Quartile. Die Assoziation blieb auch in der multivariaten Analyse (allerdings ohne die Covariate LVEF) bestehen und war unabhängig vom Ausmass der Myokardnekrose (Troponin T/I). Ein BNP-Wert von 80 pg/ml wurde hierbei als geeigneter Cutoff-Wert vorgeschlagen [15]. Welche unmittelbaren therapeutischen Massnahmen sich für die jeweiligen Risikogruppe ergeben, ist bisher noch nicht ganz klar. Da mit Troponin T/I (Myokardnekrose) [15], C-reaktivem Protein (Inflammation) [16] und Kreatinin (Endorganschaden) zur Abschätzung der Nierenfunktion weitere kardiale Marker als signifikante unabhängige Prädiktoren etabliert sind, eröffnet sich die Möglichkeit, das BNP (hämodynamischer Stress) als einen Baustein einer «Multimarker Strategie» zur Risikostratifizierung einzusetzen.
6. Problemzonen
(1.) Leicht erhöhte BNP-Werte findet man zum Teil auch bei Niereninsuffizienz, ohne dass eine Herzinsuffizienz vorliegt. Daher muss bei Patienten mit Niereninsuffizienz ein unterer Cut-off von 200 pg/ml (statt 100 pg/ml, siehe Abb. 5) verwendet werden. (2.) BNP ist ein guter Herzinsuffizienz-Marker, aber natürlich kein perfekter. Die Sensitivität ist sehr hoch, aber nicht 100%. So können z.B. Mitralvitien und ein perakutes Lungenödem mit «falsch niedrigen» BNP-Werten auftreten. Auch die Spezifität ist nicht 100%. So finden sich BNPWerte über 400 pg/ml z.B. auch bei Sepsis [17] und schwerer pulmonaler Hypertonie [18]. (3.) Adipöse Patienten haben niedrigere BNPWerte als schlanke Patienten [19]. Daher müssen bei adipösen Patienten wahrscheinlich etwas niedrigere Cut-off-Werte verwendet werden. (4.) Ob bei Frauen und bei älteren Patienten andere Cut-off-Werte als bei Männern bzw. jüngeren Patienten verwendet werden sollen, ist unklar. Auch aufgrund von Praktikabilitätsgründen befürworten wir die in Abbildung 5 dargelegten Cut-off-Werte unabhängig von Alter und Geschlecht. (5.) Das BNP tritt in mehreren Indikationsbereichen als preisgünstige und Untersucher-unabhängige Methode in Konkurrenz zur Echokardiographie. Weitere Studien sind nötig, um abschliessend beurteilen zu können, in welchen Indikationsgebieten das BNP die Echokardiographie ergänzen oder allenfalls gar ersetzen kann.
Zusammenfassend darf festgestellt werden, dass die Bestimmung von BNP als Herzinsuffizienz-Marker vor allem bei Patienten mit akuter Atemnot einen deutlichen Informationsgewinn bedeutet. Die Kosten der Bestimmung sind gering und werden durch anderweitige Ersparnisse durch den Informationszugewinn bei weitem aufgehoben. Für die anderen angesprochenen klinischen Situationen wird der unmittelbare Nutzen der BNP-Bestimmung erst durch aktuell laufende Studien geklärt werden.
Diese Arbeit wurde unterstützt durch den Schweizerischen Nationalfonds, die Schweizerische Herzstiftung, die Novartis Stiftung und die Universität Basel.
References
- Yasue, H.; Yoshimura, M.; Sumida, H.; Kikuta, K.; Kugiyama, K.; Jougasaki, M.; et al. Localisation and mechanism of secretion of B-type natriuretic peptide in comparison with those of Atype natriuretic peptide in normal subjects and patients with heart failure. Circulation 1994, 90, 195–203. [Google Scholar] [CrossRef] [PubMed]
- Levin, E.R.; Gardner, D.G.; Samson, W.K. Natriuretic peptides. N Engl J Med 1998, 339, 321–8. [Google Scholar] [PubMed]
- Brunner-La Rocca, H.P.; Kaye, D.M.; Woods, R.L.; Hastings, J.; Esler, M.D. Effects of intravenous brain natriuretic peptide on regional sympathetic activity in patients with chronic heart failure as compared with healthy control subjects. J Am Coll Cardiol 2001, 37, 1221–7. [Google Scholar] [CrossRef] [PubMed]
- Hunt, S.A.; Baker, D.W.; Chin, M.H.; Cinquegrani, M.P.; Feldman, A.M.; Francis, G.S.; et al. ACC/AHA guidelines for the evaluation and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2001, 104, 2996–3007. [Google Scholar] [PubMed]
- Remme WJ, Swedberg K for the Task Force for the Diagnosis and Treatment of Chronic heart Failure, European Society of Cardiology. Guidelines for the diagnosis and treatment of chronic heart failure. Eur Heart J 2001, 22, 1527–60.
- Maisel, A.S.; Krishnaswamy, P.; Nowak, R.M.; McCord, J.; Hollander, J.E.; Duc, P.; et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med 2002, 347, 161–7. [Google Scholar] [CrossRef] [PubMed]
- McCullough, P.A.; Nowak, R.M.; McCord, J.; Hollander, J.E.; Herrmann, H.C.; Steg, P.G.; et al. B-type natriuretic peptide and clinical judgement in emergency diagnosis of heart failure. Analysis from Breathing Not Properly (BNP) Multinational Study. Circulation 2002, 106, 416–22. [Google Scholar] [PubMed]
- Dao, Q.; Krishnaswamy, P.; Kazanegra, R.; Harrison, A.; Amirnovin, R.; Lenert, L.; et al. Utility of B-type natriuretic peptide in the diagnosis of congestive heart failure in an urgent-care setting. J Am Coll Cardiol 2001, 37, 379–85. [Google Scholar] [CrossRef] [PubMed]
- Wright, S.P.; Doughty, R.N.; Pearl, A.; et al. Plasma amino-terminal pro-brain natriuretic peptide and accuracy of heartfailure diagnosis in primary care. A randomized, controlled trial. J Am Coll Cardiol 2003, 42, 1793–800. [Google Scholar] [CrossRef] [PubMed]
- Mueller Ch Scholer, A.; Laule-Kilian, K.; Martina, B.; Schindler, C.; Buser, P.; et al. Use of B-type natriuretic peptide in the evaluation and management of acute dyspnea. N Engl J Med 2004, 350, 647–54. [Google Scholar] [CrossRef] [PubMed]
- Logeart, D.; Thabut, G.; Jourdain, P.; Chavelas, C.; Beyne, P.; Beauvais, F.; et al. Predischarge B-type natriuretic peptide assay for identifying patients at high risk of re-admission after decompensated heart failure. J Am Coll Cardiol 2004, 43, 635–41. [Google Scholar] [CrossRef] [PubMed]
- Troughton, R.W.; Frampton, C.M.; Yandle, T.G.; Espiner, E.A.; Nicholls, M.G.; Richards, A.M. Treatment of heart failure guided by plasma aminoterminal brain natriuretic peptide (NBNP) concentrations. Lancet 2000, 355, 1126–30. [Google Scholar] [CrossRef] [PubMed]
- Omland, T.; Aakvaag, A.; Bonargee, V.V.; Caidahl, K.; Lie, R.T.; Nilsen, D.W.; et al. Plasma brain natriuretic peptide as an indicator of left ventricular systolic function and long term survival after acute myocardial infarction. Circulation 1996, 93, 1963–9. [Google Scholar] [CrossRef] [PubMed]
- De Lemos, J.A.; Morrow, D.A.; Bentley, J.H.; Omland, T.; Sabatine, M.S.; McCabe, C.H.; et al. The prognostic value of B-type natriuretic peptide in patients with acute coronary syndromes. N Engl J Med 2001, 345, 1014–21. [Google Scholar] [CrossRef] [PubMed]
- Morrow, D.A.; De Lemos, J.A.; Sabatine, M.S.; Murphy, S.A.; Demopoulos, L.A.; DiBattiste, P.M.; et al. Evaluation of B-type natriuretic peptide for risk assessment in unstable angina/ non-ST-elevation myocardial infarction. J Am Coll Cardiol 2003, 41, 1264–72. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Mueller Ch Buettner, H.J.; Hodgson, J.M.B.; Marsch, S.; Perruchoud, A.P.; Roskamm, H.; et al. Inflammation and long-term mortality after non-ST-elevation acute coronary syndrome treated with a very early invasive strstrategy in 1042 consecutive patients. Circulation 2002, 105, 1412–5. [Google Scholar] [CrossRef] [PubMed]
- Tung, R.H.; Garcia, C.; Morss, A.M.; Pino, R.M.; Fifer, M.A.; Thompson, B.T.; et al. Utility of B-type natriuretic peptide for the evaluation of intensive care unit shock. Crit Care Med 2004, 32, 1643–7. [Google Scholar] [CrossRef] [PubMed]
- Nagaya, N.; Nishikimi, T.; Uematsu, M.; Satoh, T.; Oya, H.; Kyotani, S.; et al. Plasma brain natriuretic peptide as a prognostic indicator in patients with primary pulmonary hypertension. Circulation 2000, 102, 865–70. [Google Scholar] [CrossRef] [PubMed]
- Wang, T.J.; Larson, M.G.; Levy, D.; Benjamin, E.J.; Leip, E.P.; Wilson, P.W.F.; et al. Impact of obesity on plasma natriuretic peptide levels. Circulation 2004, 109, 594–600. [Google Scholar] [CrossRef] [PubMed]
© 2004 by the authors. Attribution - Non-Commercial - NoDerivatives 4.0.