Abstract
Non-vitamin K-dependent oral anticoagulants have replaced vitamin K antagonists in thromboembolism prevention in the case of non-valvular atrial fibrillations as a first choice treatment, based on studies with 4 different substances with tens of thousands of patients, which prove the safety, above all, but also the efficacy of the substances. This is being increasingly reinforced by “real world data”, which, despite numerous important limitations, are able to show an overall consistent effect with the large randomized clinical trials. Even in special situations, such as renal failure, fragility and other high-risk groups, NOACs appear to be superior to vitamin K antagonists. Meanwhile, a direct effective antidote to Dabigatran is available; approval for the antidote for the FXa inhibitor is expected for 2018. In the case of patients with absolute contraindications for anticoagulation, the interventional left atrial appendage occlusion may represent a good alternative option.
Einführung
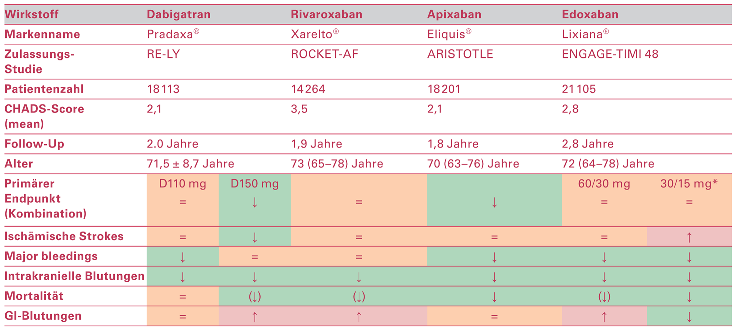
Das Vorhoffiimmern stellt weiterhin die häufigste Form supraventrikulärer Herzrhythmusstörungen dar und seine Prävalenz nimmt zu. Im Jahr 2010 waren über 30 Millionen Menschen weltweit davon betro en [1], wobei nach verschiedenen Schätzungen in 20 Jahren 14–17 Millionen Patienten allein in Europa zu erwarten sind [2]. Die wichtigste Komplikation des Vorhoffiimmerns ist der Hirnschlag. Bereits Ende des letzten Jahrtausends konnte nachgewiesen werden, dass Vitamin-K-Antagonisten durch eine Hemmung des Gerinnungssystems die Rate an Vorhoffiimmernassoziierten Hirnschlägen signifikant verringern [3,4]. In der Tat stellt die Antikoagulation bisher die einzige in grossen Studien nachgewiesene Therapie dar, die zu einer Reduktion der Morbidität und Mortalität beim Vorhoffiimmern führt. Mit den direkten, nicht Vitamin-K-abhängigen oralen Antikoagulantien (NOACs) stehen nunmehr vier Substanzen zur Verfügung, mit denen die Behandlung weiter verbessert werden kann [5,6,7,8,9,10] – mit mindestens äquivalenter Reduktion von Schlaganfällen bei Reduktion schwerer Blutungen und Hirnblutungen sowie zumindest tendenziell einer Reduktion der Gesamtmortalität (Table 1 [11]). Die Vielfalt der Substanzen, die heute eingesetzt werden können, hat einerseits zur «Qual der Wahl» geführt, welches Medikament bei welchem Patienten eingesetzt werden sollte, andererseits jedoch vor allem Möglichkeiten für eine Individualisierung der Therapie eröffnet. Das Ziel dieses Übersichtsartikels ist es, die wichtigsten Neuerungen im Bereich der direkten Antikoagulantien zusammenzufassen. Die Essenz dieser Arbeit wurde an der SGK-Jahrestagung 2016 in Lausanne präsentiert und basiert zum Teil auf früheren Übersichtsarbeiten der Autoren [12,13,14,15].

Table 1.
Übersicht über die Phase-III-Studien der zugelassenen NOACs. Cave: Kein direkter Vergleich möglich! Zusammenstellung nur zur Illustration.
Guidelines ESC 2016
Die Vorhoffiimmern-Guidelines der Europäischen GeGesellschaft ür Kardiologie bezüglich oraler Antikoagulation [11] enthalten unter anderem folgende wichtige Neuerungen:
Welche Patienten benötigen eine orale Antikoagulation ?
- -
- Unverändert zu den Guidelines aus dem Jahr 2012 soll das Risiko für ein thrombembolisches Ereignis anhand des CHA2DS2-VASc-Score berechnet werden (Klasse I, Level of Evidence A) [11].
- -
- Ein Score von ≥2 bei Männern bzw. ≥3 bei Frauen impliziert ein signifikant erhöhtes Risiko, womit diese Patientengruppe von einer oralen Antikoagulation profitiert (Klasse I, Level of Evidence A).
- -
- Bei einem CHA2DS2-VASc-Score von 0 bei Männern bzw. 1 bei Frauen (bedingt durch das weibliche Geschlecht als einzigem Risikofaktor) gibt es keine Daten, dass eine orale Antikoagulation in der Stroke-Prävention einen Vorteil bringt, womit diese Population keine orale Antikoagulation benötigt.
- -
- Bei einem CHA2DS2-VASc von 1 bei Männern bzw. 2 bei Frauen gibt es mittlerweile wachsende Evidenz, dass eine orale Antikoagulation auch hier die Stroke-Rate reduziert. Daher empfehlen die Guidelines, dass auch in dieser Population eine orale Antikoagulation begonnen werden sollte (Klasse-IIa-Indikation) [11].
- -
- Der HAS-BLED-Score wird in den neuen Guidelines nicht mehr zur Risikostratifizierung bezüglich Blutungsrisiko empfohlen. Dies vor dem Hintergrund, dass Patienten mit einem hohen HAS-BLED-Score in der Regel auch einen erhöhten CHA2DS2-VASc-Score vorweisen und in manchen Arbeiten sogar relativ gesehen mehr von einer Antikoagulation profitieren als solche mit niedrigem HAS-BLED-Score [16]. Stattdessen wird empfohlen, bei jeder Kontrolle auf reversible Risikofaktoren für eine Blutung zu achten und diese wenn irgend möglich zu kontrollieren.
Welche Antikoagulantien sollten eingesetzt werden?
- -
- Bereits in den letzten Guidelines von 2012 hat das Expertengremium die NOACs gegenüber den Vitamin-K-Antagonisten bevorzugt, damals mit einer Empfehlungsklasse IIa [17]. Mittlerweile hat sich die Überlegenheit der NOACs in zahlreichen weiteren Studien, Subgruppenanalysen sowie in «Realworld»-Erhebungen bestätigt, so dass die neuen Guidelines 2016 eindeutig den NOACs vor den Vitamin-K-Antagonisten den Vorzug geben, dies mit einer Klasse-I-Indikation und einem Level of Evidence A [11]. Quintessenz: Therapie der Wahl zur Schlaganfallsprävention bei Vorhoffiimmern sind die NOACs.
- -
- Als weitere Neuerung wird nunmehr klar vom Einsatz von Plättchenhemmern wie Aspirin als alleinige Therapie in der Prävention eines Hirnschlages beim Vorhoffiimmern abgeraten (Klasse III) – dies vor dem Hintergrund, dass der Benefit dieser Substanzen marginal ist, das Blutungsrisiko hingegen deutlich unterschätzt wird. Plättchenhemmer spielen somit heutzutage in dieser Indikation keine Rolle mehr.
Wie Vorgehen bei Patienten mit einer eingeschränkten Nierenfunktion?
Eine eingeschränkte Nierenfunktion geht mit einem erhöhten Risiko für thrombembolische Ereignisse wie auch für vermehrte Blutungen einher [14,18]. Andererseits werden die direkten Antikoagulantien in unterschiedlichem Ausmass über die Niere eliminiert, so dass die Dosis entsprechend der Nierenfunktion angepasst werden muss [11] (Abb. 1). Die bisherigen Daten zeigen, dass NOACs bei leichter bis mittelschwer eingeschränkter Nierenfunktion (CrCl >30 ml/min) sicher verwendet werden können. In allen grossen Zulassungsstudien wurden Patienten mit einer CrCl von über 30 ml/min eingeschlossen (in der ARISTOTLEStudie bis zu einer CrCl von 25 ml/min), wobei die Effektivität gegenüber Warfarin (Reduktion thromboembolischer Ereignisse) unabhängig von der Nierenfunktion war. Gemäss den europäischen Guidelines sind alle direkten Antikoagulantien bis zu einer CrCl von 30 ml/min zugelassen (mit Dosisreduktion gemäss Schema). Persönlich setzen wir Dabigatran bei einer CrCl unter 40 ml/min in der Regel nicht mehr ein, da bei einer renalen Clearance von >80% das Risiko einer Akkumulation bei (teil akzidenteller) Verschlechterung der Nierenfunktion deutlich erhöht ist.
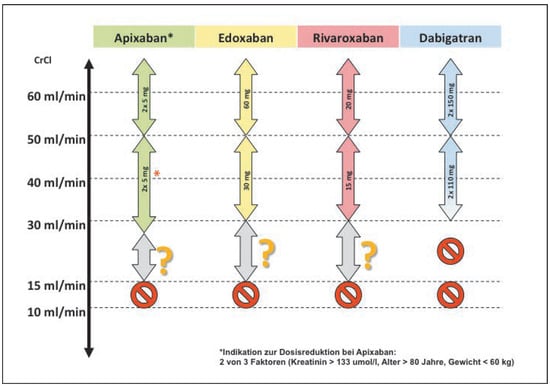
Abbildung 1.
Verwendung der NOACs bei eingschränkter Nierenfunktion. Siehe Text für Details. * Dosisreduktion von Apixaban bei 2 von 3 Kriterien: Alter ≥80 Jahre, Gewicht ≤60 mg, Kreatinin ≥133 µmol/l.
Im Bereich einer CrCl von 15–30 ml/min besteht ein Graubereich. Eine CrCl von unter 30 (bzw. 25) ml/min war zwar Ausschlusskriterium in den Zulassungsstudien. In einer Subgruppen-Analyse der ARISTOTLE-Studie konnte gezeigt werden, dass bei mittelschwer eingeschränkter Nierenfunktion (CrCl 30–50 ml/min) eine relativ gesehen grössere Reduktion der Blutungskomplikationen im Vergleich zu Warfarin nachgewiesen wurde als bei Patienten mit leicht eingeschränkter oder normaler Nierenfunktion [19,20]. Ein ähnlicher Trend lässt sich für Edoxaban beobachten [21,22]. Extrapolative Daten bei Patienten mit sich verschlechternder Nierenfunktion zeigen darüber hinaus kein Signal für reduzierte Effizienz oder Sicherheit bei Patienten mit schwerer Niereninsuffizienz. In der Tat erscheint es unwahrscheinlich, dass sich die Beobachtungen der ARISTOTLE- bzw. ENGAGE-AF-Studie bei einer CrCl von 15–30 ml/min zu Gunsten des Warfarins ändern würden, so dass in der Schweiz alle Faktor-Xa-Hemmer (Apixaban, Edoxaban, Rivaroxaban) bis zu einer CrCl von 15 ml/min zugelassen sind. Spezifische randomisierte Studien für den Einsatz von NOACs bei Patienten mit schwer eingeschränkter Nierenfunktion liegen gegenwärtig noch nicht vor, sie werden in einigen Jahren erwartet. Andererseits liegen solche Studien für Vitamin-K-Antagonisten ebenfalls nicht vor (und laut Schweizerischer Fachinformation ist Phenprocoumon kontraindiziert bei Patienten mit «manifester Niereninsuffizienz»). Entsprechend ist die Kontraindikation, die noch in den Guidelines 2012 für Vorhoffiimmern für den Einsatz von NOACs bei schwerer Niereninsuffizienz bestand, in den neuen Guidelines nicht mehr genannt. Die Entscheidung muss, wie häufig in ähnlichen Grenzsituationen, individualisiert gefällt werden. Wir empfehlen in der Regel den Einsatz von (dosisreduziertem) Apixaban oder Edoxaban auch bei Patienten mit schwer eingeschränkter Nierenfunktion vor dem Einsatz eines Vitamin-K-Antagonisten, jedoch nicht ohne eine ausführliche Aufklärung hinsichtlich Nutzen, Risiko und Datenlage in dieser Patientenpopulation.
Zweifelsohne von grosser Bedeutung ist eine regelmässige Kontrolle der Nierenretentionsparameter und eine Anpassung, bzw. ein Wechsel der Substanz bei sich verschlechternder Funktion der Nieren.
Antidota der direkten oralen Antikoagulantien
Eine bisher oft vorgebrachte Limitation der neuen direkten Antikoagulantien war das Fehlen eines Antidots. Trotz signifikant weniger Blutungskomplikationen der NOACs verglichen mit VKA [23,24] können Situationen auftreten (schwere Blutungen, notfallmässiger chirurgischer Eingri), in denen eine sofortige, spezifische Antagonisierung wünschenswert ist. Mittlerweile sind für beide Wirkstogruppen spezifische Antidota entwickelt worden: Idarucizumab als Hemmer von Dabigatran, das bereits zugelassen ist, sowie die bis anhin noch nicht zugelassenen Substanzen Andexanet alfa als Antidot der FXa-Hemmer und Ciraparantag als Inhibitor für beide Substanzklassen (Abb. 2) [25].
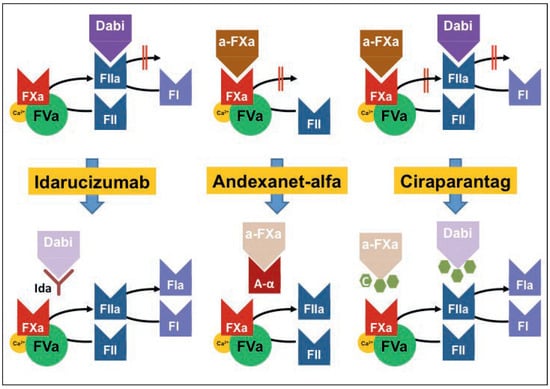
Abbildung 2.
Wirkmechanismen der direkten NOAC-Antagonisten. Siehe Text für Details.
Idarucizumab (Praxbind®)
Idarucizumab ist ein humanisiertes Antikörperfragment mit einer 350-mal höheren Affinität für Dabigatran als Thrombin, womit es stärker an dessen aktivem Zentrum bindet und somit die Inaktivierung des Thrombins vermeidet [26]. In der Phase-III-RE-VERSE AD (REversal Effects of Idarucizumab on Active Dabigatran) Studie wurden 90 Patienten unter Dabigatran-Einnahme mit entweder einer aktiven, schweren Blutung oder mit einer notfallmässigen Operation-/Interventions-Indikation mit Idarucizumab behandelt [27]. Bei beinahe allen Patienten wurde innert Minuten die prokoagulatorische Wirkung von Dabigatran aufgehoben. Eine suffiziente Hämostase konnte bei den Patienten mit einer Blutung innert 11 Stunden erreicht werden; eine unauällige intraoperative Gerinnungssituation fand sich bei 33 der 36 Patienten, die sich unter Dabigatranmedikation einer Notfalloperation unterziehen mussten.
Idarucizumab (Praxbind®) ist inzwischen in der Schweiz zugelassen. Die Ziel-Dosis beträgt 5 g und wird intravenös in zwei Dosen à 2.5 g über jeweils 5–10 Minuten verabreicht.
Andexanet alfa
Andexanet alfa ist ein modifiziertes FXa-Protein mit einer hohen Affinität zum aktiven Zentrum der FXaHemmer, ist aber so verändert, dass es katalytisch nicht aktiv ist [28]. Zwei parallele Phase-III-Studien (ANNEXA-A und ANNEXA-R) belegten die rasche Antagonisierung des E ekts von sowohl Apixaban wie auch Rivaroxaban nach einer Bolus-Gabe, gefolgt von einer Infusion von Andexanet alfa bei gesunden Probanden [29]. Im Rahmen der prospektiven ANNEXA-4-Studie wurde die Wirkung von Andexanet alfa bei Patienten mit einer schweren Blutung untersucht (typischerweise gastrointestinal oder intrakranial). Bei 79% der Patienten konnte innerhalb von 12 Stunden nach der Applikation eine sehr gute Hämostase erreicht werden, dies bei ebenfalls nur geringen Nebenwirkungen [30]. Aktuell ist Andexanet alfa von der Food and Drug Administration (FDA) wie auch von der Swissmedic noch nicht zugelassen; die Zulassung in der Schweiz wird für frühestens 2017 erwartet.
Ciraparantag
Ciraparantag ist das bisher einzige Antidot, das sowohl FXa-Antagonisten wie auch den direkten Thrombinhemmer Dabigatran hemmt. Es ist ein kleines Molekül, das über Wasserstoffbrücken an Heparin wie auch an die aktiven Zentren von FXa-Hemmern und Dabigatran bindet [31]. Bisher wurde es bei Probanden untersucht, die Edoxaban eingenommen haben, und zeigte eine sofortige (innert 10 Minuten) und andauernde (über 24 Stunden) Wirkung [31].
«Real world»-Daten
Eine bisherige «Limitation» der NOACs war das Fehlen von Daten bezüglich der Effektivität und Sicherheit unter Alltagsbedingungen. Auch diesbezüglich gibt es erfreulicherweise neue Untersuchungen, die nicht nur die tiefe Rate der Blutungskomplikationen, die in den Zulassungsstudien beobachtet wurde, bestätigt [32,33], sondern auch die Wirksamkeit untersucht haben [33,34,35]. Diese Studien verwendeten Daten von Patienten, die in den USA einem Versicherungsverbund angehörten. Patienten unter den jeweiligen NOACs wurden in einer sogenannten «Propensity Score Matched»-Analyse mit Patienten von potentiell gleichem Risiko unter Warfarin verglichen. Zusammenfassend bestätigen die Studien die Sicherheit der neuen Substanzen (Reduktion der Blutungskomplikationen), die in den Studien nachgewiesen werden konnte, bei gleichzeitig sehr guter Effektivität [33,34,35].
Eine retrospektive Analyse von Yao et al. von der Mayo Clinic konnte bei knapp über 125 OOO Patienten mit Vorhoffiimmern unter oraler Antikoagulation die Überlegenheit von Apixaban gegenüber VKA in der Reduktion von Schlaganfällen oder systemischen Embolien bei gleichzeitiger Reduktion aller relevanten Blutungskomplikationen («Major bleedings», intrakranielle und gastrointestinale Blutungen) bestätigen [9,33]. Ebenso widerspiegelten die Ergebnisse die Befunde für Rivaroxaban: In der Effektivität gleich wie Warfarin bei weniger intrakraniellen, aber vermehrten gastrointestinalen Blutungen (was in etwa den Ergebnissen der ROCKET-AF-Zulassungsstudie entspricht) [8,33]. Etwas unterschiedlich waren die Daten für Dabigatran: Die Wirkung bezüglich des Endpunkts Stroke / systemische Embolien war gleich wie bei Warfarin, bei tendenziell im Vergleich zur Studie eher besserem Blutungs-Nebenwirkungsprofil (insbesondere keine erhöhte Rate an gastrointestinalen Blutungen) [7,33].
In der REVISIT-US-Studie wurden Rivaroxaban und Apixaban jeweils mit Warfarin verglichen. Für beide Substanzen bestätigte sich erneut die signifikant tiefere Rate an intrakraniellen Blutungen. Der kombinierte Endpunkt war bei der Rivaroxaban-Population ebenfalls signifikant tiefer, was primär durch die Reduktion der hämorrhagischen Schlaganfälle bedingt war (dies bei numerischer, wenn auch knapp nicht signifikanter tieferer Rate an ischämischen Hirnschlägen alleine). Die Apixaban-Population zeigte numerisch ebenfalls eine Reduktion des kombinierten Endpunkts; bezüglich ischämischen Hirnschlägen zeigte sich eine ähnliche Rate wie unter Warfarin. Eine mögliche Erklärung für diese Diskrepanz ist die höhere Rate an Patienten, welche die reduzierte Dosis an Apixaban eingenommen haben (2.5 mg vs. 5 mg) [34].
Schliesslich wurden in einer kürzlich publizierten FDA-Analyse erstmals Patienten unter Dabigatran (N = 52240) mit solchen unter Rivaroxaban (N = 66651) verglichen [35]. Die Studie zeigte einen Trend für ein niedrigeres thrombobembolisches Schlaganfallsrisiko unter Rivaroxaban verglichen mit Dabigatran (HR, 0.81; 95%CI, 0.65–1.01; P = 0.07) [35]. Gleichzeitig zeigte sich jedoch eine höhere Inzidenz sowohl intrakranieller (HR, 1.65; 95%CI, 1.20–2.26; P = 0.002) als auch schwerer extrakranieller Blutungen (HR, 1.48; 95%CI, 1.32–1.67; P <0.001) sowie ein Trend zu einer höheren Gesamtmortalität (HR, 1.15; 95%CI, 1.00–1.32; P = 0.051).
«Real world»-Daten sind wichtig, um den Effekt einer neuen Therapie unter Alltagsbedingungen zu untersuchen. Dies ist der Vorteil gegenüber der Zulassungsstudie, die eine genau vordefinierte Population unter besten Beobachtungsbedingungen einschliesst. Naturgemäss haben aber auch solche Untersuchungen relevante Limitationen, die in der Gesamtheit zuweilen grösser sind als die randomisierter Studien. Es sind retrospektive Analysen. Die Diagnosen und die Verschreibungen der oralen Antikoagulantien wurden anhand von Versicherungsdaten gesammelt; daher ist nicht auszuschliessen, dass einzelne Diagnosen inkorrekt waren oder dass die Medikamente nicht eingenommen wurden; eine zentrale Adjudikation findet nicht statt. Ausserdem fehlen gewisse Angaben wie z.B. die LVEF und der Typ des Vorhoffiimmerns (paroxysmal vs. persistierend). Das Problem des «residuellen Confounding», also von Unterschieden in den Baseline-Charakteristika zwischen den Gruppen, die nicht erfasst wurden, ist das wahrscheinlich grösste Problem solcher Untersuchungen, was deren Aussagekraft letztlich enorm limitiert. Ebenso der Einschluss von zum Teil selektierten Patientenpopulationen (z.B. nur ältere Patienten bei Graham et al. [35]) Schliesslich ist das Follow-up zuweilen sehr kurz (speziell in der genannten FDA-Analyse). Zusammenfassend müssen solche Analysen mit grosser Vorsicht genossen werden und dürfen nicht unter dem Mantel der «Real world» und einem suggerierten «realistischen Abbild der Verschreibungswirklichkeit» als einzige Wahrheit überinterpretiert werden. Insbesondere erscheinen Aussagen über nicht unter Studienbedingungen untersuchte Vergleiche – wie beispielsweise der oben aufgeführte direkte Vergleich von Dabigatran und Rivaroxaban – äusserst fragwürdig und aufgrund der genannten Limitationen nicht legitim. Die primäre Aussage der «Real world»-Daten ist die prinzipielle Bestätigung der in den grossen Zulassungsstudien erhoben Ergebnisse; und dies ist als sehr positiv zu werden.
NOACs bei Patienten mit Sturzrisiko
Antikoagulation bei Patienten mit Sturzrisiko ist eine grosse Herausforderung. Zum einen steigt die Prävalenz des Vorhoffiimmerns bei fragilen, älteren Patienten an; auch das Risiko eines assoziierten Hirnschlags ist höher, nicht zuletzt aufgrund des Alters sowie der oft vorhandenen Komorbiditäten (arterielle Hypertonie, Diabetes mellitus usw.). Auf der anderen Seite steigt das Risiko für Blutungskomplikationen. Patienten mit Sturzrisiko stellen daher eine bezüglich Antikoagulation chronisch unterversorgte Population dar, obwohl extrapolative Analysen ergeben haben, dass Patienten knapp 300-mal pro Jahr stürzen müssten, damit das Risiko einer schweren Blutung den Benefit überwiegen würde [36]. Zur Rolle der NOACs bei diesen Patienten lagen bisher nicht viele Daten vor. Eine kürzlich publizierte Subgruppen-Analyse der ENGAGETIMI-48-Studie hat die Effizienz und Sicherheit von Edoxaban bei Patienten mit erhöhtem Sturzrisiko gegenüber jenen ohne erhöhtes Risiko verglichen [37]. Dabei konnte nachgewiesen werden, dass trotz eines erhöhten Sturzrisikos in dieser Population der Benefit von Edoxaban erhalten blieb und insbesondere die intrakraniellen und schweren Blutungskomplikationen nicht zugenommen haben, was für eine hohe Sicherheit der Substanz spricht. Aufgrund des höheren absoluten Risikos für Ereignisse war auch die absolute Risiko-Reduktion ausgeprägter bei diesen Patienten, mit entsprechend kleinerer «number needed to treat» unter Behandlung mit Edoxaban verglichen mit VKA.
Device-Systeme zur Reduktion von thrombembolischen Ereignissen
Der grosse Nachteil aller oralen Antikoagulantien ist die Tatsache, dass sie in der Regel lebenslang eingenommen werden müssen, womit das Risiko an Blutungskomplikationen immer vorhanden ist. Mit den Vorhofsohr-Occludersystemen soll das Problem der Langzeit-Antikoagulation umgangen werden. Das am intensivsten untersuchte Device ist das Watchmann®-System von Boston Scientific [11]; es liegen dazu hierzu Daten von zwei randomisierten Trials (PROTECT AF und PREVAIL) sowie Resultate einer Meta-Analyse auf Patientenlevel vor, in der neben den beiden erwähnten Studien auch Patienten aus zwei Beobachtungsregistern eingeschlossen wurden [38,39,40,41,42].
Die Langzeitdaten der PROTECT-AF Studie sind positiv und zeigen einen Mortalitätsbenefit des Occluders gegenüber der Antikoagulation mit Warfarin [43]. Letzterer wird jedoch primär durch eine Reduktion der schweren Blutungen sowie von Hirnblutungen getragen (ähnlich wie bei den NOACs vs. Warfarin); eine Reduktion der ischämischen Infarkte konnte nicht gesehen werden. Im Gegenteil; die Ergebnisse der Meta-Analyse zeigen, dass bezüglich des primären kombinierten Endpunkts hämorrhagischer und ischämischer Hirnschlag der mechanische Vorhofsohrverschluss gleich gut ist wie die Therapie mittels Warfarin.
Untersucht man hingegen die beiden Hirnschlag-Formen getrennt, zeigt sich in der Gruppe mit Verschluss-System eine Erhöhung der ischämischen bei gleichzeitig reduzierter Inzidenz hämorrhagischer Strokes (was nachzuvollziehen ist bei fehlender Notwendigkeit einer oralen Antikoagulation). Die erhöhte Inzidenz ischämischer Hirnschläge suggeriert in erster Linie, dass Patienten mit Vorhoffiimmern Schlaganfälle auch auf dem Boden anderer Pathologien erleiden, nicht nur als Folge von Thromben aus dem Vorhofsohr [42].
Aktuell sind die Vorhofsohr-Occluder-Systeme daher zur Schlaganfallsprophylaxe nicht den oralen Antikoagulantien gleichzustellen und werden gemäss den neuen Guidelines 2016 für Vorhoffiimmern – der verfügbaren Evidenz entsprechend – lediglich bei Patienten mit einer Kontraindikation zur Antikoagulation empfohlen (Indikation IIb) [11]. Zu einer Ausweitung der Indikation werden zwingend weitere Studien notwendig sein, unter anderem ein Vergleich der Occluder mit NOACs als Kontrolle (anstatt Warfarin, was aus oben genannten Gründen nicht mehr der «State of the art»-Therapie entspricht). Bis dahin muss, nicht zuletzt aufgrund der Ergebnisse oben genannter Occluderstudien, davon ausgegangen werden, dass der Schlaganfall beim Vorhoffiimmern eine systemische Erkrankung ist, die primär einer systemischen Therapie bedarf, der Antikoagulation.
Disclosure statement
Alexander Breitenstein erhielt Ausbildungsunterstützung von Actelion, Biotronik und Biosense Webster sowie Vortragshonorare von Pfizer. Jan Steffel hat Beratungs- und / oder Vortragshonorare erhalten von Amgen, Astra-Zeneca, Atricure, Bayer, Biosense Webster, Biotronik, Boehringer-Ingelheim, Boston Scientific, Bristol-Myers Squibb, Cook Medical, Daiichi Sankyo, Medtronic, Novartis, Pfizer, Sanofi-Aventis, Sorin, St. Jude Medical and Zoll. Dr. Ste el is Co-director of CorXL. Dr. Steffel hat Grant Support für seine Institution erhalten von Bayer Healthcare, Biosense Webster, Biotronik, Boston Scientific, Daiichi Sankyo, Medtronic, und St. Jude Medical.
References
- Chugh, S.S.; Havmoeller, R.; Narayanan, K.; Singh, D.; Rienstra, M.; Benjamin, E.J.; et al. Worldwide epidemiology of atrial fibrillation: A Global Burden of Disease 2010 Study. Circulation. 2014, 129, 837–847. [Google Scholar] [CrossRef] [PubMed]
- Krijthe, B.P.; Kunst, A.; Benjamin, E.J.; Lip, G.Y.; Franco, O.H.; Hofman, A.; et al. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. Eur Heart J. 2013, 34, 2746–2751. [Google Scholar] [CrossRef] [PubMed]
- Petersen, P.; Boysen, G.; Godtfredsen, J.; Andersen, E.D.; Andersen, B. Placebo-controlled, randomised trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation. The Copenhagen AFASAK study. Lancet. 1989, 1, 175–179. [Google Scholar] [CrossRef] [PubMed]
- Connolly, S.J.; Laupacis, A.; Gent, M.; Roberts, R.S.; Cairns, J.A.; Joyner, C. Canadian Atrial Fibrillation Anticoagulation (CAFA) Study. J Am Coll Cardiol. 1991, 18, 349–355. [Google Scholar] [CrossRef]
- Ruff, C.T.; Giugliano, R.P.; Braunwald, E.; Hoffman, E.B.; Deenadayalu, N.; Ezekowitz, M.D.; et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: A meta-analysis of randomised trials. Lancet. 2014, 383, 955–962. [Google Scholar] [CrossRef]
- Steffel, J.; Braunwald, E. Novel oral anticoagulants: Focus on stroke prevention and treatment of venous thrombo-embolism. Eur Heart J. 2011, 32, 1968–1976. [Google Scholar] [CrossRef]
- Connolly, S.J.; Ezekowitz, M.D.; Yusuf, S.; Eikelboom, J.; Oldgren, J.; Parekh, A.; et al. RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009, 361, 1139–1151. [Google Scholar] [CrossRef]
- Patel, M.R.; Mahaffey, K.W.; Garg, J.; Pan, G.; Singer, D.E.; Hacke, W.; et al. ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011, 365, 883–891. [Google Scholar] [CrossRef]
- Granger, C.B.; Alexander, J.H.; McMurray, J.J.; Lopes, R.D.; Hylek, E.M.; Hanna, M.; et al. ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011, 365, 981–992. [Google Scholar] [CrossRef]
- Giugliano, R.P.; Ruff, C.T.; Braunwald, E.; Murphy, S.A.; Wiviott, S.D.; Halperin, J.L.; et al. ENGAGE AF-TIMI 48 Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013, 369, 2093–2104. [Google Scholar] [CrossRef]
- Kirchhof, P.; Benussi, S.; Kotecha, D.; Ahlsson, A.; Atar, D.; Casadei, B.; et al. ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016, 37, 2893–2962. [Google Scholar] [CrossRef]
- Steffel, J.; Ruff, C.T.; Goldhaber, S.; et al. Stroke prevention in atrial fibrillation. UniMed, Bremen; 2014.
- Steffel, J. Zehn Fragen aus der täglichen Anwendung der Neuen Oralen Antikoagulantien (NOACs). Cardiovasc. 2014, 13, 2–6. [Google Scholar]
- Steffel, J. Neue orale Antikoagulanzien bei eingeschränkter Nierenfunktion und Dialyse. Leading Opinions Nephrologie. 2013, 2, 73–75. [Google Scholar]
- Steffel, J. Die neuen Antikoagulanzien – Praktische Aspekte in der Anwendung. Leading Opinions Kardiologie + Gefässmedizin 2012, 2, 10–14. [Google Scholar]
- Banerjee, A.; Lane, D.A.; Torp-Pedersen, C.; Lip, G.Y. Net clinical benefit of new oral anticoagulants (dabigatran, rivaroxaban, apixaban) versus no treatment in a ‘real world’ atrial fibrillation population: A modelling analysis based on a nationwide cohort study. Thromb Haemost. 2012, 107, 584–589. [Google Scholar] [CrossRef]
- Camm, A.J.; Lip, G.Y.; De Caterina, R.; Savelieva, I.; Atar, D.; Hohnloser, S.H.; et al. ESC Committee for Practice Guidelines (CPG). 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: An update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J. 2012, 33, 2719–2747. [Google Scholar]
- Marinigh, R.; Lane, D.A.; Lip, G.Y. Severe renal impairment and stroke prevention in atrial fibrillation: Implications for thromboprophylaxis and bleeding risk. J Am Coll Cardiol. 2011, 57, 1339–1348. [Google Scholar] [CrossRef]
- Hohnloser, S.H.; Hijazi, Z.; Thomas, L.; Alexander, J.H.; Amerena, J.; Hanna, M.; et al. Efficacy of apixaban when compared with warfarin in relation to renal function in patients with atrial fibrillation: Insights from the ARISTOTLE trial. Eur Heart J. 2012, 33, 2821–2830. [Google Scholar] [CrossRef]
- Steffel, J.; Hindricks, G. Apixaban in renal insufficiency: Successful navigation between the Scylla and Charybdis. Eur Heart J. 2012, 33, 2766–2768. [Google Scholar] [CrossRef][Green Version]
- Bohula, E.A.; Giugliano, R.P.; Ruff, C.T.; Kuder, J.F.; Murphy, S.A.; Antman, E.M.; et al. Impact of Renal Function on Outcomes With Edoxaban in the ENGAGE AF-TIMI 48 Trial. Circulation. 2016, 134, 24–36. [Google Scholar] [CrossRef]
- Koretsune, Y.; Yamashita, T.; Kimura, T.; et al. Short-Term Safety and Plasma Concentrations of Edoxaban in Japanese Patients With Non-Valvular Atrial Fibrillation and Severe Renal Impairment. Circulation journal: Official journal of the Japanese Circulation Society 2015, 79, 1486–1495. [Google Scholar] [CrossRef] [PubMed]
- van Ryn, J.; Stangier, J.; Haertter, S.; Liesenfeld, K.H.; Wienen, W.; Feuring, M.; et al. Dabigatran etexilate – a novel, reversible, oral direct thrombin inhibitor: Interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost. 2010, 103, 1116–1127. [Google Scholar] [PubMed]
- Suryanarayan, D.; Schulman, S. Potential antidotes for reversal of old and new oral anticoagulants. Thromb Res. 2014, 133 (Suppl 2), S158–S166. [Google Scholar] [CrossRef] [PubMed]
- Enriquez, A.; Lip, G.Y.; Baranchuk, A. Anticoagulation reversal in the era of the non-vitamin K oral anticoagulants. Europace European pacing, arrhythmias, and cardiac electrophysiology 2016, 18, 955–964. [Google Scholar] [CrossRef]
- Schiele, F.; van Ryn, J.; Canada, K.; Newsome, C.; Sepulveda, E.; Park, J.; et al. A specific antidote for dabigatran: Functional and structural characterization. Blood. 2013, 121, 3554–3562. [Google Scholar] [CrossRef]
- Pollack, C.V., Jr.; Reilly, P.A.; Eikelboom, J.; Glund, S.; Verhamme, P.; Bernstein, R.A.; et al. Idarucizumab for Dabigatran Reversal. N Engl J Med. 2015, 373, 511–520. [Google Scholar] [CrossRef]
- Lu, G.; DeGuzman, F.R.; Hollenbach, S.J.; Karbarz, M.J.; Abe, K.; Lee, G.; et al. A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa. Nat Med. 2013, 19, 446–451. [Google Scholar] [CrossRef]
- Siegal, D.M.; Curnutte, J.T.; Connolly, S.J.; Lu, G.; Conley, P.B.; Wiens, B.L.; et al. Andexanet Alfa for the Reversal of Factor Xa Inhibitor Activity. N Engl J Med. 2015, 373, 2413–2424. [Google Scholar] [CrossRef]
- Connolly, S.J.; Milling, T.J.; Jr Eikelboom, J.W.; Gibson, C.M.; Curnutte, J.T.; Gold, A.; et al. ANNEXA-4 Investigators. Andexanet Alfa for Acute Major Bleeding Associated with Factor Xa Inhibitors. N Engl J Med. 2016, 375, 1131–1141. [Google Scholar] [CrossRef]
- Ansell, J.E.; Bakhru, S.H.; Laulicht, B.E.; Steiner, S.S.; Grosso, M.; Brown, K.; et al. Use of PER977 to reverse the anticoagulant effect of edoxaban. N Engl J Med. 2014, 371, 2141–2142. [Google Scholar] [CrossRef]
- Lip, G.Y.; Keshishian, A.; Kamble, S.; Pan, X.; Mardekian, J.; Horblyuk, R.; et al. Real-world comparison of major bleeding risk among non-valvular atrial fibrillation patients initiated on apixaban, dabigatran, rivaroxaban, or warfarin. A propensity score matched analysis. Thromb Haemost. 2016, 116, 975–986. [Google Scholar] [CrossRef]
- Yao, X.; Abraham, N.S.; Sangaralingham, L.R.; Bellolio, M.F.; McBane, R.D.; Shah, N.D.; et al. Effectiveness and Safety of Dabigatran, Rivaroxaban, and Apixaban Versus Warfarin in Nonvalvular Atrial Fibrillation. J Am Heart Assoc. 2016, 5, e003725. [Google Scholar] [CrossRef]
- Coleman, C.I.; Antz, M.; Bowrin, K.; Evers, T.; Simard, E.P.; Bonnemeier, H.; et al. Real-world evidence of stroke prevention in patients with nonvalvular atrial fibrillation in the United States: The REVISIT-US study. Curr Med Res Opin. 2016, 32, 2047–2053. [Google Scholar] [CrossRef] [PubMed]
- Graham, D.J.; Reichman, M.E.; Wernecke, M.; Hsueh, Y.H.; Izem, R.; Southworth, M.R.; et al. Stroke, Bleeding, and Mortality Risks in Elderly Medicare Beneficiaries Treated With Dabigatran or Rivaroxaban for Nonvalvular Atrial Fibrillation. JAMA Intern Med. 2016, 176, 1662–1671. [Google Scholar] [CrossRef] [PubMed]
- Man-Son-Hing, M.; Nichol, G.; Lau, A.; Laupacis, A. Choosing antithrombotic therapy for elderly patients with atrial fibrillation who are at risk for falls. Arch Intern Med. 1999, 159, 677–685. [Google Scholar] [CrossRef] [PubMed]
- Steffel, J.; Giugliano, R.P.; Braunwald, E.; Murphy, S.A.; Mercuri, M.; Choi, Y.; et al. Edoxaban Versus Warfarin in Atrial Fibrillation Patients at Risk of Falling: ENGAGE AF-TIMI 48 Analysis. J Am Coll Cardiol. 2016, 68, 1169–1178. [Google Scholar] [CrossRef]
- Holmes, D.R., Jr.; Kar, S.; Price, M.J.; Whisenant, B.; Sievert, H.; Doshi, S.K.; et al. Prospective randomized evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial fibrillation versus long-term warfarin therapy: The PREVAIL trial. J Am Coll Cardiol. 2014, 64, 1–12. [Google Scholar] [CrossRef]
- Holmes, D.R.; Reddy, V.Y.; Turi, Z.G.; Doshi, S.K.; Sievert, H.; Buchbinder, M.; et al. PROTECT AF Investigators. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: A randomised non-inferiority trial. Lancet. 2009, 374, 534–542. [Google Scholar] [CrossRef]
- Reddy, V.Y.; Doshi, S.K.; Sievert, H.; Buchbinder, M.; Neuzil, P.; Huber, K.; et al. PROTECT AF Investigators. Percutaneous left atrial appendage closure for stroke prophylaxis in patients with atrial fibrillation: 2.3-Year Follow-up of the PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation) Trial. Circulation. 2013, 127, 720–729. [Google Scholar]
- Holmes, D.R.; Jr Doshi, S.K.; Kar, S.; Price, M.J.; Sanchez, J.M.; Sievert, H.; et al. Left Atrial Appendage Closure as an Alternative to Warfarin for Stroke Prevention in Atrial Fibrillation: A Patient-Level Meta-Analysis. J Am Coll Cardiol. 2015, 65, 2614–2623. [Google Scholar] [CrossRef]
- Reddy, V.Y.; Holmes, D.; Doshi, S.K.; Neuzil, P.; Kar, S. Safety of percutaneous left atrial appendage closure: Results from the Watchman Left Atrial Appendage System for Embolic Protection in Patients with AF (PROTECT AF) clinical trial and the Continued Access Registry. Circulation. 2011, 123, 417–424. [Google Scholar] [CrossRef]
- Reddy, V.Y.; Sievert, H.; Halperin, J.; Doshi, S.K.; Buchbinder, M.; Neuzil, P.; et al. PROTECT AF Steering Committee and Investigators. Percutaneous left atrial appendage closure vs warfarin for atrial fibrillation: A randomized clinical trial. JAMA. 2014, 312, 1988–1998. [Google Scholar] [CrossRef]
© 2017 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.