Summary
Autonomic dysfunction and atrial arrhythmias: from bench to bedside
The autonomic nervous system plays a major role in the initiation and maintenance of atrial fibrillation (AF) experimentally. Cervical stimulation of vagal trunks or of atrial vagal fibers shortens action potential duration, increases dispersion of refractory periods and promotes triggered beats. The combination of these promotes anterograde block of conduction in regions of prolonged action potential duration, resulting in multiple wavelets and in AF. In contrast, sympathetic stimulation alone does not appear to promote AF because it does not increase dispersion of refractory periods, except when there is an underlying structural heart disease. Heart disease favors structural and electrophysiological atrial remodeling as well as heterogeneous sympathetic hyperinnervation, promoting dispersion of refractory periods at rapid heart rate (ie alternans). Clinically, the role of the autonomic nervous system in AF appears limited, but data are lacking because of technical constraints. Experimentally, vagal denervation by sectioning cervical trunks prevents AF initiation, but the technique is hardly suitable to humans. Interestingly, a recent study suggests that atrial vagal denervation by radiofrequency catheter ablation decreases AF recurrence in humans; however, these findings need to be substantiated by additional studies using a consensual definition of rhythmic recurrence in light of the recent observation that partial vagal denervation may increase AF susceptibility experimentally.
Key words: atrial fibrillation; autonomic nervous system; vagal nervous system; sympathetic nervous system; ablation
Résumé
Expérimentalement, le système nerveux autonome joue un rôle majeur dans l’initiation et le maintien de la fibrillation auriculaire (FA). La stimulation cervicale des troncs vagaux, ou sélective des fibres auriculaires, réduit la durée des potentiels d’action, augmente les dispersions des périodes réfractaires et favorise la survenue de battements triggérés. La combinaison de ces trois effets favorise la survenue de bloc de conduction unidirectionnel et de fragmentation des fronts d’excitation, conduisant à la création de multiples ondelettes et donc de la FA. A l’opposé, la stimulation sympathique à elle-seule n’est pas capable d’induire de FA; il lui manque la dispersion des durées de potentiel d’action, qui n’est obtenue qu’en présence d’une cardiopathie sous-jacente. La cardiopathie joue un rôle en favorisant un remodelling structurel et électrophysiologique des oreillettes, mais aussi en provoquant une hyperinnervation sympathique hétérogène permettant de disperser les durées de potentiel d’action lors d’accroissement du rythme. D’un point de vue clinique, le rôle joué par le système nerveux autonome dans la FA paraît limité, mais les données sont rares et l’apport en terme de compréhension physiopathologique reste modeste de par les difficultés d’enregistrement. Expérimentalement, la dénervation vagale cardiaque par section des troncs cervicaux prévient la FA, mais cette technique n’est guère envisageable chez l’homme. Une étude clinique récente suggère que la dénervation vagale des oreillettes par radiofréquence réduit la récidive de FA; cependant, ces données doivent être corroborées par de plus amples séries, utilisant notamment une définition consensuelle de la récidive rythmique compte tenu d’un possible effet proarythmique d’une dénervation vagale partielle.
Mots de clés: fibrillation auriculaire; système nerveux autonome; système nerveux parasympathique; système nerveux sympathique;ablation
Introduction
La fibrillation auriculaire (FA) est l’une des arythmies les plus fréquentes et les plus invalidantes de notre société. La
Figure 1 montre un exemple typique de FA: la ligne de base est irrégulière et l’activité auriculaire précédant habituellement la dépolarisation des ventricules est remplacée par un aspect sinusoïdal, irrégulier en fréquence et en amplitude, signant une désorganisation de l’activité électrique des oreillettes qui n’est plus sous le contrôle du nœud sinusal.
La prévalence de la FA est estimée à 0,4% de la population globale. Dans l’étude Framingham, la prévalence de FA dans la population augmentait significativement avec l’âge: 2% de la population d’un âge compris entre 60–69 ans souffrait de FA; cette valeur atteignait 9% chez les sujets âgés de plus de 80 ans, ce qui aura un impact socio-économique certain dans l’avenir compte tenu du vieillissement des populations occidentales. Cette arythmie est apparemment la cause la plus fréquente d’accidents cérébro-vasculaires, d’autant plus si cette dernière est associée à une cardiopathie sous-jacente. Dans l’étude Framingham, la proportion d’accidents cérébro-vasculaires attribuables à la FA augmentait de même en fonction de l’âge, passant de 7% chez les patients <60 ans à 36% chez ceux >80 ans [
1,
2]. La FA est de plus un facteur indépendant de mauvais pronostic. La FA et l’insuffisance cardiaque coexistent fréquemment; l’un et l’autre s’influencent négativement, augmentant d’autant la morbidité et la mortalité associées à l’autre condition [
3,
4]. La FA est dite «paroxystique» lorsque l’accès est spontanément résolutif; elle est dite «persistante» lorsqu’elle est soutenue, qu’elle soit cardioversée (médicamenteusement ou électriquement) ou non. Lorsque la FA persiste au delà d’une année, avec ou sans tentatives de rétablissement du rythme sinusal, la FA est dite «permanente» [
5].
Classiquement, les patients souffrant d’une FA permanente démontrent des signes de remodelling structurel des oreillettes. L’une des caractéristiques du patient souffrant de FA dans un contexte de cardiopathie est la présence d’une fibrose interstitielle dont l’extension est proportionnelle à la fréquence et la durée des accès de FA. La quantité de collagène de type I, inexistant chez les patients sans accès de FA, augmente dans la FApersistante nécessitant un traitement médicamenteux pour maintenir le rythme sinusal, pour atteindre un maximum chez ceux dont la FA est permanente, c’est-à-dire dont le rythme sinusal ne peut être maintenu [
6]. De plus, les altérations suivantes ont été rapportées cliniquement et expérimentalement: dilatation des oreillettes, hypertrophie cellulaire, fibrose interstitielle avec redistribution des gap junctions conduisant à une diminution des vélocités de conduction et à une propagation hétérogène des fronts d’excitation, et une réduction de la durée des potentiels d’action.
Haissaguerre et al. [
7], entre 1996 et 1998, ont changé radicalement les perspectives du traitement de la FA, en démontrant qu’une proportion non négligeable des accès de FA paroxystique était induite par un ou plusieurs foyers ectopiques provenant des veines pulmonaires. La
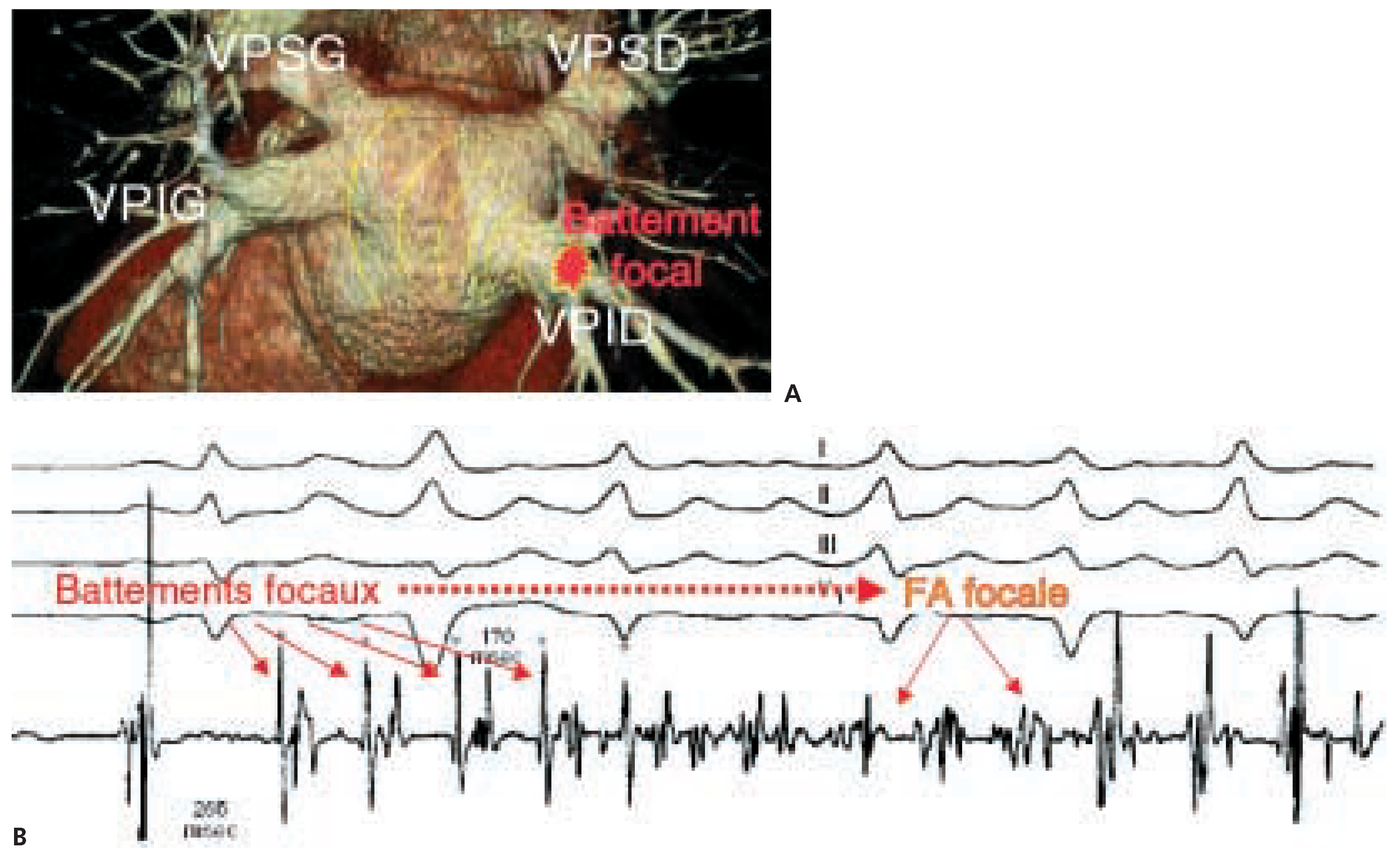
Figure 2A montre l’anatomie classique des veines pulmonaires, au nombre de quatre. Cette vue montre la paroi postérieure de l’oreillette gauche avec le départ des 4 veines pulmonaires. Les veines pulmonaires sont des structures vasculaires composées de muscle lisse, mais il est connu depuis les années 60 que des manchons de muscle strié de quelques mm à quelques cm de longueur peuvent pénétrer de l’oreillette en direction des veines pulmonaires. Grâce aux travaux pionniers d’Haissaguerre et al. [
7], il est maintenant bien établi que des foyers ectopiques très rapides peuvent prendre naissance à l’intérieur de ces manchons veineux striées, et que ces derniers seraient à l’origine de la majorité des FA dites idiopathiques (lone atrial fibrillation en anglais), c’est-à-dire sans anomalie structurelle cardiaque sous-jacente. La
Figure 2B montre un exemple de FA paroxystique à point de départ de la veine pulmonaire inférieure droite. Notez le phénomène d’onde P sur T (P/T) indicatif de la survenue d’une extrasystole auriculaire sur l’onde T du complexe ventriculaire précédent. Cette extrasystole décharge ensuite à haute fréquence, jusqu’à des couplages de 170 msec (c.-à-d. 370 bpm), produisant une FA par conduction anarchique des fronts d’excitation à travers les oreillettes (fibrillatory conduction en anglais); dans le cas présent de l’oreillette gauche vers la droite. La présence de foyers ectopiques dans les veines pulmonaires est associée à des anomalies des propriétés électrophysiologiques du tissu musculaire veineux sous-jacent. La durée des potentiels d’action des veines incriminées (telle qu’appréciée par la mesure de la période réfractaire effective) s’est révélée significativement abaissée, et les propriétés de conduction décrémentielle augmentées comparativement à un groupe contrôle sans foyer ectopique veineux [
8].
Récemment, Hsu et coll. [
9] ont démontré le bénéfice de l’isolation des veines pulmonaires associée à une compartimentalisation (debulking en anglais) de l’oreillette gauche par lig-nes de radiofréquence chez les patients souffrant de FA permanente et d’une insuffisance cardiaque. Le rythme sinusal a pu être maintenu chez 75% des patients à un an, mais au prix d’une deuxième procédure dans 50% des cas. De plus, cette procédure a permis d’améliorer très significativement la fonction cardiaque; ce bénéfice était plus marqué chez les patients souffrant d’une cardiomyopathie dilatée (présumée d’origine tachyarythmique) que chez ceux souffrant d’une dysfonction ventriculaire consécutive à une maladie structurelle.
En général, une tachyarythmie auriculaire ou ventriculaire se développe en réponse à un mécanisme initiateur (c.-à-d. triggers), et devient soutenue en présence d’un substrat structurel ou électrique. Quel rôle le système nerveux autonome (SNA) peut-il jouer dans la physiopathologie de la FA? Ce dernier peut avoir un rôle de modulateur d’une part des mécanismes déclenchants, en favorisant ou en inhibant la survenue d’extrasystoles par exemple, et d’autre part en altérant dynamiquement le substrat nécessaire au maintien de la tachyarythmie. Coumel et al. [
10,
11] ont été parmi les premiers à rapporter des cas de FA semblant impliquer le SNA chez des patients sans cardiopathie sous-jacente. Deux modes de présentation ont été décrits: (1.) une accélération du rythme sinusal suivie d’une extrasystole auriculaire avec phénomène P/T déclenchant un accès de FA; (2.) une décélération rapide du rythme cardiaque suivie d’un bigéminisme auriculaire transitoire avec phénomène P/T se terminant par une FA. Dans les deux cas, la fréquence cardiaque devait atteindre de manière reproductible une valeur seuil pour initier l’accès de FA. Quel rôle le SNA peut-il jouer dans ce scénario? Le premier cas suggère une dominance sympathique et le deuxième cas une dominance vagale. Or, on sait que des cellules, dont le fonctionnement est altéré, peuvent présenter une oscillation de leur potentiel transmembranaire en réaction à une variation critique de leur fréquence de dépolarisation; cette oscillation, lorsqu’elle survient dans la phase 3 du potentiel d’action, est appelée post-potentiel précoce (early after depolarization en anglais) et lorsqu’elle survient dans la phase de repos diastolique (phase 4), est appelée post-potentiel tardif (late after depolarization en anglais). Dans les deux cas, cette anomalie de la dépolarisation peut atteindre le potentiel seuil et déclencher une extrasystole (c.-à-d. battement triggéré). Des données expérimentales et cliniques suggèrent qu’une automaticité anormale [
12,
13] et/ou qu’une activité triggerée [
14,
15,
16] seraient à l’origine des battements ectopiques à point de départ des veines pulmonaires, et que toutes deux seraient en partie contrôlées par le tonus sympathique et parasympathique [
13,
14,
15,
16]. Les premiers observations cliniques rapportées par Coumel et al. [
10,
11] sont une bonne illustration de la complexité des mécanismes impliqués dans le genèse de FA à point de départ des veines pulmonaires.
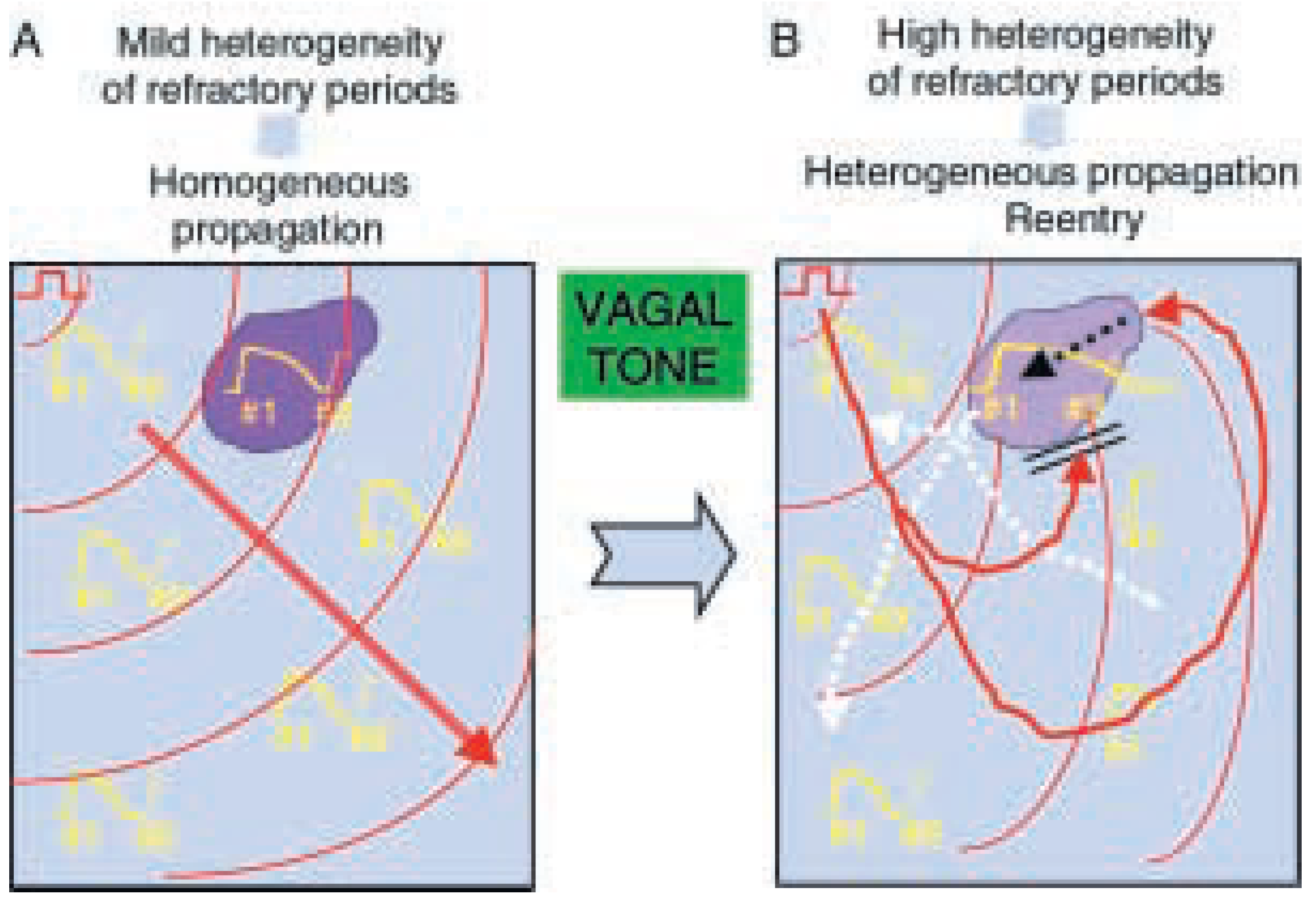
Le deuxième élément nécessaire en principe au maintien d’une arythmie par réentrée est la dispersion de la durée des potentiels d’action. La
Figure 3 illustre ce principe. En présence d’une dispersion modérée des durées de potentiels d’action (
Figure 3A), chaque battement d’une stimulation rapide se propage harmonieusement à travers le tissu. A l’opposé, lorsque la dispersion atteint une valeur critique (
Figure 3B), les fronts d’activation, lors d’une stimulation rapide, peuvent bloquer (double ligne de couleur noire) dans une région de durée de potentiel d’action prolongée (îlot mauve); l’activation alors contourne l’îlot réfractaire, poursuit son chemin, et peut dans certaines conditions réactiver tardivement (flèche pointillée de couleur noire) le tissu précédemment réfractaire lorsque ce dernier a récupéré. La pénétration tardive du front d’activation dans l’îlot (mauve) permet ultérieurement de dépolariser (flèche pointillée de couleur blanche) à nouveau le tissu «normal», formant ainsi le premier battement d’une réentrée. De quelle manière le SNA peut-il favoriser la réentrée dans les oreillettes? Il est bien établi expérimentalement que la stimulation vagale diminue globalement la durée des potentiels d’action auriculaires tout en augmentant leur dispersion, favorisant ainsi l’induction de FA lors de stimulations auriculaires ectopiques ou rapides [
17]. Le SN sympathique favorise de même la survenue de battements triggérés et réduit la durée des potentiels d’action. A l’opposé de la stimulation vagale, la stimulation sympathique n’altère pas la dispersion des durée de potentiels d’action et par conséquent n’induit pas de FA en l’absence de cardiopathie [
18]. Liu et al. [
18] ont en effet montré expérimentalement que la dispersion des durées de potentiel d’action lors de stimulation vagale doublait par rapport à la valeur mesurée durant la stimulation sympathique, elle-même comparable aux valeurs contrôles.
Données expérimentales supportant le rôle du SNA dans l’initiation et la maintenance de la FA
Expérimentalement, quels sont les arguments en faveur d’un rôle du SN vagal dans le genèse de FA paroxystique: Schauerte et al. [
14] ont instrumenté des chiens avec des électrodes d’enregistrement multipolaires placées sur l’épicarde, en regard des veines pulmonaires. Durant la stimulation auriculaire, un train d’impulsions de haute fréquence (20 Hz) délivré brièvement après le stimulus auriculaire (c.-à-d. dans la période réfractaire auriculaire) a été appliqué à tour de rôle dans les 4 veines afin de stimuler sélectivement les fibres vagales circulant dans les parois des veines pulmonaires. Hors stimulation, à haute fréquence, les veines pulmonaires ne montraient aucune extrasystole auriculaire. Durant la stimulation, les veines développaient des extrasystoles spontanées, certaines déclenchant des accès de tachycardie auriculaire et de FA. Les extrasystoles les plus précoces survenaient au site de stimulation à haute fréquence, suggérant une relation de cause à effet. L’empalement in situ de quelques cellules de cette région montrait: (1.) la survenue de post-potentiels précoces en rapport avec la stimulation à haute fréquence, et (2.) la suppression des extrasystoles et des post-potentiels précoces après perfusion d’atropine. En résumé, ces données expérimentales suggèrent que le SN vagal favorise la survenue d’extrasystoles par un mécanisme triggéré, qui, associé à l’augmentation de la dispersion des périodes réfractaires, peut faciliter la survenue d’accès de FA. Le SN vagal favorisant expérimentalement les extrasystoles auriculaires et la dispersion des durées de potentiel d’action, certains auteurs ont tenté d’en moduler sa fonction afin de prévenir d’éventuels accès de FA. Expérimentalement, la section des deux troncs vagaux prévient efficacement les accès de FA [
17]. Cependant, lorsque la dénervation vagale est partielle, ne touchant que l’oreillette droite par exemple, des données expérimentales ont montré un effet paradoxal sous forme d’une facilitation des accès de FA [
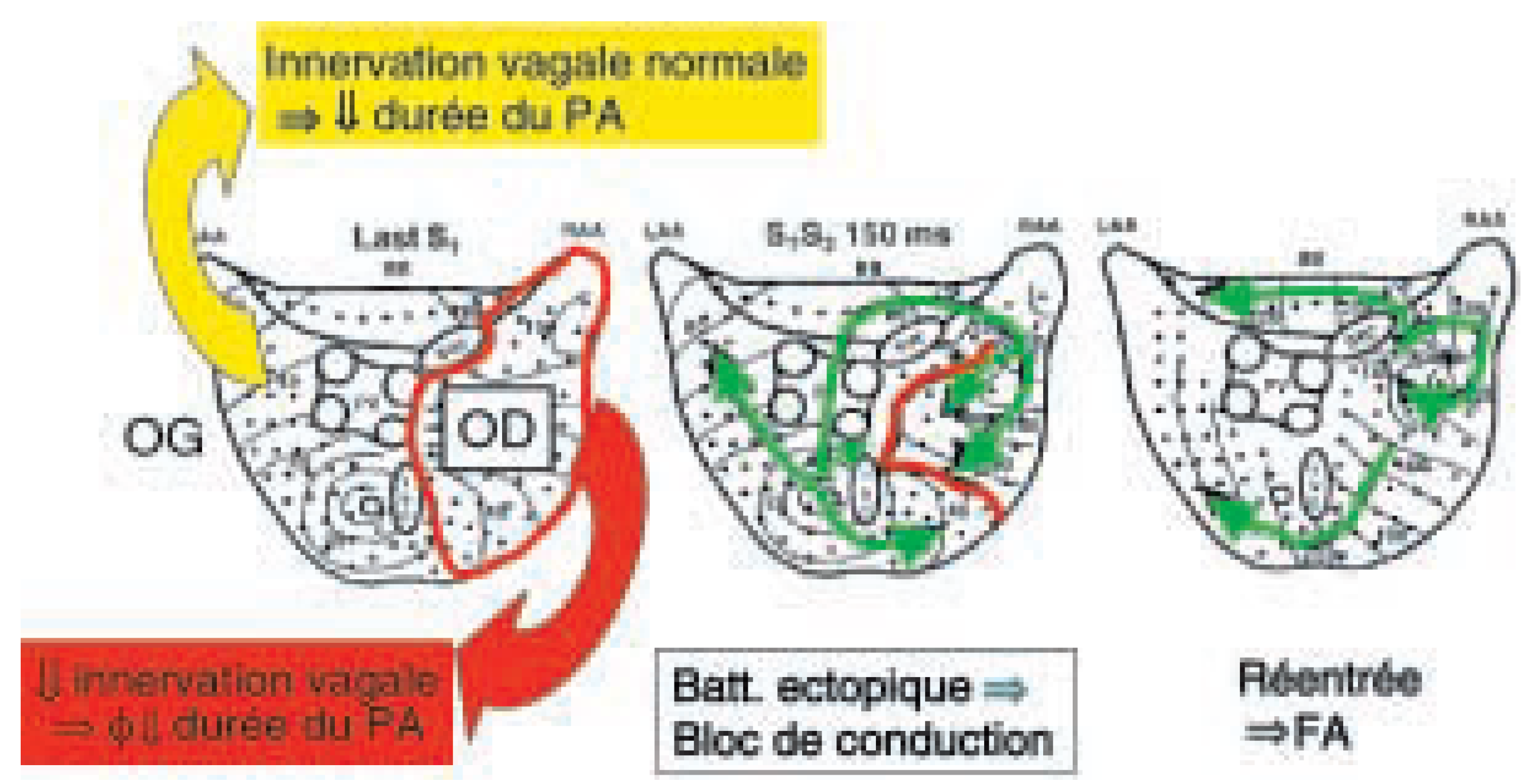
19]. La
Figure 4 illustre ce mécanisme. Les chiffres en rapport avec les lignes indiquent les temps d’activation isochrones suivant la dernière stimulation auriculaire. La stimulation vagale, dans ce contexte de dénervation partielle, réduit la durée des potentiels d’action de l’oreillette gauche, sans altérer celle de l’oreillette droite, ce qui a pour effet d’augmenter la dispersion des durées de potentiels d’action. Le panneau de gauche montre la propagation harmonieuse des fronts d’activation lors d’une stimulation régulière (S1S1) située à la base de l’oreillette gauche (sous les veines pulmonaires) durant l’activation vagale. Le panneau suivant (milieu) montre la propagation d’un battement prématuré (S1S2) d’un couplage de 150 ms. Ce battement (S2) se propage harmonieusement dans l’oreillette gauche compte tenu des courtes durées des potentiels d’action, mais bloque au niveau de l’oreillette droite car cette dernière est encore en phase réfractaire de la dépolarisation précédente (S1). Ce bloc de conduction unidirectionnel est contourné par le front de propagation, puis est envahi tardivement une fois le tissu de l’oreillette droite sorti de sa période réfractaire. Le dernier panneau montre que l’activation tardive de l’oreillette droite permet à son tour de réactiver le tissu auriculaire gauche, formant le premier battement d’un accès de FA. Ces données suggèrent un possible effet délétère d’une dénervation vagale incomplète dans la prevention d’accès de FA.
Qu’en est-il du SN sympathique? Une stimulation sympathique globale en elle-même réduit la durée des potentiels d’action mais n’altère pas leur dispersion, ce qui fait qu’expérimentalement cette stimulation ne favorise pas les accès de FA. Al’opposé, une innervation sympathique hétérogène favorise la FA [
20,
21]. Jayachandran et al. [
20] ont montré chez le chien qu’une stimulation auriculaire rapide durant 6 semaines s’accompagnait d’une hyperinnervation sympathique hétérogène des oreillettes et d’une susceptibilité accrue à la FA. Récemment, Miyaushi et al. [
21] ont rapporté un remodelling sympathique auriculaire consécutif à un infarctus ventriculaire limité, sans atteinte ischémique des oreillettes. Ces auteurs ont montré l’augmentation du nombre de fibres sympathiques mais aussi la présence de facteur de croissance nerveux touchant tout autant les oreillettes que les veines pulmonaires! La stimulation auriculaire rapide dans ces conditions augmentait significativement la dispersion des périodes réfractaires auriculaires, la survenue d’extrasystoles à point de départ des veines pulmonaires et les accès de FA contrairement aux cas contrôles. Notons que cette hyperinnervation sympathique accroissait la variation de battement à battement de la durée (c.-à-d. alternance) des potentiels d’action, mécanisme impliqué dans la genèse d’arythmies par réentrée [
22,
23]. En résumé, des modèles expérimentaux partageant certaines similitudes avec des maladies cardiaques humaines, tels que les foyers ectopiques à haute fréquence des veines pulmonaires ou l’infarctus du myocarde, ont démontré le développement d’une hyperinnervation sympathique hétérogène des oreillettes, favorisant la survenue de FA.
Données cliniques supportant le rôle du SNA dans l’initiation et la maintenance de la FA
Comparées aux données expérimentales, les données cliniques sur le rôle du SNA dans la genèse de la FA sont bien plus rares. L’analyse de la variabilité sinusale (HRV) est une technique non invasive permettant d’évaluer le degré d’activation du SNA au niveau cardiaque. L’HRV se base sur les fréquences de fluctuations du rythme cardiaque afin de determiner le degré d’activation sympathique ou parasympathique. L’une des techniques employée dans l’HRV est l’analyse spectrale, consistant à représenter l’amplitude des fluctuations en fonction de leur fréquence (c.-à-d. spectre d’amplitude) à l’aide d’une transformée de Fourier. Typiquement, le spectre de l’HRV est subdivisé en trois ban-des de fréquence: (1.) les très basses fréquences, multifactorielles mais en partie médiées par des fluctuations très lentes du volume respiratoire modulant l’activité sympathique cardiaque et vasculaire; (2.) les basses fréquences, sous le contrôle du baroréflexe carotidien, et qui, en fonction des conditions d’enregistrement, sont plutôt représentatives de l’activité vagale ou sympathique cardiaque; et (3.) les hautes fréquences modulées par le rythme respiratoire, et représentatives de l’activation vagale cardiaque. De par sa sophistication, cette technique présente plusieurs limitations importantes. Premièrement, l’analyse des hautes fréquences repose sur les fluctuations du rythme respiratoire, modulant en conséquence le rythme cardiaque via le SN vagal. Or, les variations du rythme respiratoire sont telles qu’elles peuvent déborder sur le domaine des basses fréquences, diminuant d’autant la quantité d’activation vagale mesurée dans les hautes fréquences tout en majorant artificiellement le degré d’activation sympathique estimé à l’aide des basses fréquences. Deuxièmement, toutes extrasystoles affectera l’HRV puisque cette mesure repose sur les variations battement à battement du rythme sinusal. Habituellement, les extrasystoles sont supprimées et l’intervalle manquant est interpolé. Mais cela ne suffit pas entièrement à corriger l’effet des extrasystoles, qui, de part la chute fréquente de la TA consécutive à leur prématurité, entraîne une contrerégulation sympathique cardiaque et vasculaire dans le domaine des basses fréquences, accroissant transitoirement l’activité sympathique cardiaque. Ceci dit, l’HRV reste un outil précieux et unique de mesure non invasive de l’activité du SNA au niveau cardiaque.
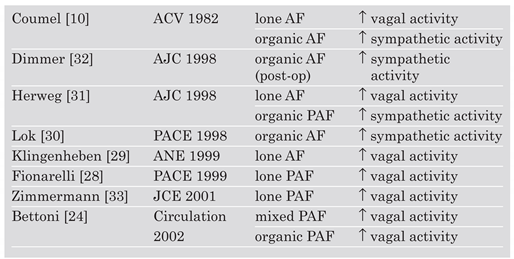
Tableau 1.
Résultats de l’analyse de la variabilité sinusale avant FA.
Tableau 1.
Résultats de l’analyse de la variabilité sinusale avant FA.
Le tableau 1 résume les études ayant utilisé l’HRV afin d’évaluer le rôle du SNA dans la genèse de FA paroxystique. Les premiers résultats ont été rapportés par Coumel et al. à la fin des années septante. En analysant battement à battement les variations du rythme cardiaque, Coumel et al. [
10,
11] ont observé deux spécimens: (1.) typiquement, les patients souffrant de FA idiopathique présentaient un ralentissement du rythme cardiaque dans les secondes précédant l’accès de FA, ce qui suggérait une activation vagale; (2.) à l’opposé, les patients souffrant de FA dans un contexte de cardiopathie présentaient une accélération du rythme cardiaque, suggérant une activation sympathique cardiaque avant l’accès arythmique. Les études résumées dans le tableau 1 rapportent des résultats partiellement contradictoires. Dans l’ensemble, ces données suggèrent que les patients souffrant de FA idiopathique ont un certain degré d’activation vagale cardiaque dans les minutes avant l’accès arythmique. En ce qui concerne les FA organiques, les résultats sont moins unanimes, ce qui peut être mis sur le compte de l’hétérogénéité des populations étudiées, et des limites méthodologiques de l’HRV liées à la présence fréquente d’extrasystoles et à la difficulté de cantonner la respiration dans le domaines des hautes fréquences. Bettoni et Zimmermann, deux confrères genevois, ont publié récemment l’une des plus grandes séries utilisant l’analyse de l’HRV avant FA paroxystique [
24]. Le collectif comprenait des patients avec FA idiopathique et dans un contexte de cardiopathies. L’analyse a été réalisée sur un collectif de 77 patients consécutifs souffrant d’accès de FA d’une durée de 30 minutes au moins; tous les patients étaient en rythme sinusal dans l’heure précédant l’arythmie. Sur l’ensemble de la population, la fréquence cardiaque augmentait modestement mais significativement avant l’accès; cette augmentation était accompagnée paradoxalement d’un accroissement des fluctuations de haute fréquence, compatible avec une augmentation du tonus vagal. Les fluctuations de basse fréquence augmentaient significativement dans les 15 minutes avant l’accès, pour diminuer dans les dernières minutes, suggérant une activation suivie d’une inhibition sympathique cardiaque.
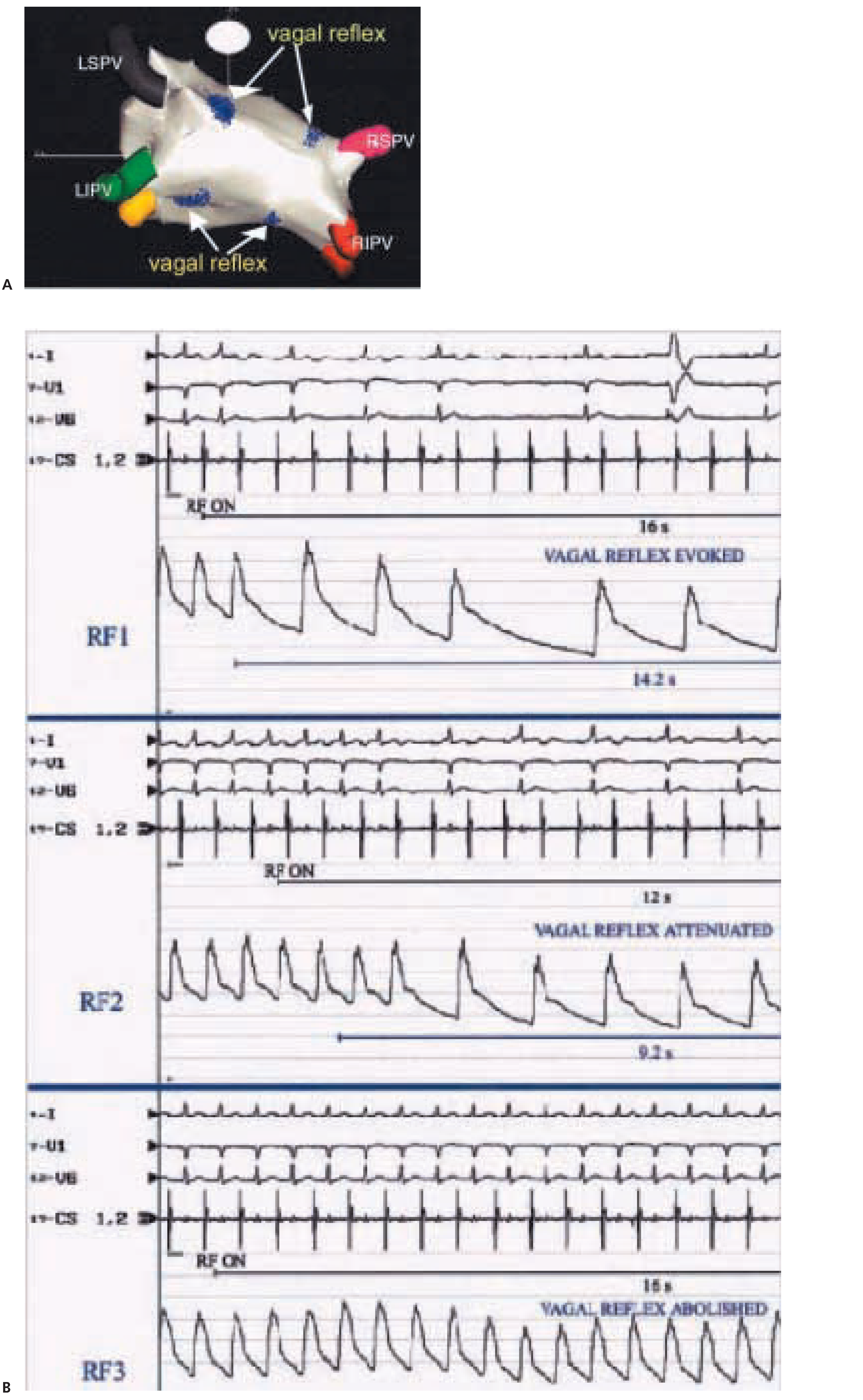
Pappone et al. [
25] ont publié récemment les résultats de l’ablation par radiofréquence des veines pulmonaires dans un collectif de 300 patients souffrant de FA paroxystique. Chez 34% de ces patients, un réflexe vagal a été observé lors de l’isolation des ostias des veines pulmonaires, le plus souvent lors de l’isolation de la veine pulmonaire supérieure gauche. La
Figure 5A montre les sites d’ablation déclenchant des réflexes vasovagaux. Les veines pulmonaires gauches déclenchaient une bradycardie sinusale et une hypotension artérielle, alors que les veines droites déclenchaient plus typiquement un bloc atrio-ventriculaire accompagné d’une hypotension. La figure 5B (supérieur) montre un exemple typique de réflexe sous forme d’un bloc atrio-ventriculaire indiquant une vagotonie cardiaque, accompagné d’une chute tensionnelle signant une inhibition sympathique vasculaire. Dans cette étude, les sites démontrant ce type de réponse ont été ablatés jusqu’à disparition totale des réflexes vagaux (
Figure 5B milieu et inférieur). Les deux panneaux suivants (milieu et inférieur) montrent la disparition progressive de la bradycardie et de l’hypotension au fur et à mesure de l’application de la radiofréquence. Ces auteurs ont rapporté une augmentation du nombre d’accès de FA de courte durée dans les premières semaines suivant l’intervention, puis une diminution plus importante des récidives chez les patients dont le réflexe vasovagal a été ablaté et dont la dénervation vagale au long terme était la plus profonde comparativement à ceux qui ne présentaient pas de réflexe ou à ceux dont l’innervation vagale se maintenait après ablation. Un travail récent suggère de même que la récidive après ablation par radiofréquence de FA paroxystiques est bien plus élevée chez les FA dites vagales (c.-à-d. survenant pendant les repas ou durant les phase de repos) comparée aux formes adrénergiques ou à celles non classables [
26]. Ces études suggèrent d’une part que le SN vague semble jouer un rôle dans la genèse de FA chez certains patients, et d’autre part que l’ablation des fibres vagales auriculaires gauches périostiales améliorerait le maintien du rythme sinusal après isolation des veines pulmonaires. Ces observations cependant doivent être corroborées par de plus amples séries. De plus, la détection de la récidive au long cours n’est pas optimale à l’heure actuelle en raison des difficultés techniques rencontrées avec les systèmes de monitoring conventionnel (par ex. tolérance). La définition de la récidive rythmique est aussi variable d’un centre à l’autre, et le succès de la procédure est surestimé si seule la récidive de FA est comptée, alors qu’une proportion non négligeable de ces patients présente des récidives sous forme de tachycardies auriculaires.
Conclusions
Expérimentalement, le SNA joue un rôle majeur dans l’initiation et le maintien de la FA. La stimulation vagale au niveau des troncs cervicaux ou sélectivement au niveau des fibres auriculaires réduit la durée des potentiels d’action, augmente la dispersion de ces derniers et favorise la survenue de battements triggérés. La combinaison de ces trois effets favorise la survenue de bloc de conduction unidirectionnel et de fragmentation des fronts d’excitation (c.-à-d. wavebreaks), conduisant à la création de multiples ondelettes. A l’opposé, la stimulation sympathique à elle-seule n’est pas capable d’induire de FA car il lui manque la dispersion des durées de potentiel d’action, qui n’est obtenue qu’en présence d’une cardiopathie sous-jacente. La cardiopathie joue un rôle en favorisant un remodelling structurel et électrophysiologique des oreillettes, mais aussi en provoquant une hyperinnervation sympathique hétérogène permettant de disperser les durées de potentiel d’action lors d’accroissement du rythme.
D’un point de vue clinique, le rôle joué par le SNA paraît limité dans l’initiation et le maintien de la FA, mais les données sont rares et l’apport en terme de compréhension physiopathologique reste modeste de par les difficultés d’enregistrement. Expérimentalement, la dénervation vagale cardiaque par section des troncs cervicaux prévient la FA, technique guère envisageable chez l’homme. Cliniquement, une étude récente [
25] suggère que la dénervation vagale sélective des oreillettes par radiofréquence réduit la récidive de FA, mais ces données doivent être corroborées par de plus amples séries, intégrant notamment une définition consensuelle de la récidive rythmique compte tenu d’un possible effet pro-arythmique de la dénervation vagale partielle [
19].