Echokardiographie bei Kardialer Resynchronisationstherapie
Summary
Echocardiogaphy in Cardiac Resynchronisation Therapy
Zusammenfassung
Einführung
Konventionelle echokardiographische Parameter
M-Mode
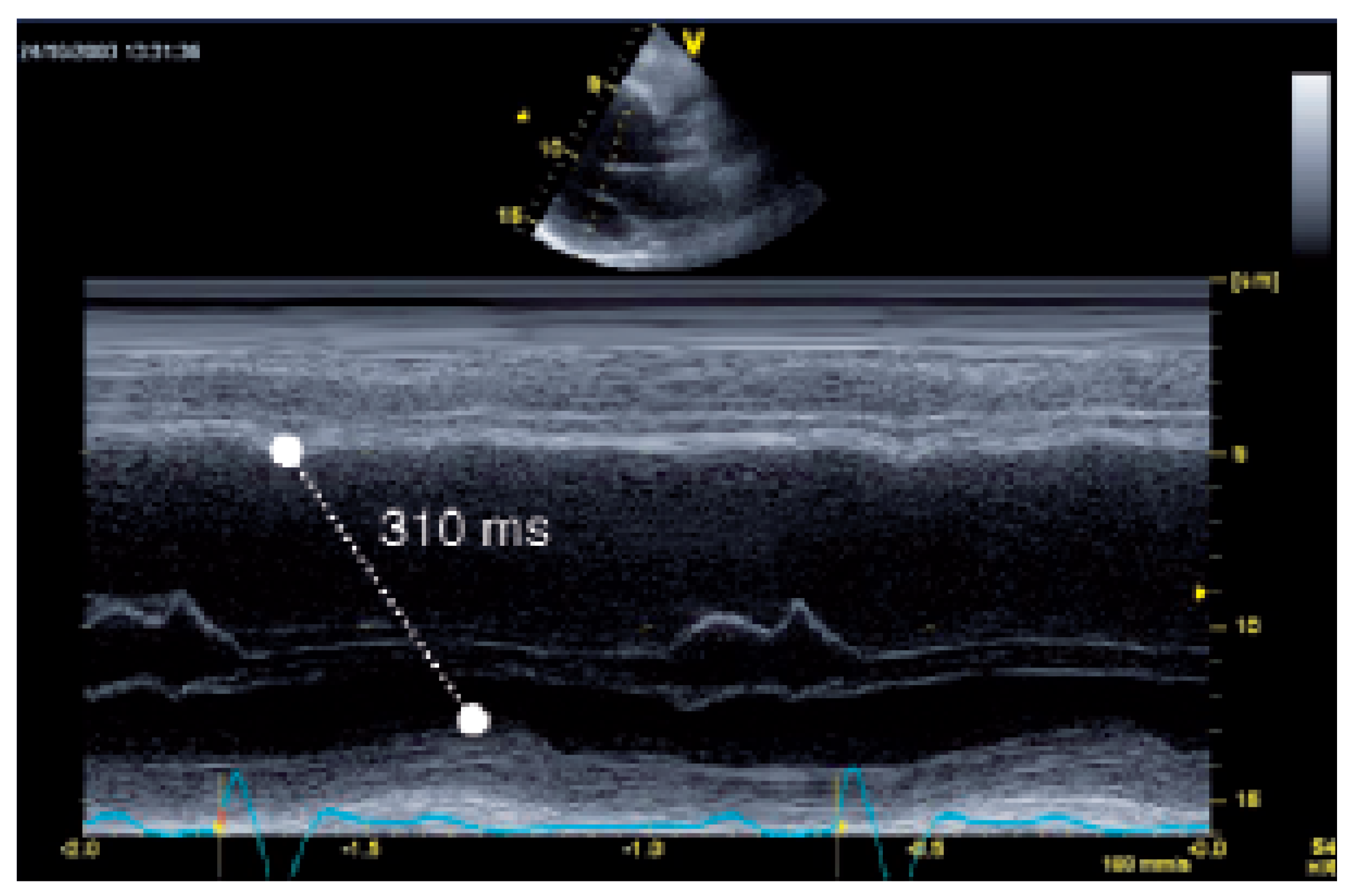
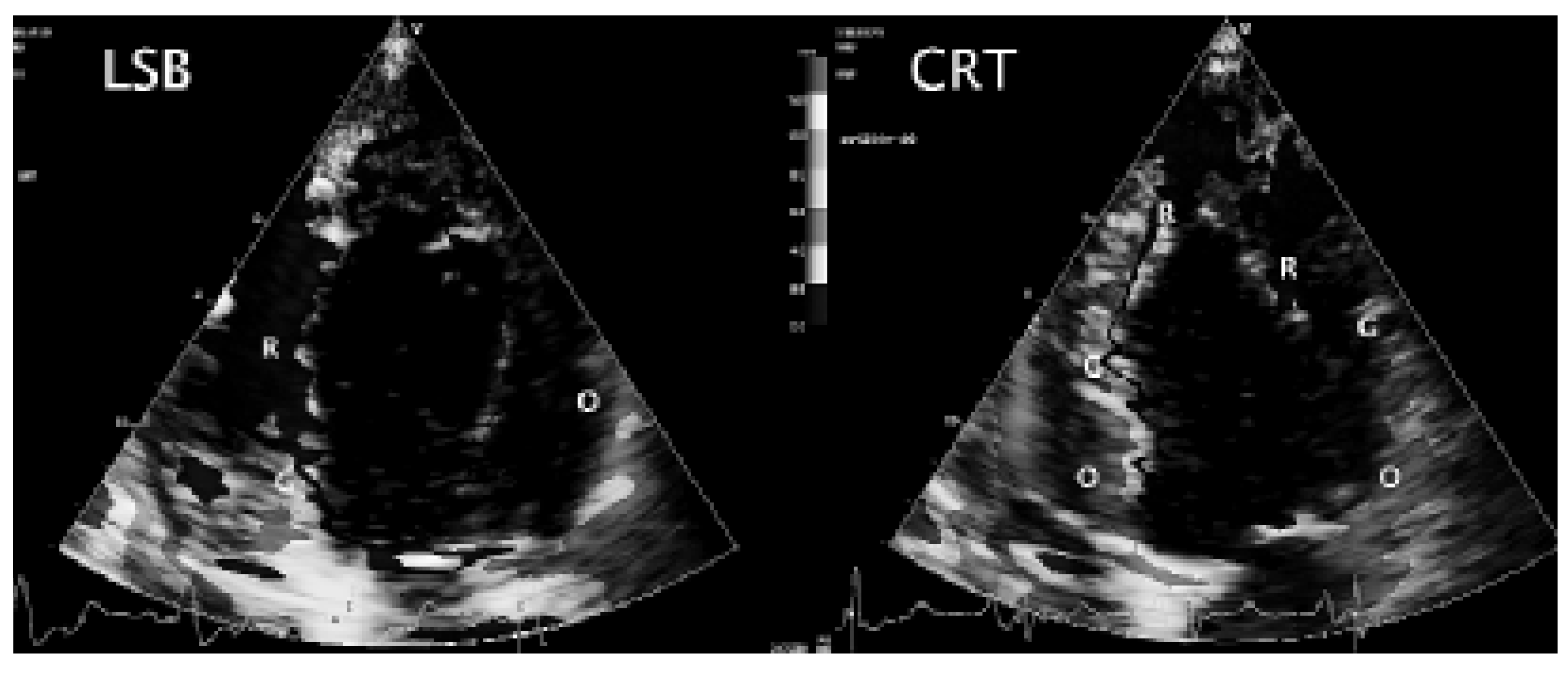
Konventionelle Doppler-Echokardiographie
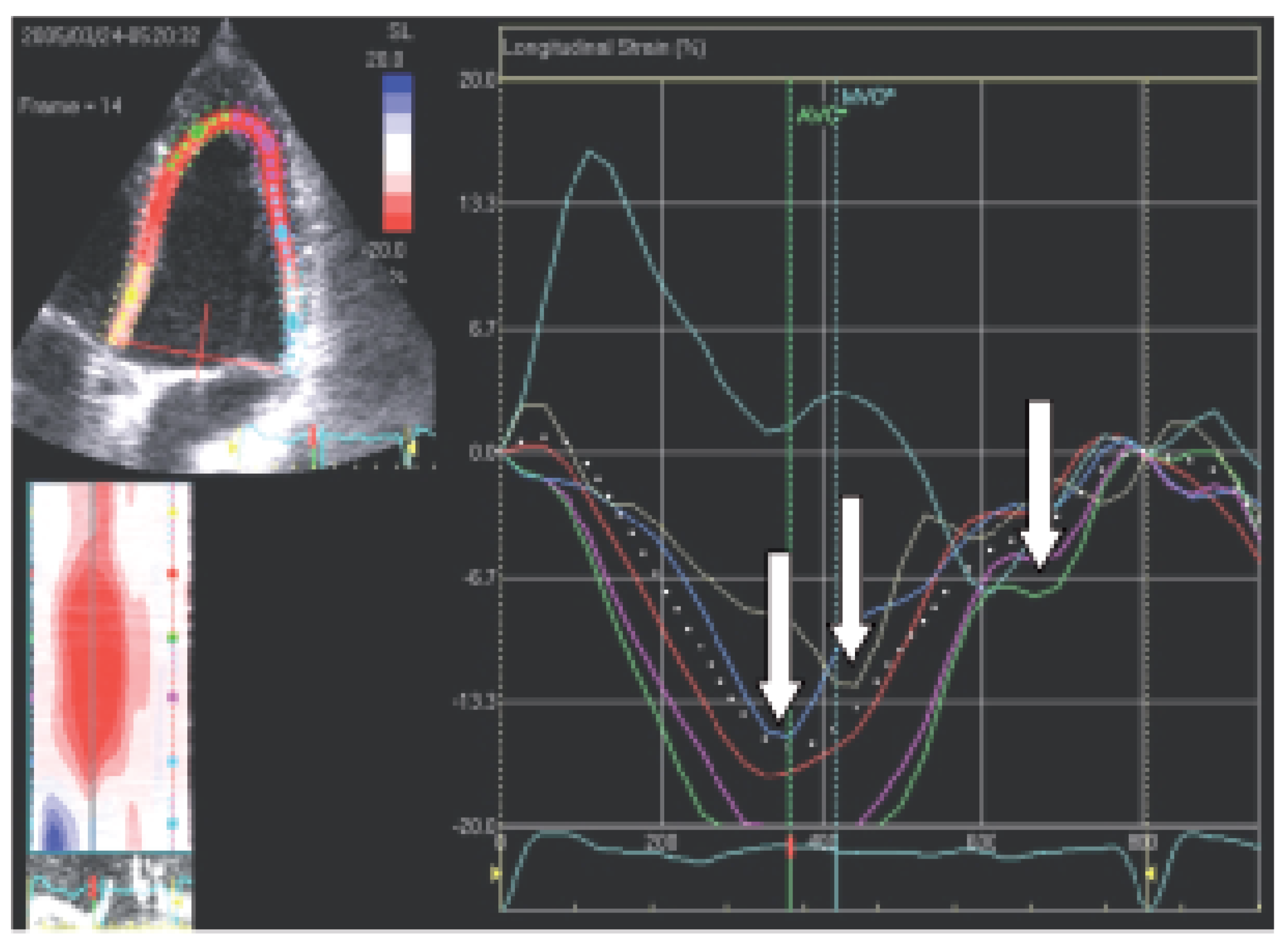
Gewebedoppler-Echokardiographie
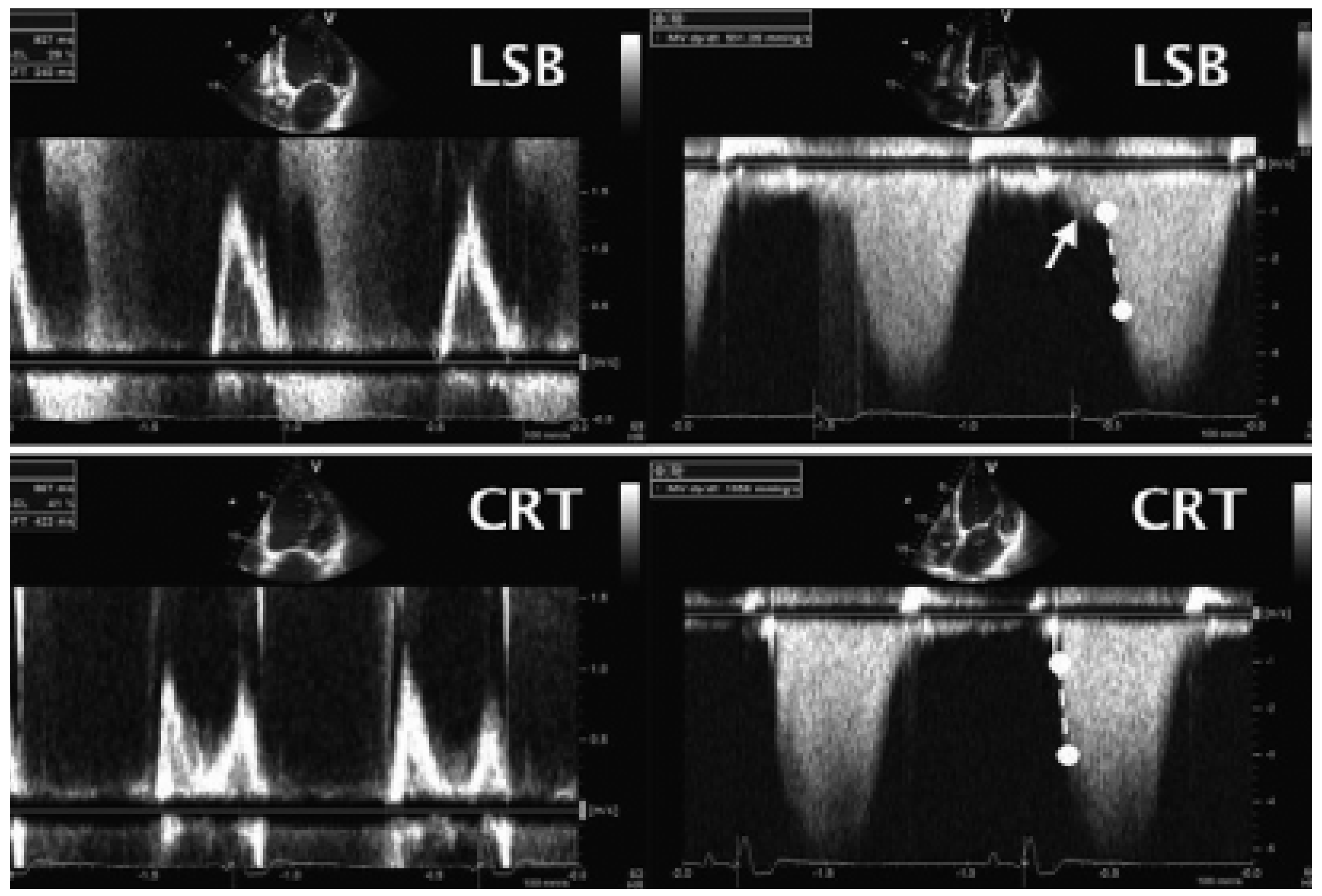
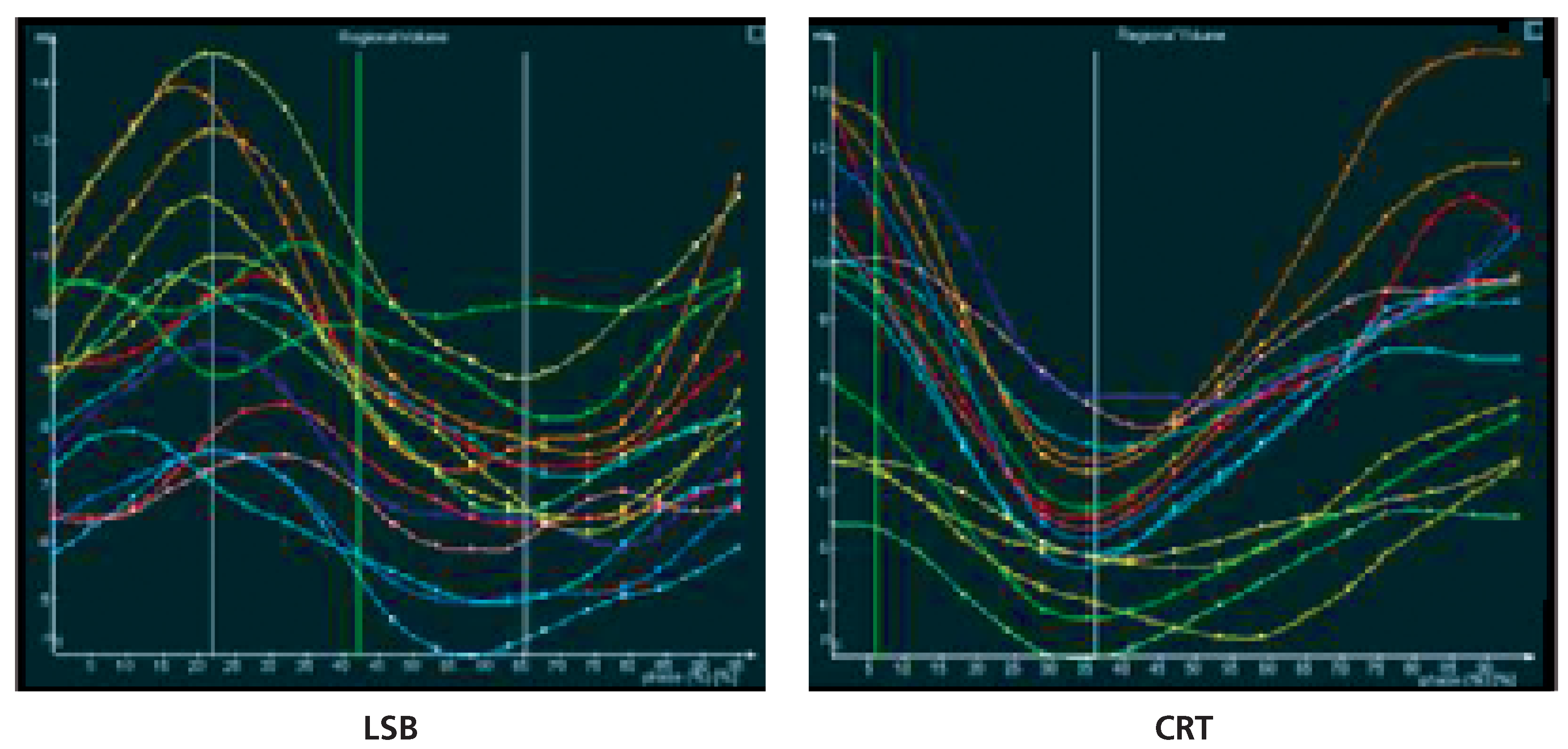
2D- und 3D-Echokardiographie
Optimierung der Programmierten Zeitintervalle
Schlussfolgerung
References
- Ansalone, G.; Giannantoni, P.; Ricci, R.; Trambaiolo, P.; Fedele, F.; Santini, M. Doppler myocardial imaging to evaluate the effectiveness of pacing sites in patients receiving biventricular pacing. J Am Coll Cardiol 39, 489–499. [CrossRef]
- Bargiggia, G.S.; Bertucci, C.; Recusani, F.; Raisaro, A.; De Servi, S.; Valdes-Cruz, L.M.; et al. A new method for estimating left ventricular dP/dt by continuous wave Doppler-echocardiography. Validation studies at cardiac catheterization. Circulation 1989, 80, 1287–1292. [Google Scholar] [CrossRef]
- Bax, J.J.; Ansalone, G.; Breithardt, O.A.; Derumeaux, G.; Leclercq, C.; Schalij, M.J.; et al. Echocardiographic evaluation of cardiac resynchronization therapy: Ready for routine clinical use? A critical appraisal. J Am Coll Cardiol 2004, 44, 1–9. [Google Scholar] [CrossRef]
- Bax, J.J.; Bleeker, G.B.; Marwick, T.H.; Molhoek, S.G.; Boersma, E.; Steendijk, P.; et al. Left ventricular dyssynchrony predicts response and prognosis after cardiac resynchronization therapy. J Am Coll Cardiol 2004, 44, 1834–1840. [Google Scholar] [CrossRef]
- Bax, J.J.; Marwick, T.H.; Molhoek, S.G.; Bleeker, G.B.; van Erven, L.; Boersma, E.; et al. Left ventricular dyssynchrony predicts benefit of cardiac resynchronization therapy in patients with end-stage heart failure before pacemaker implantation. Am J Cardiol 2003, 92, 1238–1240. [Google Scholar] [CrossRef]
- Bax, J.J.; Visser, F.C.; Poldermans, D.; Elhendy, A.; Boersma, E.; Visser, C.A.; et al. Prognostic value of perfusion-FDG mismatch in ischemic cardiomyopathy. J Nucl Cardiol 2002, 9, 675–677. [Google Scholar] [CrossRef]
- Becker, M.; Niedeggen, A.; Kühl, H.; Breithardt, O.A.; Hoffmann, R. Optimierte Platzierung der linksventrikulären Sonde biventrikulärer Schrittmacher mit Hilfe der 2D-Strain-Analyse. Z Kardiol 2005, 94, 19. [Google Scholar]
- Bleeker, G.B.; Schalij, M.J.; Molhoek, S.G.; Verwey, H.F.; Holman, E.R.; Boersma, E.; et al. Relationship between QRS duration and left ventricular dyssynchrony in patients with end-stage heart failure. J Cardiovasc Electrophysiol 2004, 15, 544–549. [Google Scholar] [CrossRef]
- Bode-Schnurbus, L.; Bocker, D.; Block, M.; Gradaus, R.; Heinecke, A.; Breithardt, G.; et al. QRS duration: A simple marker for predicting cardiac mortality in ICD patients with heart failure. Heart 2003, 89, 1157–1162. [Google Scholar] [CrossRef]
- Breithardt, O.A.; Stellbrink, C.; Franke, A.; Balta, O.; Diem, B.H.; Bakker, P.; et al. Acute effects of cardiac resynchronization therapy on left ventricular Doppler indices in patients with congestive heart failure. Am Heart J 2002, 143, 34–44. [Google Scholar] [CrossRef]
- Breithardt, O.A.; Stellbrink, C.; Herbots, L.; Claus, P.; Sinha, A.; Bijnens, B.; et al. Cardiac resynchronization therapy can reverse abnormal myocardial strain distribution in patients with heart failure and left bundle-branch block. J Am Coll Cardiol 2003, 42, 486–494. [Google Scholar] [CrossRef]
- Breithardt, O.A.; Stellbrink, C.; Kramer, A.P.; Sinha, A.M.; Franke, A.; Salo, R.; et al. Echocardiographic quantification of left ventricular asynchrony predicts an acute hemodynamic benefit of cardiac resynchronization therapy. J Am Coll Cardiol 2002, 40, 536–545. [Google Scholar] [CrossRef]
- Bristow, M.R.; Saxon, L.A.; Boehmer, J.; Krueger, S.; Kass, D.A.; De Marco, T.; et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004, 350, 2140–2150. [Google Scholar] [CrossRef]
- Cassidy, D.M.; Vassallo, J.A.; Marchlinski, F.E.; Buxton, A.E.; Untereker, W.J.; Josephson, M.E. Endocardial mapping in humans in sinus rhythm with normal left ventricles: Activation patterns and characteristics of electrograms. Circulation 1984, 70, 37–42. [Google Scholar] [CrossRef]
- Cleland, J.G.; Daubert, J.C.; Erdmann, E.; Freemantle, N.; Gras, D.; Kappenberger, L.; et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005, 352, 1539–1549. [Google Scholar] [CrossRef]
- Faber, L.; Lamp, B.; Hering, D.; Bogunovic, N.; Scholtz, W.; Heintze, J.; Vogt, J.; Horstkotte, D. Analyse der inter- und intraventrikulären Asynchronie mittels Fluss- und GewebeDopplerechokardiographie [Analysis of inter- and intraventricular asynchrony by tissue Doppler echocardiography]. Z Kardiol 2003, 92, 994–1002. [Google Scholar] [CrossRef]
- Franke, A.; Breithardt, O.A.; Rulands, D.; Sinha, A.M.; Kuhl, H.P.; Stellbrink, C. Quantitative analysis of regional left ventricular wall motion patterns in patients with cardiac resynchronization therapy using real-time 3D echocardiography. Circulation 2003, 108 (Suppl S), 2231, (abstract). [Google Scholar]
- Garrigue, S.; Jais, P.; Espil, G.; Labeque, J.N.; Hocini, M.; Shah, D.C.; et al. Comparison of chronic biventricular pacing between epicardial and endocardial left ventricular stimulation using Doppler tissue imaging in patients with heart failure. Am J Cardiol 2001, 88, 858–862. [Google Scholar] [CrossRef]
- Gorcsan J3rd Kanzaki, H.; Bazaz, R.; Dohi, K.; Schwartzman, D. Usefulness of echocardiographic tissue synchronization imaging to predict acute response to cardiac resynchronization therapy. Am J Cardiol 2004, 93, 1178–1181. [Google Scholar] [CrossRef]
- Gregoratos, G.; Abrams, J.; Epstein, A.E.; Freedman, R.A.; Hayes, D.L.; Hlatky, M.A.; et al. ACC/AHA/NASPE 2002 guideline update for implantation of cardiac pacemakers and antiarrhythmia devices-summary article: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/NASPE Committee to Update the 1998 Pacemaker Guidelines). J Am Coll Cardiol 2002, 40, 1703–1719. [Google Scholar]
- Grines, C.L.; Bashore, T.M.; Boudoulas, H.; Olson, S.; Shafer, P.; Wooley, C.F. Functional abnormalities in isolated left bundle branch block. The effect of interventricular asynchrony. Circulation 1989, 79, 845–853. [Google Scholar] [CrossRef]
- Iuliano, S.; Fisher, S.G.; Karasik, P.E.; Fletcher, R.D.; Singh, S.N. QRS duration and mortality in patients with congestive heart failure. Am Heart J 2002, 143, 1085–1091. [Google Scholar] [CrossRef]
- Kapetanakis, S.; Cooklin, M.; Monaghan, M.J. Mechanical resynchronisation in biventricular pacing illustrated by real time transthoracic three dimensional echocardiography. Heart 2004, 90, 482. [Google Scholar] [CrossRef][Green Version]
- Kass, D.A. Ventricular resynchronization: Pathophysiology and identification of responders. Rev Cardiovasc Med 2003, 4 (Suppl 2), S3–13. [Google Scholar][Green Version]
- Kindermann, M.; Fröhlig, G.; Doerr, T.; Schieffer, H. Optimizing the AV delay in DDD pacemaker patients with high degree AV block: Mitral valve Doppler versus impedance cardiography. PACE 1997, 20, 2453–2462. [Google Scholar] [CrossRef]
- Little, W.C.; Reeves, R.C.; Arciniegas, J.; Katholi, R.E.; Rogers, E.W. Mechanism of abnormal interventricular septal motion during delayed left ventricular activation. Circulation 1982, 65, 1486–1491. [Google Scholar] [CrossRef]
- Meluzin, J.; Novak, M.; Mullerova, J.; Krejci, J.; Hude, P.; Eisenberger, M.; Dusek, L.; Dvorak, I.; Spinarova, L. A fast and simple echocardiographic method of determination of the optimal atrioventricular delay in patients after biventricular stimulation. Pacing Clin Electrophysiol 2004, 27, 58–64. [Google Scholar] [CrossRef]
- Nelson, G.S.; Berger, R.D.; Fetics, B.J.; Talbot, M.; Spinelli, J.C.; Hare, J.M.; et al. Left ventricular or biventricular pacing improves cardiac function at diminished energy cost in patients with dilated cardiomyopathy and left bundle-branch block. Circulation 2000, 102, 3053–3059. [Google Scholar] [CrossRef]
- Oguz, E.; Dagdeviren, B.; Bilsel, T.; Akdemir, O.; Erdinler, I.; Akyol, A.; et al. Echocardiographic prediction of long-term response to biventricular pacemaker in severe heart failure. Eur J Heart Fail 2002, 4, 83–90. [Google Scholar] [CrossRef][Green Version]
- Penicka, M.; Bartunek, J.; De Bruyne, B.; Vanderheyden, M.; Goethals, M.; De Zutter, M.; et al. Improvement of left ventricular function after cardiac resynchronization therapy is predicted by tissue Doppler imaging echocardiography. Circulation 2004, 109, 978–983. [Google Scholar] [CrossRef]
- Perego, G.B.; Chianca, R.; Facchini, M.; Frattola, A.; Balla, E.; Zucchi, S.; et al. Simultaneous vs. sequential biventricular pacing in dilated cardiomyopathy: An acute hemodynamic study. Eur J Heart Fail 2003, 5, 305–313. [Google Scholar] [CrossRef]
- Pitzalis, M.V.; Iacoviello, M.; Romito, R.; Guida, P.; De Tommasi, E.; Luzzi, G.; et al. Ventricular asynchrony predicts a better outcome in patients with chronic heart failure receiving cardiac resynchronization therapy. J Am Coll Cardiol 2005, 45, 65–69. [Google Scholar] [CrossRef]
- Pitzalis, M.V.; Iacoviello, M.; Romito, R.; Massari, F.; Rizzon, B.; Luzzi, G. Cardiac resynchronization therapy tailored by echocardiographic evaluation of ventricular asynchrony. J Am Coll Cardiol 2002, 40, 1615–1622. [Google Scholar] [CrossRef]
- Prinzen, F.W.; Augustijn, C.H.; Allessie, M.A.; Arts, T.; Delhaas, T.; Reneman, R.S. The time sequence of electrical and mechanical activation during spontaneous beating and ectopic stimulation. Eur Heart J 1992, 13, 535–543. [Google Scholar] [CrossRef]
- Ritter, P.; Dib, J.C.; Mahaux, V.; Lelièvre, T.; Soyeur, D.; Lavergne, T.; et al. New method for determing the optimal atrio-ventricular delay in patients paced in DDD mode for complete atrio-aentricular block. PACE 1995, 18, 855. [Google Scholar]
- Rouleau, F.; Merheb, M.; Geffroy, S.; Berthelot, J.; Chaleil, D.; Dupuis, J.M. Echocardiographic assessment of the interventricular delay of activation and correlation to the QRS width in dilated cardiomyopathy. Pacing Clin Electrophysiol 2001, 24, 1500–1506. [Google Scholar] [CrossRef]
- Schuster, P.; Faerestrand, S.; Ohm, O.J. Colour tissue velocity imaging can show resynchronisation of longitudinal left ventricular contraction pattern by biventricular pacing in patients with severe heart failure. Heart 2003, 89, 859–864. [Google Scholar] [CrossRef][Green Version]
- Schuster, P.; Faerestrand, S.; Ohm, O.J. Color Doppler tissue velocity imaging can disclose systolic left ventricular asynchrony independent of the QRS morphology in patients with severe heart failure. Pacing Clin Electrophysiol 2004, 27, 460–467. [Google Scholar] [CrossRef]
- Silvet, H.; Amin, J.; Padmanabhan, S.; Pai, R.G. Prognostic implications of increased QRS duration in patients with moderate and severe left ventricular systolic dysfunction. Am J Cardiol 2001, 88, 182–185, A6. [Google Scholar] [CrossRef]
- Sogaard, P.; Egeblad, H.; Kim, W.; Jensen, H.; Pedersen, A.; Kristensen, B.; et al. Tissue doppler imaging predicts improved systolic performance and reversed left ventricular remodeling during long-term cardiac resynchronization therapy. J Am Coll Cardiol 2002, 40, 723–730. [Google Scholar] [CrossRef]
- Sogaard, P.; Egeblad, H.; Pedersen, A.K.; Kim, W.Y.; Kristensen, B.O.; Hansen, P.S.; et al. Sequential versus simultaneous biventricular resynchronization for severe heart failure: Evaluation by tissue Doppler imaging. Circulation 2002, 106, 2078–2084. [Google Scholar] [CrossRef]
- Van Gelder, B.M.; Bracke, F.A.; Meijer, A.; Lakerveld, L.J.; Pijls, N.H. Effect of optimizing the VV interval on left ventricular contractility in cardiac resynchronization therapy. Am J Cardiol 2004, 93, 1500–1503. [Google Scholar] [CrossRef]
- Vassallo, J.A.; Cassidy, D.M.; Marchlinski, F.E.; Buxton, A.E.; Waxman, H.L.; Doherty, J.U.; et al. Endocardial activation of left bundle branch block. Circulation 1984, 69, 914–923. [Google Scholar] [CrossRef]
- Yu, C.M.; Chau, E.; Sanderson, J.E.; Fan, K.; Tang, M.O.; Fung, W.H.; et al. Tissue Doppler echocardiographic evidence of reverse remodeling and improved synchronicity by simultaneously delaying regional contraction after biventricular pacing therapy in heart failure. Circulation 2002, 105, 438–445. [Google Scholar] [CrossRef]
- Yu, C.M.; Fung, J.W.; Zhang, Q.; Chan, C.K.; Chan, Y.S.; Lin, H.; et al. Tissue Doppler imaging is superior to strain rate imaging and postsystolic shortening on the prediction of reverse remodeling in both ischemic and nonischemic heart failure after cardiac resynchronization therapy. Circulation 2004, 110, 66–73. [Google Scholar] [CrossRef]
- Yu, C.M.; Yang, H.; Lau, C.P.; Wang, Q.; Wang, S.; Lam, L.; et al. Regional left ventricle mechanical asynchrony in patients with heart disease and normal QRS duration: Implication for biventricular pacing therapy. Pacing Clin Electrophysiol 2003, 26, 562–570. [Google Scholar] [CrossRef]
- Yu, C.M.; Zhang, Q.; Fung, J.W.; Chan, H.C.; Chan, Y.S.; Yip, G.W.; et al. A novel tool to assess systolic asynchrony and identify responders of cardiac resynchronization therapy by tissue synchronization imaging. J Am Coll Cardiol 2005, 45, 677–684. [Google Scholar] [CrossRef]


Disclaimer/Publisher’s Note: The statements, opinions and data contained in all publications are solely those of the individual author(s) and contributor(s) and not of MDPI and/or the editor(s). MDPI and/or the editor(s) disclaim responsibility for any injury to people or property resulting from any ideas, methods, instructions or products referred to in the content. |
© 2005 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Breithardt, O.-A.; Göbel, B.; Becker, M.; Franke, A. Echokardiographie bei Kardialer Resynchronisationstherapie. Cardiovasc. Med. 2005, 8, 426. https://doi.org/10.4414/cvm.2005.01136
Breithardt O-A, Göbel B, Becker M, Franke A. Echokardiographie bei Kardialer Resynchronisationstherapie. Cardiovascular Medicine. 2005; 8(12):426. https://doi.org/10.4414/cvm.2005.01136
Chicago/Turabian StyleBreithardt, Ole-A., Björn Göbel, Michael Becker, and Andreas Franke. 2005. "Echokardiographie bei Kardialer Resynchronisationstherapie" Cardiovascular Medicine 8, no. 12: 426. https://doi.org/10.4414/cvm.2005.01136
APA StyleBreithardt, O.-A., Göbel, B., Becker, M., & Franke, A. (2005). Echokardiographie bei Kardialer Resynchronisationstherapie. Cardiovascular Medicine, 8(12), 426. https://doi.org/10.4414/cvm.2005.01136



