Sind die Gen- Oder Stammzelltherapie Eine Therapeutische Option? †
Summary
Zusammenfassung
Einleitung
Gentherapie-Studien
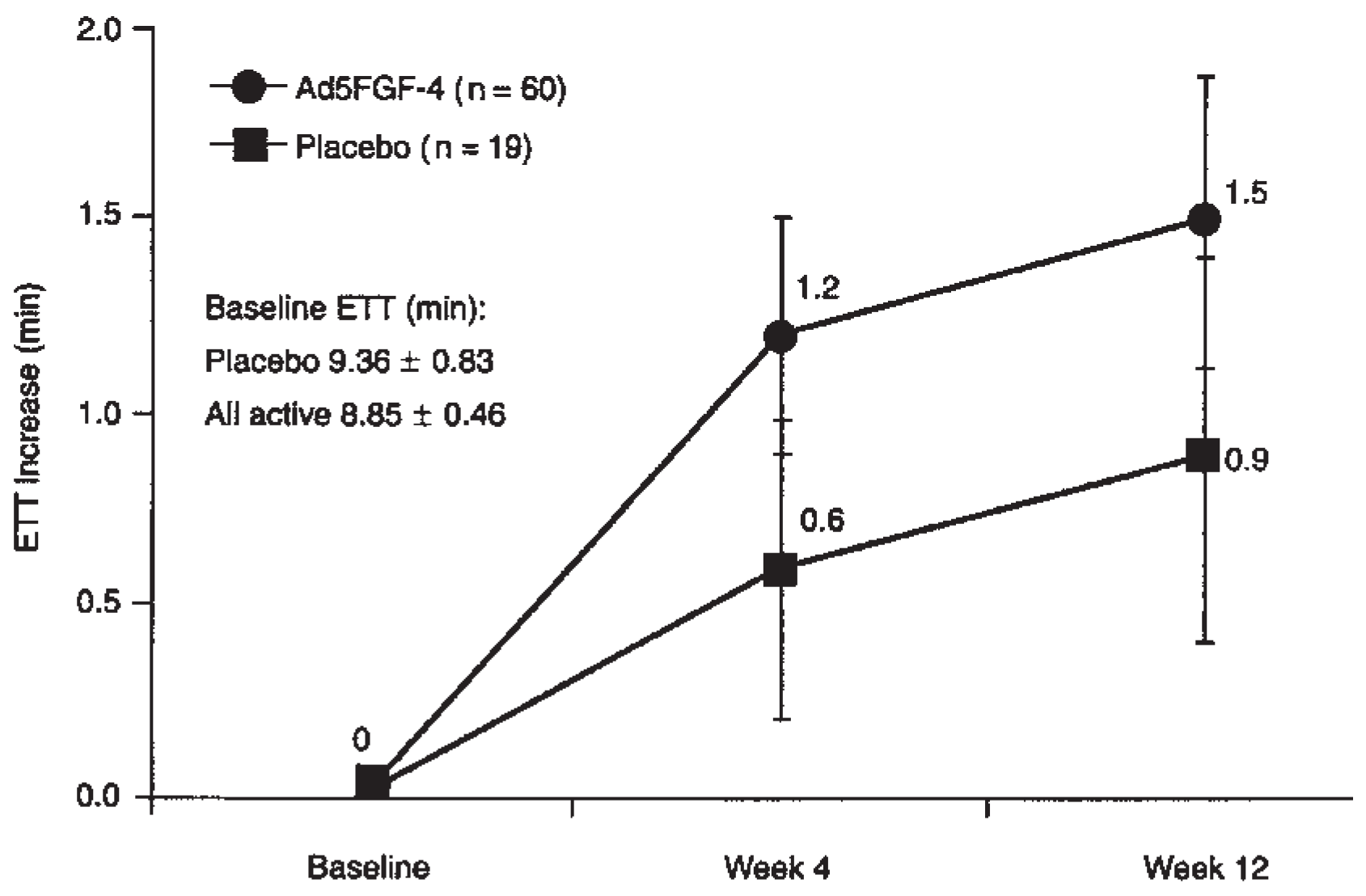
The Angiogenic GENe Therapy trials (AGENT-Studien)
Regional Angiogenesis with Vascular Endothelial growth factor in peripheral arterial disease (RAVE-Studie)
Therapeutic Angiogenesis Leg Ischaemia Study for Management of Arteriopathy and Non-healing ulcer (TALISMAN-Studien)
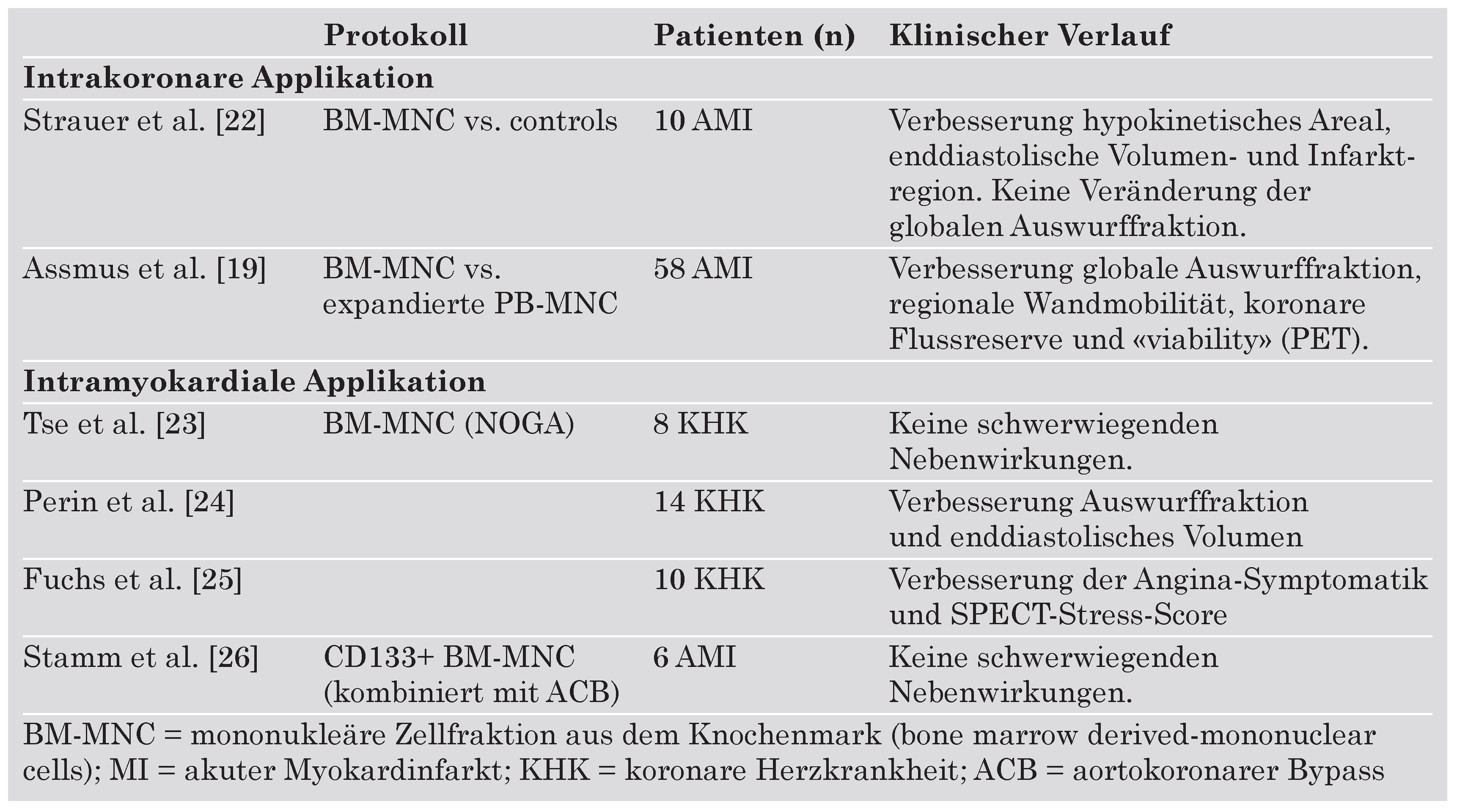
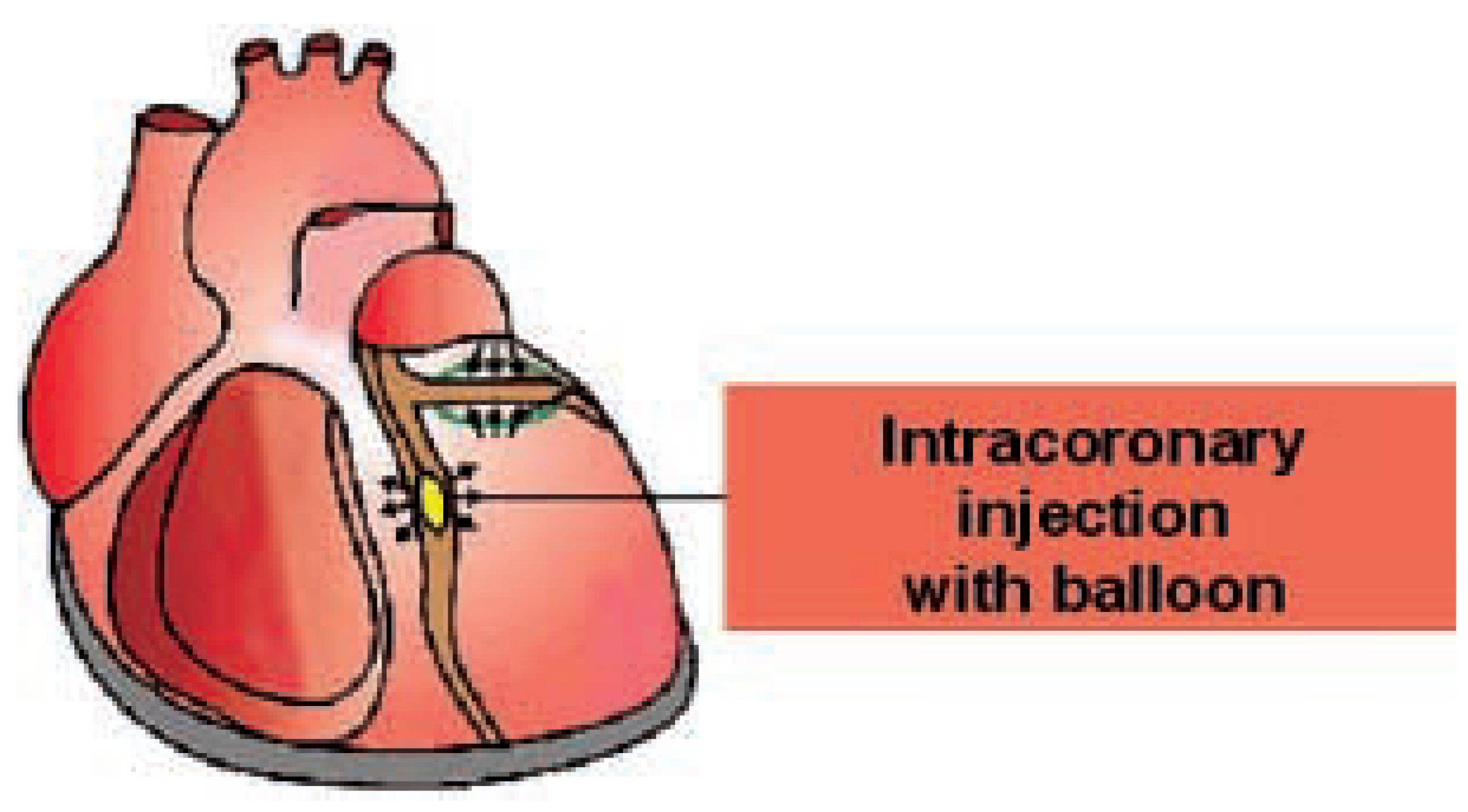
Stammzelltherapie
Therapeutic Angiogenesis using Cell Transplantation (TACT-Studie)
Transplantation Of adult Progenitor cells in ischaemic heart disease (TOPCARE-AMI-Studie) und Bone Marrow Transfer to Enhance ST-Elevation Infarct Regeneration (BOOST-Studie)
Referenzen
- Carmeliet, P. Mechanisms of angiogenesis and arteriogenesis. Nature Med 2000, 6, 389–395. [Google Scholar] [CrossRef]
- Asahara, T.; Masuda, H.; Takahashi, T.; et al. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathophysiological neovascularization. Circ Res 1999, 85, 221–228. [Google Scholar] [CrossRef] [PubMed]
- Isner, J.M.; Takayuki, A. Angiogenesis and vasculogenesis as therapeutic strategies for postnatal neovascularization. J Clin Invest 1999, 103, 1231–1236. [Google Scholar] [CrossRef]
- Isner, J.M. Myocardial gene therapy. Nature 2002, 415, 234–239. [Google Scholar] [CrossRef]
- Baumgartner, I.; Isner, J.M. Somatic gene therapy in the cardiovascular system. Ann Rev Physiol 2001, 63, 427–450. [Google Scholar] [CrossRef] [PubMed]
- Ylä-Herttuala, S.; Alitalo, K. Gene transfer as a tool to induce therapeutic vascular growth. Nature Med 2003, 9, 694–701. [Google Scholar] [CrossRef] [PubMed]
- Grines, C.; Rubanyi, G.M.; Kleiman, N.S.; Marrott, P.; Watkins, M.W. Angiogeneic gene therapy with adenovirus 5 fibroblast growth factor-4 (Ad5FGF-4): A new option for the treatment of coronary artery disease. Am J Cardiol 2003, 92, 24–31. [Google Scholar] [CrossRef]
- Rajagopalan, S.; Mohler, E.R.; Lederman, R.J.; et al. Regional angiogenesis with vascular endothelial growth factor in peripheral arterial disease. Circulation 2003, 108, 1933–1938. [Google Scholar] [CrossRef]
- Dor, Y.; Djonov, V.; Abramovitch, R.; et al. Conditional switching of VEGF provides new insights into adult neovascularization and pro-angiogenic therapy. EMBO J 2002, 21, 1939–1947. [Google Scholar] [CrossRef]
- Baumgartner, I.; Pieczek, A.; Manor, O.; et al. Constitutive expression of phVEGF165 following intramuscular gene transfer promotes collateral vessel development in patients with critical limb ischemia. Circulation 1998, 97, 1114–1123. [Google Scholar] [CrossRef]
- Shyu, K.G.; Manor, O.; Magner, M.; Yancopoulos, G.D.; Isner, J.M. Direct intramuscular injection of plasmid DNA encoding angiopoietin-1 but not angiopoietin-2 augments revascularization in the rabbit ischemic hindlimb. Circulation 1999, 98, 2081–2087. [Google Scholar] [CrossRef] [PubMed]
- Comerota, A.J.; Throm, R.C.; Miller, K.; et al. Naked plasmid DNA encoding fibroblast growth factor type 1 for the treatment of end-stage unreconstructible lower extremity ischemia: Preliminary results of a phase I trial. J Vasc Surg 2002, 35, 930–936. [Google Scholar] [CrossRef] [PubMed]
- Baumgartner, I.; Chronos, N.; Comerota, A.; et al. Distribution and expression of FGF-1 transgene in lower limb muscle of individuals with severe PAOD. AHA (abstract) 2004. [Google Scholar]
- Asahara, T.; Murohara, T.; Sullivan, A.; et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science 1997, 275, 964–967. [Google Scholar] [CrossRef] [PubMed]
- Kalka, C.; Masuda, H.; Takahashi, T.; et al. Transplantation of ex vivo expanded endothelial progenitor cells for therapeutic neovascularization. Proc Nat Acad Sci USA 2000, 97, 3422–7. [Google Scholar] [CrossRef]
- Takahashi, T.; Kalka, C.; Masuda, H.; et al. Ischemiaand cytokine-induced mobilization of bone-marrow-derived endothelial progenitor cells for neovascularization. Nature Med 1999, 5, 434–438. [Google Scholar] [CrossRef]
- Dimmeler, S.; Aicher, A.; Vasa, M.; et al. HMG-CoA reductase inhibitors (statins) increase endothelial progenitor cells via the PI 3-kinase/Akt pathway. J. Clin. Invest. 2001, 108, 391–7. [Google Scholar] [CrossRef]
- Tateishi-Yuyama, E.; Matsubara, H.; Murohara, T.; et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: A pilot study and a randomized controlled trial. Lancet 2002, 360, 427–35. [Google Scholar] [CrossRef]
- Assmus, B.; Schachinger, V.; Teupe, C.; et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction (TOPCARE-AMI). Circulation 2002, 106, 3009–3017. [Google Scholar] [CrossRef]
- Wollert, K.C.; Meyer, G.P.; Lotz, J.; et al. Intracoronary autologous bone-marrow cell transfer after myocardial infarction: The BOOST randomised controlled clinical trial. Lancet 2004, 364, 141–148. [Google Scholar] [CrossRef]
- Dormandy, J.A.; Heeck, L.; Vig, S. Peripheral Arterial Occlusive Disease: Clinical Data for Decision Making; W.B. Saunders: Philadelphia, PA, USA, 1999. [Google Scholar]
- Strauer, B.E.; Brehm, M.; Zeus, T.; et al. Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans. Circulation 2002, 106, 1913–1918. [Google Scholar] [CrossRef]
- Tse, H.F.; Kwong, Y.L.; Chan, J.K.; Lo, G.; Ho, C.L.; Lau, C.P. Angiogenesis in ischaemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation. Lancet 2003, 361, 47–49. [Google Scholar] [CrossRef] [PubMed]
- Perin, E.C.; Dohmann, H.F.R.; Borojevic, R.; et al. Transendocardial autologous bone marrow cell transplantation for severe, chronic ischemic heart failure. Circulation 2003, 107, 2291–302. [Google Scholar] [CrossRef] [PubMed]
- Fuchs, S.; Satler, L.F.; Kornowski, R.; et al. Catheter-based autologous bone marrow myocardial injection in no-option patients with advanced coronary artery disease: A feasibility study. JACC 2003, 41, 1721–1724. [Google Scholar] [CrossRef] [PubMed]
- Stamm, C.; Westphal, B.; Kleine, H.D.; et al. Autologous bonemarrow stem-cell transplantation for myocardial regeneration. Lancet 2003, 361, 45–46. [Google Scholar] [CrossRef]
© 2004 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Baumgartner, I. Sind die Gen- Oder Stammzelltherapie Eine Therapeutische Option? Cardiovasc. Med. 2004, 7, 331. https://doi.org/10.4414/cvm.2004.01047
Baumgartner I. Sind die Gen- Oder Stammzelltherapie Eine Therapeutische Option? Cardiovascular Medicine. 2004; 7(9):331. https://doi.org/10.4414/cvm.2004.01047
Chicago/Turabian StyleBaumgartner, Iris. 2004. "Sind die Gen- Oder Stammzelltherapie Eine Therapeutische Option?" Cardiovascular Medicine 7, no. 9: 331. https://doi.org/10.4414/cvm.2004.01047
APA StyleBaumgartner, I. (2004). Sind die Gen- Oder Stammzelltherapie Eine Therapeutische Option? Cardiovascular Medicine, 7(9), 331. https://doi.org/10.4414/cvm.2004.01047





