Plättchenhemmung Durch Thienopyridine beim Akuten Koronarsyndrom und nach Perkutaner Koronarer Intervention—Praktische Empfehlungen
Summary
Zusammenfassung
Einleitung
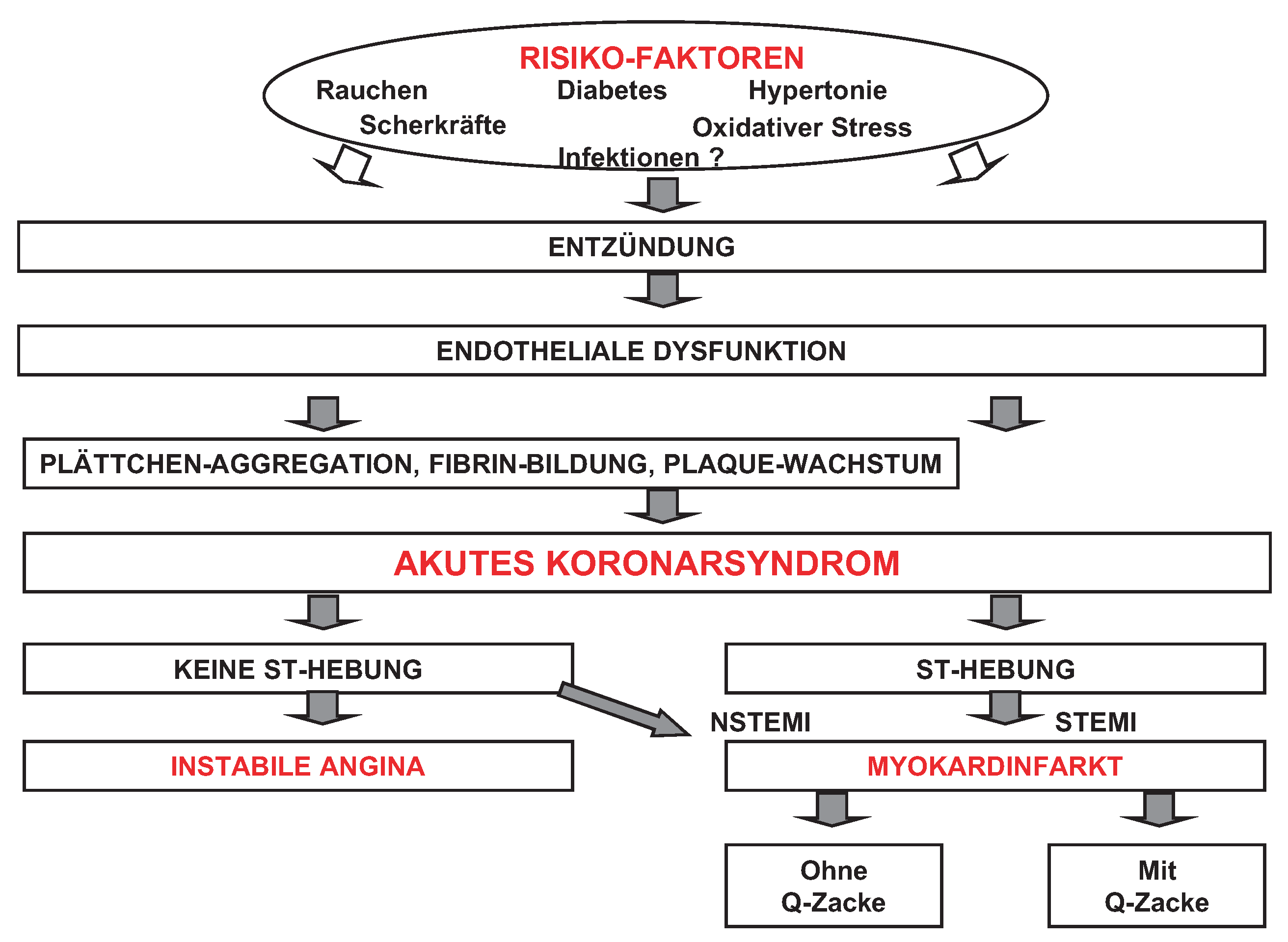
Biologie akuter Koronarsyndrome
Klinik akuter Koronarsyndrome
Risikostratifizierung


Clopidogrel bei atherothrombotischen Erkrankungen
Klinik akuter Koronarsyndrome
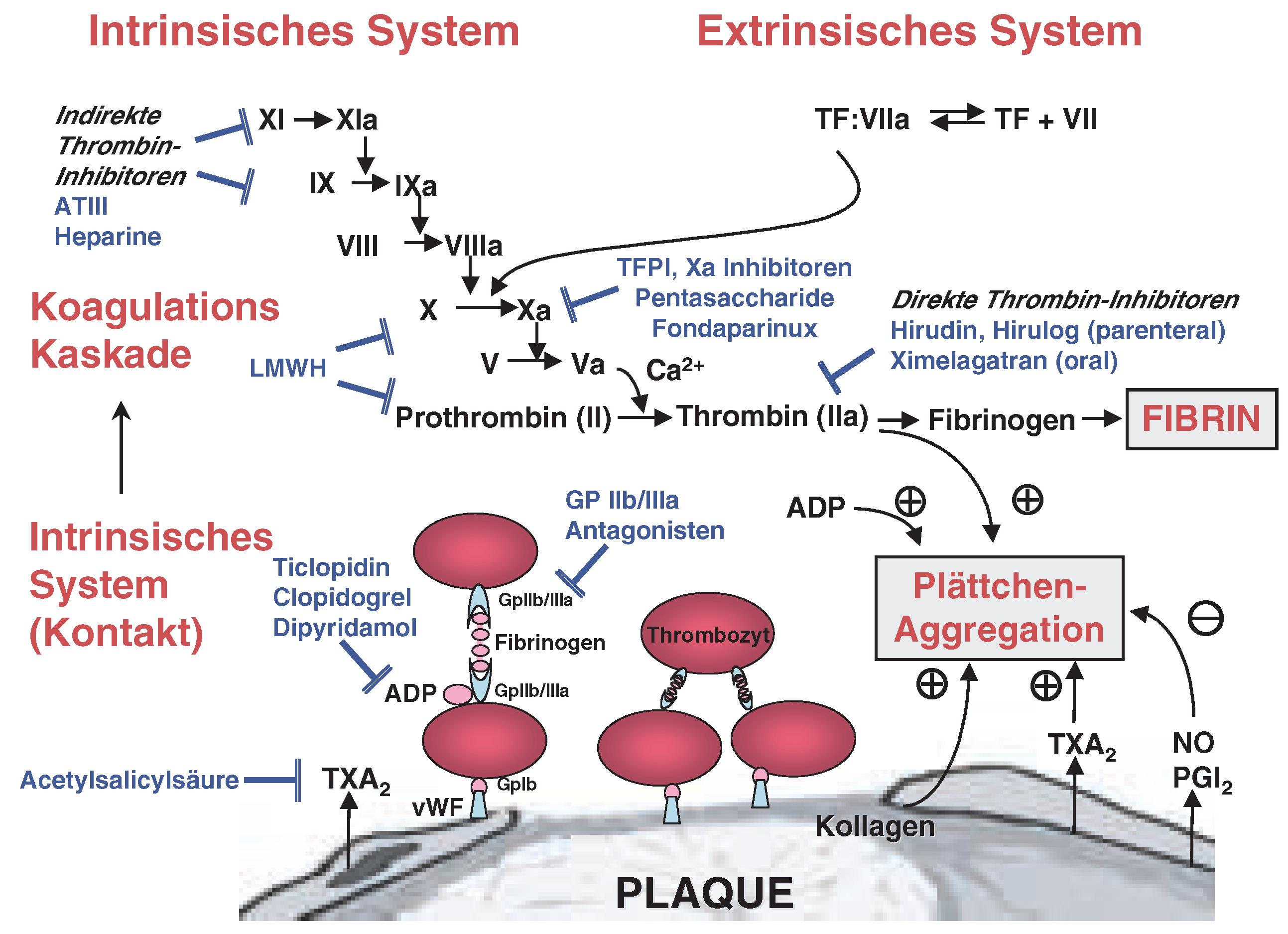
Pharmakologie

Interaktionen
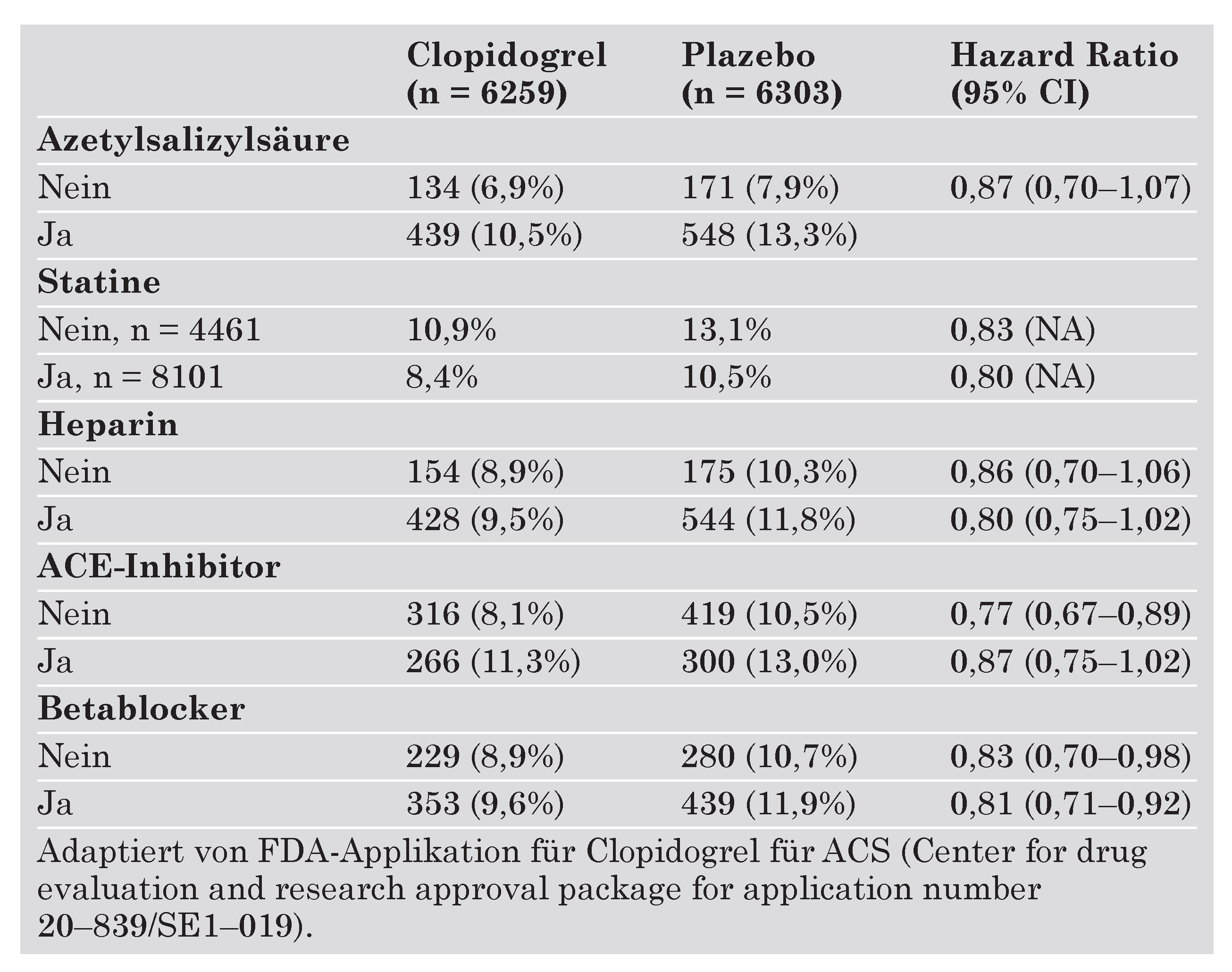
Sekundärprävention atherothrombotischer Erkrankungen
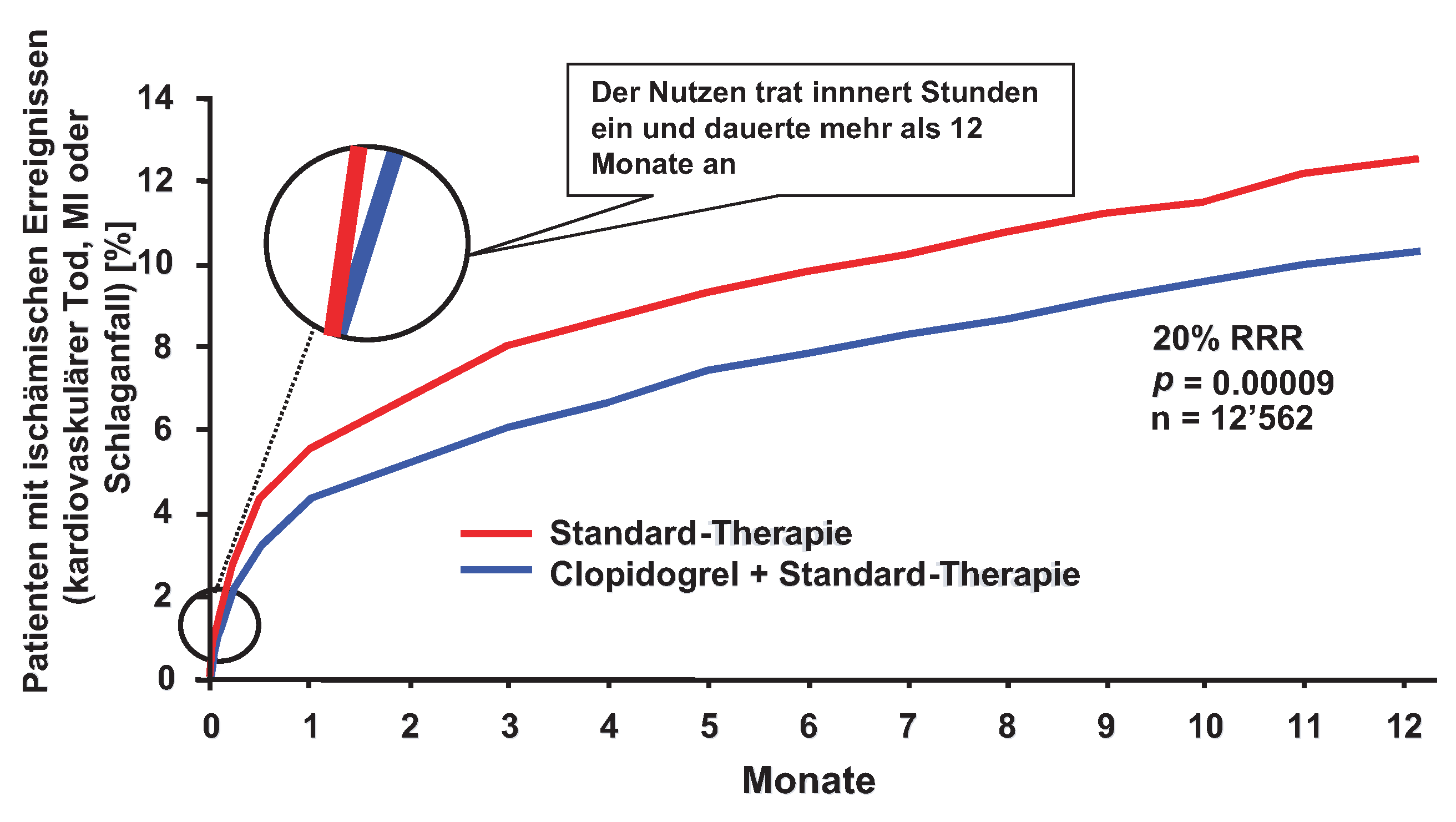
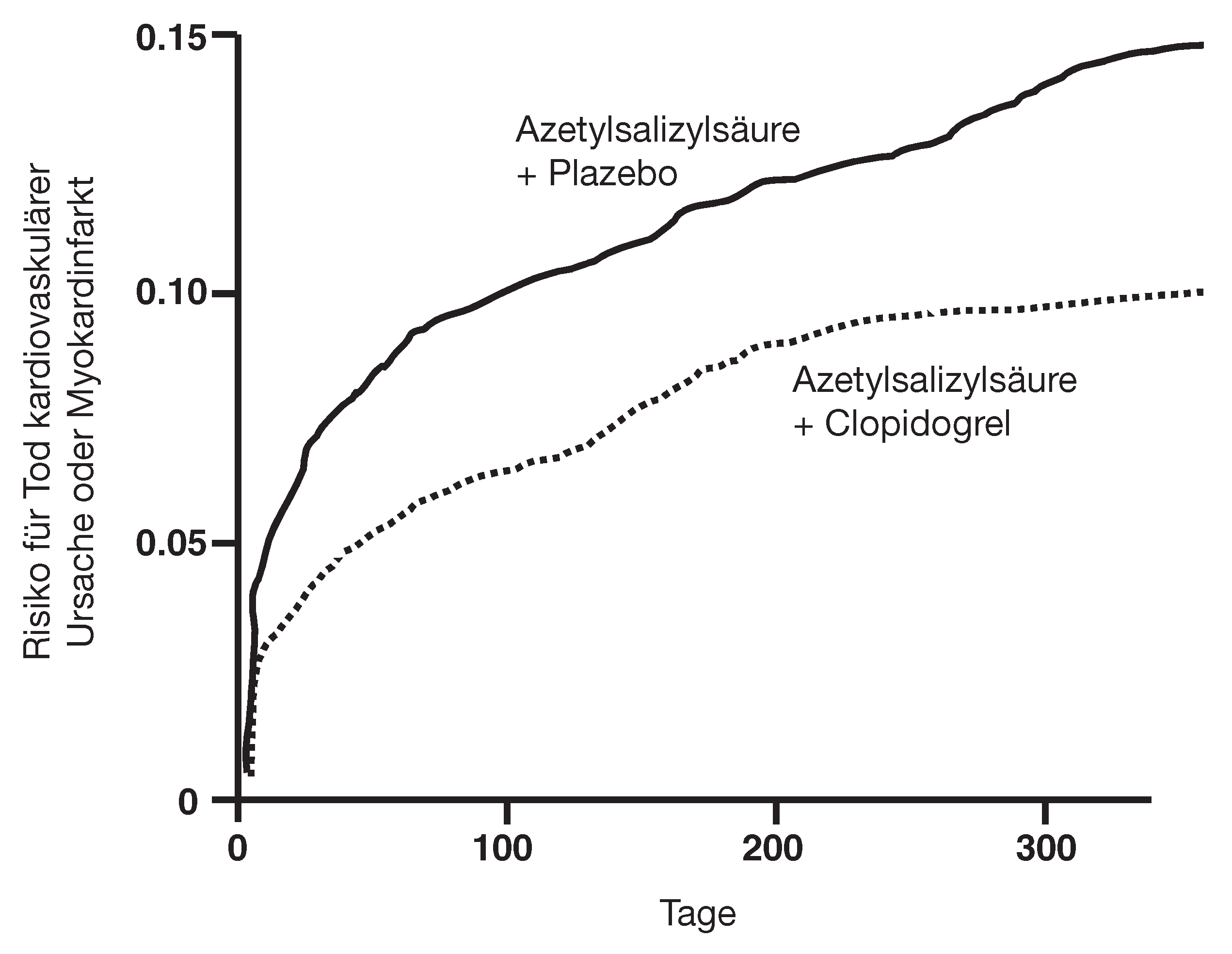
Clopidogrel beim akuten Koronarsyndrom
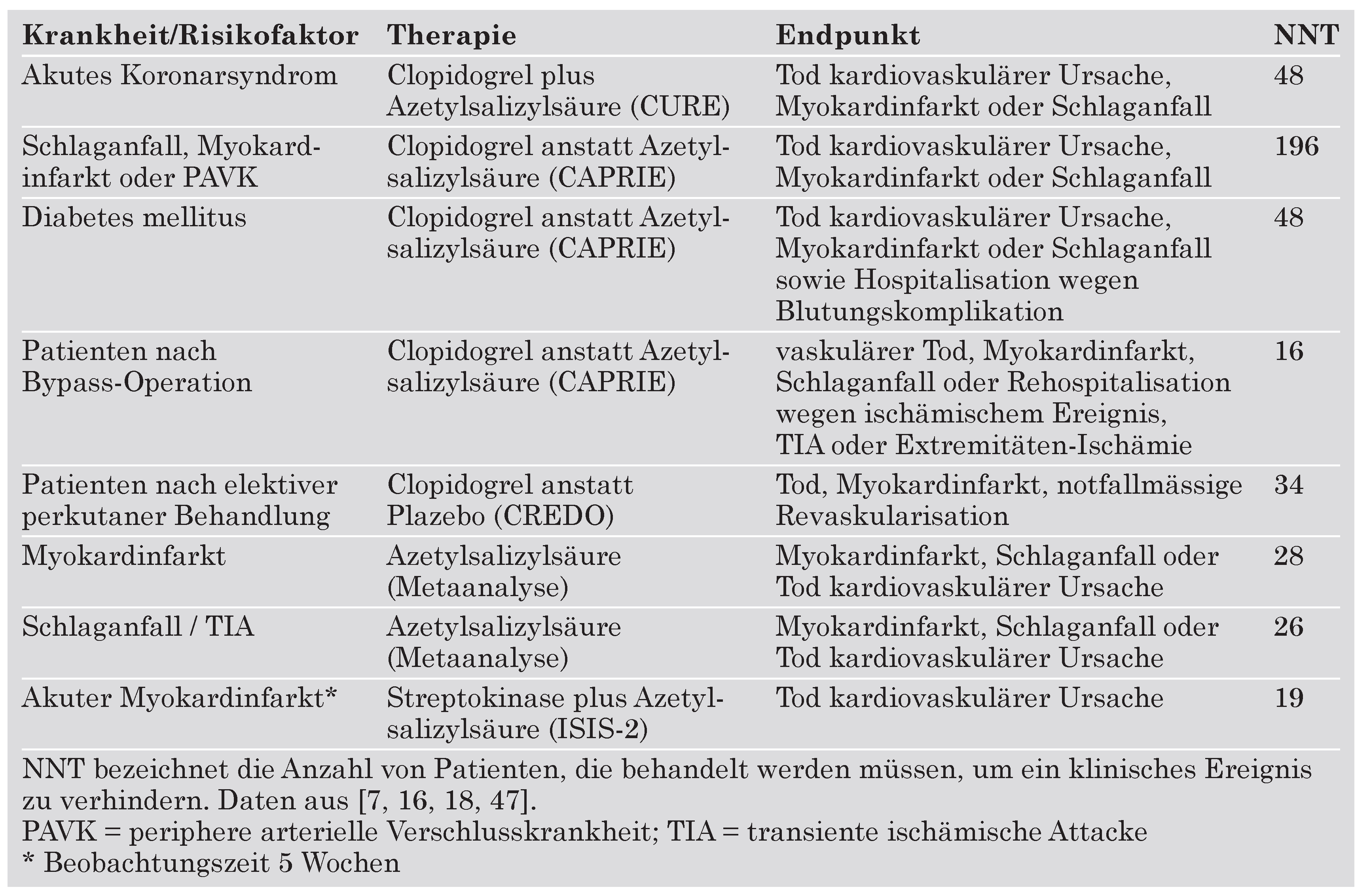
Akutes Koronarsyndrom mit invasiver Therapie
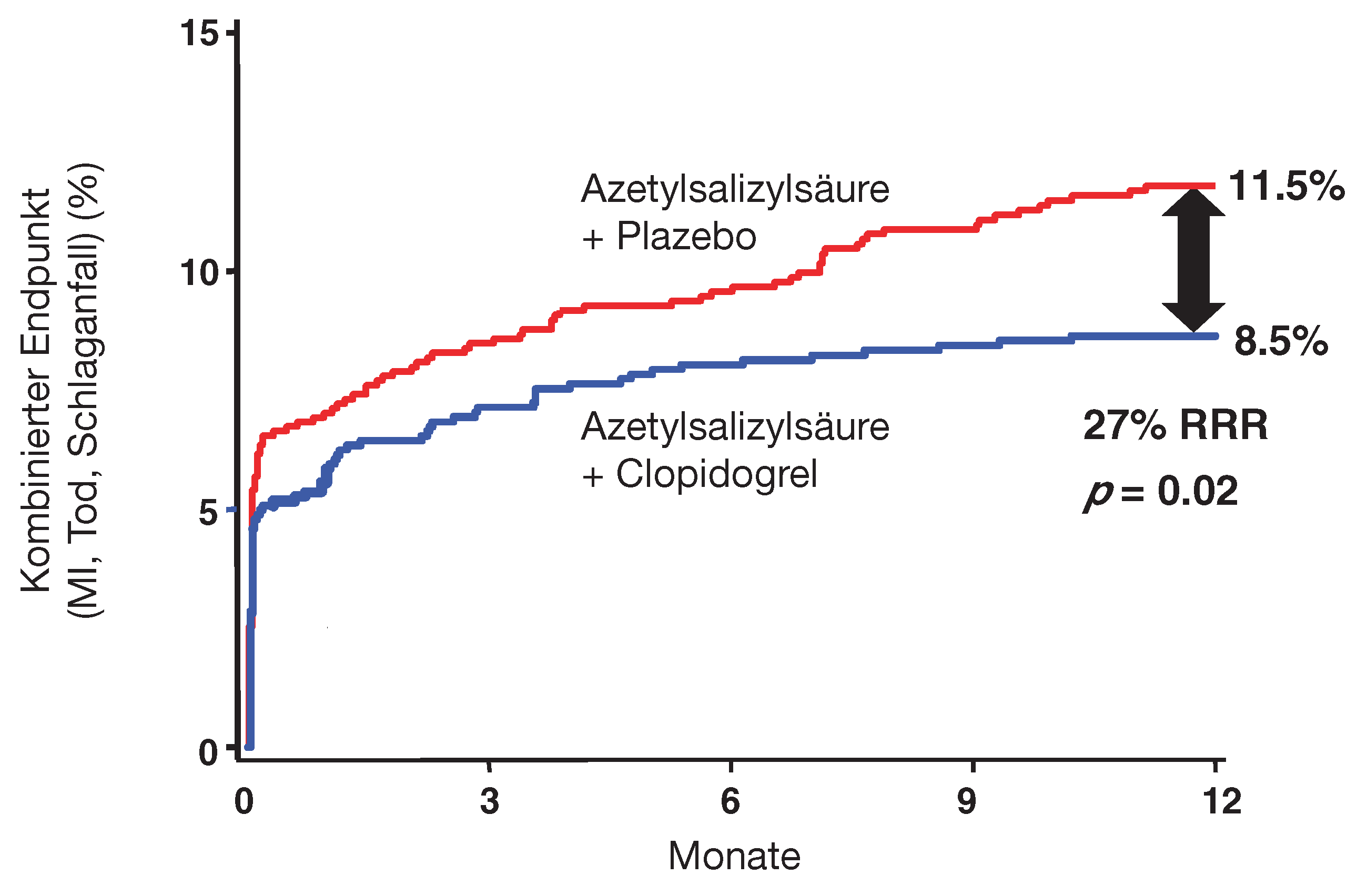
PCI-CURE
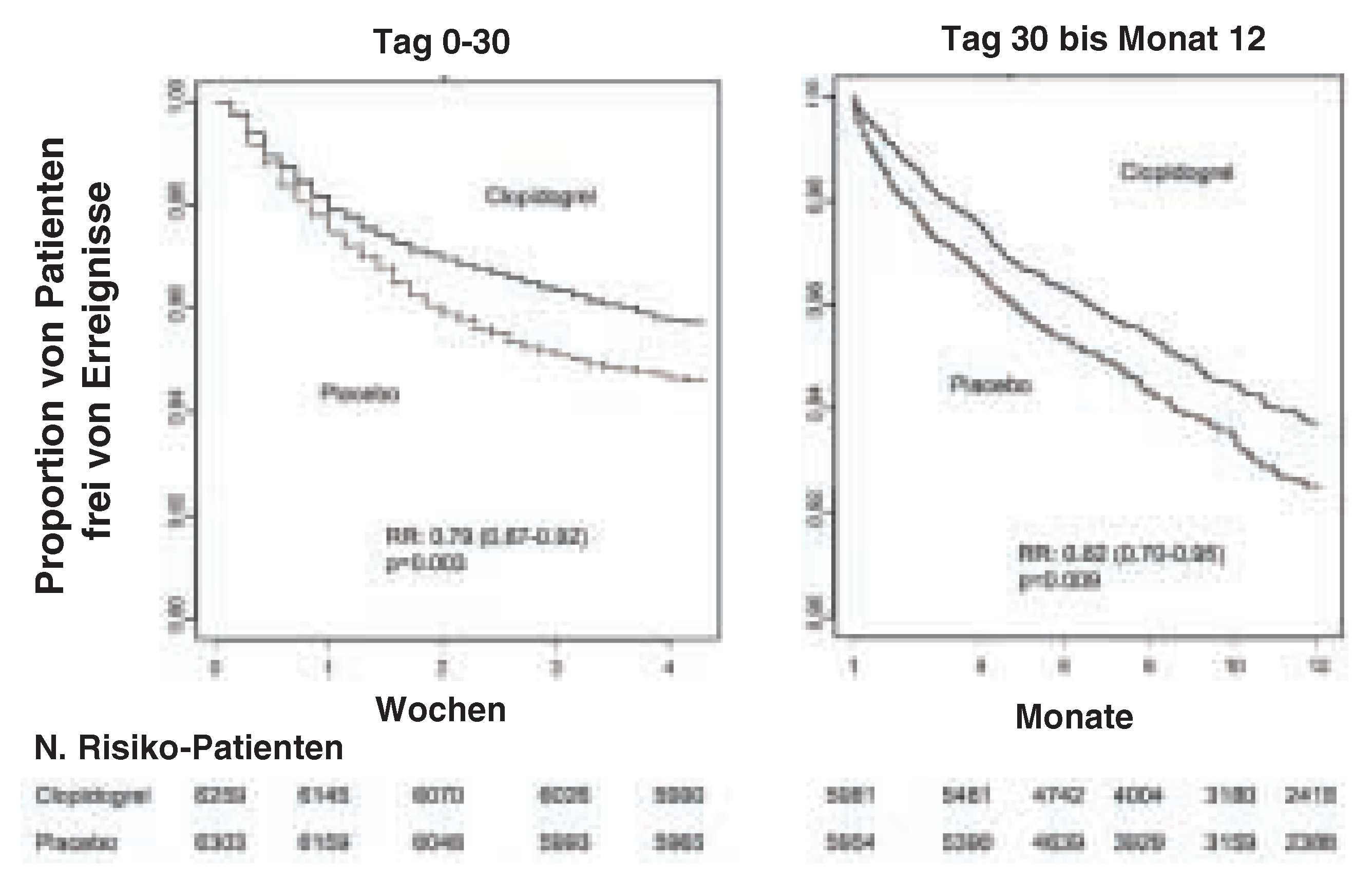
CREDO
Studien-Limitationen
CURE
PCI-CURE
CREDO
Kosten-Analyse
Offene Fragen
Praktische Empfehlungen
Niederrisikopatient
ST-Hebungsinfarkt (STEMI)
Nicht-ST-Hebungsinfarkt (NSTEMI)
Bei PCI
Behandlungsdauer
Chirurgische Patienten
References
- Corti R, Fuster V, Badimon JJ. Pathogenetic concepts of acute coronary syndromes. J. Am. Coll. Cardiol. 2003, 41, 7–14S. [Google Scholar] [CrossRef]
- Fuster V, Fayad ZA, Badimon JJ. Acute coronary syndromes: biology. Lancet.
- Bertrand ME, Simoons ML, Fox KA, et al. Management of acute coronary syndromes: acute coronary syndromes without persistent ST segment elevation; recommendations of the Task Force of the European Society of Cardiology. Eur. Heart J. 2000, 21, 1406–1432. [Google Scholar] [CrossRef]
- Myocardial infarction redefined: a consensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the redefinition of myocardial infarction. Eur. Heart J. 2000, 21, 1502–1513. [CrossRef]
- Jarvis B, Simpson K. Clopidogrel: a review of its use in the prevention of atherothrombosis. Drugs 2000, 60, 347–377. [Google Scholar] [CrossRef]
- Gurbel PA, Cummings CC, Bell CR, Alford AB, Meister AF, Serebruany VL. Onset and extent of platelet inhibition by clopidogrel loading in patients undergoing elective coronary stenting: the Plavix Reduction of New Thrombus Occurrence (PRONTO) Trial. Am. Heart J. 2003, 145, 239–247. [Google Scholar] [CrossRef]
- A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996, 348, 1329–1339. [Google Scholar]
- Lau WC, Waskell LA, Watkins PB, et al. Atorvastatin reduces the ability of clopidogrel to inhibit platelet aggregation: a new drug-drug interaction. Circulation 2003, 107, 32–37. [Google Scholar] [CrossRef] [PubMed]
- Neubauer H, Gunesdogan B, Hanefeld C, Spiecker M, Mugge A. Lipophilic statins interfere with the inhibitory effects of clopidogrel on platelet function – a flow cytometry study. Eur. Heart J. 2003, 24, 1744–1749. [Google Scholar] [CrossRef] [PubMed]
- Muller I, Besta F, Schulz C, Massberg S, Schonig A, Gawa, M. Prevalence of clopidogrel non-responders among patients with stable angina pectoris scheduled for elective coronary stent placement. Thromb. Haemost. 2003, 89, 783–787. [Google Scholar] [CrossRef]
- Serebruany VL, Malinin AI, Callahan KP, Gurbel PA, Steinhubl SR. Statins do not affect platelet inhibition with clopidogrel during coronary stenting. Atherosclerosis 2001, 159, 239–41. [Google Scholar] [CrossRef]
- Serebruany VL, Midei MG, Malinin AI, et al. Atorvastatin does not affect the antiplatelet properties of clopidogrel in patients undergoing coronary stenting in the Interaction of Atorvastatin and Clopidogrel (INTERACTION) Trial. Circulation.
- Saw J, Steinhubl SR, Berger PB, et al. Lack of adverse clopidogrel-atorvastatin clinical interaction from secondary analysis of a randomized, placebo-controlled clopidogrel trial. Circulation 2003, 108, 921–924. [Google Scholar] [CrossRef]
- Serebruany VL, Steinhubl SR, Hennekens CH. Are antiplatelet effects of clopidogrel inhibited by atorvastatin? A research question formulated but not yet adequately tested. Circulation 2003, 107, 1568–1569. [Google Scholar] [CrossRef] [PubMed]
- Collaborative overview of randomised trials of antiplatelet therapy – I, Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. Antiplatelet Trialists' Collaboration. BMJ 1994, 308, 81–106. [Google Scholar]
- Bhatt DL, Chew DP, Hirsch AT, Ringleb PA, Hacke W, Topol EJ. Superiority of clopidogrel versus aspirin in patients with prior cardiac surgery. Circulation 2001, 103, 363–368. [Google Scholar] [CrossRef] [PubMed]
- Haldemann R, Luscher TF, Szucs TD. Cost-effectiveness analysis of clopidogrel in secondary prevention of cardiovascular events. Schweiz. Rundsch. Med. Prax. 2001, 90, 539–45. [Google Scholar]
- Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox, KK. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N. Engl. J. Med. 2001, 345, 494–502. [Google Scholar] [CrossRef]
- Jneid H, Bhatt DL, Corti R, Badimon JJ, Fuster V, Francis GS. Aspirin and clopidogrel in acute coronary syndromes, therapeutic insights from the CURE study. Arch. Intern. Med. 2003, 163, 1145–1153. [Google Scholar] [CrossRef]
- Steinhubl SR, Berger PB, Mann JT 3rd, et al. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA 2002, 288, 2411–2420. [Google Scholar] [CrossRef]
- Leon MB, Baim DS, Popma JJ, et al. A clinical trial comparing three antithrombotic-drug regimens after coronaryartery stenting. Stent Anticoagulation Restenosis Study Investigators. N. Engl. J. Med. 1998, 339, 1665–1671. [Google Scholar] [CrossRef]
- Bertrand ME, Rupprecht HJ, Urban P, Gershlick AH, Investigators FT. Double-blind study of the safety of clopidogrel with and without a loading dose in combination with aspirin compared with ticlopidine in combination with aspirin after coronary stenting: the Clopidogrel ASpirin Stent International Cooperative Study (CLASSICS). Circulation 2000, 102, 624–629. [Google Scholar]
- Mehta SR, Yusuf S, Peters RJ, et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001, 358, 527–533. [Google Scholar] [CrossRef]
- Yusuf S, Mehta SR, Zhao F, et al. Early and late effects of clopidogrel in patients with acute coronary syndromes. Circulation 2003, 107, 966–972. [Google Scholar] [CrossRef] [PubMed]
- Annemans L, Lindgren P, Frei A, Gabriel S, Spiesser J. PCICURE health economic analysis: summary of costs and effects. Eur Heart J, 2003.
- Wallentin L, Wilcox RG, Weaver WD, et al. Oral ximelagatran for secondary prophylaxis after myocardial infarction: the ESTEEM randomised controlled trial. Lancet 2003, 362, 789–797. [Google Scholar] [CrossRef] [PubMed]
- Bauer KA, Eriksson BI, LASSEN MR, Turpie AG. Fondaparinux compared with enoxaparin for the prevention of venous thromboembolism after elective major knee surgery. N. Engl. J. Med. 2001, 345, 1305–1310. [Google Scholar] [CrossRef] [PubMed]
- Eriksson BI, Bauer KA, Lassen MR, Turpie AG. Fondaparinux compared with enoxaparin for the prevention of venous thromboembolism after hip-fracture surgery. N. Engl. J. Med. 2001, 345, 1298–1304. [Google Scholar] [CrossRef]
- Turpie AG, Eriksson BI, Lassen MR, Bauer KA. Fondaparinux, the first selective factor Xa inhibitor. Curr. Opin. Hematol 2003, 10, 327–332. [Google Scholar] [CrossRef]
- Corti R, Fuster V, Badimon JJ. The strategy for assuring a better future for the vessel wall. Eur. Heart J. 2002, 4, A31–41. [Google Scholar] [CrossRef]
- Braunwald E, Antman EM, Beasley JW, et al. ACC/AHA guidelines for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction: executive summary and recommendations. A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (committee on the management of patients with unstable angina). Circulation 2000, 102, 1193–1209. [Google Scholar]
- Braunwald, E. Unstable angina. A classification. Circulation 1989, 80, 410–414. [Google Scholar]
- Van Miltenburg-van Zijl AJ, Simoons ML, Veerhoek RJ, Bossuyt PM. Incidence and follow-up of Braunwald subgroups in unstable angina pectoris. J. Am. Coll. Cardiol. 1995, 25, 1286–92. [Google Scholar] [CrossRef]
- Antman EM, Cohen M, Bernink PJ, et al. The TIMI risk score for unstable angina/non-ST elevation MI: a method for prognostication and therapeutic decision making. JAMA 2000, 284, 835–842. [Google Scholar] [CrossRef] [PubMed]
- Gottlieb SO, Weisfeldt ML, Ouyang P, et al. Effect of the addition of propranolol to therapy with nifedipine for unstable angina pectoris: a randomized, double-blind, placebo-controlled trial. Circulation 1986, 73, 331–337. [Google Scholar] [CrossRef]
- Curfman GD, Heinsimer JA, Lozner EC, Fung HL. Intravenous nitroglycerin in the treatment of spontaneous angina pectoris: a prospective, randomized trial. Circulation 1983, 67, 276–282. [Google Scholar] [CrossRef]
- Eikelboom JW, Anand SS, Malmberg K, Weitz JI, Ginsberg JS, Yusuf S. Unfractionated heparin and low-molecularweight heparin in acute coronary syndrome without ST elevation: a meta-analysis. Lancet 2000, 355, 1936–1942. [Google Scholar] [CrossRef]
- Invasive compared with non-invasive treatment in unstable coronary-artery disease: FRISC II prospective randomised multicentre study. Fragmin and fast Revascularisation during InStability in Coronary artery disease Investigators. Lancet 1999, 354, 708–715. [Google Scholar]
- Smith SC, Jr. , Dove JT, Jacobs AK, et al. ACC/AHA guidelines for percutaneous coronary intervention (revision of the 1993 PTCA guidelines)-executive summary: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (Committee to revise the 1993 guidelines for percutaneous transluminal coronary angioplasty) endorsed by the Society for Cardiac Angiography and Interventions. Circulation 2001, 103, 3019–3041. [Google Scholar]
- The Long-term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N. Engl. J. Med. 1998, 339, 1349–1355. [Google Scholar] [CrossRef]
- Sacks FM, Pfeffer MA, Moye LA, et al. The effects of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N. Engl. J. Med. 1996, 335, 1001–1009. [Google Scholar] [CrossRef] [PubMed]
- The Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994, 344, 1383–1389.
- Schwartz GG, Olsson AG, Ezekowitz MD, et al. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial. JAMA 2001, 285, 1711–1718. [Google Scholar] [CrossRef] [PubMed]
- Virmani R, Liistro F, Stankovic G, et al. Mechanism of late in-stent restenosis after implantation of a paclitaxel derivate-eluting polymer stent system in humans. Circulation 2002, 106, 2649–2651. [Google Scholar] [CrossRef]
- Nyman I, Areskog M, Areskog NH, Swahn E, Wallentin L. Very early risk stratification by electrocardiogram at rest in men with suspected unstable coronary heart disease. The RISC Study Group. J. Intern. Med. 1993, 234, 293–301. [Google Scholar]
- Hamm CW, Goldmann BU, Heeschen C, Kreymann G, Berger J, Meinertz T. Emergency room triage of patients with acute chest pain by means of rapid testing for cardiac troponin T or troponin I. N. Engl. J. Med. 1997, 337, 1648–1653. [Google Scholar] [CrossRef]
- Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases of suspected acute myocardial infarction: ISIS-2. ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Lancet 1988, 2, 349–60. [Google Scholar]
© 2004 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Corti, R.; Spieker, L.E.; Mach, F.; Erne, P.; Moccetti, T.; Beer, J.; Urban, P.; Buser, P.; Rickenbacher, P.; Eberli, F.R.; et al. Plättchenhemmung Durch Thienopyridine beim Akuten Koronarsyndrom und nach Perkutaner Koronarer Intervention—Praktische Empfehlungen. Cardiovasc. Med. 2004, 7, 159. https://doi.org/10.4414/cvm.2004.01023
Corti R, Spieker LE, Mach F, Erne P, Moccetti T, Beer J, Urban P, Buser P, Rickenbacher P, Eberli FR, et al. Plättchenhemmung Durch Thienopyridine beim Akuten Koronarsyndrom und nach Perkutaner Koronarer Intervention—Praktische Empfehlungen. Cardiovascular Medicine. 2004; 7(4):159. https://doi.org/10.4414/cvm.2004.01023
Chicago/Turabian StyleCorti, Roberto, Lukas E. Spieker, François Mach, Paul Erne, Tiziano Moccetti, Jürg Beer, Phillip Urban, Peter Buser, Peter Rickenbacher, Franz R. Eberli, and et al. 2004. "Plättchenhemmung Durch Thienopyridine beim Akuten Koronarsyndrom und nach Perkutaner Koronarer Intervention—Praktische Empfehlungen" Cardiovascular Medicine 7, no. 4: 159. https://doi.org/10.4414/cvm.2004.01023
APA StyleCorti, R., Spieker, L. E., Mach, F., Erne, P., Moccetti, T., Beer, J., Urban, P., Buser, P., Rickenbacher, P., Eberli, F. R., Sigwart, U., Hunziker, P., Walter, A., Kappenberger, L., Bertel, O., Windecker, S., Clemetson, K. J., Meier, B., & Lüscher, T. F. (2004). Plättchenhemmung Durch Thienopyridine beim Akuten Koronarsyndrom und nach Perkutaner Koronarer Intervention—Praktische Empfehlungen. Cardiovascular Medicine, 7(4), 159. https://doi.org/10.4414/cvm.2004.01023



