Bedeutung und Epidemiologie der Endokarditis †
Einleitung
Globale Bedeutung der Endokarditis
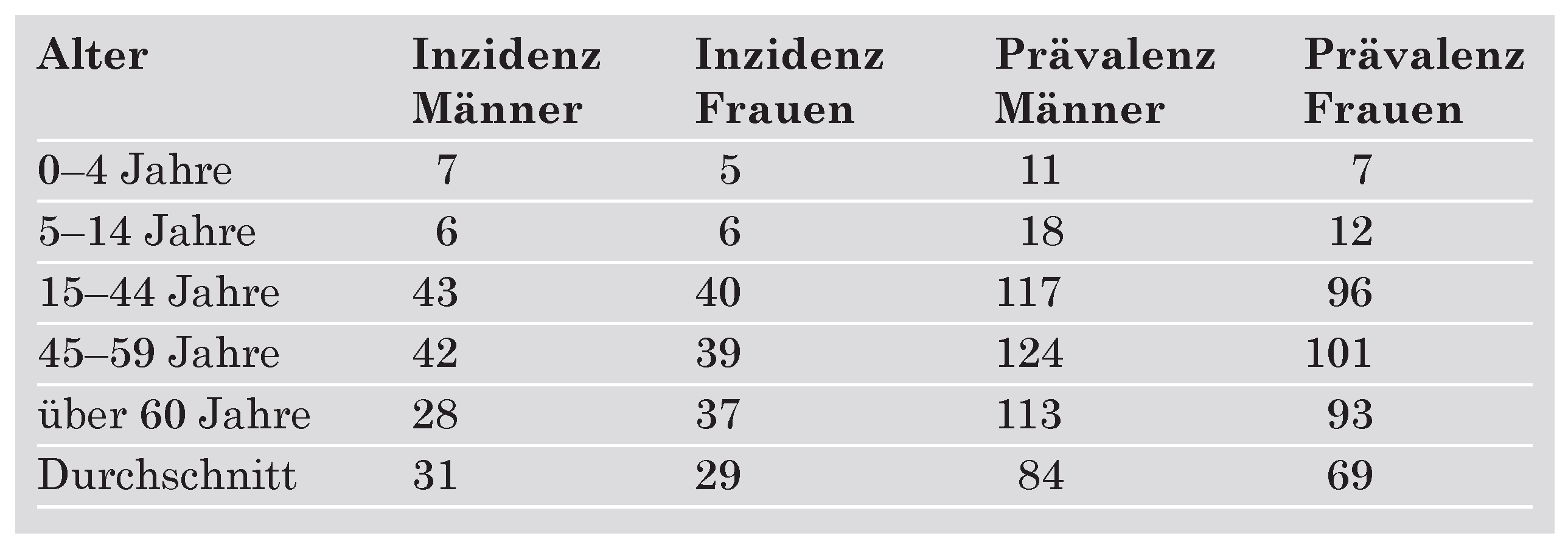
Prädisponierende Faktoren und Prognose der infektiösen Endokarditis
Nosokomiale Infektionen
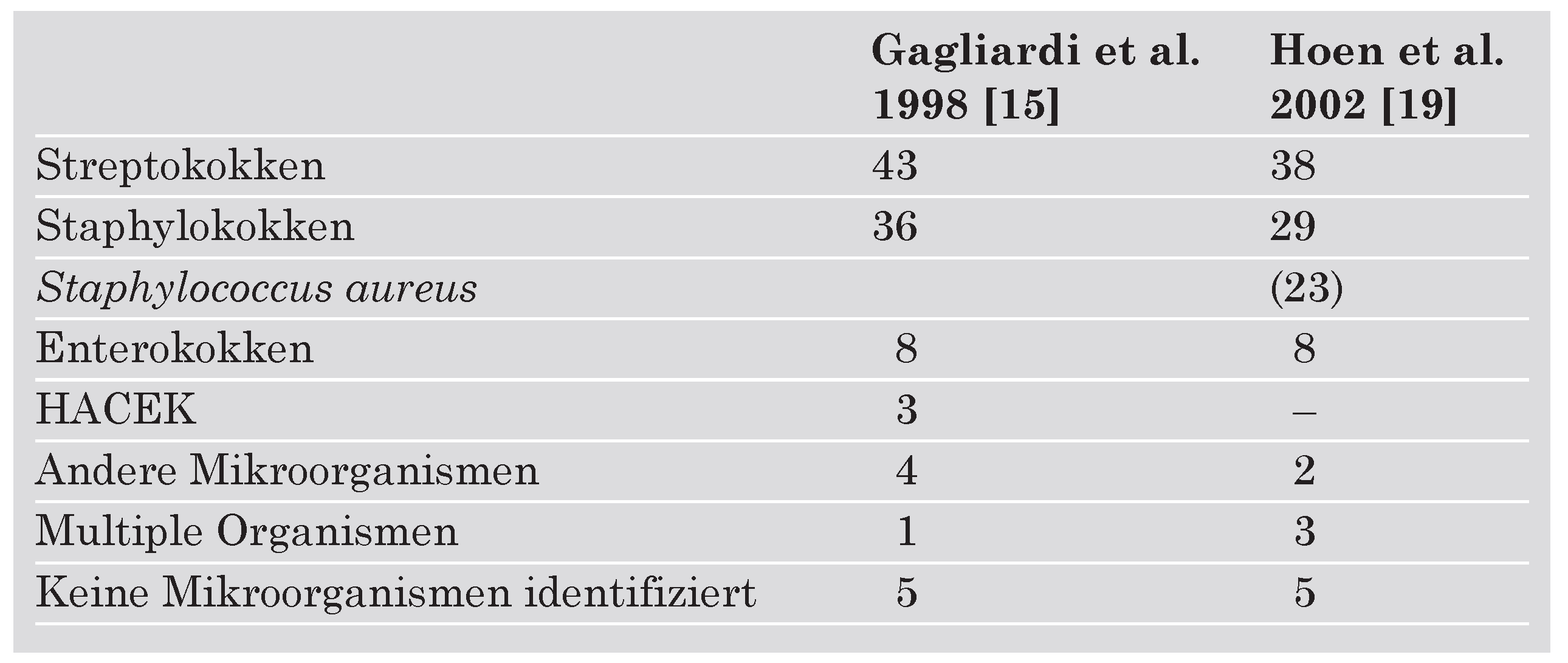
Häufigkeit der Erreger
Pilzbedingte infektiöse Endokarditis
Kultur-negative Endokarditis

Letalität der infektiösen Endokarditis
Ökonomische Bedeutung der Endokarditis in der Schweiz
References
- Agnihotri, A.K.; et al. The prevalence of infective endocarditis after aortic valve replacement. J. Thorac. Cardiovasc. Surg. 1995, 110, 1708–1720. [Google Scholar] [CrossRef]
- Arvay, A.; et al. Incidence and risk factors of prosthetic valve endocarditis. Eur J Cardiothorac Surg 1988, 2, 340–6. [Google Scholar] [PubMed]
- Barnes, P.D.; Crook, D.W.M. Culture negative endocarditis. J. Infect. 1997, 35, 209–213. [Google Scholar] [CrossRef] [PubMed]
- Bayer, A.S.; Scheld, M. Endocarditis and intravascular infections. In: Mandel GL, Bennett JE, Dolin R, eds. Mandell, Douglas and Bennett's Principles and Practice of Infectious Diseases. Philadelphia, PA: Churchill Livingston; 2000. p. 857–902.
- Berlin, J.A.; Abrutyn, E.; Strom, B.L.; Kinman, J.L.; Levison, M.E.; Korzeniowski, O.M.; et al. Incidence of infective endocarditis in the Delaware Valley, 1988–1990. Am J Cardiol 1995, 76, 933–936. [Google Scholar] [CrossRef] [PubMed]
- Bundesamt für Statistik, Neuenburg 2002.
- Calderwood, S.B.; et al. Risk factors for the development of prosthetic valve endocarditis. Circulation 1985, 72, 31–37. [Google Scholar] [CrossRef]
- Chen, S.C.; Dwyer, D.E.; Sorrell, T.C. A comparison of hospital and community-acquired infective endocarditis. Am. J. Cardiol. 1992, 70, 1449–1452. [Google Scholar] [CrossRef]
- Christensen, J.J.; et al. Bacteremia/septicemia due to Aerococcus-like organisms: report of seventeen cases. Clin. Infect. Dis. 1995, 21, 943–947. [Google Scholar] [CrossRef]
- Das, M.; et al. Infective endocarditis caused by HACEK microorganisms. Annu. Rev. Med. 1997, 48, 25–33. [Google Scholar] [CrossRef]
- Dyson, C.; et al. Infective endocarditis: an epidemiological review of 128 episodes. J. Infect. 1999, 38, 87–93. [Google Scholar] [CrossRef]
- Ellis, M.E.; Al-Abdely, H.; Sandridge, A.; Greer, W.; Ventura, W. Fungal endocarditis: evidence in the world literature, 1965–1995. Clin Infect Dis 2001, 32, 50–62. [Google Scholar] [CrossRef]
- Fernandez-Guerrero, M.L.; Verdejo, C.; Azofra, J.; de Gorgolas, M. Hospital-acquired infectious endocarditis not associated with cardiac surgery: an emerging problem. Clin. Infect. Dis. 1995, 20, 16–23. [Google Scholar] [CrossRef]
- Friedland, G.; von Reyn, C.F.; Levy, B.; Arbeit, R.; Dasse, P.; Crumpacker, C. Nosocomial endocarditis. Infect. Control 1984, 5, 284–288. [Google Scholar] [CrossRef]
- Gagliardi, J.P.; Nettles, R.E.; McCarty, D.E.; Sanders, L.L.; Corey, G.R.; Sexton, D.J. Native valve infective endocarditis in elderly and younger adult patients: comparison of clinical features and outcomes with use of the Duke criteria and the Duke Endocarditis Database. Clin. Infect. Dis. 1998, 26, 1165–1168. [Google Scholar] [CrossRef]
- Giamarellou, H. Nosocomial cardiac infections. J. Hosp. Infect. 2002, 50, 91–105. [Google Scholar] [CrossRef]
- Gilleece, A.; Buckley, A.; Qiuckley, P.; Fenelon, L. Infective endocarditis: evaluation of the Duke criteria and transoesophagial echocardiography for the diagnosis of endocarditis. J. Infect. 1998, 36, A10. [Google Scholar] [CrossRef]
- Murray, C.; Lopez, A. Global Health Statistics, Oxford University Press 1996.
- Hoen et, a.l. Changing profile of infective endocarditis: results of a one-year survey in France. JAMA 2002, 288, 75–81. [Google Scholar] [CrossRef]
- Hogevik, H.; et al. Epidemiologic aspects of infective endocarditis in an urban population. A five-year prospective study. Medicine 1995, 74, 324–339. [Google Scholar] [CrossRef] [PubMed]
- Ivert, T.S.; et al. Prosthetic valve endocarditis. Circulation 1984, 69, 223–232. [Google Scholar] [CrossRef] [PubMed]
- Karchmer, A.W. Infections of prosthetic valves and intravascular devices. In: Mandell GL, Bennett JE, Dolin R, eds. Principles and Practise of Infectious Disease. 5th ed. Philadelphia: Churchill Livingstone;
- Kazanjian, P.H. Infective endocarditis: review of 60 cases treated in community hospitals. Infect. Dis. Clin. Pract. 1993, 2, 41–46. [Google Scholar] [CrossRef]
- Kupferwasser, L.I.; et al. Kulturnegative Endokarditis: Ätiologie, Diagnostik, Management und Therapie. Herz 2001, 26, 398–408. [Google Scholar] [CrossRef]
- Manoff, S.B.; et al. Human immunodeficiency virus infection and infective endocarditis among injecting drug users. Epidemiology 1996, 7, 566–570. [Google Scholar] [CrossRef] [PubMed]
- McLeod, R.; Remington, J.S. Fungal endocarditis. In: Rahimtoola SH, ed. Infective Endocarditis. New York: Green and Stratton;
- Mylonakis, E.; et al. Infective endocarditis in adults. N. Engl. J. Med. 2001, 345, 1318–1330. [Google Scholar] [CrossRef] [PubMed]
- Pazin, G.J.; Saul, S.; Thompson, M.E. Blood culture positivity: suppression by outpatient antibiotic therapy in patients with bacterial endocarditis. Arch Intern Med.
- Pierrotti, L.C.; Baddour, L.M. Fungal endocarditis, 1995–2000. Chest 2002, 122, 302–310. [Google Scholar] [CrossRef] [PubMed]
- Rubinstein, E.; et al. Fungal endocarditis. Eur. Heart J. 1995, 16, 84–89. [Google Scholar] [CrossRef]
- Strom, B.L.; et al. Risk factors for infective endocarditis: oral hygiene and nondental exposures. Circulation 2000, 102, 2842–2848. [Google Scholar] [CrossRef]
- Terpenning, M.S.; Buggy, B.; Kaufmann, C.A. Hospital-acquired infective endokarditis. Arch. Intern. Med. 1988, 148, 1601–1603. [Google Scholar] [CrossRef]
- Tunkel, A.R.; Kaye, D. Endocarditis with negative blood cultures [Editorial]. N. Engl. J. Med. 1992, 326, 1215–1217. [Google Scholar] [CrossRef]
- Vlessis, A.A.; et al. Infective endocarditis: ten-year review of medical and surgical therapy. Ann. Thorac. Surg. 1996, 61, 1217–1222. [Google Scholar] [CrossRef]
- Watanakunakorn, C.; Burkert, T. Infective endocarditis at a large community teaching hospital, 1980–1990. A review of 210 episodes. Medicine (Baltimore) 1993, 72, 90–102. [Google Scholar] [CrossRef]
© 2004 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Szucs, T.D.; Cathomas, G. Bedeutung und Epidemiologie der Endokarditis. Cardiovasc. Med. 2004, 7, 181. https://doi.org/10.4414/cvm.2004.01022
Szucs TD, Cathomas G. Bedeutung und Epidemiologie der Endokarditis. Cardiovascular Medicine. 2004; 7(4):181. https://doi.org/10.4414/cvm.2004.01022
Chicago/Turabian StyleSzucs, Thomas D., and Gieri Cathomas. 2004. "Bedeutung und Epidemiologie der Endokarditis" Cardiovascular Medicine 7, no. 4: 181. https://doi.org/10.4414/cvm.2004.01022
APA StyleSzucs, T. D., & Cathomas, G. (2004). Bedeutung und Epidemiologie der Endokarditis. Cardiovascular Medicine, 7(4), 181. https://doi.org/10.4414/cvm.2004.01022



