Concepts et Évidences de l’importance de la Fréquence Cardiaque de Repos dans la Prévention et la Prise en Charge des Maladies Cardiovasculaires
Abstract
Introduction
Evidences épidémiologiques
- Fréquence cardiaque de repos élevée, facteur de risque cardiovasculaire indépendant chez le patient coronarien
- Fréquence cardiaque de repos élevée, facteur de risque cardiovasculaire indépendant chez les patients diabétiques
- Fréquence cardiaque de repos élevée, facteur de risque cardiovasculaire indépendant chez les patients hypertendus
- Fréquence cardiaque de repos élevée: facteur de risque cardiovasculaire chez les patients âgés
- Fréquence cardiaque élevée: facteur de risque cardiovasculaire indépendant dans la population normale
Mécanismes physiopathologiques
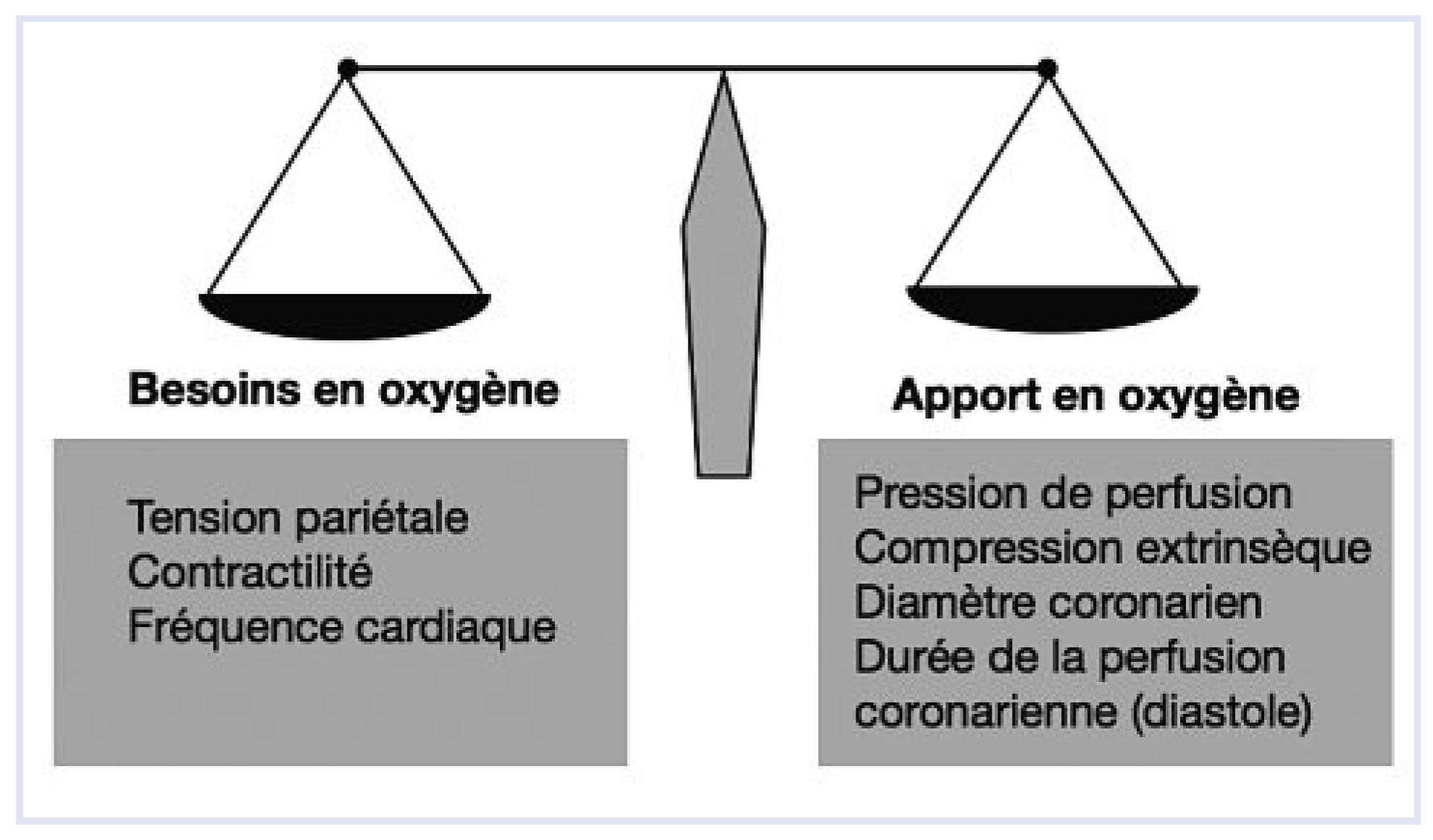
- Fréquence cardiaque de repos et équilibre ischémique myocardique
- Fréquence cardiaque de repos et insuffisance cardiaque
- Effets oxydatifs, athérogenèse et apoptose
Réduction de la fréquence cardiaque de repos dans la pratique clinique
- Population générale
- –
- pratiquer régulièrement une activité physique,
- –
- éviter les situations de stress psychologique,
- –
- diminuer l’exposition à des substances stimulantes.
- Patients avec angine de poitrine
- Patients avec insuffisance cardiaque congestive
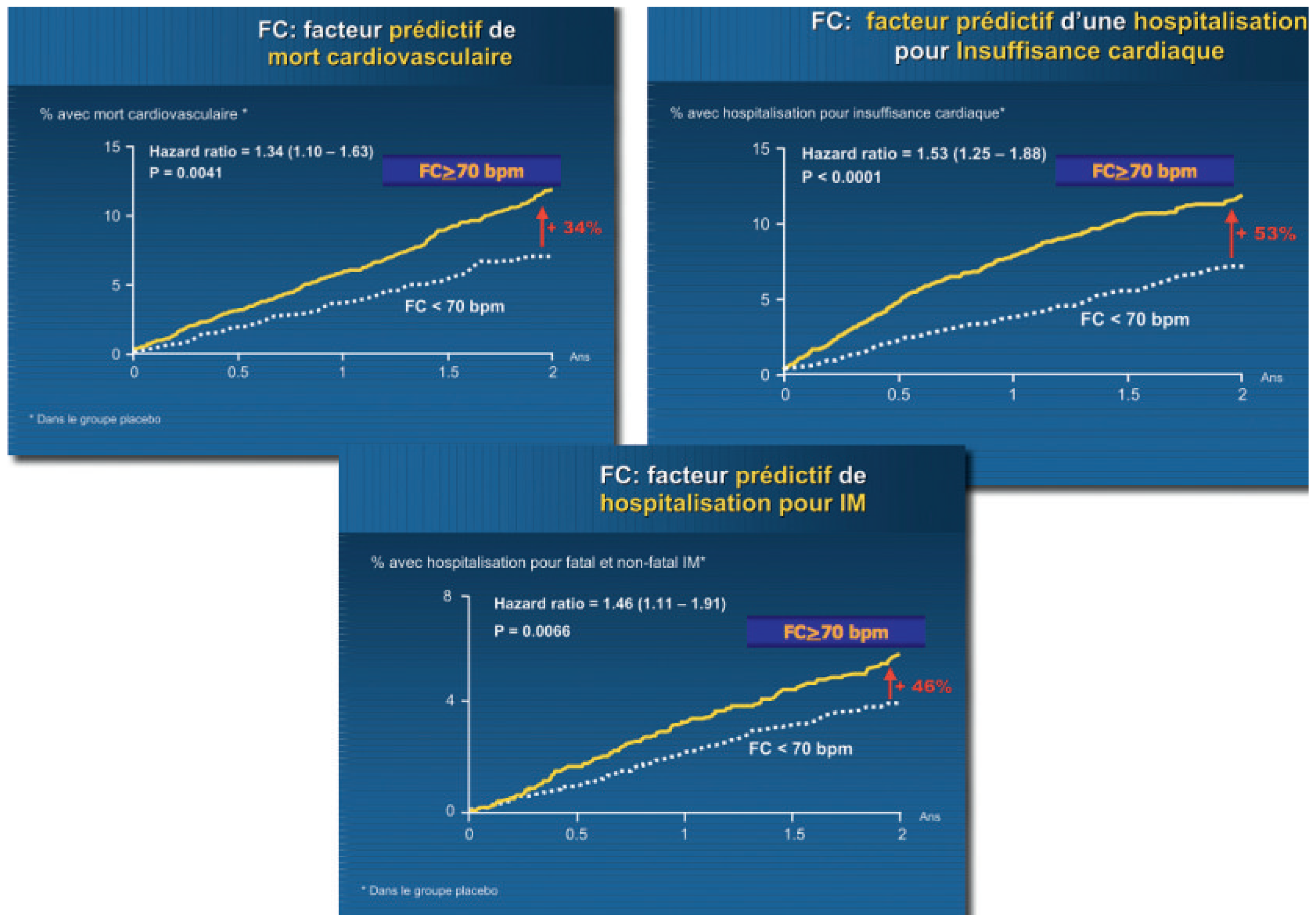
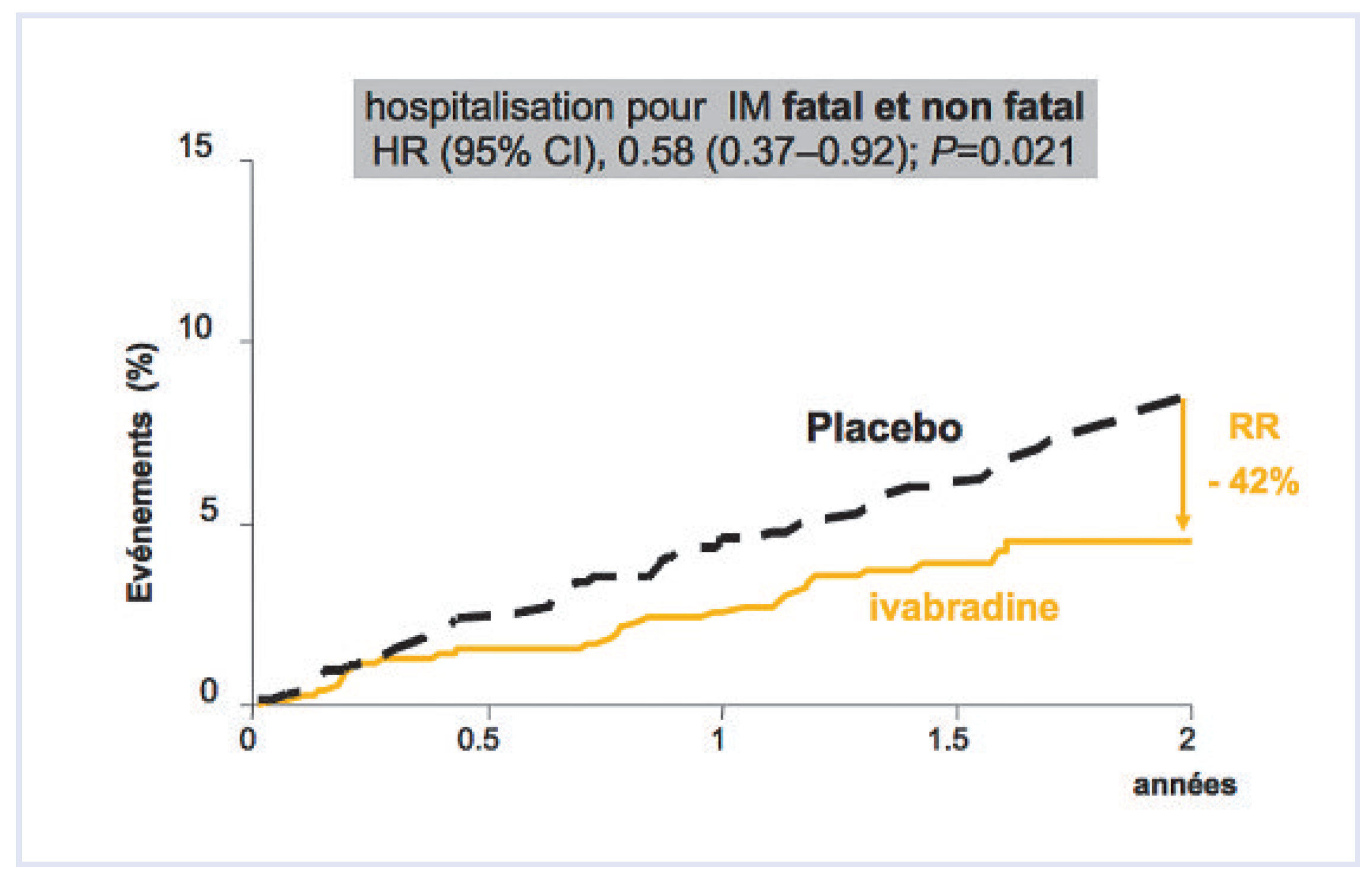
- Patients coronariens à risque
- –
- Mortalité cardiovasculaire de 34% (p = 0,004)
- –
- Recours à la revascularisation coronaire de 38% (p = 0,04)
- –
- Risque d’infarctus du myocarde fatal ou non de 46% (p = 0,007)
- –
- Hospitalisation pour insuffisance cardiaque de 53% (p = 0,0001)
- Patients hypertendus
Conclusion
Funding
References
- Andrews, T.C.; et al. Sunsets of Ambulatory Myocardial Ischemia Based on heart Rate Activity: Circadian Distribution and Response to Anti-Ischemic Medication. Circulation. 1993, 88, 92–100. [Google Scholar] [CrossRef]
- Meyer, K.; Simmet, A.; Junker, C. Acute myocardial infarction and associated deaths in Switzerland—an approach to estimating incidence. Kardiovaskuläre Medizin. 2007, 10, 279–284. [Google Scholar]
- Cook, S.; Togni, M.; Schaub, M.C.; et al. High heart rate: a cardiovascular risk factor? Eur Heart J. 2006, 27(20), 2387–2393. [Google Scholar] [CrossRef]
- Cook, S.; Hess, O.M. Resting heart rate and cardiovascular events: time for a new crusade? Eur Heart J. 2010, 31(5), 517–519. [Google Scholar] [CrossRef]
- Cook, S.; Hess, O.M. Fréquence cardiaque élevée comme facteur de risque cardiovasculaire que dit l’évidence? Cardiovasc Med. 2007, 7(6), 202–208. [Google Scholar]
- Disegni, E.; Goldbourt, U.; Reicher-Reiss, H.; et al. The predictive value of admission heart rate on mortality in patients with acute myocardial infarction. SPRINT Study Group. Secondary Prevention Reinfarction Israeli Nifedipine Trial. J Clin Epidemiol. 1995, 48(10), 1197–1205. [Google Scholar] [CrossRef] [PubMed]
- Copie, X.; Hnatkova, K.; Staunton, A.; et al. Predictive power of increased heart rate versus depressed left ventricular ejection fraction and heart rate variability for risk stratification after myocardial infarction. Results of a two-year follow-up study. J Am Coll Cardiol. 1996, 27(2), 270–276. [Google Scholar] [CrossRef]
- Hathaway, W.R.; Peterson, E.D.; Wagner, G.S.; et al. Prognostic significance of the initial electrocardiogram in patients with acute myocardial infarction. GUSTO-I Investigators. Global Utilization of Streptokinase and t-PA for Occluded Coronary Arteries. JAMA. 1998, 279(5), 387–391. [Google Scholar] [CrossRef] [PubMed]
- Zuanetti, G.; Mantini, L.; Hernandez-Bernal, F.; et al. Relevance of heart rate as a prognostic factor in patients with acute myocardial infarction: insights from GISSI-2 study. Eur Heart J Suppl. 1998, 19 (Suppl F), F19–F26. [Google Scholar]
- Mauss, O.; Klingenheben, T.; Ptaszynski, P.; Hohnloser, S.H. Bedside risk stratification after acute myocardial infarction: prospective evaluation of the use of heart rate and left ventricular function. J Electrocardiol. 2005, 38(2), 106–112. [Google Scholar] [CrossRef]
- Diaz, A.; Bourassa, M.G.; Guertin, M.C.; Tardif, J.C. Long-term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J. 2005, 26(10), 967–974. [Google Scholar] [CrossRef]
- Linnemann, B.; Janka, H.U. Prolonged QTc interval and elevated heart rate identify the type 2 diabetic patient at high risk for cardiovascular death. The Bremen Diabetes Study. Exp Clin Endocrinol Diabetes. 2003, 111(4), 215–222. [Google Scholar] [CrossRef] [PubMed]
- Cardoso, C.R.; Salles, G.F.; Deccache, W. Prognostic value of QT interval parameters in type 2 diabetes mellitus: results of a long-term follow-up prospective study. J Diabetes Complications. 2003, 17(4), 169–178. [Google Scholar] [CrossRef] [PubMed]
- Stettler, C.; Allemann, S.; Egger, M.; et al. Efficacy of drug eluting stents in patients with and without diabetes mellitus: indirect comparison of controlled trials. Heart. 2006, 92(5), 650–657. [Google Scholar] [CrossRef]
- Gillman, M.W.; Kannel, W.R.; Belanger, A.; D’Agostino, R.B. Influence of heart rate on mortality among persons with hypertension: the Framingham Study. Am Heart J. 1993, 125(4), 1148–1154. [Google Scholar] [CrossRef]
- Benetos, A.; Rudnichi, A.; Thomas, F.; et al. Influence of heart rate on mortality in a French population: role of age, gender, and blood pressure. Hypertension. 1999, 33(1), 44–52. [Google Scholar] [CrossRef]
- Thomas, F.; Rudnichi, A.; Bacri, A.M.; et al. Cardiovascular mortality in hypertensive men according to presence of associated risk factors. Hypertension. 2001, 37(5), 1256–1261. [Google Scholar] [CrossRef]
- Palatini, P.; Casiglia, E.; Julius, S.; Pessina, A.C. High Heart Rate: A Risk Factor for Cardiovascular Death in Elderly Men. Arch Intern Med. 1999, 159(6), 585–592. [Google Scholar] [CrossRef]
- Bangalore, S.; Sawhney, S.; Messerli, F.H. Relation of Beta-Blocker-Induced Heart Rate Lowering and Cardioprotection in Hypertension. J Am Coll Cardiol. 2008, 52, 1482–1489. [Google Scholar] [CrossRef]
- Williams, B.; Lacy, P.S.; Thom, S.M.; et al. Differential impact of blood pressure-lowering drugs on central aortic pressure and clinical outcomes: principal results of the Conduit Artery Function Evaluation (CAFE) study. Circulation. 2006, 113, 1213–1225. [Google Scholar] [CrossRef] [PubMed]
- Hsia, J.; Larson, J.C.; Ockene, J.K.; et al. Resting heart rate as a low tech predictor of coronary events in women: prospective cohort study. BMJ. 2009, 338(feb03_2), b219. [Google Scholar] [CrossRef] [PubMed]
- Benetos, A.; Thomas, F.; Bean, K.; et al. Resting heart rate in older people: a predictor of survival to age 85. J Am Geriatr Soc. 2003, 51(2), 284–285. [Google Scholar] [CrossRef]
- Schillinger, W.; Lehnart, S.E.; Prestle, J.; et al. Influence of SR Ca(2+)-ATPase and Na(+)-Ca(2+)-exchanger on the force-frequency relation. Basic Res Cardiol. 1998, 93 (Suppl 1), 38–45. [Google Scholar] [CrossRef]
- Yamamoto, E.; Lai, Z.F.; Yamashita, T.; et al. Enhancement of cardiac oxidative stress by tachycardia and its critical role in cardiac hypertrophy and fibrosis. J Hypertens. 2006, 24(10), 2057–2069. [Google Scholar] [CrossRef] [PubMed]
- Manuck, S.B.; Kaplan, J.R.; Clarkson, T.B. Behaviorally induced heart rate reactivity and atherosclerosis in cynomolgus monkeys. Psychosom Med. 1983, 45(2), 95–108. [Google Scholar] [CrossRef] [PubMed]
- Heidland, U.E.; Strauer, B.E. Left ventricular muscle mass and elevated heart rate are associated with coronary plaque disruption. Circulation. 2001, 104(13), 1477–1482. [Google Scholar] [CrossRef]
- Custodis, F.; Baumhäkel, M.; Schlimmer, N.; et al. Heart Rate Reduction by Ivabradine Reduces Oxidative Stress, Improves Endothelial Function, and Prevents Atherosclerosis in Apolipoprotein E-Deficient Mice. Circulation. 2008, 117(18), 2377–2387. [Google Scholar] [CrossRef]
- Coburn, A.F.; Grey, R.M.; Rivera, S.M. Observations on the relation of heart rate, life span, weight and mineralization in the digoxin-treated A-J mouse. Johns Hopkins Med J. 1971, 128(4), 169–193. [Google Scholar]
- Palatini, P.; Benetos, A.; Grassi, G.; et al. Identification and management of the hypertensive patient with elevated heart rate: statement of a European Society of Hypertension Consensus Meeting. J Hypertens. 2006, 24(4), 603–610. [Google Scholar] [CrossRef]
- Meyer, P.; Kayser, B.; Kossovsky, M.; et al. Stairs instead of elevators at work: Cardioprotective effects of prognostic intervention. Eur J Cardiovasc Prev. & Rehab. 2010, in press. [Google Scholar]
- Graham, I.; Atar, D.; Borch-Johnsen, K.; et al. European guidelines on cardiovascular disease prevention in clinical practice: full text. Fourth Joint Task Force of the European Society of Cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of nine societies and by invited experts). Eur J Cardiovasc Prev Rehabil. 2007, 14 (Suppl 2), S1–S113. [Google Scholar]
- Gibbons, R.J.; Abrams, J.; Chatterjee, K.; et al. ACC/AHA 2002 Guideline Update for the Management of Patients With Chronic Stable Angina—Summary Article: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Chronic Stable Angina). Circulation. 2003, 107(1), 149–158. [Google Scholar]
- The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet. 1999, 353(9146), 9–13.
- Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERITHF). Lancet. 1999, 353(9169), 2001–2007.
- Hjalmarson, A.; Goldstein, S.; Fagerberg, B.; et al. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: the Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure (MERIT-HF). MERIT-HF Study Grou Jama. 2000, 283(10), 1295–1302. [Google Scholar] [CrossRef]
- Packer, M.; Bristow, M.R.; Cohn, J.N.; et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Grou N Engl J Med. 1996, 334(21), 1349–1355. [Google Scholar] [CrossRef]
- Packer, M.; Coats, A.J.; Fowler, M.B.; et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001, 344(22), 1651–1658. [Google Scholar] [CrossRef] [PubMed]
- Lechat, P.; Hulot, J.S.; Escolano, S.; et al. Heart rate and cardiac rhythm relationships with bisoprolol benefit in chronic heart failure in CIBIS II Trial. Circulation. 2001, 103(10), 1428–1433. [Google Scholar] [CrossRef]
- Fox, K.; Ford, I.; Steg, P.G.; Tendera, M.; Ferrari, R. BEAUTIFUL Investigators. Effect of ivabradine on cardiovascular outcomes in patients with stable coronary artery disease and left-ventricular systolic dysfunction with limiting angina: a subgroup analysis of the randomized, controlled BEAUTIFUL trial. Eur Heart J. 2009, 30, 2337–2345. [Google Scholar] [CrossRef]
- Fox, K.; Ford, I.; Steg, G.; et al. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet. 2008, 372(9641), 807–816. [Google Scholar] [CrossRef]
- Daly, C.A.; Clemens, F.; Sendon, J.L.; et al. The initial management of stable angina in Europe, from the Euro Heart Survey: a description of pharmacological management and revascularization strategies initiated within the first month of presentation to a cardiologist in the Euro Heart Survey of Stable Angina. Eur Heart J. 2005, 26, 1011–1022. [Google Scholar] [PubMed]

© 2010 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Cook, S.; Hess, O.M.; Lerch, R.; Lüscher, T.; Mach, F. Concepts et Évidences de l’importance de la Fréquence Cardiaque de Repos dans la Prévention et la Prise en Charge des Maladies Cardiovasculaires. Cardiovasc. Med. 2010, 13, 265. https://doi.org/10.4414/cvm.2010.01525
Cook S, Hess OM, Lerch R, Lüscher T, Mach F. Concepts et Évidences de l’importance de la Fréquence Cardiaque de Repos dans la Prévention et la Prise en Charge des Maladies Cardiovasculaires. Cardiovascular Medicine. 2010; 13(9):265. https://doi.org/10.4414/cvm.2010.01525
Chicago/Turabian StyleCook, Stéphane, Otto M. Hess, René Lerch, Thomas Lüscher, and François Mach. 2010. "Concepts et Évidences de l’importance de la Fréquence Cardiaque de Repos dans la Prévention et la Prise en Charge des Maladies Cardiovasculaires" Cardiovascular Medicine 13, no. 9: 265. https://doi.org/10.4414/cvm.2010.01525
APA StyleCook, S., Hess, O. M., Lerch, R., Lüscher, T., & Mach, F. (2010). Concepts et Évidences de l’importance de la Fréquence Cardiaque de Repos dans la Prévention et la Prise en Charge des Maladies Cardiovasculaires. Cardiovascular Medicine, 13(9), 265. https://doi.org/10.4414/cvm.2010.01525