Fréquence Cardiaque Élevée Comme Facteur de Risque Cardiovasculaire: Que Dit L’évidence?
Summary
Résumé
«… De battre mon coeur s’est arrêté. …» Film de Jacques Audiard
Fréquence cardiaque élevée: un facteur de risque cardiovasculaire indépendent chez les sujets à risque
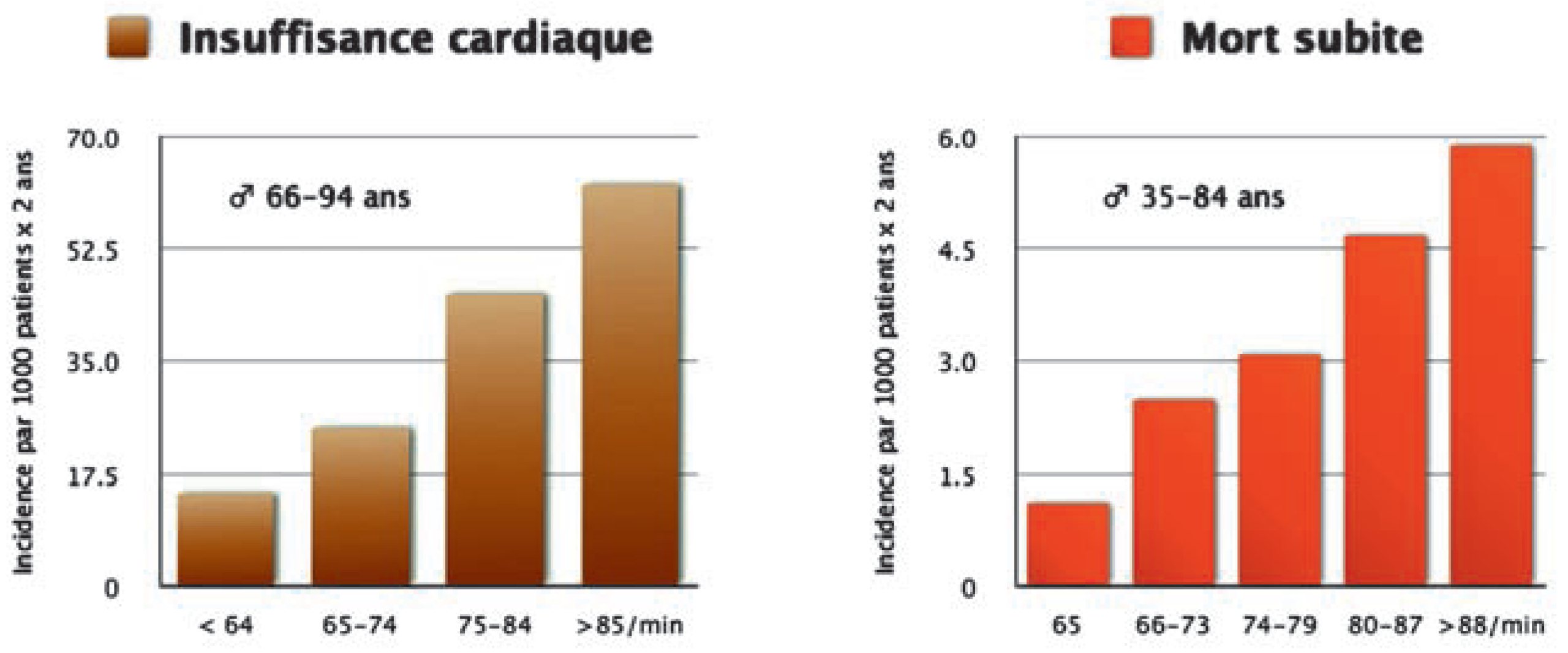
Fréquence cardiaque élevée: un facteur de risque cardiovasculaire indépendent dans la population normale
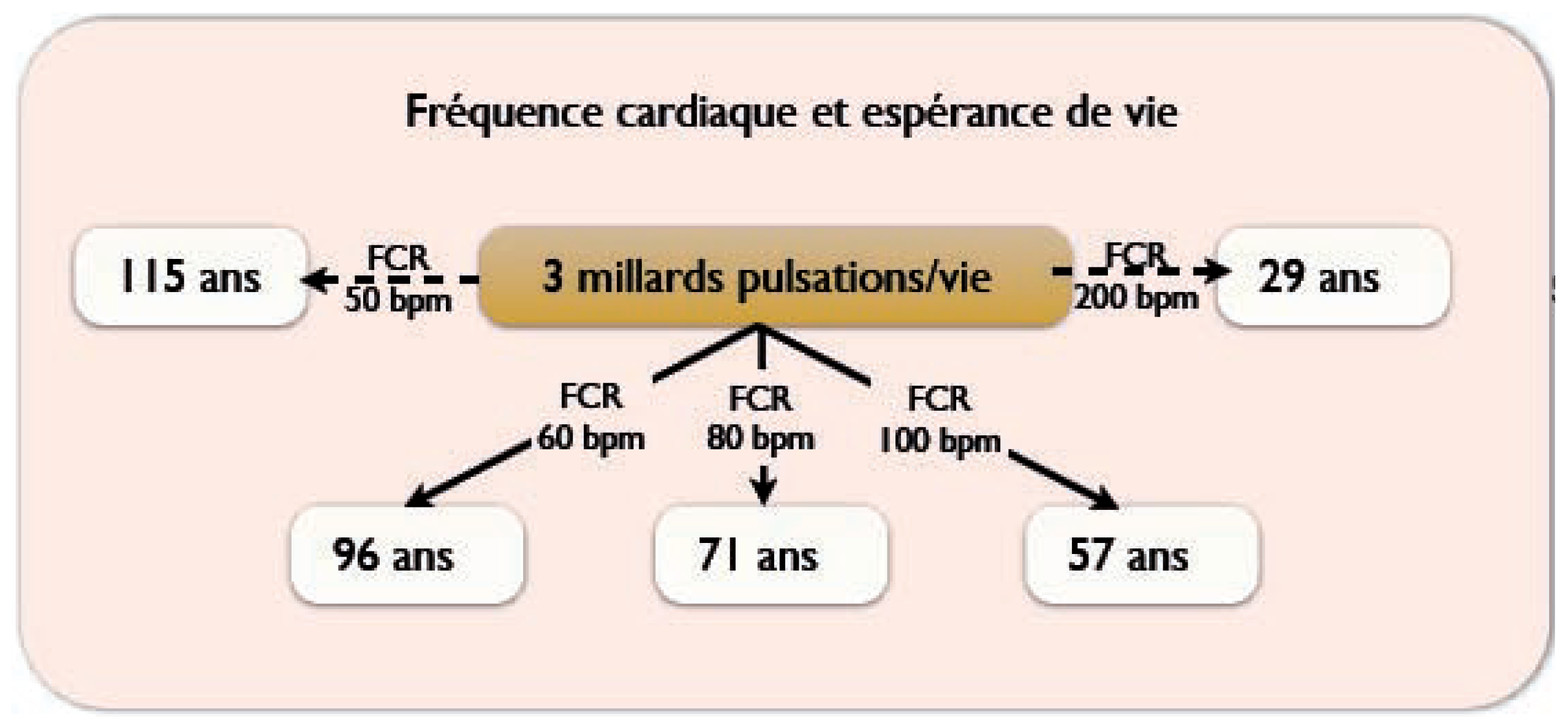
Le pouls, un compte à rebours?
FCR élevée: génétique vs facteurs environnementaux?
Thérapie abaissant la fréquence cardiaque: un élixir de jouvence?
Devons-nous prescrire des medicaments chronotropes aux patients ayant une FCR élevée, mais sans cardiopathie connue?
References
- Cook, S.; Togni, M.; Schaub, M.C.; et al. High heart rate: A cardiovascular risk factor? Eur Heart J. 2006, 27, 2387–2393. [Google Scholar] [CrossRef]
- Copie, X.; Hnatkova, K.; Staunton, A.; et al. Predictive power of increased heart rate versus depressed left ventricular ejection fraction and heart rate variability for risk stratification after myocardial infarction. Results of a two-year follow-up study. J Am Coll Cardiol. 1996, 27, 270–276. [Google Scholar] [CrossRef] [PubMed]
- Dyer, A.R.; Persky, V.; Stamler, J.; et al. Heart rate as a prognostic factor for coronary heart disease and mortality: Findings in three Chicago epidemiologic studies. Am J Epidemiol. 1980, 112, 736–749. [Google Scholar] [CrossRef] [PubMed]
- Disegni, E.; Goldbourt, U.; Reicher-Reiss, H.; et al. The predictive value of admission heart rate on mortality in patients with acute myocardial infarction. SPRINT Study Group. Secondary Prevention Reinfarction Israeli Nifedipine Trial. J Clin Epidemiol. 1995, 48, 1197–1205. [Google Scholar] [CrossRef] [PubMed]
- Hathaway, W.R.; Peterson, E.D.; Wagner, G.S.; et al. Prognostic significance of the initial electrocardiogram in patients with acute myocardial infarction. GUSTO-I Investigators. Global Utilization of Streptokinase and t-PA for Occluded Coronary Arteries. JAMA 1998, 279, 387–391. [Google Scholar] [CrossRef]
- Diaz, A.; Bourassa, M.G.; Guertin, M.C.; et al. Long-term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J. 2005, 26, 967–974. [Google Scholar] [CrossRef]
- Gillman, M.W.; Kannel, W.B.; Belanger, A.; et al. Influence of heart rate on mortality among persons with hypertension: The Framingham Study. Am Heart J. 1993, 125, 1148–1154. [Google Scholar] [CrossRef]
- Benetos, A.; Rudnichi, A.; Thomas, F.; et al. Influence of heart rate on mortality in a French population: Role of age, gender, and blood pressure. Hypertension. 1999, 33, 44–52. [Google Scholar] [CrossRef]
- Thomas, F.; Rudnichi, A.; Bacri, A.M.; et al. Cardiovascular mortality in hypertensive men according to presence of associated risk factors. Hypertension. 2001, 37, 1256–1261. [Google Scholar] [CrossRef]
- Palatini, P.; Thijs, L.; Staessen, J.A.; et al. Predictive value of clinic and ambulatory heart rate for mortality in elderly subjects with systolic hypertension. Arch Intern Med. 2002, 162, 2313–2321. [Google Scholar] [CrossRef]
- Palatini, P.; Benetos, A.; Grassi, G.; et al. Identification and management of the hypertensive patient with elevated heart rate: Statement of a European Society of Hypertension Consensus Meeting. J Hypertens. 2006, 24, 603–610. [Google Scholar] [CrossRef]
- Benetos, A.; Thomas, F.; Bean, K.E.; et al. Role of modifiable risk factors in life expectancy in the elderly. J Hypertens. 2005, 23, 1803–1808. [Google Scholar] [CrossRef]
- Menotti, A.; Mulder, I.; Nissinen, A.; et al. Prevalence of morbidity and multimorbidity in elderly male populations and their impact on 10-year all-cause mortality: The FINE study (Finland, Italy, Netherlands, Elderly). J Clin Epidemiol. 2001, 54, 680–686. [Google Scholar] [CrossRef]
- Palatini, P.; Casiglia, E.; Julius, S.; et al. High heart rate: A risk factor for cardiovascular death in elderly men. Arch Intern Med. 1999, 159, 585–592. [Google Scholar] [CrossRef]
- Kannel, W.B.; Kannel, C.; Paffenbarger, R.S., Jr.; et al. Heart rate and cardiovascular mortality: The Framingham Study. Am Heart J. 1987, 113, 1489–1494. [Google Scholar] [CrossRef]
- Kristal-Boneh, E.; Silber, H.; Harari, G.; et al. The association of resting heart rate with cardiovascular, cancer and allcause mortality. Eight year follow-up of 3527 male Israeli employees (the CORDIS Study). Eur Heart J. 2000, 21, 116–124. [Google Scholar] [CrossRef] [PubMed]
- Filipovsky, J.; Ducimetiere, P.; Safar, M.E. Prognostic significance of exercise blood pressure and heart rate in middleaged men. Hypertension. Sep 1992, 20, 333–339. [Google Scholar] [CrossRef] [PubMed]
- Seccareccia, F.; Pannozzo, F.; Dima, F.; et al. Heart rate as a predictor of mortality: The MATISS project. Am J Public Health. 2001, 91, 1258–1263. [Google Scholar] [CrossRef] [PubMed]
- Fujiura, Y.; Adachi, H.; Tsuruta, M.; et al. Heart rate and mortality in a Japanese general population: An 18-year follow-up study. J Clin Epidemiol. May 2001, 54, 495–500. [Google Scholar] [CrossRef]
- Gillum, R.F.; Makuc, D.M.; Feldman, J.J. Pulse rate, coronary heart disease, and death: The NHANES I Epidemiologic Follow-up Study. Am Heart J. 1991, 121 Pt 1, 172–177. [Google Scholar] [CrossRef]
- Levine, H.J. Rest heart rate and life expectancy. J Am Coll Cardiol. 1997, 30, 1104–1106. [Google Scholar] [PubMed]
- Azbel, M. Universal biological scaling and mortality. Proc Natl Acad Sci USA 1994, 91, 124537. [Google Scholar] [CrossRef] [PubMed]
- Ferrari, R. Editorial: Heart rate. Eur Heart J. 2003, 5 (Suppl. G), G1–G2. [Google Scholar] [CrossRef]
- Dobson, G.P. On being the right size: Heart design, mitochon-drial efficiency and lifespan potential. Clin Exp Pharmacol Physiol. 2003, 30, 590–597. [Google Scholar] [CrossRef]
- Singh, B.N. Increased heart rate as a risk factor for cardiovascular disease. Eur Heart J. 2003, 5 (Suppl G), G3–G9. [Google Scholar] [CrossRef][Green Version]
- Martin, L.J.; Comuzzie, A.G.; Sonnenberg, G.E.; et al. Major quantitative trait locus for resting heart rate maps to a region on chromosome 4. Hypertension. 2004, 43, 1146–1151. [Google Scholar] [CrossRef] [PubMed]
- Ranade, K.; Jorgenson, E.; Sheu, W.H.; et al. A polymorphism in the beta1 adrenergic receptor is associated with resting heart rate. Am J Hum Genet. 2002, 70, 935–942. [Google Scholar] [CrossRef]
- Wilk, J.B.; Myers, R.H.; Zhang, Y.; et al. Evidence for a gene influencing heart rate on chromosome 4 among hypertensives. Hum Genet. 2002, 111, 207–213. [Google Scholar] [CrossRef]
- Cook, S. Coronary artery disease, nitric oxide and oxidative stress: The «Yin-Yang» effect a Chinese concept for a world-wide pandemic. Swiss Med Wkly. 2006, 136, 103–113. [Google Scholar] [CrossRef]
- Cook, S.; Hugli, O.; Egli, M.; et al. Clustering of cardiovascular risk factors mimicking the human metabolic syndrome X in eNOS null mice. Swiss Med Wkly. 2003, 133, 360–363. [Google Scholar] [CrossRef]
- Sartori, C.; Lepori, M.; Scherrer, U. Interaction between nitric oxide and the cholinergic and sympathetic nervous system in cardiovascular control in humans. Pharmacol Ther. 2005, 106, 209–220. [Google Scholar] [CrossRef]
- Shen, W.; Ochoa, M.; Xu, X.; et al. Role of EDRF/NO in parasympathetic coronary vasodilation following carotid chemoreflex activation in conscious dogs. Am J Physiol. 1994, 267 Pt 2, H605–13. [Google Scholar] [CrossRef]
- Goodson, A.R.; Leibold, J.M.; Gutterman, D.D. Inhibition of nitric oxide synthesis augments centrally induced sympathetic coronary vasoconstriction in cats. Am J Physiol. 1994, 267 Pt 2, H1272–1278. [Google Scholar] [CrossRef] [PubMed]
- Hare, J.M.; Keaney, J.F.; Jr Balligand, J.L.; et al. Role of nitric oxide in parasympathetic modulation of beta-adrenergic myocardial contractility in normal dogs. J Clin Invest. 1995, 95, 360–366. [Google Scholar] [CrossRef]
- Hare, J.M.; Kim, B.; Flavahan, N.A.; et al. Pertussis toxin-sensitive G proteins influence nitric oxide synthase III activity and protein levels in rat heart. J Clin Invest. 1998, 101, 1424–1431. [Google Scholar] [CrossRef] [PubMed]
- Keaney, J.F.; Jr Hare, J.M.; Balligand, J.L.; et al. Inhibition of nitric oxide synthase augments myocardial contractile responses to beta-adrenergic stimulation. Am J Physiol. 1996, 271 Pt 2, H2646–52. [Google Scholar] [CrossRef]
- Chowdhary, S.; Vaile, J.C.; Fletcher, J.; et al. Nitric oxide and cardiac autonomic control in humans. Hypertension. 2000, 36, 264–269. [Google Scholar] [CrossRef] [PubMed]
- Choate, J.K.; Danson, E.J.; Morris, J.F.; et al. Peripheral vagal control of heart rate is impaired in neuronal NOS knockout mice. Am J Physiol Heart Circ Physiol. 2001, 281, H2310–7. [Google Scholar] [CrossRef]
- Jumrussirikul, P.; Dinerman, J.; Dawson, T.M.; et al. Interaction between neuronal nitric oxide synthase and inhibitory G protein activity in heart rate regulation in conscious mice. J Clin Invest. 1998, 102, 1279–1285. [Google Scholar] [CrossRef]
- Palatini, P.; Casiglia, E.; Pauletto, P.; et al. Relationship of tachycardia with high blood pressure and metabolic abnormalities: A study with mixture analysis in three populations. Hypertension. 1997, 30, 1267–1273. [Google Scholar] [CrossRef]
- Antic, V.; Van Vliet, B.N.; Montani, J.P. Loss of nocturnal dipping of blood pressure and heart rate in obesity-induced hypertension in rabbits. Auton Neurosci. 2001, 90, 152–157. [Google Scholar] [CrossRef]
- Carroll, J.F.; Thaden, J.J.; Wright, A.M.; et al. Loss of diurnal rhythms of blood pressure and heart rate caused by high-fat feeding. Am J Hypertens. 2005, 18, 1320–1326. [Google Scholar] [CrossRef][Green Version]
- Cook, S.; Hugli, O.; Egli, M.; et al. Partial gene deletion of endothelial nitric oxide synthase predisposes to exaggerated high-fat diet-induced insulin resistance and arterial hypertension. Diabetes. 2004, 53, 2067–2072. [Google Scholar] [CrossRef][Green Version]
- Wilkinson, G.S.; South, J.M. Life history, ecology and longevity in bats. Aging Cell. 2002, 1, 124–131. [Google Scholar] [CrossRef]
- Colin, P.; Ghaleh, B.; Monnet, X.; et al. Effect of graded heart rate reduction with ivabradine on myocardial oxygen consumption and diastolic time in exercising dogs. J Pharmacol Exp Ther. 2004, 308, 236–240. [Google Scholar] [CrossRef]
- Colin, P.; Ghaleh, B.; Monnet, X.; et al. Contributions of heart rate and contractility to myocardial oxygen balance during exercise. Am J Physiol Heart Circ Physiol. 2003, 284, H676–82. [Google Scholar] [CrossRef]
- Heidland, U.E.; Strauer, B.E. Left ventricular muscle mass and elevated heart rate are associated with coronary plaque disruption. Circulation. 2001, 104, 1477–1482. [Google Scholar] [CrossRef] [PubMed]
- Guth, B.D.; Heusch, G.; Seitelberger, R.; et al. Mechanism of beneficial effect of beta-adrenergic blockade on exercise-induced myocardial ischemia in conscious dogs. Circ Res. 1987, 60, 738–746. [Google Scholar] [CrossRef] [PubMed]
- Simonsen, S.; Ihlen, H.; Kjekshus, J.K. Haemodynamic and metabolic effects of timolol (Blocadren) on ischaemic myocardium. Acta Med Scand. 1983, 213, 393–398. [Google Scholar] [CrossRef]
- Hjalmarson, A. Significance of reduction in heart rate in cardiovascular disease. Clin Cardiol. 1998, 21 (Suppl. 2), II3–7. [Google Scholar] [PubMed]
- Hjalmarson, A.; Gilpin, E.A.; Kjekshus, J.; et al. Influence of heart rate on mortality after acute myocardial infarction. Am J Cardiol. 1990, 65, 547–553. [Google Scholar] [CrossRef]
- Kjekshus, J.K. Importance of heart rate in determining betablocker efficacy in acute and long-term acute myocardial infarction intervention trials. Am J Cardiol. 1986, 57, F43–9. [Google Scholar] [CrossRef]
- No authors listed. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): A randomised trial. Lancet. 1999, 353, 9–13. [Google Scholar] [CrossRef]
- No authors listed. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999, 353, 2001–2007. [Google Scholar] [CrossRef]
- Hjalmarson, A.; Goldstein, S.; Fagerberg, B.; et al. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: The Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure (MERIT-HF). MERIT-HF Study Group. JAMA. 2000, 283, 1295–1302. [Google Scholar] [CrossRef]
- Packer, M.; Bristow, M.R.; Cohn, J.N.; et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. N Engl J Med. 1996, 334, 1349–1355. [Google Scholar] [CrossRef]
- Packer, M.; Coats, A.J.; Fowler, M.B.; et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001, 344, 1651–1658. [Google Scholar] [CrossRef] [PubMed]
- Lechat, P.; Hulot, J.S.; Escolano, S.; et al. Heart rate and cardiac rhythm relationships with bisoprolol benefit in chronic heart failure in CIBIS II Trial. Circulation. 2001, 103, 1428–1433. [Google Scholar] [CrossRef] [PubMed]
- Beere, P.A.; Glagov, S.; Zarins, C.K. Retarding effect of lowered heart rate on coronary atherosclerosis. Science. 1984, 226, 180–182. [Google Scholar] [CrossRef]
- Beere, P.A.; Glagov, S.; Zarins, C.K. Experimental atherosclerosis at the carotid bifurcation of the cynomolgus monkey. Localization, compensatory enlargement, and the sparing effect of lowered heart rate. Arterioscler Thromb. 1992, 12, 1245–1253. [Google Scholar] [CrossRef]
- Kaplan, J.R.; Manuck, S.B.; Adams, M.R.; et al. Inhibition of coronary atherosclerosis by propranolol in behaviorally predisposed monkeys fed an atherogenic diet. Circulation. 1987, 76, 1364–1372. [Google Scholar] [CrossRef]
- Coburn, A.F.; Grey, R.M.; Rivera, S.M. Observations on the relation of heart rate, life span, weight and mineralization in the digoxin-treated A-J mouse. Johns Hopkins Med J. 1971, 128, 169–193. [Google Scholar]
- Allen, K.; Shykoff, B.E.; Izzo, J.L., Jr. Pet ownership, but not ace inhibitor therapy, blunts home blood pressure responses to mental stress. Hypertension. 2001, 38, 815–820. [Google Scholar] [CrossRef]
- Lee, I.M.; Hsieh, C.C.; Paffenbarger, R.S., Jr. Exercise intensity longevity in men The Harvard Alumni Health Study. JAMA 1995, 273, 1179–1184. [Google Scholar] [CrossRef]
- Paffenbarger, R.S.; Jr Hyde, R.T.; Wing, A.L.; et al. The association of changes in physical-activity level and other lifestyle characteristics with mortality among men. N Engl J Med. 1993, 328, 538–545. [Google Scholar] [CrossRef]
- Blair, S.N.; Kohl, H.W.; 3rd Barlow, C.E.; et al. Changes in physical fitness and all-cause mortality. A prospective study of healthy and unhealthy men. JAMA. 1995, 273, 1093–1098. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Hill, J.O.; Wyatt, H.R.; Reed, G.W.; et al. Obesity and the environment: Where do we go from here? Science. 2003, 299, 853–855. [Google Scholar] [CrossRef] [PubMed]
- Morabia, A.; Costanza, M.C. Does walking 15 minutes per day keep the obesity epidemic away? Simulation of the efficacy of a populationwide campaign. Am J Public Health. 2004, 94, 437–440. [Google Scholar] [CrossRef]
- WHO. Move For Health. Available online: http://www.who.int/moveforhealth/publications/en/.
- Bulc, M.; Fras, Z.; Zaletel-Kragelj, L. Twelve-year blood pressure dynamics in adults in Ljubljana area, Slovenia: Contribution of WHO Countrywide Integrated Noncommunicable Diseases Intervention Program. Croat Med J. 2006, 47, 469–477. [Google Scholar] [PubMed]
- Pardell, H.; Roure, E.; Drygas, W.; et al. East-west differences in reported preventive practices. A comparative study of six European areas of the WHO-CINDI programme. Eur J Public Health. 2001, 11, 393–396. [Google Scholar] [CrossRef][Green Version]
- Ulmer, H.; Diem, G.; Bischof, H.P.; et al. Recent trends and sociodemographic distribution of cardiovascular risk factors: Results from two population surveys in the Austrian WHO CINDI demonstration area. Wien Klin Wochenschr. 2001, 113, 573–579. [Google Scholar] [PubMed][Green Version]
- Wiesemann, A.; Metz, J.; Nuessel, E.; et al. Four years of practice-based and exercise-supported behavioural medicine in one community of the German CINDI area. Countrywide Integrated Non-Communicable Diseases Intervention. Int J Sports Med. 1997, 18, 308–315. [Google Scholar] [CrossRef] [PubMed]


© 2007 by the authors. Attribution—Non-Commercial—NoDerivatives 4.0.
Share and Cite
Cook,, S.; Hess, O.M. Fréquence Cardiaque Élevée Comme Facteur de Risque Cardiovasculaire: Que Dit L’évidence? Cardiovasc. Med. 2007, 10, 202. https://doi.org/10.4414/cvm.2007.01252
Cook, S, Hess OM. Fréquence Cardiaque Élevée Comme Facteur de Risque Cardiovasculaire: Que Dit L’évidence? Cardiovascular Medicine. 2007; 10(6):202. https://doi.org/10.4414/cvm.2007.01252
Chicago/Turabian StyleCook,, Stéphane, and Otto M. Hess. 2007. "Fréquence Cardiaque Élevée Comme Facteur de Risque Cardiovasculaire: Que Dit L’évidence?" Cardiovascular Medicine 10, no. 6: 202. https://doi.org/10.4414/cvm.2007.01252
APA StyleCook,, S., & Hess, O. M. (2007). Fréquence Cardiaque Élevée Comme Facteur de Risque Cardiovasculaire: Que Dit L’évidence? Cardiovascular Medicine, 10(6), 202. https://doi.org/10.4414/cvm.2007.01252



