Zusammenfassung
Patienten mit Bronchialkarzinom haben häufig einen symptomatischen endobronchialen Tumorbefall. Es existieren unterschiedliche Methoden, um hier, meist im fortgeschrittenen Tumorstadium, interventionell tätig zu werden. Seit den frühen 1980er Jahren haben technische Fortschritte symptomfreies Überleben und Lebensqualität für Patienten mit Lungenkrebs erhöht. Obgleich interventionelle Verfahren meist nicht die alleinigen Therapien sind, führen sie meist rasch zur Symptomverbesserung. Für Patienten mit Atemwegstenosen liefert die Stent-Implantation Symptompalliation und verbesserte Lebensqualität. Diese Übersicht zeigt die unterschiedlichen Möglichkeiten der endobronchialen Stent-Implantationstherapie auf.
Schlüsselwörter: interventionelle Bronchoskopie; Stents; Brachytherapie; Argon-PlasmaKoagulation
Einleitung
Die Prognose des Lungenkarzinoms zählt trotz aller therapeutischer Bemühungen seit 20 Jahren mit einer 5-Jahres-Überlebensaussicht bei Diagnosestellung von 10–15% unverändert zu den schlechtesten in der Onkologie [
1]. Zur Bestimmung des Gewebetyps und zur Beurteilung der Tumorausdehnung, besonders in den zentralen Atemwegen, hat sich die Bronchoskopie gegenüber allen anderen Untersuchungsmethoden als Überlegen erwiesen [
2]. Darüber hinaus wurde für Patienten, die im Verlauf ihrer Tumorerkrankung an Komplikationen durch Beteiligung der zentralen Atemwege leiden, eine Vielzahl therapeutischer und endoskopischer Verfahren entwickelt [
3].
Unter der interventionellen Bronchoskopie versteht man die Durchführung therapeutischer Eingriffe in Trachea und Bronchien mittels minimal-invasiver bronchoskopischer Techniken. Es handelt sich um ein Spezialgebiet der Pneumologie, das sich in den letzten Jahren stark weiterentwickelt hat. Die Eingriffe werden in günstigen Fällen ambulant, im allgemeinen jedoch während eines kurzen stationären Aufenthaltes durchgeführt [
4].
Die Techniken unterscheiden sich hinsichtlich des Akutund Langzeiterfolges sowie des Behandlungsrisikos. Die häufigste und neben der schweren Blutung auch die proble-matischste Komplikation ist die zentrale Atemwegobstruktion. Die Kompensationsmechanismen bei zentralen Atemwegobstruktionen können lange effektiv sein und klinische Symptome wie Atemnot und Stridor nur sehr allmählich zunehmen. Die Dekompensation tritt meistens dann auf, wenn das Lumen unter 5 mm eingeengt ist und verdicktes Sekret zu einer weiteren Stenosierung geführt hat [
3,
4]. Somit erreichen 50% der Patienten im lebensbedrohlichen Erstickungsanfall die Endoskopie-Einheit.
Indikationen zur Stent-Implantation
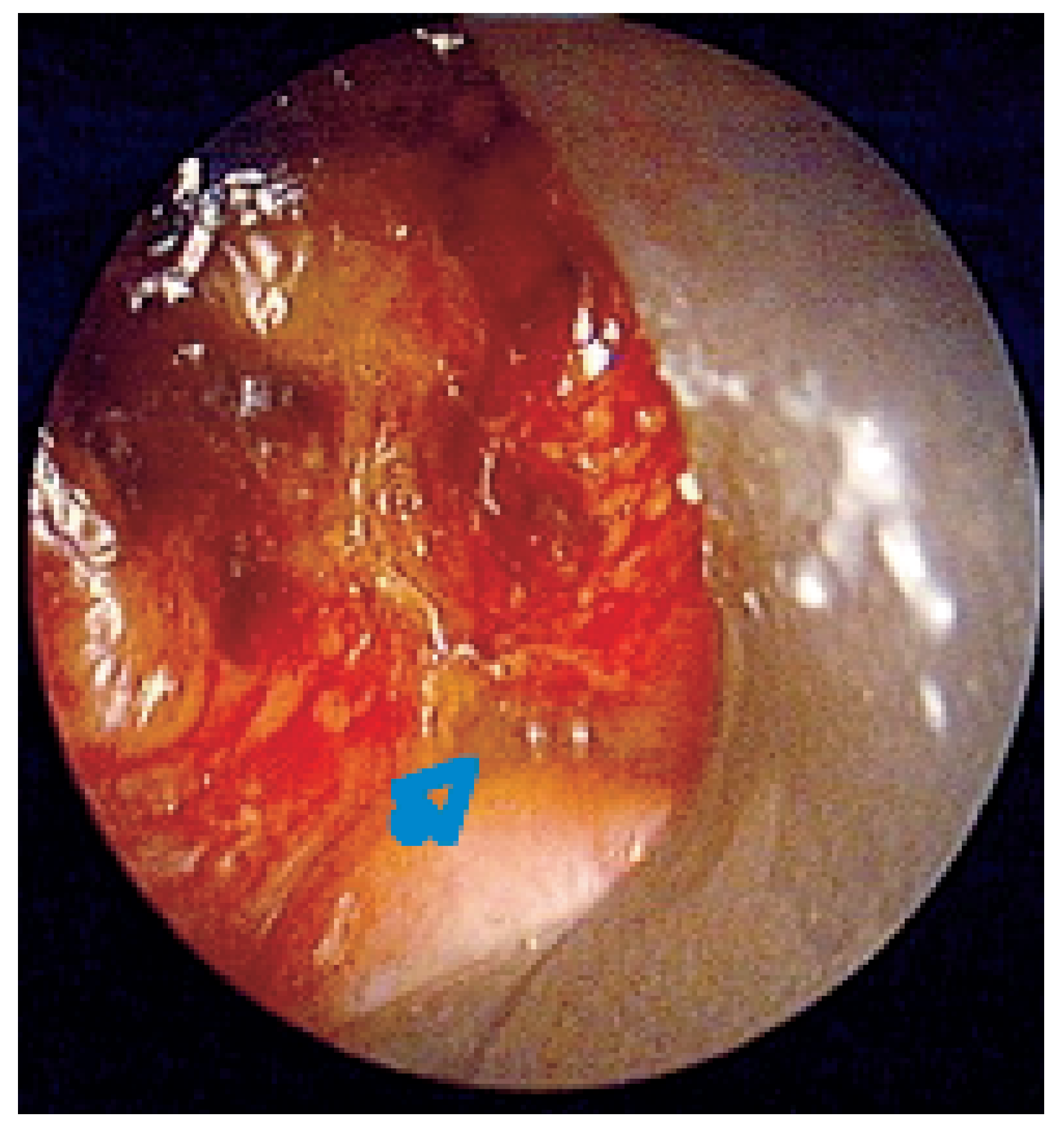
Die häufigste Indikation ist eine maligne zentrale Atemwegstenose, meistens infolge eines Bronchialkarzinoms. Dieses ist in den Industriestaaten weiterhin der zweithäufigste maligne Tumor bei beiden Geschlechtern, und nur eine Minderheit der Erkrankten kann mittels einer chirurgischen oder einer multimodalen Therapie geheilt werden. Bei ca. 30% der Patienten finden sich bereits bei Diagnosestellung zentrale Atemwegstenosen, und etwa gleich viele Patienten sterben später an den Folgen derartiger Stenosen [
5,
6]. Die Patienten leiden häufig unter quälenden Beschwerden infolge Asphyxie, poststenotischer Pneumonie und Hämoptoe, so dass die Beseitigung der Atemwegstenose einen wichtigen Beitrag zur Verbesserung der Lebensqualität darstellt. Entzündliche oder narbige Stenosen oder benigne endobronchiale Tumore können ebenfalls mit bronchoskopischen Techniken behandelt werden. Bei Patienten mit akzeptablem Operationsrisiko sollte allerdings eine klassisch-chirurgische Therapie erwogen werden, welche eine definitive Behandlung ermöglicht. Weitere Indikationen sind die Abdeckung tracheo-broncho-ösophagealer Fisteln und die Stabilisierung Chondromalaziebefallener Atemwegabschnitte, beispielsweise nach einer Lasertherapie oder bei der seltenen Polychondritis (
Table 1). Schliesslich werden interventionelle Techniken zunehmend bei der Behandlung noch nicht oder minimal-invasiver maligner Veränderungen eingesetzt [
7].
Flexible oder starre Bronchoskopie
Kurze therapeutische Eingriffe können mit dem flexiblen Bronchoskop in Lokalanästhesie durchgeführt werden, jedoch hat die starre Bronchoskopie in Allgemeinnarkose wesentliche Vorteile—wie die Sicherung der Atemwege und die bessere Kontrolle über relevante Hämorrhagien. Der grössere Arbeitskanal erlaubt zudem den Einsatz von speziellen Zusatzinstrumenten [
8]. Die Einsicht auf das Operationsgebiet erfolgt über eine starre Optik mit integrierter Beleuchtung, welche mit einem Videosystem verbunden ist. Es gilt heutzutage, dass Kollegen, die interventionell tätig sind, sich die starre Bronchoskopie für den Notfall vorbehalten sollten [
5,
6]. Klare Empfehlungen zur Durchführung von therapeutischen Bronchoskopien bestehen jedoch nach wie vor nur sehr wenig. In zwei publizierten Richtlinien (Guidelines) der amerikanischen und europäischen Fachgesellschaften [
5,
6] bezüglich der Ausbildungsgrundlage wird, um entsprechende Untersuchungen durchführen zu können, empfohlen, dass mindestens 20 Eingriffe in jeder Untersuchungstechnik durchgeführt werden sollten, bevor diese selbständig angewandt werden können. Um eine entsprechende Handhabung der Möglichkeiten zu garantieren, sollten im weiteren Verlauf dann 10 Interventionen pro Jahr durchgeführt werden. Hier handelt es sich jedoch lediglich um Empfehlungen, entsprechende Grundlagenarbeiten, die diese Aussagen untermauern, fehlen.
Vor dem endoskopischen Eingriff sollten Alternativen überdacht werden. Die Möglichkeiten sollten insbesondere dahingehend überdacht werden, ob sie zur Behebung der Symptome geeigneter und weniger risikoreich sind. Dies trifft besonders für die Auswahl der endoskopischen Möglichkeiten zu. Da sich die verschiedenen Verfahren bezüglich eines Sofortund Langzeiteffektes unterscheiden, empfiehlt es sich, ein Verfahren, dass rasch und schnell hilft, einzusetzen, um dann weitere Behandlungsmöglichkeiten offen zu halten [
2,
4]. Bieten sich endobronchiale Therapien an, kann damit oft durch Kombination der verschiedenen Verfahren ein guter Erfolg erzielt werden. Besteht die Möglichkeit, bei einer akuten Atemwegobstruktion mittels thermischen oder mechanischen Verfahren eine Akutrekanalisation herbeizuführen, sollte dies dann mit einer langfristig wirksamen Technik, wie der Brachytherapie oder der photodynamischen Therapie, kombiniert werden [
4].
Heutzutage müssen auch Kosten-Nutzen-Analysen angestellt werden, dies gilt insbesondere für Bronchialkarzinompatienten. Statistische Analysen zeigen, dass die höchsten Ausgaben für die Behandlung eines Patienten mit einem Malignom im Verlauf der letzten Lebensmonate entstehen. Letztendlich fehlen klar umschriebene Richtlinien, es sollte jedoch versucht werden, durch vergebliche Behandlungen überflüssige Kosten zu vermeiden.
Stents
Die Plazierung von Endoprothesen stellt inzwischen ein Routineverfahren in der Bronchoskopie dar. Zum Einsatz kommen Silikon-Stents oder selbstexpandierende Metall-Endoprothesen.
Dem Bronchologen steht eine verwirrende Vielfalt von Stent-Typen und -Materialien zur Verfügung (
Abb. 1). Die zylindrischen Gebilde aus Stahldraht und Nickel-Tantal sind aus der interventionellen Angiologie entliehen. Polymer-Stents wurden eigens für die Atemwege entwickelt. Aus welchem Material auch immer, ein Stent ist kein idealer physiologischer Ersatz für das stenosierte, malazieveränderte oder durch eine Fistel zerstörte Atemwegsegment, das er überbrückt. Im Gegenteil, abweichende mechanische Besonderheiten (Rigidität, Formänderungen unter seitlicher/zirkulärer Kompression, Anpassung an hochoder niederfrequente Druckschwankungen) und eigentümliche Qualitäten der inneren Oberfläche (Mikrorelief, Adhäsion) können dazu führen, dass eine zunächst krankheitsbedingte durch eine Stent-assoziierte Komplikation abgelöst wird. Deshalb ist eine rationale Auswahl von Endoprothesen nach Kriterien der kurzund langfristigen mechanischen Adaptation, Gewebeverträglichkeit und Nebenwirkungsarmut erforderlich [
9].
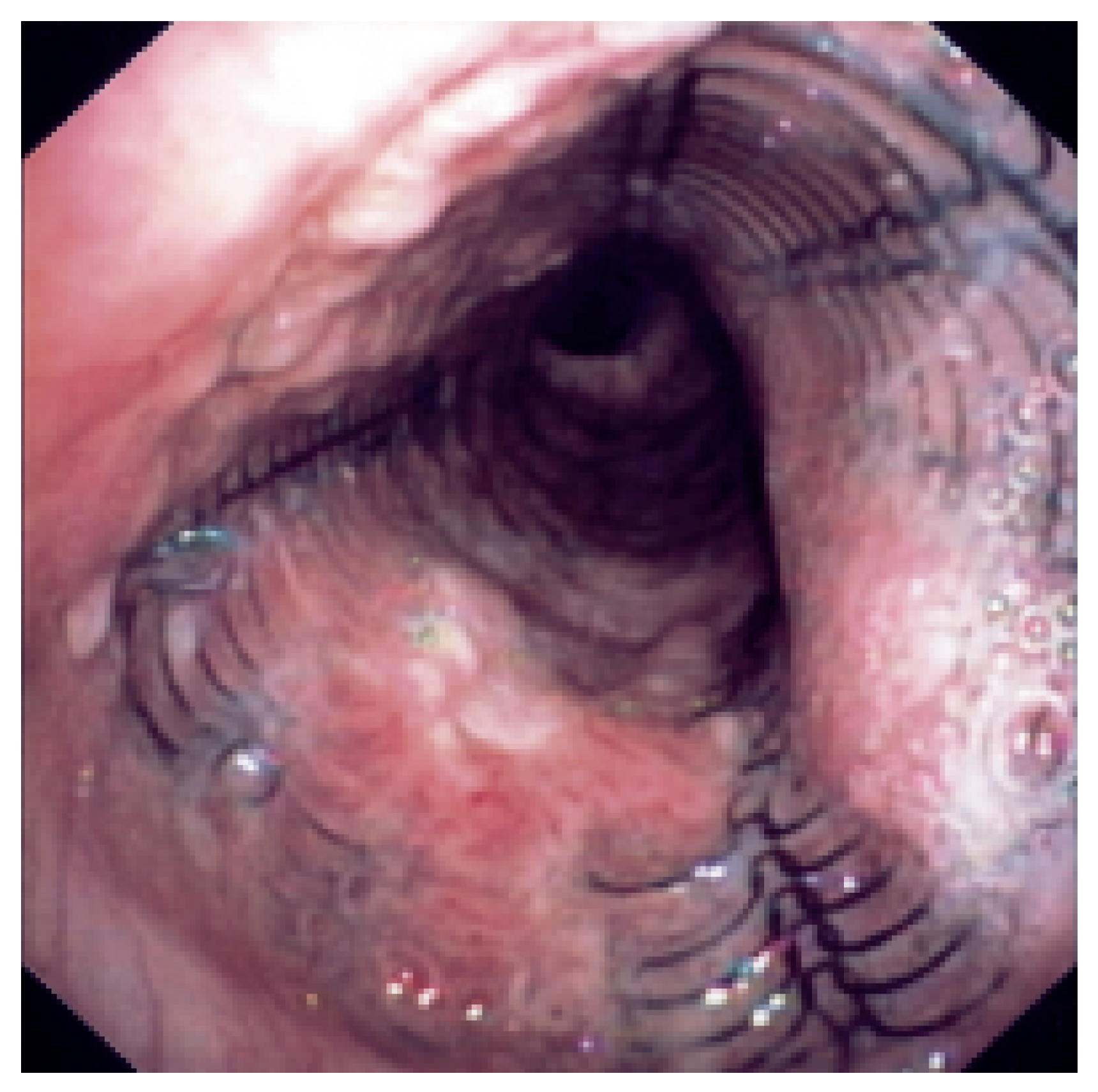
Am weitesten verbreitet sind die röhrenartigen Silikon-Stents nach Dumon (
Abb. 2 and
Abb.3), welche billig sind und auch jederzeit wieder entfernt werden können [
10]. Inzwischen wurden diverse neue Metall [
11] und Kunststoff-Stents [
12] auf den Markt gebracht, die sich aufgrund ihrer Bauart—in Form eines Scherengitters oder Maschendrahtnetzes—besser den anatomischen Gegebenheiten anpassen. Im allgemeinen ist die Verträglichkeit erstaunlich gut, wobei eine leichte Sekretretention nicht immer zu vermeiden ist. Komplikationen sind Verstopfen des Stents mit Sekret, Einwachsen von Granulationsoder Tumorgewebe an dessen Enden, selten auch Migration oder Brechen der Gitterstruktur des Stents [
13]. Zur Vermeidung einer Sekretobstruktion sind regelmässige Inhalationen mit einem elektrischen Vernebler unerlässlich.
Historie
Berichte über endoskopisch einzulegende Atemwegschienen reichen bis ins Jahr 1915, der frühen Zeit nach Einführung der Bronchoskopie zurück [
8,
9]. Sie trugen jedoch bis vor kurzer Zeit eher anekdotischen Charakter und wurden nur von vereinzelten Autoren empfohlen und tatsächlich verwendet [
14]. Der Montgomery-T-Tube, welcher 1960 entwickel wurde, war der erste spezielle Atemweg-Stent. Jedoch konnte sich die Implantation trachealer Prothesen in den tiefen Atemwegen nicht durchsetzten bis Dumon im Jahre 1989 den ersten bronchoskopisch plazierbaren, sicher anzuwendenden und allgemein verfügbaren Silikon-Stent vorstellte [
15]. In rascher Folge wurde dann von vielen Autoren, zum Teil an sehr kleinen Fallzahlen, über weitere Erfahrungen mit der Einlage von Metall-Endoprothesen berichtet, wie sie schon seit längerem in der Angiologie zur Anwendung kamen.
Silikonund Hybrid-Stents
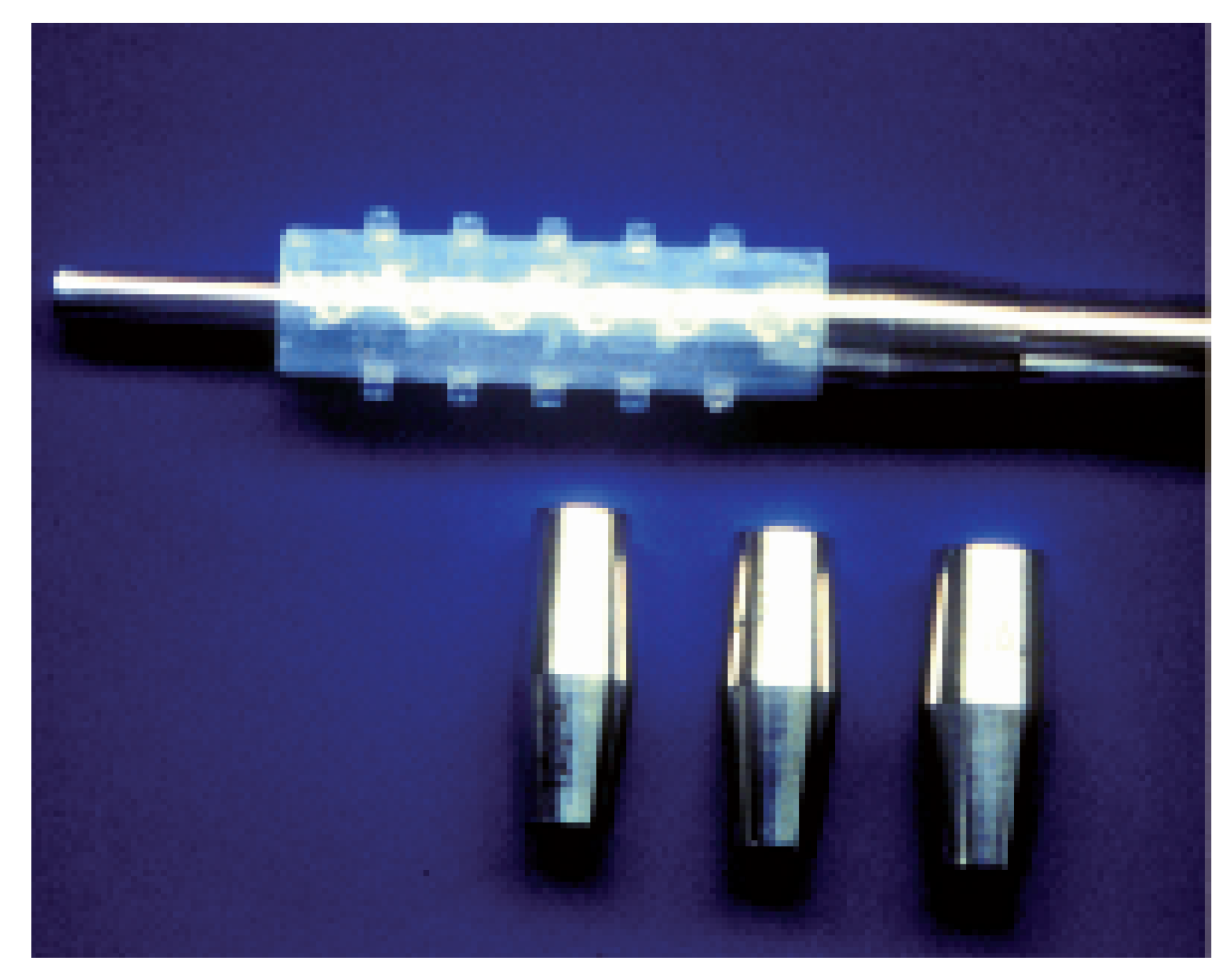
Das erste Modell, das weite Verbreitung fand, war der von Dumon entwickelte Silikon-Stent Er besteht aus einem einfachen oder verzweigten Silikonrohr mit Noppen auf der Oberfläche zur Fixierung und wird in unterschiedlichen Durchmessern, Längen und Biegungen vertrieben. Der endoskopische Einsatz erfolgt mit dem starren Bronchoskop oder einem speziellen Implantator (
Abb. 2 and
Abb. 3), oft auch unter zusätzlicher radiologischer Kontrolle. Da die starren Silikonrohre gegen Biegungen verkanten und durch zähes Sekret verlegt werden können, wurde als Verbesserung von Freitag in Analogie zum Wandaufbau der Luftröhre ein Hybrid-Stent aus Silikon entwickelt, der eine flexible Dorsalwand hat und dessen ventrale Wand durch Stahlspangen verstärkt ist [
16]. Da die Fixation durch zwei bronchiale Schenkel an der Bifurkation erfolgt, ist dieser Stent wesentlich voluminöser und entsprechend schwieriger einzusetzen.
Bifurkationsstent
Da die starren Silikonrohre gegen Biegungen verkanten und oft durch zähes Sekret verlegt werden können, wurde als Verbesserung von Freitag in Analogie zum Wandaufbau der Luftröhre ein Hybrid-Stent aus Silikon entwickelt, der eine flexible Dorsalwand hat und dessen ventrale Wand durch Stahlspangen verstärkt ist. So kann sich der Querschnitt der Prothese beim Husten verringern, was die Strömungsgeschwindigkeit erhöht und damit die Bronchialtoilette erleichtert. Dieser Stent wird durch eine distale Gabelung in beiden Hauptbronchien fixiert [
16]. Durch sein spezielles Design findet dieser Stent jedoch, als einziger, bei der Behandlung des Bifurkationssyndroms Verwendung.
Stent-Auswahl und Datenlage
Der adäquate Prothesendurchmesser kann an den Branchen der Biopsiezange oder am Durchmesser des Bronchoskops abgeschätzt werden. Um eine Dislokation zu vermeiden, muss die Prothese nach der Implantation fest in der Stenose sitzen. Die richtige Länge lässt sich ausmessen, in dem man das Endoskop von distal bis zum proximalen Stenoseende durchzieht und die zurückgelegte Distanz am Endoskop abmisst [
9,
18].
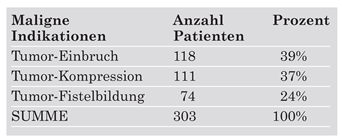
Insgesamt liegen Daten über ca. 2000 Patienten vor, denen knapp 3000 Stents implantiert wurden. Die weitaus grösste Gruppe wurde mit Silikon-Stents versorgt, ca. 30% erhielten Stents aus Stahl und Nitinol. Indikationen zur Stent-Implantation waren in
2/3 der Fälle maligne Läsionen (
Table 2) ((?
Table 2 von Lektorin eingefügt, richtig?)).
Die Hauptlokalisation war mehr oder weniger Stent-abhängig; dabei spielte die vorhandene Implantationstechnik (starr/flexibel oder beides), die Verkleinerungsmöglichkeit beim «Laden» des Applikators bzw. beim Einführen in die Stenose und die mechanische Festigkeit der vorwiegend zylindrischen Endoprothesen eine Rolle. Silikon-Stents wurden in erster Linie in die Trachea eingesetzt, deutlich seltener in Stammund Lappenbronchien. Eine wichtige Besonderheit: der Dumon-Stent ist aufgrund seiner Form und Grösse nur für den Einsatz in der Trachea geeignet.
Stent-Dislokationen werden für maligne Läsionen in 3–13% der Prothesen beschrieben. Sie treten jedoch vor allem bei Silikon-Stents auf. Die Sekrethaftung im Stent ist ein leidiges Problem, nicht nur der Silikonprothesen. Vom Stent ausgehende Infektionen sind jedoch rar. Ein Problem der Prothesen ist die zu übel riechender Atmung führende bakterielle Kontamination der Prothesen in situ. Die Granulationsbildung an den Rändern der Stents variiert von 0–15%. Mittels Zangen oder APC können sie im Rahmen der regelmässigen endoskopischen Stent-Kontrolle meist komplikationsfrei abgetragen wird [
19,
20].
Frakturen bei Metall-Stents sind selten. Das gilt ebenso für die Perforation der Bronchialwand mit nachfolgender Fistelung [
11,
13,
17].
«Multimodale Therapie» maligner Atemwegstenosen
Bei der Behandlung maligner Stenosen ist eine intensive Zusammenarbeit zwischen Pneumologen, Thoraxchirurgen, Radiotherapeuten und Onkologen erforderlich. Nach einer bronchoskopischen Wiedereröffnung einer Tumorstenose sollte, wenn immer möglich, eine konsolidierende Radiound/oder Chemotherapie folgen, da sich hiermit die rezidivfreie Zeit verlängern lässt. Je nach Situation können eine perkutane oder endoluminale Radiotherapie und/oder eine Chemotherapie in Frage kommen. Wegen des eingeschränkten Allgemeinzustandes und aus logistischen Gründen ist dies jedoch nicht immer möglich. Umgekehrt sollten höhergradige Stenosen vor einer geplanten Radiound/oder Chemotherapie interventionell-bronchoskopisch angegangen werden, da eine Wiedereröffnung mit der klassischen palliativen Therapie wegen ungenügenden Ansprechens oder Entstehung von Vernarbungen häufig nicht gelingt. Zudem verunmöglichen poststenotische Pneumonien nicht selten die zeitgerechte Durchführung einer Radiooder Chemotherapie. Die interventionelle Bronchoskopie und die klassischen palliativen Therapien sind somit sich ergänzende Therapieverfahren, die am besten kombiniert eingesetzt werden [
21,
22].
Schlussfolgerung
Die Methoden der interventionellen Bronchoskopie bieten Tumorpatienten eine äusserst effiziente Palliativtherapie. Die rasche Rekanalisation durch mechanische Verfahren—Laser und Stenting—bewirken schnelle Symptomfreiheit, die in diesem Masse weder durch eine medikamentöse Therapie noch durch eine Strahlenbehandlung erhalten werden können. Die Brachytherapie eröffnet dem Patienten eine zusätzliche Behandlungsmöglichkeit, die insbesondere bei kleinsten Tumoren auch einen kurativen Therapieansatz verfolgt. Die photodynamische Therapie bewirkt eine selektive Tumorzerstörung, ohne die Nebenwirkungen einer Strahlenbehandlung. Kurative Ansätze der Brachytherapie und der PDT bieten Patienten bei funktioneller Inoperabilität Chancen einer Heilung.
Moderne interventionelle bronchologische Verfahren bieten daher ein breites Spektrum an therapeutischen Interventionsmöglichkeiten.
Die interventionelle Bronchologie erfordert durch das Krankheitsspektrum, mit dem sie es zu tun hat, durch ihre besonderen operativen Verfahren und durch die zunehmende Differenzierung und Komplexität der mit Bronchoskopie assoziierten Techniken heute ein relativ hohes Mass an Spezialisierung. Diesem Umstand wird mit der Regelung der Ausbildung und der Anerkennung bronchologischer Qualifikation Rechnung getragen werden, was beides in Deutschland noch aussteht.
Neben der etablierten Rolle der Bronchoskopie in der Stufendiagnostik beim Verdacht auf ein Bronchialkarzinom hat sich die interventionelle Bronchoskopie in der palliativen Therapie, aber auch in der kurativen Therapie lokaler Karzinome einen grossen Stellenwert erworben. Mit den unterschiedlichen Verfahren gelingt es Patienten in lebensbedrohlichen Situationen zu stabilisieren und neben der Verbesserung der Lebensqualität oft auch eine Lebensverlängerung zu erzielen.