Proteomic Analysis of Maize Cultivars Tolerant to Drought Stress
Abstract
1. Introduction
2. Materials and Methods
2.1. Vegetal Material and Water Regimes Used
2.2. Experimental Design and Statistical Analysis
2.3. Total Soluble Protein Extraction
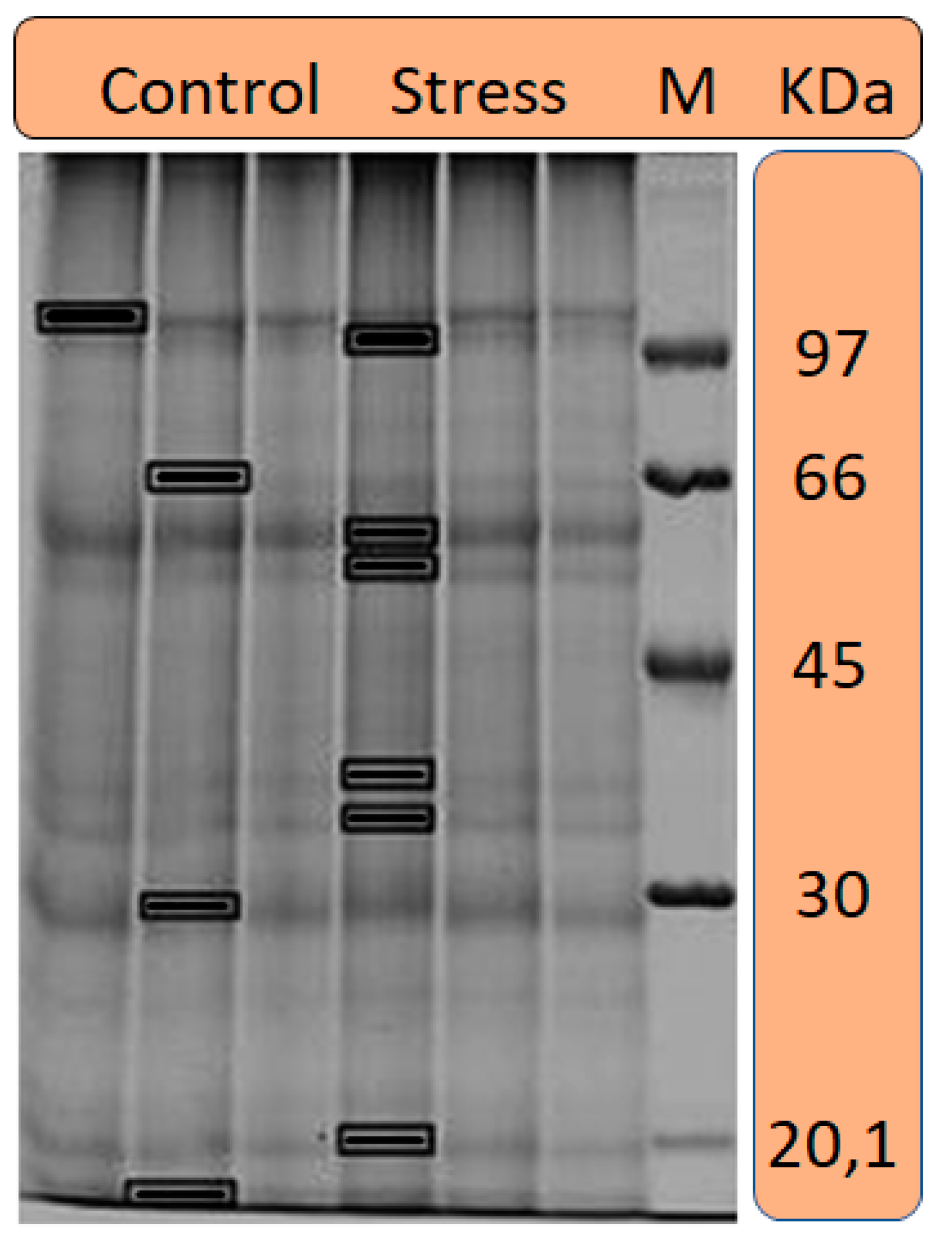
2.4. SDS-PAGE
2.5. Image Analysis and Mass Spectrometry
3. Results
4. Discussion
5. Conclusions
Author Contributions
Funding
Data Availability Statement
Acknowledgments
Conflicts of Interest
References
- Deminicis, B.B.; Vieira, H.D.; Jardim, J.G.; do Carmo Araújo, S.A.; Neto, A.C.; de Oliveira, V.C.; da Silva Lima, E. Silagem de milho-Características agronômicas e considerações. Redvet Rev. Electron. Vet. 2009, 10, 1–6. [Google Scholar]
- Campos, H.; Cooper, M.; Habben, J.E.; Edmeades, G.O.; Schussler, J.R. Improving drought tolerance in maize: A view from industry. Field Crops Res. 2004, 90, 19–34. [Google Scholar] [CrossRef]
- Carvalho, H.W.L.D.; Leal, M.D.L.D.S.; Santos, M.X.D.; Monteiro, A.A.T.; Cardoso, M.J.; Carvalho, B.C.L.D. Estabilidade de cultivares de milho em três ecossistemas do Nordeste brasileiro. Pesqui. Agropecu. Bras. 2000, 35, 1773–1781. [Google Scholar] [CrossRef][Green Version]
- Gouesnard, B.; Zanetto, A.; Welcker, C. Identification of adaptation traits to drought in collections of maize landraces from southern Europe and temperate regions. Euphytica 2016, 209, 565–584. [Google Scholar] [CrossRef]
- Nagore, M.L.; Della Maggiora, A.; Andrade, F.H.; Echarte, L. Water use efficiency for grain yield in an old and two more recent maize hybrids. Field Crops Res. 2017, 214, 185–193. [Google Scholar] [CrossRef]
- Kagoda, F.; Hearne, S.; Adewuyi, O.; Coyne, D.L. Response of drought tolerant maize inbreds to water stress under nematode infested conditions. Euphytica 2015, 206, 77–87. [Google Scholar] [CrossRef]
- Lemos, M.C.; Finan, T.J.; Fox, R.W.; Nelson, D.R.; Tucker, J. The use of seasonal climate forecasting in policymaking: Lessons from Northeast Brazil. Clim. Chang. 2002, 55, 479–507. [Google Scholar] [CrossRef]
- Nascimento, M.; Tabosa, J.N.; Tavares Filho, J.J. Avaliação de cultivares de milho no agreste semi-árido de Pernambuco. Rev. Bras. Eng. Agrícola Ambient. 2003, 7, 53–56. [Google Scholar] [CrossRef]
- Banziger, M.; Araus, J.L. Recent advances in breeding maize for drought and salinity stress tolerance. In Advances in Molecular Breeding toward Drought and Salt Tolerant Crops; Jenks, M.A., Hasegawa, P.M., Jain, S.M., Eds.; Springer: Dordrecht, The Netherlands, 2012; Volume 1, pp. 587–601. [Google Scholar]
- Chen, J.; Xu, W.; Velten, J.; Xin, Z.; Stout, J. Characterization of maize inbred lines for drought and heat tolerance. J. Soil Water Conserv. 2012, 67, 354–364. [Google Scholar] [CrossRef]
- Santos, M.X.; Andrade, C.D.L.T.; Oliveria, A.C.; Leite, C.E.P.; Carvalho, H.W.L.; Gama, E.E.G.E.; Parentoni, S.N. Comportamento de híbridos de milho selecionados e não selecionados para ASI sob estresse de água no florescimento e no enchimento de grãos. Rev. Bras. Milho Sorgo 2003, 2, 71–81. [Google Scholar] [CrossRef]
- Ertiro, B.T.; Olsen, M.; Das, B.; Gowda, M.; Labuschagne, M. Efficiency of indirect selection for grain yield in maize (Zea mays L.) under low nitrogen conditions through secondary traits under low nitrogen and grain yield under optimum conditions. Euphytica 2020, 216, 134. [Google Scholar] [CrossRef]
- Cardoso, M.J.; de Carvalho, H.W.L.; LEAL, M.D.L.; dos Santos, M.X. Comportamento, adaptabilidade e estabilidade de híbridos de milho no estado do Piauí no ano agrícola de 1998. Rev. Cient. Rural. 2000, 5, 146–153. [Google Scholar]
- Carvalho, H.W.L.D.; Leal, M.D.L.D.S.; Cardoso, M.J.; Santos, M.X.D.; Carvalho, B.C.L.D.; Tabosa, J.N.; Albuquerque, M.M. Adaptabilidade e estabilidade de cultivares e híbridos de milho no Nordeste brasileiro no ano agrícola de 1998. Pesqui. Agropecu. Bras. 2001, 36, 637–644. [Google Scholar] [CrossRef]
- Carvalho, H.W.L.D.; Leal, M.D.L.D.S.; Santos, M.X.D. Estimativas de parâmetros genéticos na população de milho CMS 35 no Estado de Sergipe. Pesqui. Agropecu. Bras. 2002, 37, 1399–1405. [Google Scholar] [CrossRef]
- Resende, M.D.V. Sistema Estatístico e Seleção Genética Computadorizada via Modelos Lineares Mistos; Embrapa Florestas: Colombo, Brazil, 2007; pp. 145–156. [Google Scholar]
- Borges, V.; Soares, A.A.; Reis, M.S.; Resende, M.D.V.; Maizeélio, V.M.O.; Leite, N.A.; Vieira, A.R. Desempenho genotípico de linhagens de arroz de terras altas utilizando metodologia de modelos mistos. Bragantia 2010, 69, 833–841. [Google Scholar] [CrossRef]
- Bornhofen, E.; Benin, G.; Storck, L.; Woyann, L.G.; Duarte, T.; Stoco, M.G.; Marchioro, S.V. Métodos estatísticos para estudo de adaptabilidade e estabilidade em trigo. Bragantia 2017, 76, 1–10. [Google Scholar] [CrossRef]
- Oliveira, I.J.D.; Atroch, A.L.; Dias, M.C.; Guimarães, L.J.; Guimarães, P.E.D.O. Seleção de cultivares de milho quanto à produtividade, estabilidade e adaptabilidade no Amazonas. Pesqui. Agropecu. Bras. 2017, 52, 455–463. [Google Scholar] [CrossRef][Green Version]
- Verissimo, M.A.A.; Oliveira, R.A.D.; Daros, E.; Härter, A. Genetic parameters and performance of sugarcane families under cold stress in the South of Brazil. Pesqui. Agropecu. Bras. 2018, 53, 583–592. [Google Scholar] [CrossRef]
- Nogueira, R.J.M.C.; Aloufa, M.A.I.; De Albuquerque, M.B. Stomatic behaviour and leaf water potential in young plants of Annona squamosa submitted to saline stress. Fruits 2004, 59, 209–214. [Google Scholar]
- Pacheco, C.M.; Pestana-Calsa, M.C.; Gozzo, F.C.; Mansur Custodio Nogueira, R.J.; Menossi, M.; Calsa Junior, T. Differentially delayed root proteome responses to salt stress in sugar cane varieties. J. Proteome Res. 2013, 12, 5681–5695. [Google Scholar] [CrossRef]
- Souza, D.L.D.; Zambalde, A.L.; Mesquita, D.L.; Souza, T.A.D.; Silva, N.L.C.D. A perspectiva dos pesquisadores sobre os desafios da pesquisa no Brasil. Educ. Pesqui. 2020, 46, 1–21. [Google Scholar] [CrossRef]
- Alves, M.D.F.A.; Alves, L.R.A.; Sarmento, E.B.; de Lima, G.A.; Crispim, D.L. Análise da precipitação pluvial de Pombal-PB relacionada com sistemas atmosféricos atuantes. Rev. Verde 2015, 10, 169–175. [Google Scholar] [CrossRef][Green Version]
- Santos, H.G.; Jacomine, P.K.T.; Dos Anjos, L.H.C.; De Oliveira, V.A.; Lumbreras, J.F.; Coelho, M.R.; Cunha, T.J.F. Sistema Brasileiro de Classificação de Solos; Embrapa: Brasília, Brazil, 2018; pp. 1–356. [Google Scholar]
- Soil Survey Staff. Available online: https://www.nrcs.usda.gov/sites/default/files/2022-09/The-Soil-Survey-Manual.pdf (accessed on 25 May 2023).
- Donagema, G.K.; de Campos, D.B.; Calderano, S.B.; Teixeira, W.G.; Viana, J.M. Manual de Métodos de Análise de Solo; Embrapa Solos: Rio de Janeiro, Brazil, 2011; pp. 1–212. [Google Scholar]
- Alvarenga, A.A.; Nery, F.C.; Rodrigues, A.M. Experimentação em Fisiologia Vegetal; Editora UFLA: Minas Gerais, Brazil, 2014; pp. 1–171. [Google Scholar]
- Boaretto, L.F. Análise do Transcritôma e Proteôma do Colmo de Cana-de-Açúcar Relacionada ao Metabolismo da Sacarose. Doctoral Dissertation, Universidade de São Paulo, São Paulo, Brazil, 2012. [Google Scholar]
- Bradford, M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976, 72, 248–254. [Google Scholar] [CrossRef] [PubMed]
- Hurkman, W.J.; Tanaka, C.K. Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis. Plant Physiol. 1986, 81, 802–806. [Google Scholar] [CrossRef] [PubMed]
- Melo, A.V.; dos Santos, V.M.; Varanda, M.A.F.; Cardoso, D.P.; Dias, M.A.R. Desempenho agronômico de genótipos de milho submetidos ao estresse hídrico no sul do estado do tocantins. Rev. Bras. Milho Sorgo 2018, 17, 177–189. [Google Scholar] [CrossRef]
- Souza, P.H.N.; Bastos, G.Q.; de Andrade Dutra Filho, J. Interação cana-de-açúcar x épocas de colheita na Microrregião Centro de Pernambuco via modelos mistos. Res. Soc. Dev. 2020, 9, e713997700. [Google Scholar] [CrossRef]
- Silva, H.D.C.; Anunciação Filho, C.J.; Bastos, G.Q.; Dutra Filho, J.A.; Simões Neto, D.E. Repeatibility of agroindustrial characters in sugarcane in different harvest cycles. Rev. Ciênc. Agron. 2018, 49, 275–282. [Google Scholar] [CrossRef]
- Garcia, C.H.; Nogueira, M.C.S. Utilização da metodologia REML/BLUP na seleção de clones de eucalipto. Sci. For. 2005, 68, 107–112. [Google Scholar]
- Oliveira, R.A.; Daros, E.; Bespalhok Filho, J.C.; Zambon, J.L.C.; Ido, O.T.; Weber, H.; Hugo, Z.E.N.I. Seleção de famílias de cana-de-açúcar via modelos mistos. Sci. Agra. 2008, 9, 269–274. [Google Scholar] [CrossRef]
- Carvalho, A.D.; Silva, G.O.; Resende, F.V. Adaptabilidade e estabilidade de populações de cenoura pelo método REML/BLUP. Hort. Bras. 2017, 35, 69–74. [Google Scholar] [CrossRef][Green Version]
- Costa, J.R.D.; de Pinho, J.L.; Parry, M.M. Produção de matéria seca de cultivares de milho sob diferentes níveis de estresse hídrico. Rev. Bras. Eng. Agríc. Ambient. 2008, 12, 443–450. [Google Scholar] [CrossRef]
- Mendes, F.F.; Guimarães, L.J.M.; Souza, J.C.; Guimarães, P.E.O.; Pacheco, C.A.P.; Machado, J.R.A.; Meirelles, W.F.; Silva, A.R.; Parentoni, S.N. Adaptability and stability of maize varieties using mixed model methodology. Crops Breed. Appl. Biotechnol. 2012, 12, 111–117. [Google Scholar] [CrossRef]
- Pereira, T.B.; Carvalho, J.P.F.; Botelho, C.E.; Resende, M.D.V.D.; Rezende, J.C.D.; Mendes, A.N.G. Eficiência da seleção de progênies de café F4 pela metodologia de modelos mistos (REML/BLUP). Bragantia 2013, 72, 230–236. [Google Scholar] [CrossRef][Green Version]
- Maia, M.C.C.; de Oliveira, L.C.; Vasconcelos, L.F.L.; Lima Neto, F.P.; Yokomizo, G.K.I.; Araújo, L.D. Repetibilidade de características quantitativas de frutos em seleções elite de manga rosa. Rev. Agro@mbiente Online 2017, 11, 56–62. [Google Scholar] [CrossRef]
- Rosado, A.M.; Rosado, T.B.; Alves, A.A.; Laviola, B.G.; Bhering, L.L. Seleção simultânea de clones de eucalipto de acordo com produtividade, estabilidade e adaptabilidade. Pesqui. Agropecu. Bras. 2012, 47, 964–971. [Google Scholar] [CrossRef]
- Eberhart, S.T.; Russell, W.A. Stability parameters for comparing varieties 1. Crop Sci. 1966, 6, 36–40. [Google Scholar] [CrossRef]
- Teodoro, P.E.; Barroso, L.M.A.; Nascimento, M.; Torres, F.E.; Sagrilo, E.; Santos, A.D.; Ribeiro, L.P. Artificial neural networks to identify semi-prostrate cowpea genotypes with high phenotypic adaptability and stability. Pesqui. Agropecu. Bras. 2015, 50, 1054–1060. [Google Scholar] [CrossRef]
- Bernini, C.S.; Santo, F.A.S.; Silva, D.S.; Figueiredo, Z.N. Seleção fenotípica de híbridos de milho para ambientes de baixa altitude e deficit hídrico. Pesqui. Agrárias Ambient. 2020, 8, 172–177. [Google Scholar] [CrossRef]
- Crosa, C.F.R.; Ortiz, A.C.; Felipez, W. Germinação e desenvolvimento de sementes de dois híbridos de milho sob estesse hídrico. Rev. Científica Rural. 2021, 23, 110–123. [Google Scholar] [CrossRef]
- Dutra Filho, J.A.; Souto, L.S.; Luna, R.G.; Souza, A.S.; Silva, F.G.; Silva, F.A.C.; Simões Neto, D.E.; Calsa Junior, T. Mixed modeling for fiber yield genetic selection in sugarcane. Rev Fac Cienc Agrar 2021, 53, 11–19. [Google Scholar] [CrossRef]
- Messmer, R.; Fracheboud, Y.; Banzinger, M.; Vargas, M.; Stamp, P.; Ribaut, J.M. Drought stress and tropical maize: QTL-by-environment interactions and stability of QTLs across environments for yield components and secondary traits. Theor. Appl. Genet. 2009, 119, 913–930. [Google Scholar] [CrossRef] [PubMed]
- Resende, M.D.V.; Lopes, P.S.; Silva, R.L.; Pires, I.E. Seleção genômica ampla (GWS) e maximização da eficiência do melhoramento genético. Pesq. Flor. Bras. 2008, 56, 63–77. [Google Scholar]
- Dekkers, J.C.M. Prediction of response to marker assisted and genomic selection using selection index theory. J. Anim. Breed. Genet. 2007, 124, 331–341. [Google Scholar] [CrossRef] [PubMed]
- Zhu, Y.; Wu, N.; Song, W.; Yin, G.; Qin, Y.; Yan, Y.; Hu, Y. Soybean (Glycine max) expansin gene superfamily origins: Segmental and tandem duplication events followed by divergent selection among subfamilies. BMC Plant Biol. 2014, 14, 93. [Google Scholar] [CrossRef]
- Patterson, K.; Walters, L.A.; Cooper, A.M.; Olvera, J.G.; Rosas, M.A.; Rasmusson, A.G.; Escobar, M.A. Nitrate-regulated glutaredoxins control Arabidopsis primary root growth. Plant Physiol. 2016, 170, 989–999. [Google Scholar] [CrossRef]
- Balsera, M.; Arellano, J.B.; Gutiérrez, J.R.; Heredia, P.; Revuelta, J.L.; De Las Rivas, J. Structural analysis of the PsbQ protein of photosystem II by Fourier transform infrared and circular dichroic spectroscopy and by bioinformatic methods. Biochemistry 2003, 42, 1000–1007. [Google Scholar] [CrossRef]
- Vessal, S.; Arefian, M.; Siddique, K.H. Proteomic responses to progressive dehydration stress in leaves of chickpea seedlings. BMC Genom. 2020, 21, 523. [Google Scholar] [CrossRef]
- Tejada-Jimenez, M.; Chamizo-Ampudia, A.; Calatrava, V.; Galvan, A.; Fernandez, E.; Llamas, A. From eukaryotic molybdenum cofactor biosynthesis to the clandestine enzyme mARC. Molécules 2018, 23, 3287. [Google Scholar] [CrossRef]


| pH | P | K+ | Na+ | Ca2+ | Mg2+ | H+ + Al3+ | CEC | MO | PST |
|---|---|---|---|---|---|---|---|---|---|
| H2O | mg dm−3 | -------------------Cmolcdm−3---------------- | g kg−1 | % | |||||
| 7.1 | 868 | 0.34 | 0.02 | 5.0 | 2.7 | 0.0 | 8.06 | 5.71 | <1 |
| Traits | ||||||
|---|---|---|---|---|---|---|
| PH | LW | GPM | DPM | NG | GW100 g | |
| Gv | 113.11 | 0.39 | 1485.7 | 356.56 | 2608.6 | 28.74 |
| VC × E | 1.77 | 0.00 | 86.93 | 6.65 | 25.16 | 1.60 |
| RV | 475.57 | 0.28 | 825.93 | 356.79 | 5411.0 | 7.62 |
| PV | 590.45 | 0.67 | 2398.5 | 719.80 | 8044.8 | 37.98 |
| h2 g | 0.19 | 0.58 | 0.62 | 0.50 | 0.32 | 0.76 |
| h2 m | 0.59 | 0.89 | 0.89 | 0.85 | 0.74 | 0.93 |
| CAG | 0.77 | 0.94 | 0.94 | 0.92 | 0.86 | 0.97 |
| R2C × E | 0.00 | 0.00 | 0.03 | 0.00 | 0.00 | 0.04 |
| rG × L | 0.98 | 0.98 | 0.94 | 0.98 | 0.99 | 0.95 |
| CVg (%) | 6.66 | 7.87 | 13.70 | 17.00 | 23.45 | 46.53 |
| CVe (%) | 13.65 | 6.63 | 10.21 | 17.01 | 33.78 | 23.96 |
| Mean | 159.77 | 7.92 | 281.40 | 111.03 | 217.74 | 11.52 |
| Effect | Likelihood ratio test (LRT) | |||||
| Genotype | 185.18 ** | 12.03 ** | 205.92 ** | 182.73 ** | 185.31 ** | 75.52 ** |
| Traits | ||||||||
|---|---|---|---|---|---|---|---|---|
| Plant Height (PH)/Accuracy: 77% | ||||||||
| Cultivars | g + ge | u + g + ge | Genetic gain | Mean | ||||
| 30% | 60% | 30% | 60% | 30% | 60% | 30% | 60% | |
| AG8677P | 13.93 | 14.06 | 153.67 | 193.86 | 13.93 | 14.06 | 153.67 | 193.86 |
| 30F53YH | −1.08 | −0.99 | 138.65 | 178.80 | 6.42 | 6.53 | 146.16 | 186.33 |
| 2B688PW | −2.16 | −2.27 | 137.57 | 177.52 | 3.56 | 3.59 | 143.30 | 183.39 |
| 2B604PW | −3.16 | −3.22 | 136.55 | 176.57 | 1.87 | 1.88 | 141.61 | 181.68 |
| ROBUSTO | −7.50 | −7.55 | 132.23 | 172.24 | 0.00 | 0.00 | 139.73 | 179.80 |
| Leaf width (LW)/Accuracy: 94% | ||||||||
| 2B688PW | 0.75 | 0.75 | 8.50 | 8.84 | 0.75 | 0.75 | 8.50 | 8.84 |
| 30F53YH | 0.34 | 0.30 | 8.09 | 8.39 | 0.54 | 0.52 | 8.30 | 8.62 |
| AG8677P | 0.07 | 0.08 | 7.83 | 8.18 | 0.39 | 0.38 | 8.14 | 8.47 |
| ROBUSTO | −0.42 | −0.41 | 7.32 | 7.67 | 0.18 | 0.18 | 7.94 | 8.27 |
| 2B604PW | −0.74 | −0.72 | 7.00 | 7.36 | 0.00 | 0.00 | 7.75 | 8.09 |
| Green plant mass (GPM)/Accuracy: 94% | ||||||||
| ROBUSTO | 53.1 | 59.77 | 301.9 | 373.86 | 53.18 | 59.77 | 301.93 | 373.80 |
| 30F53YH | 21.0 | 11.65 | 269.8 | 325.71 | 37.12 | 35.71 | 285.87 | 349.70 |
| 2B688PW | −11.0 | −6.38 | 237.7 | 307.67 | 21.07 | 21.68 | 269.82 | 335.70 |
| AG8677P | −29.4 | −28.03 | 219.2 | 286.01 | 8.43 | 9.25 | 257.18 | 323.85 |
| 2B604PW | −33.7 | −37.01 | 215.0 | 277.03 | 0.00 | 0.00 | 248.75 | 314.05 |
| Dry plant mass (DPM)/Accuracy: 92% | ||||||||
| ROBUSTO | 22.78 | 23.69 | 120.29 | 148.26 | 22.78 | 23.69 | 120.29 | 148.25 |
| 30F53YH | 13.18 | 12.81 | 110.69 | 137.38 | 17.98 | 18.25 | 115.49 | 142.81 |
| 2B688PW | −5.06 | −4.35 | 92.45 | 120.21 | 10.30 | 10.72 | 107.81 | 135.28 |
| AG8677P | −13.8 | −14.03 | 83.65 | 110.52 | 4.26 | 4.53 | 101.77 | 129.09 |
| 2B604PW | −17.0 | −18.03 | 80.45 | 106.42 | 0.00 | 0.00 | 97.50 | 124.56 |
| Number of grains per ear (NG)/Accuracy: 86% | ||||||||
| AG8677P | 50.18 | 50.64 | 229.30 | 307.01 | 50.18 | 50.64 | 229.29 | 307.01 |
| 2B688PW | 18.90 | 18.93 | 198.02 | 275.29 | 34.54 | 34.79 | 213.65 | 291.15 |
| 2B604PW | 3.68 | 3.68 | 182.80 | 260.04 | 24.25 | 24.42 | 203.37 | 280.78 |
| 30F53YH | −10.3 | −10.33 | 168.79 | 246.02 | 15.61 | 15.73 | 194.73 | 272.09 |
| ROBUSTO | −62.4 | −62.93 | 116.67 | 193.42 | 0.00 | 0.00 | 179.12 | 256.36 |
| Weight of one hundred seeds (GW100g)/Accuracy: 97% | ||||||||
| AG8677P | 4.11 | 4.66 | 14.87 | 16.94 | 4.11 | 4.66 | 14.87 | 16.94 |
| 30F53YH | 2.82 | 4.08 | 13.58 | 16.36 | 3.47 | 4.37 | 14.22 | 16.65 |
| 2B688PW | 2.44 | 1.03 | 13.20 | 13.21 | 3.13 | 3.25 | 13.88 | 15.54 |
| 2B604PW | −0.75 | −1.02 | 10.00 | 11.25 | 2.15 | 2.18 | 12.91 | 14.47 |
| ROBUSTO | −8.64 | −8.75 | 2.11 | 3.52 | 0.00 | 0.00 | 10.75 | 12.28 |
| Treatment | Spot ID | Access | Protein | Score | Organism | Function |
|---|---|---|---|---|---|---|
| Control | 1.1_C | Q0IRB0 | Glutaredoxin-C13 | 47 | Oryza sativa | Electron transport |
| 2.3_C | Q0DNU1 | Transcription factor GATA 19 | 49 | Oryza sativa | Cell differentiation | |
| 2.8_C | Q38872 | Kinase 6 | 38 | Arabidopsis thaliana | Catalytic activity | |
| 2.10_C | Q7XA07 | Cytoplasmic Dynein 1 of Intermediate Light Chain 2 | 40 | Chlamydomonas reinhardtii | Development protein | |
| Stress | 1.2_E | O22827 | Molybdopterin synthase | 39 | Arabidopsis thaliana | Catalytic activity |
| 1.4_E | Q38872 | Kinase 6 | 36 | Arabidopsis thaliana | Catalityc activity | |
| 1.5_E | O49292 | Domain PsbP | 41 | Arabidopsis thaliana | Photosynthesis | |
| 1.6_E | Q38872 | Kinase 6 | 43 | Arabidopsis thaliana | Catalityc activity | |
| 1.7_E | Q6IVU7 | Expansin-B6 | 49 | Arabidopsis thaliana | Reproduction |
Disclaimer/Publisher’s Note: The statements, opinions and data contained in all publications are solely those of the individual author(s) and contributor(s) and not of MDPI and/or the editor(s). MDPI and/or the editor(s) disclaim responsibility for any injury to people or property resulting from any ideas, methods, instructions or products referred to in the content. |
© 2023 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).
Share and Cite
Pinto, M.C.; de Oliveira, O.H.; de Oliveira, M.B.A.; da Silva, C.R.; de Figueiredo, M.P.S.; de Luna, R.G.; Souza, A.d.S.; Souto, L.S.; de Oliveira Godim, A.R.; de Almeida Lacerda, R.R.; et al. Proteomic Analysis of Maize Cultivars Tolerant to Drought Stress. Agronomy 2023, 13, 2186. https://doi.org/10.3390/agronomy13082186
Pinto MC, de Oliveira OH, de Oliveira MBA, da Silva CR, de Figueiredo MPS, de Luna RG, Souza AdS, Souto LS, de Oliveira Godim AR, de Almeida Lacerda RR, et al. Proteomic Analysis of Maize Cultivars Tolerant to Drought Stress. Agronomy. 2023; 13(8):2186. https://doi.org/10.3390/agronomy13082186
Chicago/Turabian StylePinto, Mariana Cabral, Odair Honorato de Oliveira, Maria Beatriz Araújo de Oliveira, Cleiton Ribeiro da Silva, Marcela Portela Santos de Figueiredo, Rômulo Gil de Luna, Anielson dos Santos Souza, Lauter Silva Souto, Ancélio Ricardo de Oliveira Godim, Rodolfo Rodrigo de Almeida Lacerda, and et al. 2023. "Proteomic Analysis of Maize Cultivars Tolerant to Drought Stress" Agronomy 13, no. 8: 2186. https://doi.org/10.3390/agronomy13082186
APA StylePinto, M. C., de Oliveira, O. H., de Oliveira, M. B. A., da Silva, C. R., de Figueiredo, M. P. S., de Luna, R. G., Souza, A. d. S., Souto, L. S., de Oliveira Godim, A. R., de Almeida Lacerda, R. R., Porto, A. C. F., Gomes-Silva, F., Vasconcelos, J. M. d., Moreira, G. R., Costa, M. L. L. d., Pereira de Figueiredo, M. R., Silva, F. A. C., Alvino, F. C. G., Silva, A. E. P., ... Dutra Filho, J. d. A. (2023). Proteomic Analysis of Maize Cultivars Tolerant to Drought Stress. Agronomy, 13(8), 2186. https://doi.org/10.3390/agronomy13082186









