Summary
According to the large, randomised, multicentric trials of the 1990’s, carotid-endarterectomy (CEA) is the «gold standard» of treatment for most patients with a proximal stenosis of the internal carotid artery (ACI), especially for those with a high-grade (70–99%), symptomatic stenosis. During the last years CEA has been further refined and standardised. Its results in terms of stroke risk and mortality are so good, that CEAcan be recommended as the prophylactic treatment of choice even in patients with an asymptomatic, highgrade ACI-stenosis and in patients with a 50–69%, evidently symptomatic stenosis, provided that their approximate life expectancy exceeds five years. Today’s scientific evidence, the current results of CEA, but also the analysis of the relevant, known pro’s and con’s of CEA and of the current endovascular treatment options, e.g. carotid angioplasty and stenting (CAS) support the view of CEA being the first option for ACI-stenosis.
Zusammenfassung
Gemäss den grossen, randomisierten Studien der 1990er Jahre ist die Karotis-Endarterektomie (CEA) der Goldstandard in der Behandlung der hochgradigen (70–99%), vor allem der symptomatischen Stenose am Abgang der Arteria carotis interna (ACI). Die Resultate dieses prophylaktischen Eingriffs in bezug auf Schlaganfall-Risiko und Mortalität sind in vielen Zentren so gut, dass die CEA auch Patienten mit einer asymptomatischen, hochgradigen Stenose und Patienten mit einer mittelgradigen, offensichtlich symptomatischen Stenose empfohlen werden kann. Die aktuelle wissenschaftliche Evidenz, die ausgezeichneten Resultate der modernen CEAund die Analyse der Vor- und Nachteile dieser Operation im Vergleich mit der endovaskulären Behandlung mittels Karotis-Angioplastie und Stenting (CAS) zeigen, dass die CEA die erste Behandlungsoption bei ACI-Stenose ist.
Einführung
Der Hintergrund für diesen Beitrag ist die Debatte, ob die Karotis-Endarterektomie (CEA), zurzeit der goldene Standard für die Behandlung der Stenose der Arteria carotis interna (ACI) [
1,
2,
3,
4,
5], früher oder später durch eine endovaskuläre Behandlungsmethode, wie die Angioplastie mit Stenting
(Carotid Angioplasty with Stenting = CAS), abgelöst werden soll. Die laufenden, multizentrischen Phase-III-Vergleichsstudien werden in den nächsten 2–3 Jahren diesbezüglich wichtige Erkenntnisse bringen [
6,
7,
8,
9]. Die CEA, besonders die mikrochirurgische CEA, wurde seit Ende der 1990er Jahre weiter perfektioniert und standardisiert und bietet heute noch bessere Resultate als in der Zeit der grossen CEAStudien [10, 11].
Wir haben diesen Beitrag aufgebaut, um das Rationale und die Stärken der mikrochirurgischen CEA hervorzuheben mit dem Anspruch, zu zeigen, dass diese Methode, unter der Auflage einer tadellosen Qualität, in der prophylaktischen Behandlung der Mehrzahl der Patienten mit symptomatischer und asymptomatischer ACI-Stenose kaum zu überbieten ist. Das Ziel der invasiven Behandlung der ACI-Stenose ist die Behebung der Schlaganfall-Ursache, um das Risiko eines Schlaganfalls prophylaktisch zu vermindern. Wir werden zunächst die Pathophysiologie des Schlaganfalls bei Karotisstenose und dann das natürliche Schlaganfall-Risiko bei asymptomatischer und symptomatischer ACI-Stenose behandeln. Danach werden wir die heute geltende wissenschaftliche Evidenz bezüglich CEA und endovaskulärer Behandlung zusammenfassen und die wesentlichen Unterschiede dieser zwei Behandlungsmethoden erläutern.
Pathophysiologie des Schlaganfalls bei Karotisstenose: arterioarterielle Embolien und nicht hämodynamische Insuffizienz
Die arteriosklerotische Einengung am Abgang der Arteria carotis interna verursacht ca. 15–20% der Schlaganfälle. Die Ursache des ischämischen Hirninsultes ist bei mehr als 90% dieser Patienten eine arterioarterielle Embolie mit nachfolgendem Territorial-Infarkt [
12].
Seltener kann es zu einem globalen Perfusionsdefizit der peripheren Versorgungsgebiete der ACI und zu sogenannten Wasserscheiden-Infarkten kommen. Die ausgezeichnete Kollateralzirkulation durch den Circulus willisii und durch Anastomosen mit der A. carotis externa kann in aller Regel das Perfusionsdefizit einer bis hin zur Okklussion progredienten Stenose der ACI kompensieren, so dass die hämodynamische Insuffizienz eine untergeordnete Rolle in der Pathophysiologie des Schlaganfalls bei ACI-Stenose spielt.
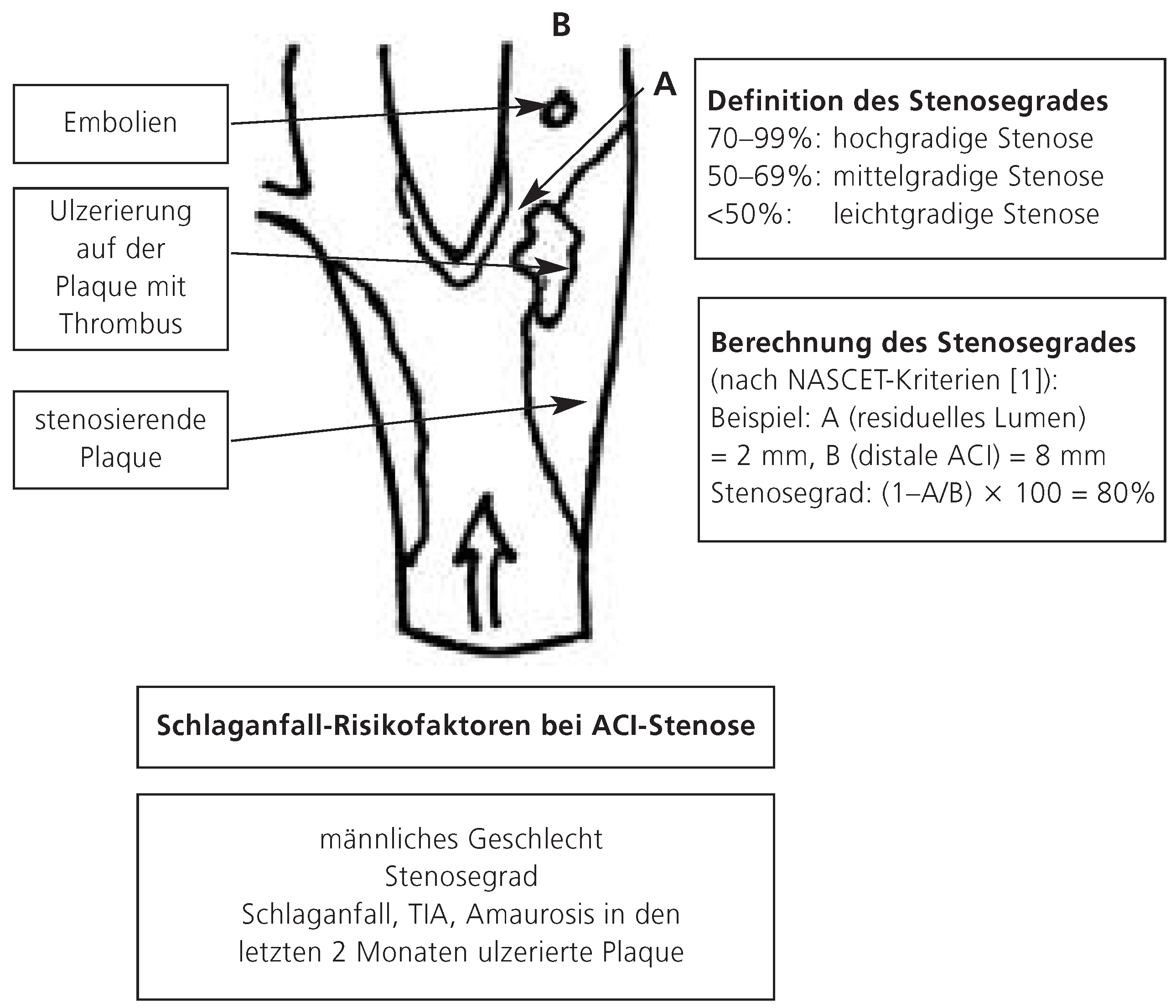
Bei zunehmender Einengung des Gefässlumens, in der Regel nach einer Reduktion des Gefässdurchmessers um 60–70%, kommt es zu einer zunehmenden Flussbeschleunigung durch die Stenose [
13] (Abb. 1). Der hämodynamische «Stress» auf das Endothel führt zur Ulzeration der arteriosklerotischen Plaque, und schliesslich zur arterioarteriellen Embolisation von fibrinoplakettären oder Cholesterin-Thromben und zum ischämischen Schlaganfall. Dieses pathophysiologische Modell erklärt, warum das Schlaganfall-Risiko mit dem Stenosegrad zunächst steigt [
1] und bei Subokklusion und Okklusion des Gefässes, d.h. wenn der Fluss wieder langsamer wird oder sistiert, wieder abrupt abnimmt [14, 15].
Abbildung 1.
Pathophysiologie und Risiko eines Schlaganfalls bei ACI-Stenose. Die hochgradige Stenose am Abgang der ACI (in diesem Beispiel 80%) wird hämodynamisch relevant und führt zu einer lokalen Erhöhung der Flussgeschwindigkeit und zum erhöhten Wandstress, welche zu Endothelulzerationen und schliesslich zu arterioarteriellen Embolien führen. Stenosegrad, nachgewiesene Plaque-Ulzerationen und stattgehabte Embolien sind unter den vier wichtigsten Risikofaktoren für weitere zerebrovaskuläre, ischämische Ereignisse.
Abbildung 1.
Pathophysiologie und Risiko eines Schlaganfalls bei ACI-Stenose. Die hochgradige Stenose am Abgang der ACI (in diesem Beispiel 80%) wird hämodynamisch relevant und führt zu einer lokalen Erhöhung der Flussgeschwindigkeit und zum erhöhten Wandstress, welche zu Endothelulzerationen und schliesslich zu arterioarteriellen Embolien führen. Stenosegrad, nachgewiesene Plaque-Ulzerationen und stattgehabte Embolien sind unter den vier wichtigsten Risikofaktoren für weitere zerebrovaskuläre, ischämische Ereignisse.
Das natürliche Schlaganfall-Risiko bei Karotisstenose: viel höher bei symptomatischen Patienten
Das individuelle Risiko bei ACI-Stenose steigt mit dem Stenosegrad [1, 2, 16] und vor allem dann, wenn die Stenose bereits zu (transienten oder permanenten) zerebrovaskulären und okulären Ereignissen geführt hat (Abb. 1). Das grösste Schlaganfall-Risiko liegt dementsprechend bei Patienten (v.a. Männern) mit einer hochgradigen (70–99%), symptomatischen Karotisstenose vor und beträgt trotz medizinischer Behandlung 12–13% im ersten Jahr und 20–25% während den ersten 3 Jahren nach dem ersten Ereignis [1, 2] (Tab. 1). Dieses Risiko sinkt zwar massiv bei asymptomatischen Patienten, bleibt aber bedeutend, wenn eine hochgradige Karotis-Stenose vorliegt. Bei jedem Patienten mit einer ACIStenose muss das geschätzte, natürliche Schlaganfall-Risiko gegen das Behandlungsrisiko abgewogen werden.
Tabelle 1.
Natürliches Schlaganfall-Risiko unter konservativer Behandlung bei symptomatischer versus asymptomatischer Karotisstenose, je nach Stenosegrad. Bei jedem Patienten mit einer ACI-Stenose muss das geschätzte, natürliche Schlaganfall-Risiko gegen das Behandlungsrisiko abgewogen werden.
Tabelle 1.
Natürliches Schlaganfall-Risiko unter konservativer Behandlung bei symptomatischer versus asymptomatischer Karotisstenose, je nach Stenosegrad. Bei jedem Patienten mit einer ACI-Stenose muss das geschätzte, natürliche Schlaganfall-Risiko gegen das Behandlungsrisiko abgewogen werden.
Karotis-Endarterektomie: die Behandlung der Wahl für die Schlaganfall-Prophylaxe bei Karotis-Stenose
Die wissenschaftliche Evidenz
Nach einer bewegten Vorgeschichte seit der Einführung dieser Operation 1954 [17, 18] haben mehrere multizentrische, randomisierte Phase-III-Studien in den 1990er Jahren die Überlegenheit der CEA gegenüber der alleinigen medizinischen Behandlung der hochgradigen, symptomatischen ACI-Stenose klar belegt [1, 2, 4, 5, 16]. Eine Analyse der Daten der wesentlichen randomisierten Studien (NASCET, ECST, VA309) hat bestätigt, dass die CEAbei symptomatischen Patienten mit einer hochgradigen ACI-Stenose (70–99%) das Risiko für einen ipsilateralen Schlaganfall bzw. das Risiko von einem invalidisierenden, ipsilateralen Schlaganfall um 16 bzw. 7% reduziert [
15]. Das Resultat für dieses Kollektiv von insgesamt 589 operierten Patienten (total 1095) war statistisch hochsignifikant gewesen (p <0,001). Die gleiche Analyse zeigte eine kleinere, jedoch noch signifikante (p = 0,04) Risikoreduktion von 4,6% (ipsilateraler Schlaganfall) und 2,3% (invalidisierender oder fataler, ipsilateraler Schlaganfall) bei 828 operierten Patienten (total 1549) mit einer mittelgradigen (50–69%), symptomatischen Stenose. Patienten mit einer leichtgradigen ACI-Stenose haben von dem Eingriff hingegen gar nicht profitiert. Diese Daten sind in Tabelle 2 zusammengefasst.
Tabelle 2.
Verminderung des Schlaganfall-Risikos durch CEA verglichen mit der konservativen Behandlung [
15].
Tabelle 2.
Verminderung des Schlaganfall-Risikos durch CEA verglichen mit der konservativen Behandlung [
15].
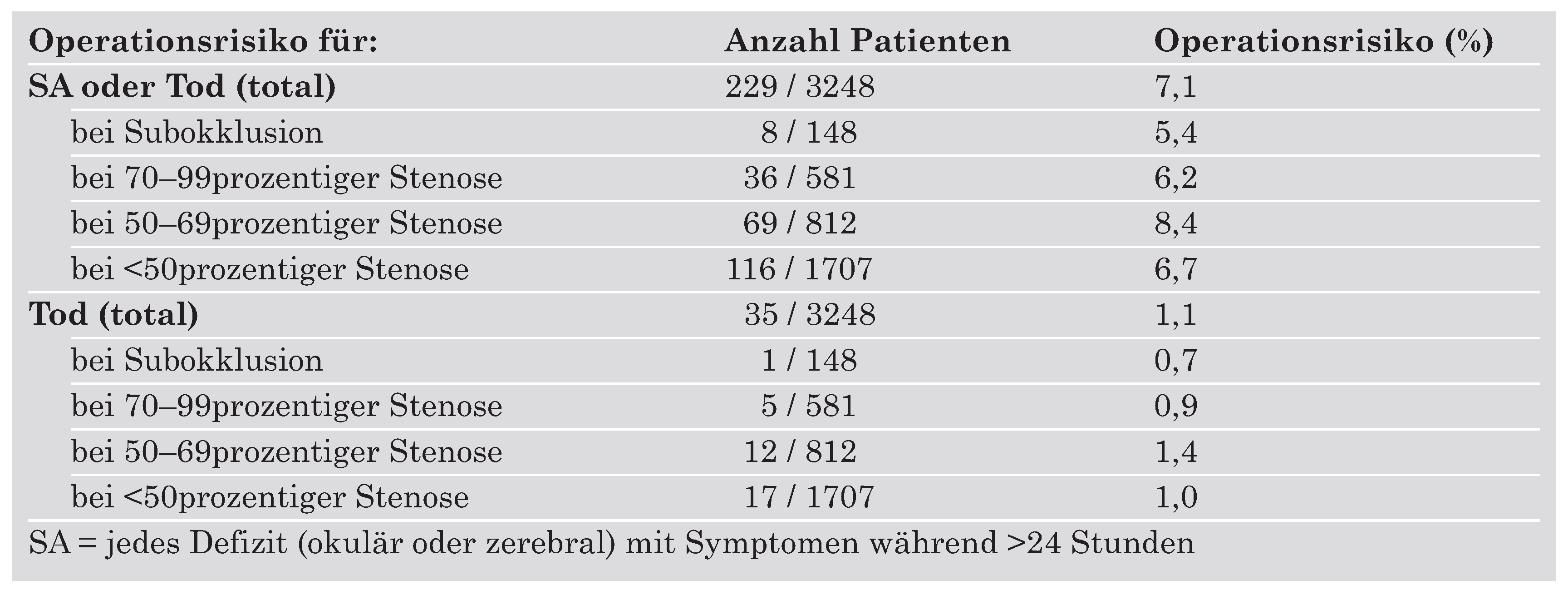
Das operationsbedingte Risiko für Schlaganfall oder Tod unterschieden sich in den NASCET-, ECST- und VA309-Studien sowie unter den verschiedenen Stenosegrad-Gruppen nicht signifikant. Das Operationsrisiko für Schlaganfall und Tod für die gepoolten Patienten dieser drei wesentlichen Studien ist in Tabelle 3 zusammengefasst und betrug 7% (Mortalität 1%).
Tabelle 3.
Risiko der CEA: Schlaganfall (SA) und Mortalität in den ersten 30 postoperativen Tagen [
15].
Tabelle 3.
Risiko der CEA: Schlaganfall (SA) und Mortalität in den ersten 30 postoperativen Tagen [
15].
Zwei grosse, randomisierte Studien untersuchten den hypothetischen Vorteil der CEA gegenüber der besten medizinischen Behandlung allein bei asymptomatischen Patienten [3, 19]. Die erste zeigte in einem Kollektiv von 1662 Patienten mit asymptomatischer, über 60prozentiger ACI-Stenose ein 5-Jahres-Risiko für Schlaganfall und Tod von 11% unter medizinischer Behandlung verglichen mit 5,1% nach CEA. Das operative Risiko für Schlaganfall und Tod war in dieser Studie, verglichen mit den Vorgängerstudien bei symptomatischen Patienten, sehr klein, und betrug nur 2,3%. Die zweite Studie zeigte in einem Kollektiv von 3120 Patienten jünger als 75 Jahre mit einer asymptomatischen, >70prozentigen Stenose, ein 5-Jahres-Schlaganfall-Risiko von ca. 12% ohne CEA(davon die Hälfte der Schlaganfälle invalidisierend) gegenüber 6% in der CEA-Gruppe (3,1prozentiges Risiko für perioperativen Schlaganfall und Mortalität eingeschlossen) (p <0,0001 bzw. 0,004 für invalidisierende Schlaganfälle).
Die aktuellen Indikationen für eine CEA Für die Stellung der Operationsindikation im individuellen Fall muss man (1.) das individuelle Schlaganfall-Risiko (siehe Abb. 1), (2.) die Lebenserwartung und (3.) das Operationsrisiko, abhängig vom Patienten und von der Qualität der Operation [14, 20], berücksichtigen. Die entsprechenden Richtlinien für die Indikation zur CEA sind in Tabelle 4 zusammengefasst [
21].
Tabelle 4.
Richtlinien für die Indikation zu einer CEA [
21].
Tabelle 4.
Richtlinien für die Indikation zu einer CEA [
21].
Die «mikrochirurgische» CEA: die Berner Erfahrung
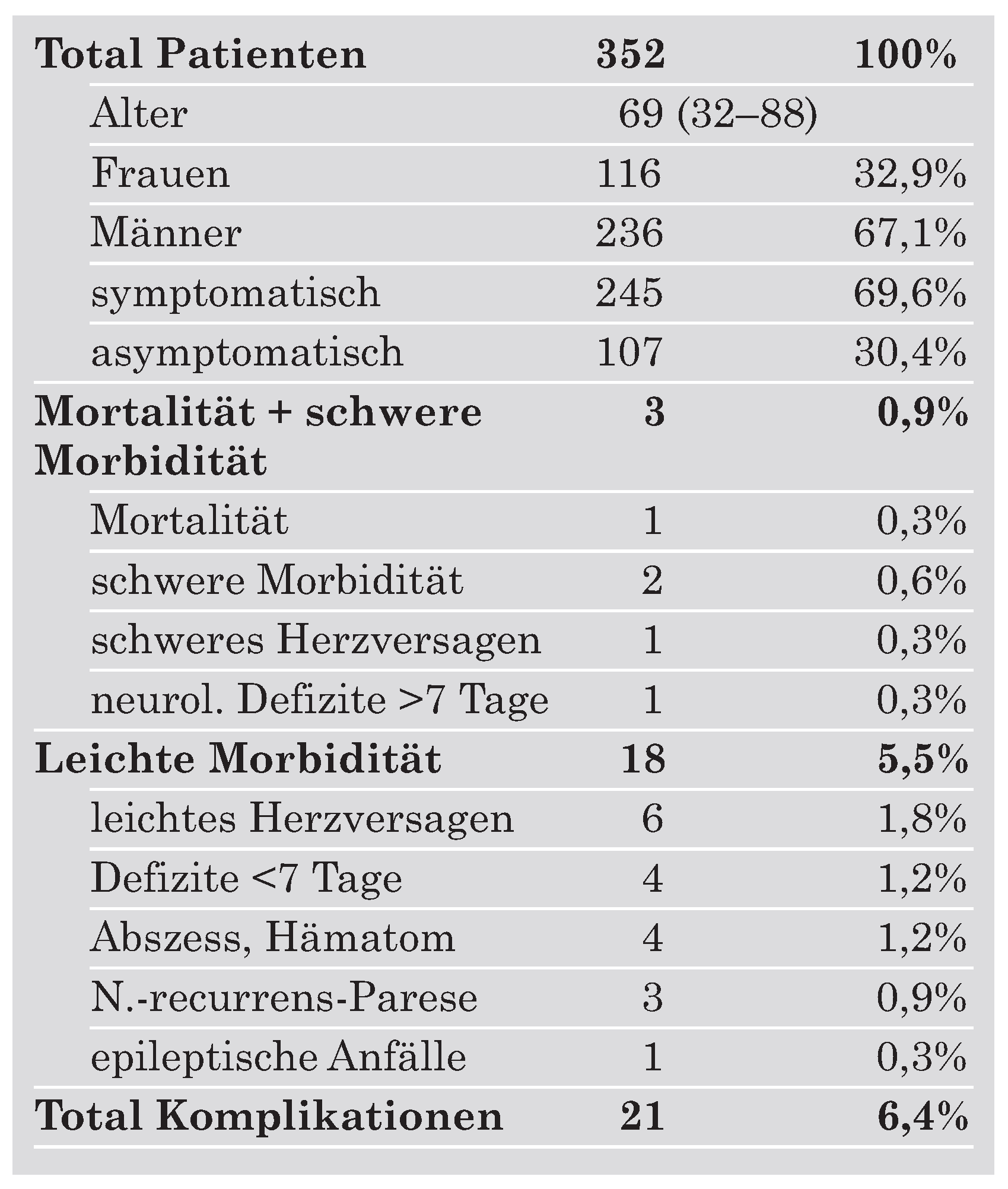
Die Resultate von operativen Eingriffen variieren bekanntlich von Zentrum zu Zentrum teilweise erheblich. Die Kenntnis der Resultate eines bestimmten Eingriffs in einem bestimmten Zentrum ist gerade für prophylaktische Eingriffe wie die CEA sehr wichtig, um die Operationsindikation möglichst patientengerecht zu stellen. Seit Jahren verfolgen wir prospektiv, in Zusammenarbeit mit den neurologischen Kollegen des neurovaskulären Ultraschallabors, unsere Resultate mit der sogenannten mikrochirurgischen Endarterektomie [10, 20] (Tab. 5).
Tabelle 5.
Perioperative Komplikationen (erste 30 postoperative Tage) der mikrochirurgischen CEA bei 352 konsekutiven Patienten operiert zwischen Mai 1998 und Februar 2005 in der Klinik für Neurochirurgie am Inselspital, Bern.
Tabelle 5.
Perioperative Komplikationen (erste 30 postoperative Tage) der mikrochirurgischen CEA bei 352 konsekutiven Patienten operiert zwischen Mai 1998 und Februar 2005 in der Klinik für Neurochirurgie am Inselspital, Bern.
Die Häufigkeit von schwerem Schlaganfall und Tod in der perioperativen Zeit (bis 30 Tage postoperativ) in unserer Serie war mit knapp 1% bedeutend kleiner als in den grossen CEA-Studien. Diese Resultate entsprechen einer Besserung der operativen Technik im Laufe der letzten Jahre mit einer Senkung des Risikos für Schlaganfall und Tod deutlich unter 2% [
11]. Die CEA ist an unserem Zentrum ein standardisierter Eingriff mit einer steilen Lernkurve [
10]. Die Resultate von Tabelle 5 beziehen sich nämlich auf eine konsekutive Serie von Patienten operiert von zwei Chirurgen (A. B. und L. M.) ohne Ausschluss der Lernphase. Der Eingriff wird in Intubationsnarkose unter kontinuierlichem, transkraniellem Doppler-Monitoring der Flussgeschwindigkeiten der ipsilateralen A. cerebri media (ACM), durchgeführt. Verschiedene Massnahmen werden getroffen, um das Risiko von zerebrovaskulären Ereignissen zu vermindern. Bereits vor der Vorbereitung der Gefässe wird Heparin (100 IE/kg KG) i.v. verabreicht. Während der Abklemmphase, zur Verminderung des zerebralen Sauerstoffbedarfs, wird die intravenöse Anästhesie unter EEG-«burst-suppression» mit Propofol vertieft. Ein überbrückender Shunt während der Abklemmphase wird nur bei signifikantem Abfall der Flussgeschwindigkeit in der ACM (um mehr als 60%) eingeführt; der Shunt ist somit in nur ca. 25% der Patienten notwendig. Nach Entfernung der Plaque wird das Gefässlumen unter dem Operationsmikroskop inspiziert und von potentiellen Emboliequellen befreit. Anschliessend, immer unter mikroskopischer Sicht, wird die Arteriotomie mit einer primären Gefässnaht verschlossen, so dass eine Erweiterungsplastik nicht notwendig ist.
Ein Vergleich zwischen CEA und endovaskulärer Behandlung
Zwei unterschiedliche Behandlungsmethoden
Die CEA erlaubt die Behebung der Stenose durch die Entfernung der Embolie-Quelle; das Stenting erlaubt die Behebung der Stenose durch Auspressen der Embolie-Quelle und Einbau eines Fremdkörpers, um die Gefäss-Dilatation zu stabilisieren.
Durch die temporäre Abklemmung der ACI am Anfang der CEA wird die Emboliegefahr früh, bevor eine wesentliche Manipulation der Emboliequelle stattgefunden hat, während des Eingriffs unterbunden. Die endovaskuläre Behandlung bedingt als erster Schritt die Führung des Katheters durch die Stenose, um distal davon den Protektionsschirm zu entfalten. Die Emboliegefahr durch diese Manipulation steigt proportional mit dem Grad der Gefässeinengung und mit der Gefährlichkeit der Plaque. Gerade die Patienten, die von der prophylaktischen Behandlung am meisten profitieren sollten, d.h. Patienten mit einer hochgradigen Stenose nach kürzlich stattgehabter arterioarterieller Embolie, sind theoretisch am meisten gefährdet.
Durch die CEA wird kein Fremdmaterial ausser das Nahtmaterial eingeführt. Eine Reintervention an gleicher Stelle, z.B. bei Rezidiv-Stenose, wird bei Zustand nach Einlage eines metallischen Stents viel problematischer.
Nach einer CEA sind sowohl sonographische und als auch kernspintomographische Untersuchungen frei von Artefakten möglich. Diese beiden nicht-invasiven Untersuchungsmethoden werden nach Einbau eines metallischen Stents qualitativ einschränkt oder gar verunmöglicht; ein klarer Nachteil in der postinterventionellen Nachsorge.
Die Datenlage
Die endovaskuläre Behandlung der ACIStenose hat, wie die CEA, eine lange Vorgeschichte. Die inakzeptable Komplikationsrate durch thromboembolische Ereignisse, welche zum Abbruch der zwei ersten Vergleichsstudien führte [22, 23], ist durch die Einführung eines distalen Schutzsystems wesentlich verbessert worden [
24]. Die CAVATAS-1-Vergleichsstudie wurde aus verschiedenen Gründen (z.B. die Patientenselektion und die Inhomogenität der angewandten endovaskulären Technik) zurecht kritisiert. Die Resultate sowohl der endovaskulären als auch der chirurgischen Behandlung waren, verglichen mit denen der grossen CEA-Studien, viel schlechter (Tab. 7). Die kürzlich veröffentlichte, multizentrische, randomisierte SAPPHIRE-Studie [
25] (Tab. 6) verdient hingegen eine detailliertere Analyse. Im Rahmen dieser randomisierten Studie wurden 334 sogenannte CEA-Hochrisiko-Patienten entweder mit Stenting (mit intraoperativem Schutzschirm) oder mit CEA behandelt. Es wurden nur Patienten eingeschlossen, die mindestens eines der folgenden Kriterien erfüllten: (1.) signifikante Herz- oder (2.) Lungenkrankheit, (3.) kontralateraler ACI-Verschluss, (4.) Alter >80 Jahre, (5.) kontralaterale Parese des N. recurrens oder (6.) ein Status nach Hals-Dissektion oder Radiotherapie, und (7.) Rezidiv-Stenose nach CEA. Als perioperative Komplikation während den ersten 30 Tagen postinterventionell traten Schlaganfall oder Tod in 4,8% der endovaskulär behandelten Patienten und in 5,6% der CEA-Patienten auf. Dieser statistisch nicht signifikante Unterschied (p = 0,36) führte die Autoren zu den Schlussfolgerungen, (1.), dass die zwei Behandlungsmethoden in dieser Patientenpopulation gleichwertig seien und (2.), dass die endovaskuläre Behandlung aufgrund ihrer geringeren Zugangsmorbidität, die Behandlung der ersten Wahl für CEA-Hochrisiko-Patienten werden sollte. Das grösste Problem mit dieser Studie ist u.E. die Patientenselektion: über 70% der Patienten hatten eine
asymptomatische, hochgradige ACIStenose. Ein Behandlungsrisiko von Schlaganfall und Tod von 4,8%, bzw. 5,6% ist bereits zu hoch, um diesen Patienten überhaupt eine invasive Behandlung zu empfehlen [3, 19]. Mit einer solchen Komplikationsrate würden wir diesen Patienten keine CEA empfehlen. Eine Komplikationsrate von 4,8% in der endovaskulär behandelten Gruppe scheint auch deswegen sehr hoch, weil die endovaskuläre Behandlung von asymptomatischen Stenosen (bedingt durch in der Regel glatte, nicht ulzerierte Plaques) weniger gefährlich sein sollte als die von symptomatischen Stenosen. Ein weiteres Problem mit dieser Studie ist die Wahl von Rezidiv-Stenosen, Status nach Radiotherapie und Status nach Hals-Dissektion als Einschlusskriterien. An unserem Zentrum werden Patienten mit einem der 3 obenerwähnten CEA-Hochrisiko-Kriterien systematisch endovaskulär behandelt. Diese verbreitete Praxis erklärt, warum in der SAPPHIREStudie mehr Patienten ausser Protokoll in das endovaskuläre Register eingeschlossen wurden als in die Studie selber. Patienten mit den übrigen sogenannten CEA-Hochrisikofaktoren, vor allem diejenigen Patienten mit einem kontralateralen ACI-Verschluss und einem Alter >80 Jahre, werden hingegen in unserem sowie in anderen Zentren mit geringerem Risiko durch CEA behandelt [20, 26]. Ein potentiell wichtiger, aber noch unklarer Befund der SAPPHIRE-Studie ist das hohe, kombinierte Risiko für Schlaganfall + Herzinfarkt + Tod nach 30 Tagen + ipsilateralem Schlaganfall und Tod mit neurologischer Ursache nach 1 Jahr, vor allem nach CEA(20,1%) aber auch nach Angioplastie (12,2%, p = 0,04 für den Unterschied). Dieser Unterschied, der ausschliesslich bei Patienten mit einer asymptomatischen Stenose massiv und statistisch signifikant war (9,9% nach CEA versus 21,5% nach Stenting, p = 0,02), war allerdings vor allem durch die höhere Inzidenz von nicht-Q-Wellen-Myokardinfarkten in der CEA-Gruppe (6,2%) gegenüber der endovaskulären Gruppe (3%, p = 0,04) bedingt. Die klinische Bedeutung dieser in ACI-Stenose-Studien erstmals verwendeten Endpunkte ist noch unklar. Klar ist allerdings, dass, wenn diese Komplikationen tatsächlich relevant wären, Patienten mit asymptomatischen ACI-Stenosen nicht mehr invasiv, d.h. weder endovaskulär noch chirurgisch, behandelt werden sollten.
Tabelle 6.
Resultate der SAPPHIREStudie [
25]. Die Resultate der bisher einzigen, randomisierten Vergleichsstudie zwischen Stenting und CEA bei Patienten mit einem erhöhten Risiko für die CEA zusammengefasst. Die Komplikationsrate war für diese meistens (>70%) asymptomatischen Patienten viel höher als das Risiko des natürlichen Verlaufs unter medizinischer Behandlung (Schlaganfall-Risiko: 2–3% pro Jahr).
Tabelle 6.
Resultate der SAPPHIREStudie [
25]. Die Resultate der bisher einzigen, randomisierten Vergleichsstudie zwischen Stenting und CEA bei Patienten mit einem erhöhten Risiko für die CEA zusammengefasst. Die Komplikationsrate war für diese meistens (>70%) asymptomatischen Patienten viel höher als das Risiko des natürlichen Verlaufs unter medizinischer Behandlung (Schlaganfall-Risiko: 2–3% pro Jahr).
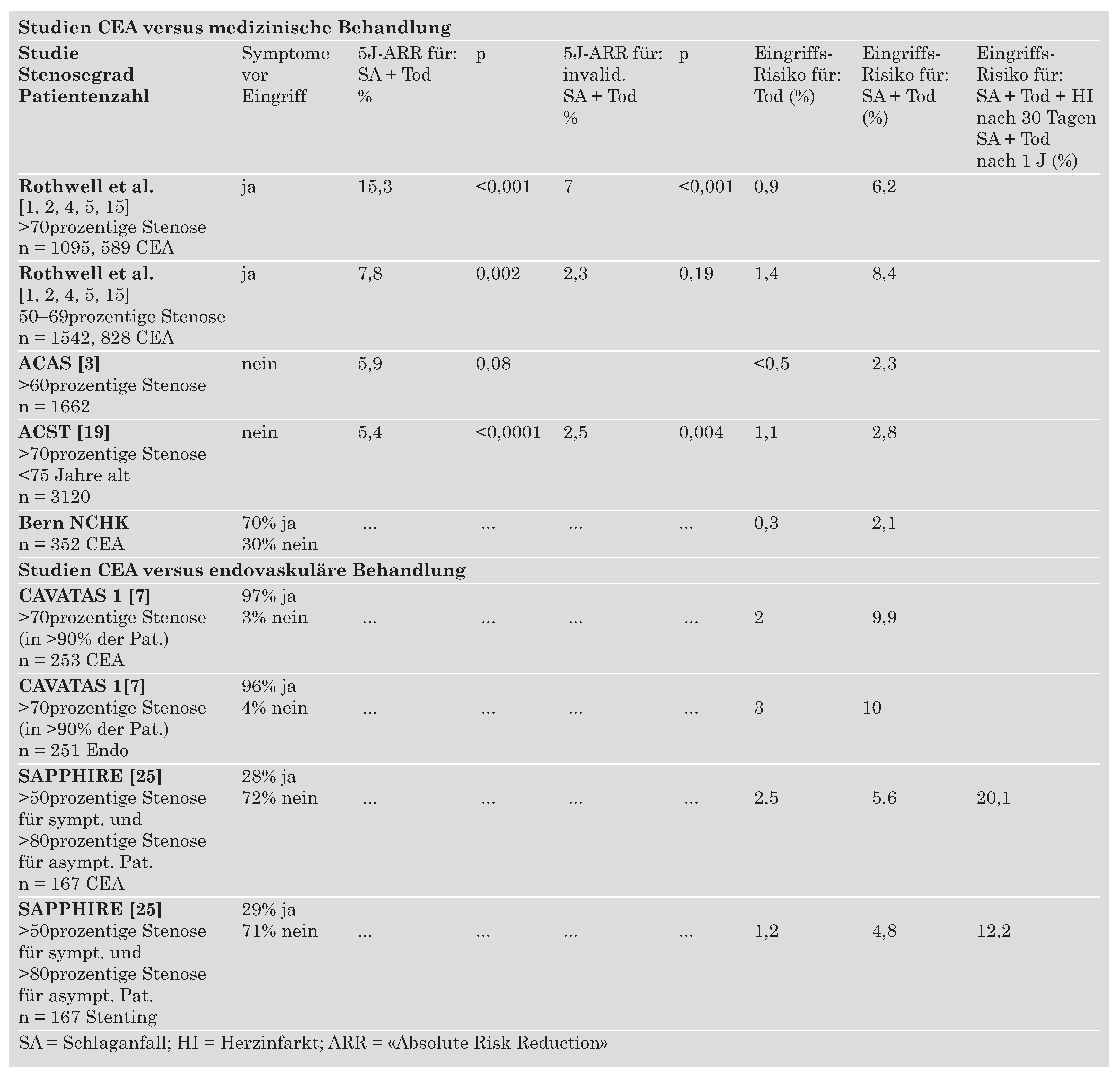
Tabelle 7.
Resultate der wesentlichen CEA- und Angioplastie-Studien sowie unserer CEA-Serie, im Quervergleich.
Tabelle 7.
Resultate der wesentlichen CEA- und Angioplastie-Studien sowie unserer CEA-Serie, im Quervergleich.
In Tabelle 7 sind die Resultate der grossen CEA-Studien, der zwei bisher veröffentlichten Stenting-Studien und unserer Serie von mikrochirurgischen CEA zusammengefasst.
Die postoperative Mortalität nach CEAist gemäss den wichtigsten CEA-Studien gering, tendenziell unter 1%. Die Mortalität der endovaskulären Behandlung und der CEA in den kleineren Stent-versus-CEA-Studien ist hingegen mit 1–3% tendenziell höher. Die Morbidität der endovaskulären Behandlung und der CEA in der CAVATAS-1-Studie ist wesentlich höher als in den CEA-Schlüsselstudien (NASCET, ECST, VA309) und in unserer Serie. Das gleiche gilt für die SAPPHIRE-Studie im Vergleich mit den Referenz-Studien über asymptomatische, hochgradige Stenosen (ACASund ACST-Studie). Wenn man den neuen Endpunkt, der in der SAPPHIRE-Studie erstmals verwendet wurde, betrachtet, wird klar, dass die Komplikationsrate (12,2% für Stenting und 20,1% für die CEA) während dem ersten postoperativen Jahr bei diesen meistens asymptomatischen Patienten höher als das natürliche Risiko unter medizinischer Behandlung ist.
Invasiv versus nicht invasiv?
Ist die CEA eine invasive und die endovaskuläre Behandlung eine nicht-invasive Methode? Die Antwort ist nein. Die wesentliche Morbidität beider Behandlungsmethoden entsteht nicht durch den Zugang, sondern durch die Manipulationen am corpus delicti. Die schmerzfreie Narbe am Hals spielt für Patienten in dieser Altersgruppe so gut wie keine Rolle. Die Morbidität des operativen Zugangs (Hämatome, Infekte, Parese des N. recurrens oder Hypoglossus) ist zwar häufiger nach CEA als bei endovaskulärer Behandlung (Hämatome oder Pseudoaneurysmata an der Punktionsstelle), sie ist aber selten relevant und sehr selten mit bleibenden Konsequenzen verbunden. Wir denken allerdings nicht, dass die Zugangs-Morbidität in der Wahl der Behandlungsmethode von entscheidender Bedeutung ist.
Rezidiv-Stenose nach CEA und Stenting
Das Rezidiv-Risiko nach Stenting scheint höher als nach CEA. Die Daten sind aber nicht konklusiv. In unserer Serie mussten knapp 1% der Patienten wegen einer hochgradigen Rezidiv-Stenose behandelt werden. In einer grossen CEA-Serie fand sich eine hochgradige Rezidiv-Stenose nur in 0,6% der Patienten [
11]. Ein höhere, 5prozentige Inzidenz von behandlungsbedürftigen Rezidiv-Stenosen nach Stenting wurde kürzlich beschrieben [
27]. Die laufenden, multizentrischen, randomisierten Studien sollten diesbezüglich klarere Daten liefern.
Schlussfolgerung
Die beste und häufigste Indikation für die invasive Behandlung der ACI-Abgangstenose besteht bei Patienten mit einer symptomatischen, hochgradigen Stenose (70–99%) und einer Lebenserwartung von mehr als 2 Jahren. Für diese Patienten ist die Karotis-Endarterektomie mit einem Morbiditäts- und Mortalitätsrisiko unter 7% die Behandlung der ersten Wahl. Unter der Auflage eines Morbiditätsund Mortalitätsrisikos unter 3% kann die Indikation zur CEA auf Patienten mit einer mindestens 2jährigen Lebenserwartung und einer mittelgradigen (50–69%), symptomatischen Stenose und auf Patienten mit einer mindestens 5jährigen Lebenserwartung und einer hochgradigen, asymptomatischen Stenose erweitert werden. Aufgrund der aktuellen Datenlage und von theoretischen Überlegungen ist das endovaskuläre Stenting mit Anwendung des distalen Protektionsschirmes eine Alternative zur CEAin ausgewählten Patienten, bei denen das Risiko der CEA, vor allem aus internistischen Gründen, zu gross erscheint. Die drei laufenden, multizentrischen Vergleichsstudien werden in den nächsten Jahren den Platz der endovaskulären Behandlung der ACI-Abgangsstenose besser definieren.