Summary
Lowering LDL-cholesterol in patients with high risk for cardiovascular diseases nowadays is absolutely undebated. Clinical trials with statins have shown that the more LDLcholesterol is lowered the greater the obtained benefit is. The drugs of choice for LDL-cholesterol lowering are the various statins which either in their highest dose or in combination with ezetimibe in most incidences allows to achieve the required target values. Apart from LDL lowering the increase in HDL is of growing importance. Lowering of LDL-cholesterol is usually associated with a reduction in clinical endpoints of about 30%, while preliminary studies suggest as much as 90% reduction by the combination of decrease in LDL- and increase in HDL-cholesterol. Increasing HDL may be achieved by fibrates or a new form of nicotinic acid with delayed effect, the infusion of reconstituted HDL, apo A-I or apo A-I-Milano, inhibition of the cholesterol ester transfer protein or the inhibition of the cannabinoid receptor 1. The combination of these drugs with statins promise to further improve the prevention of cardiovascular diseases in patients at high risk by drug therapy.
Zusammenfassung
Die Senkung des LDL-Cholesterins bei Patienten mit hohem Risiko für kardiovaskuläre Ereignisse ist heute absolut unbestreitbar. Die klinischen Studien mit Statinen haben dabei ergeben, dass, je tiefer der LDL-Cholesterinwert gesenkt wird, desto grösser der Nutzen für den Behandelten wird. Medikamente der Wahl sind dabei die verschiedenen Statine, die in Höchstdosierung oder in Kombination mit Ezetimibe die Erreichung der geforderten Zielwerte grösstenteils gestatten. Neben der Senkung von LDL-Cholesterin wird aber immer deutlicher, dass der Erhöhung tiefer HDLCholesterinwerte eine ebenso grosse Bedeutung zukommt. Während die LDL-Cholesterinsenkung eine relative Verminderung der klinischen Endpunkte für kardiovaskuläre Ereignisse von durchschnittlich 30% bewirkt, stellt die gleichzeitige Senkung von LDL-Cholesterin und Erhöhung von HDL-Cholesterin in ersten Studien eine relative Risikoverminderung um 90% in Aussicht. Zur Erhöhung der HDL-Cholesterinkonzentration kommen Fibrate, eine neue Form der Nikotinsäure mit verzögerter Wirkung sowie neue Therapien wie die Infusion von rekonstituiertem HDL, Apo-A-I bzw. Apo-A-I-Milano, die Inhibition des Cholesterinester-Transferproteins oder die Inhibition des Cannabinoid-Rezeptors 1 in Frage. Kombinationen dieser Medikamente mit Statinen lassen für die Zukunft weitere Verbesserungen der medikamentösen Prävention bei Patienten mit hohem Risiko für kardiovaskuläre Krankheiten erwarten.
Einführung
Die Einführung und klinische Erprobung der Statine haben Lipide und Lipoproteine als kardiovaskuläre Risikofaktoren und ihre Beeinflussung zur Senkung des koronaren Risikos in den Brennpunkt nicht nur der Atheroskleroseforschung, sondern auch des klinischen Alltags gerückt. Der Nutzen der Statin-Behandlung bei Patienten mit hohem Risiko für kardiovaskuläre Ereignisse ist mittlerweile absolut unbestritten. Bei Risikopatienten stellt sich heute nicht mehr die Frage, ob eine lipidregulierende Therapie angezeigt ist, sondern vielmehr stellen sich die folgenden Fragen:
- -
Wie tief sollte der LDL-Cholesterinwert gesenkt werden?
- -
Wie lassen sich derartige Zielwerte erreichen?
- -
Sind alle Statine gleich?
- -
Ist das LDLCholesterin das einzige therapeutische Ziel?
- -
Welchen Stellenwert haben andere lipidmodulierende Therapien?
Wie Tief Sollte der LDL-Cholesterinwert Gesenkt Werden?
Dass tiefere LDL-Cholesterinwerte mit weniger koronaren Ereignissen einhergehen, wurde in der 4S-Studie [
1] erstmals gezeigt und in weiteren Untersuchungen wie der PostCABG-Studie [
2] und der Heart-ProtectionStudy [
3] bestätigt. Die Überlegenheit der aggressiven Cholesterinsenkung wurde auch in der ALLIANCE-Studie [
4] festgestellt. Der ultimative Beweis, dass tieferes LDL-Cholesterin in der Tat besser ist, wurde in der kürzlich veröffentlichten TNT-Studie (Treat To New Targets) [
5] erbracht. In dieser Untersuchung wurden 10,001 Patienten randomisiert mit Atorvastatin 10 oder 80 mg/Tag während 5 Jahren behandelt. Dabei wurde ein mittlerer LDL-Cholesterinwert von 2.6 mmol/l in der Gruppe mit der niedrigen Dosierung und ein solcher von 1.8 mmol/l in der hochdosierten Gruppe erreicht. Die Senkung von LDL-Cholesterin auf durchschnittlich 1.8 mmol/l war mit einer 22prozentigen Senkung des relativen Risikos assoziiert, die absolute Risikoreduktion betrug 2.2%. Die Gesamtmortalität war allerdings zwischen den beiden Gruppen nicht signifikant verschieden, da die Studie nicht dazu ausgelegt war. Dies hätte eine Anzahl von mindestens 17,000 Patienten benötigt.
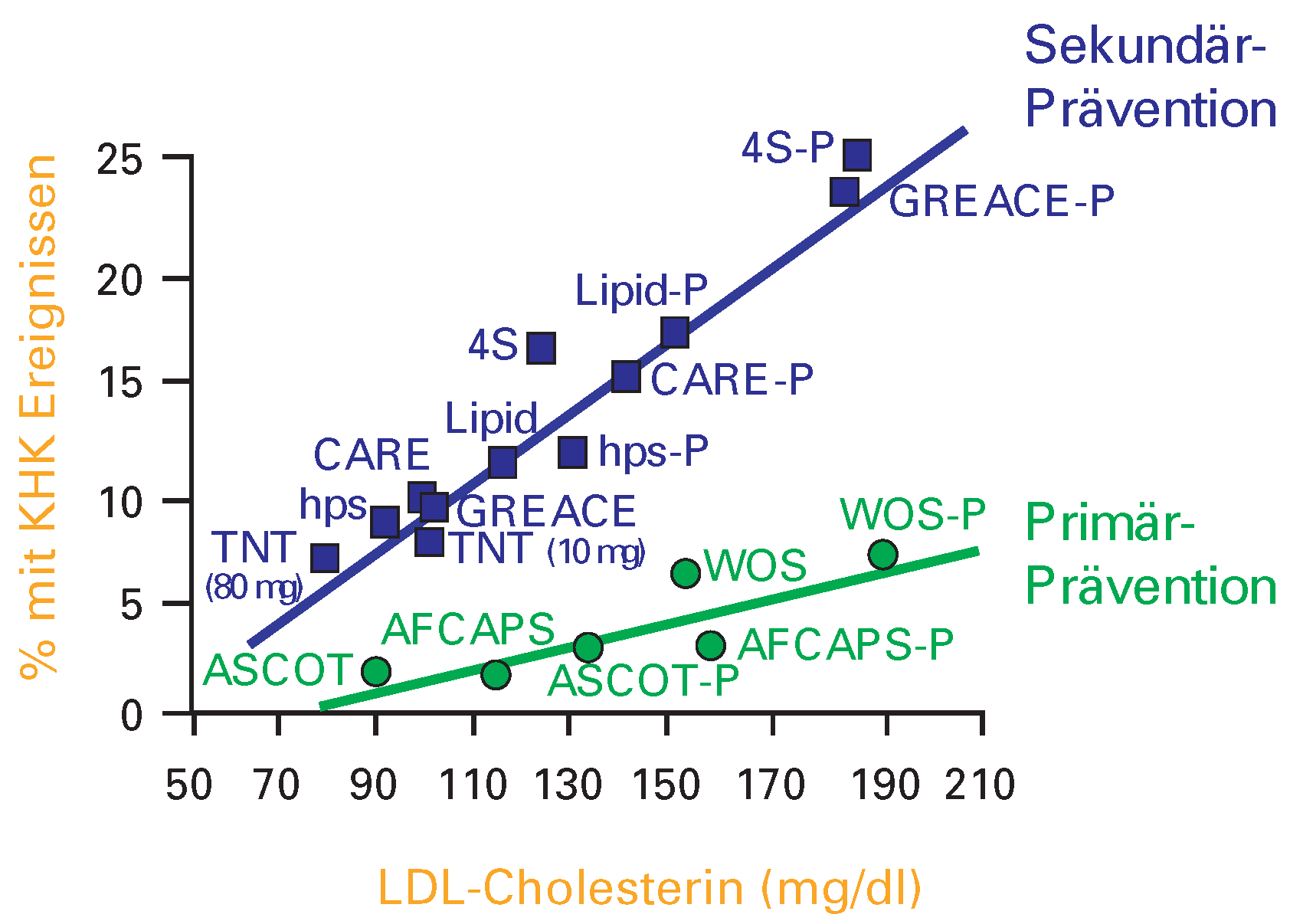
Aus den heute zur Verfügung stehenden Daten lässt sich aufgrund des Ausgangswerts und der Senkung von LDL-Cholesterin die Reduktion kardiovaskulärer Ereignisse voraussagen (
Figure 1). Die Frage, wie tief LDL-Cholesterin tatsächlich im Einzelfall gesenkt werden muss, ist noch nicht eindeutig beantwortet. Allerdings deuten die neueren Studien daraufhin, dass zumindest bei Hochrisikopatienten ein LDL-Cholesterinwert unter 2.0 mmol/l anzustreben ist. Vermutlich liegt der physiologische LDL-Cholesterinwert sogar bei 1.5 mmol/l.
Wie Lassen Sich Derartige Zielwerte Erreichen?
Bei äquipotenter Dosis weisen alle Statine eine ähnliche LDL-Cholesterinsenkung auf. Bei fixer oder zugelassener Dosierung zeigen sich jedoch wesentliche Unterschiede. Bei dieser Dosierung rangiert die Wirkung auf LDLCholesterin zwischen 17% mit Fluvastatin bei 20 mg/Tag bis 38% mit Atorvastatin 10 mg/Tag [
6]. Ähnliche Daten wurden in der STELLARUntersuchung festgestellt. Die LDL-Cholesterinsenkung variierte zwischen 20% mit Pravastatin 10 mg/Tag bis 55% mit Rosuvastatin 40 mg/Tag (
Table 1) [
7]. Diese Unterschiede wurden in einer Metaanalyse mit 264 Studien, welche im Jahr 2003 publiziert wurde, bestätigt [
8]. Auch hier zeigten die verschiedenen Statine einen 2–3fachen Unterschied im Ausmass der LDL-Cholesterinsenkung über die verschiedenen Dosierungen.
Table 1.
Prozentuale LDL-Cholesterinsenkung mit 6 verschiedenen Statinen in den zugelassenen Dosierungen [
6,
7].
Table 1.
Prozentuale LDL-Cholesterinsenkung mit 6 verschiedenen Statinen in den zugelassenen Dosierungen [
6,
7].
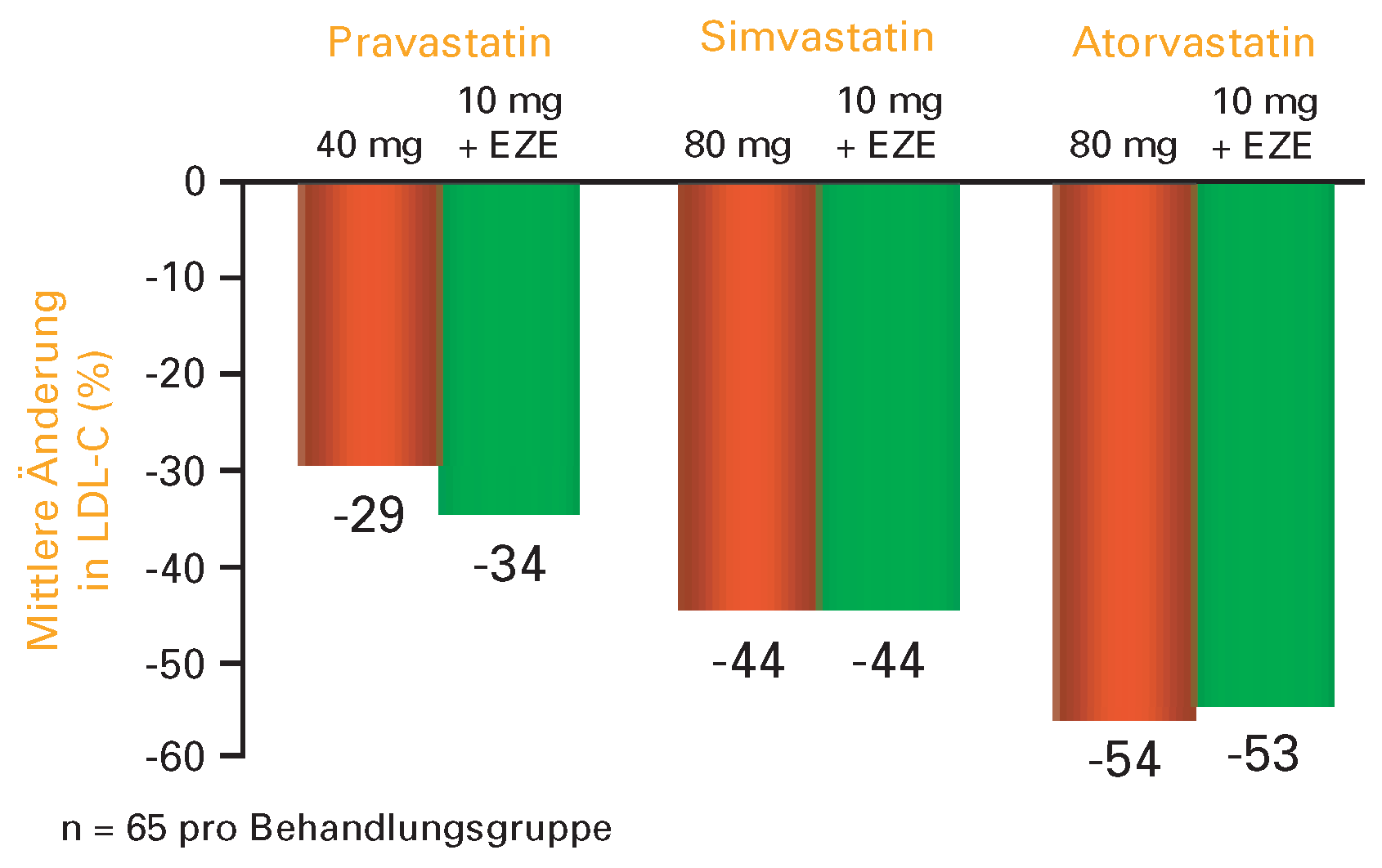
Die wirksamste LDL-Cholesterinsenkung wird jeweils mit der Initialdosis erreicht. Sie betrug in den meisten Studien ca. 30%. Jede Verdoppelung der Dosierung führt nur zu einer weiteren Senkung um 6%, was bei Hochrisikopatienten mit sehr stark erhöhten Werten zu unbefriedigenden Ergebnissen führen kann. Diesen Umständen kann mit der doppelten Wirkungsweise von Ezetimibe in Kombination mit einem Statin begegnet werden. Ezetimibe hemmt selektiv die intestinale Cholesterinresorption und verringert damit das Cholesterinangebot für die Leber. Statine auf der anderen Seite verringern die Synthese von endogenem Cholesterin in der Leber. Diese beiden Mechanismen wirken synergistisch und ergänzen sich damit in der Cholesterinsenkung. Ezetimibe senkt LDL-Cholesterin um ca. 20%, was der dreifachen Verdoppelung einer Statin-Dosierung entspricht (
Figure 2).
Mit dieser Kombination lassen sich die Zielwerte in praktisch allen Fällen erreichen. Allerdings fehlt für die Therapie mit Ezetimibe und Statin im Gegensatz zur hochdosierten Statin-Therapie noch die Evidenz mit klinischen Endpunkten.
Sind Alle Statine Gleich?
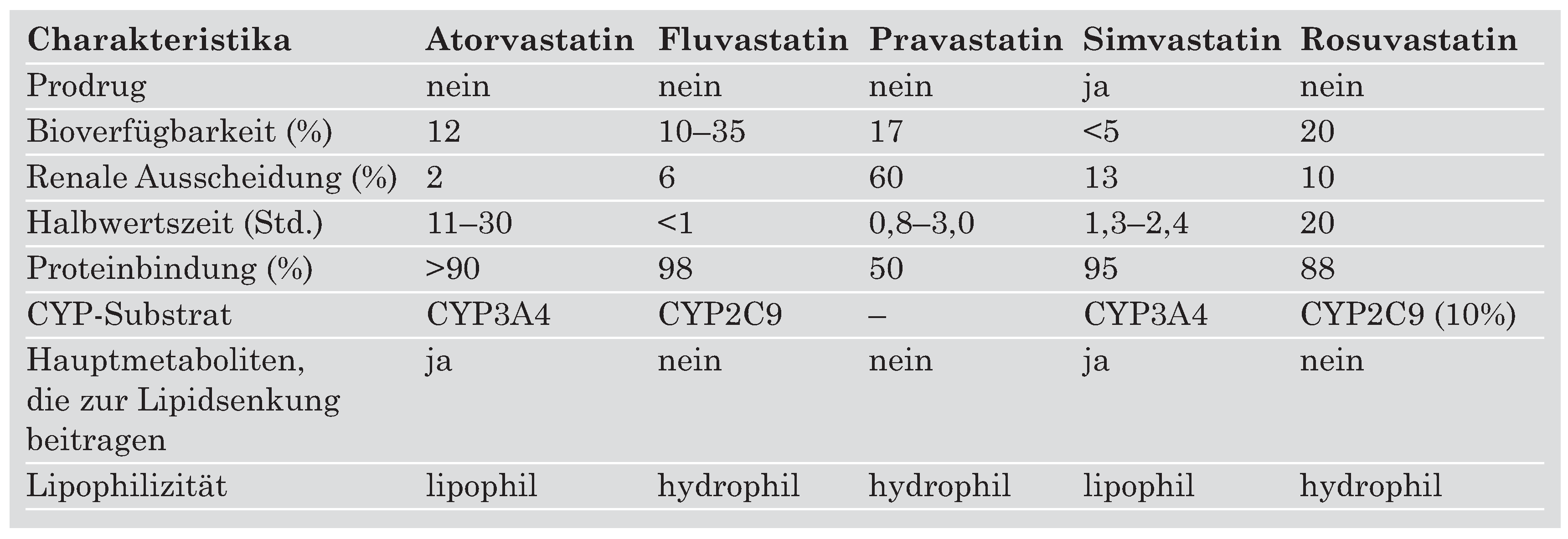
Obschon alle Statine die gleiche Reaktion inhibieren, nämlich die Umwandlung von 3-Hydroxy-3-methylglutaryl-CoA in Mevalonsäure durch die HMG-CoA-Reduktase, zeigen sie Unterschiede in bezug auf ihre Struktur, ihre Effektivität bei der LDL-Cholesterinsenkung und ihre Pharmakokinetik. Die Charakteristika der in der Schweiz zugelassenen Statine sind in
Table 2 enthalten.
Table 2.
Charakteristika der in der Schweiz zugelassenen Statine.
Table 2.
Charakteristika der in der Schweiz zugelassenen Statine.
In Anbetracht der unterschiedlichen Effektivität in bezug auf die Senkung von LDLCholesterin stellt sich die Frage nach deren Konsequenzen in bezug auf die Reduktion klinischer Endpunkte. Dabei muss zwischen «harten» Endpunkten wie Anzahl kardiovaskulärer Ereignisse oder Mortalität an kardiovaskulären Erkrankungen und sogenannten «weichen» Endpunkten wie Änderung in der Intima-Media-Dicke oder dem Volumen an atherosklerotischem Gewebe, wie es durch IVUS (intravaskulärer Ultraschall) gemessen wird, unterschieden werden. Zieht man letzteren zu Hilfe, ergeben sich substanzielle Unterschiede zwischen einzelnen Statinen. In der ASAP-Studie (
Atorvastatin vs.
Simvastatin on
Atherosclerosis
Progression) wurde gezeigt, dass mit der höchsten therapeutischen Dosis von Atorvastatin (80 mg/Tag) die Dicke der arteriellen Wand nach 2 Jahren vermindert wurde, während eine Behandlung mit 40 mg Simvastatin pro Tag während der gleichen Zeit die Arterienwanddicke weiterhin zugenommen hatte [
9]. Ähnliche Resultate wurden auch bei einem Vergleich von Atorvastatin und Pravastatin festgestellt (ARBITER) [
10]. Mit Hilfe der IVUS-Methode wurde eine Reduktion des Volumens der atherosklerotischen Plaque nach 18monatiger Behandlung mit 80 mg Atorvastatin pro Tag beobachtet, während mit 40 mg Pravastatin pro Tag das Volumen der atherosklerotischen Plaque weiterhin zunahm (REVERSAL-Studie) [
11]. Dies wirft die Frage auf, ob die Unterschiede durch die grössere LDL-Cholesterinsenkung mit Atorvastatin bedingt sind oder ob auch andere Unterschiede zwischen den einzelnen Medikamenten, z.B. pleiotrope Wirkungen, eine Rolle spielen. Interessanterweise wurden in der REVERSAL-Studie Unterschiede in der Progression der atherosklerotischen Plaques bei gleicher prozentualer LDL-Cholesterinsenkung festgestellt. Während mit Atorvastatin bei einer Reduktion des LDL-Cholesterinwerts um 40% keine Progression beobachtet wurde, war dies bei gleicher prozentualer LDL-Cholesterinsenkung mit Pravastatin der Fall [
12]. Eine spätere Analyse ergab, dass mit Atorvastatin eine stärkere Senkung des CRP (C-reaktives Protein) (–36,4%) als mit Pravastatin (–5,2%) erreicht wurde, welche den Unterschied erklären könnte. Auch in der PROVE-IT-Studie zeigte sich, dass Patienten, bei welchen sowohl LDL-Cholesterin als auch CRP stark gesenkt wurden, am meisten von der Statin-Therapie profitierten [
13].
Die Erklärung für diese Resultate ist derzeit noch nicht abgeschlossen. Ob es sich tatsächlich um eine antiinflammatorische Wirkung der Statine handelt, ist, angesichts der unterschiedlichen Wirkung der Statine auf andere inflammatorische Parameter, insbesondere Interleukin-6, den Stimulus für CRP, ungewiss. Möglicherweise spielt das CRP selbst eine aktive Rolle bei der Entstehung der Atherosklerose und seine Absenkung durch Statine könnte tatsächlich zu einem zusätzlichen Nutzen beitragen.
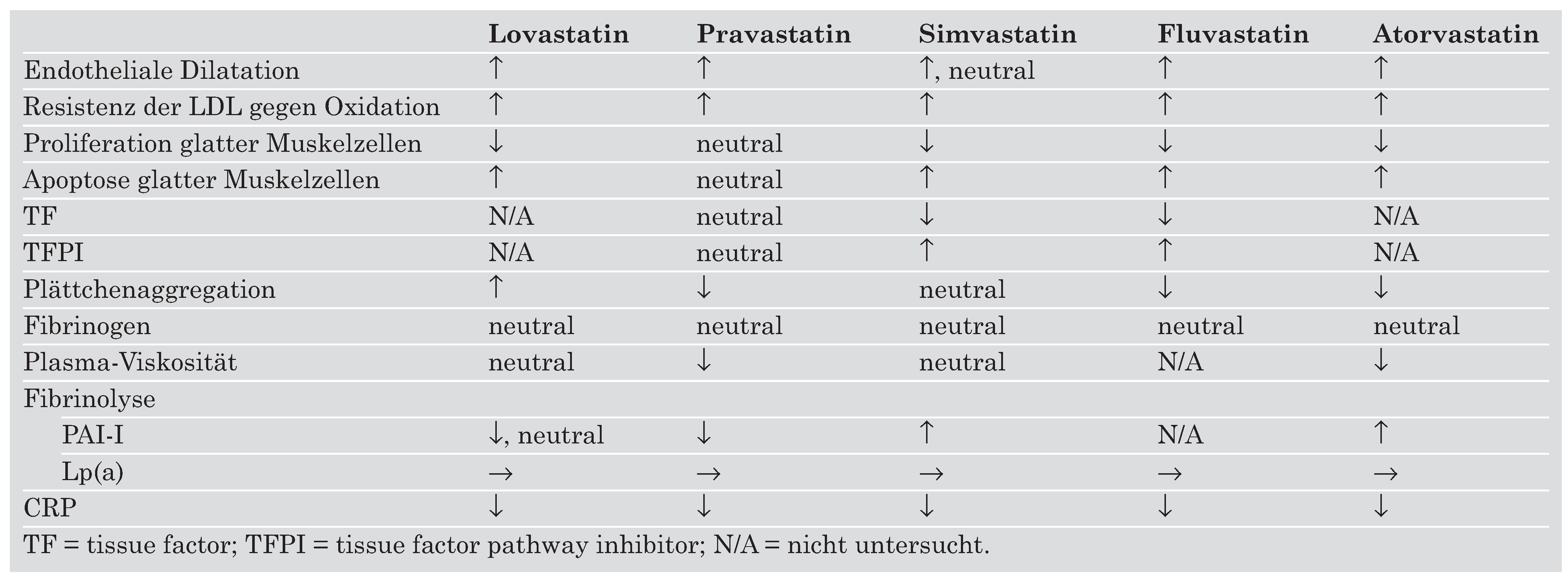
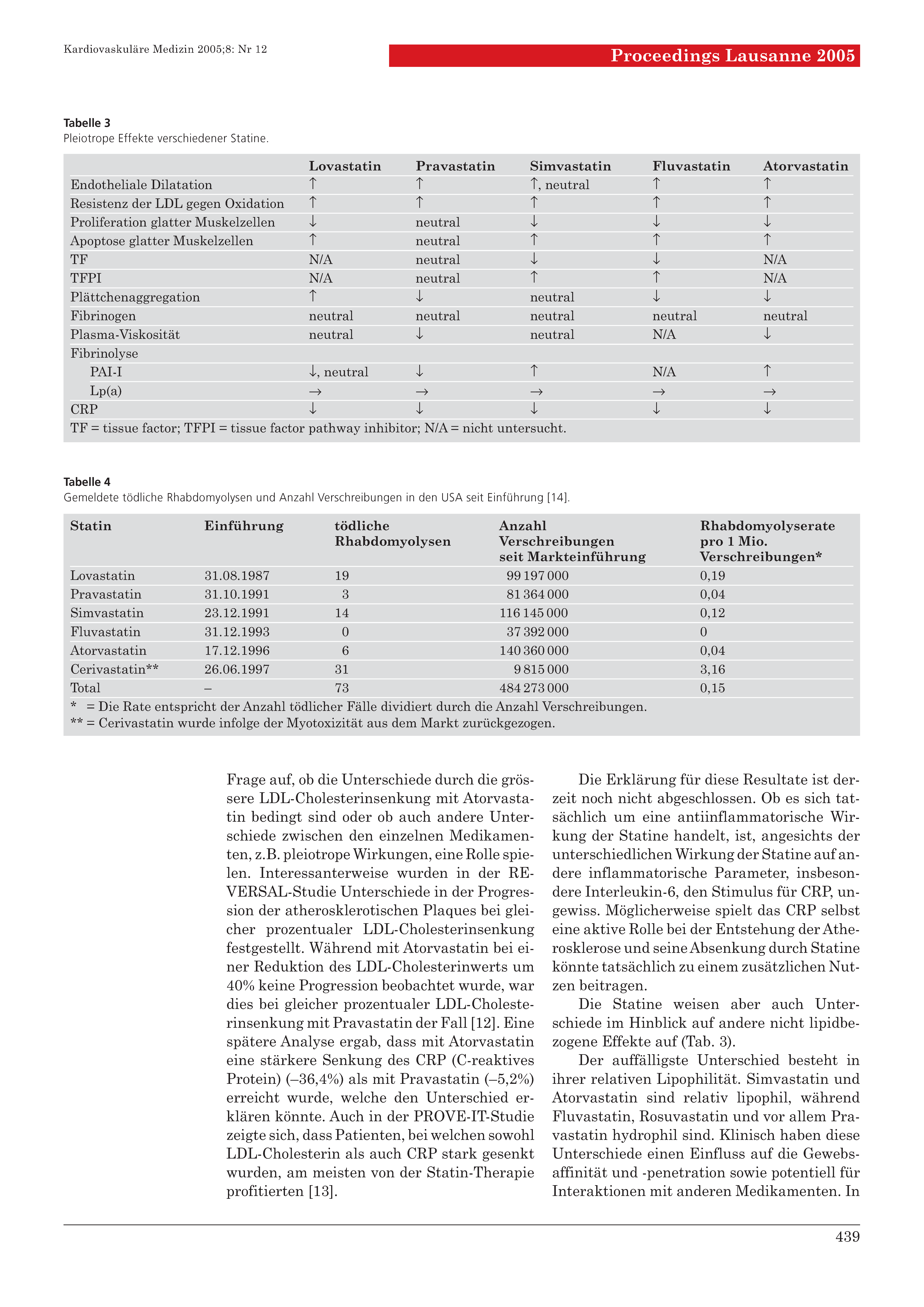
Die Statine weisen aber auch Unterschiede im Hinblick auf andere nicht lipidbezogene Effekte auf (
Table 3).
Table 3.
Pleiotrope Effekte verschiedener Statine.
Table 3.
Pleiotrope Effekte verschiedener Statine.
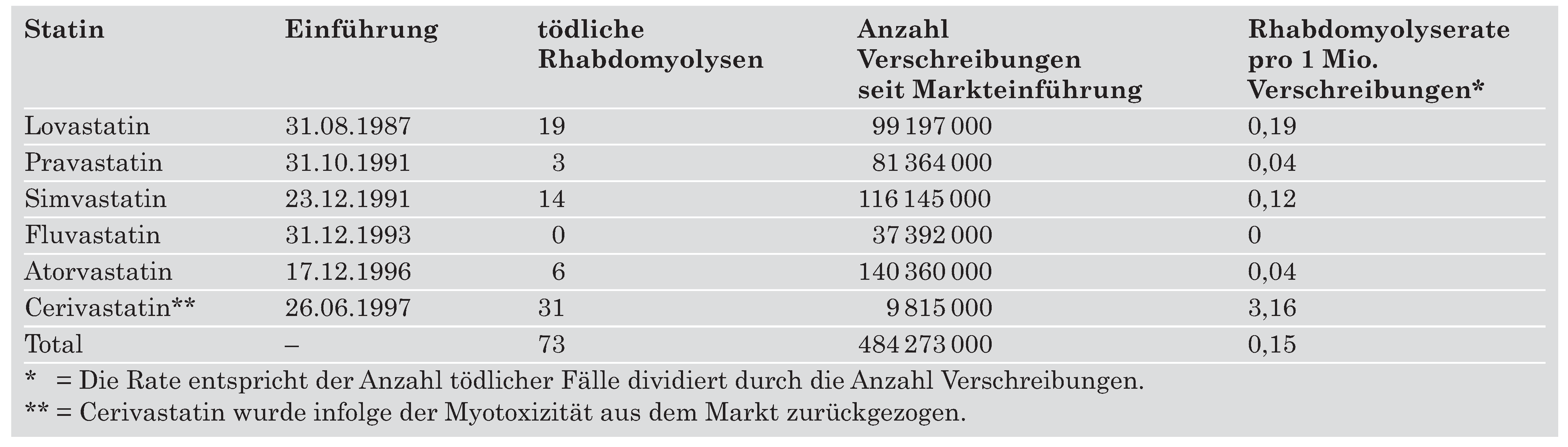
Der auffälligste Unterschied besteht in ihrer relativen Lipophilität. Simvastatin und Atorvastatin sind relativ lipophil, während Fluvastatin, Rosuvastatin und vor allem Pravastatin hydrophil sind. Klinisch haben diese Unterschiede einen Einfluss auf die Gewebsaffinität und -penetration sowie potentiell für Interaktionen mit anderen Medikamenten. In dieser Hinsicht ist der Metabolismus über Cytochrom P450 von einiger Bedeutung. Ein Grossteil der Medikamente wird über das Isoenzym 3A4 metabolisiert, so auch Atorvastatin und Simvastatin. Potentiell kann es dadurch zur ungünstigen Erhöhung der Statin-Konzentration kommen oder die Wirkung des ebenfalls auf dem gleichen Weg abgebauten zusätzlichen Medikamentes kann abgeschwächt werden. In der Praxis scheint dieser Befund eine untergeordnete Rolle zu spielen, da klinisch bedeutende Interaktionen eher selten sind und Rhabdomyolysen sowohl mit hydrophilen als mit hydrophoben Statinen in gleich geringem Ausmasse aufgetreten sind (
Table 4).
Table 4.
Gemeldete tödliche Rhabdomyolysen und Anzahl Verschreibungen in den USA seit Einführung [
14].
Table 4.
Gemeldete tödliche Rhabdomyolysen und Anzahl Verschreibungen in den USA seit Einführung [
14].
Ein wesentlicher Unterschied zwischen den einzelnen Statinen ist der Effekt auf die Proliferation und die Apoptose von vaskulären glatten Muskelzellen. Pravastatin inhibiert die Proliferation im Gegensatz zu den übrigen Statinen nicht. Es fördert zudem die Apoptose dieser Zellen nicht, während die übrigen Statine dies tun. Die klinische Bedeutung dieser In-vitro-Beobachtung ist allerdings noch unklar. Pravastatin hat in klinischen Studien ähnlich gute Resultate ergeben wie die hydrophoben Statine.
Statine unterscheiden sich aber auch in der «Lagtime» zwischen Therapiebeginn und der Divergenz zwischen Plazebound Verumkurve. Bei der Behandlung mit Atorvastatin gehen diese Kurven bereits innerhalb weniger Monate auseinander, in der ASCOT- und der AVERT-Studie praktisch von Beginn weg, während bei den übrigen Statinen ein derartiger Effekt gewöhnlich erst nach mehr als einem Jahr beobachtet wird (
Figure 3). Ob diese Beobachtung auf die statistische Grösse oder auf die stärkere LDL-Cholesterinsenkung durch Atorvastatin oder auf die stärkere Senkung des CRP zurückzuführen ist oder ob andere nichtlipidbezogene Faktoren involviert sind, kann derzeit nicht entschieden werden.
Ist das LDL-Cholesterin das Einzige Therapeutische Ziel?
Mit den Statinen sind äusserst wirkungsvolle Medikamente zur Senkung des atherogenen LDL-Cholesterins entwickelt worden. Die klinische Evidenz für die Lipidregulierung bezieht sich denn auch vorwiegend auf die Wirkung der LDL-Cholesterinsenkung. Die meisten Statin-Trials haben eine 25–35prozentige Senkung der Morbidität/Mortalität ergeben. Es bleibt also ein Restrisiko von ca. 70%. Diese Tatsache ruft nach zusätzlichen Therapien zur
Erhöhung der klinischen Wirksamkeit der Lipidmodulation. Epidemiologisch spielt das HDL-Cholesterin eine praktisch ebenso bedeutende Rolle wie das LDL-Cholesterin. Während die Senkung vom LDL-Cholesterin um 1% durchschnittlich eine etwa 2prozentige Senkung der Mortalität bewirkt, erlaubt die Erhöhung vom HDL-Cholesterin um 1% eine etwa 3prozentige Mortalitätssenkung bei Frauen und eine 2prozentige bei Männern [
17]. Es ist denn kaum verwunderlich, dass derzeit grosse Anstrengungen unternommen werden, das HDL-Cholesterin medikamentös zu erhöhen. Die wohl am längsten bekannten medikamentösen Methoden zur Erhöhung des HDL-Cholesterins sind die Therapie mit Fibraten oder mit Nikotinsäure-Derivaten.
Die HDL-Cholesterinerhöhung durch Statine ist mit etwa 5–10% relativ bescheiden, wobei Unterschiede je nach Körpergewicht, Alkoholkonsum und Erhöhung der Plasma-Triglyzeride bestehen. Die Antwort auf die Statin-Therapie ist also Phänotyp-abhängig. HDLCholesterine sind nicht eine einheitliche Lipoproteinklasse, sondern bestehen aus verschiedenen Untergruppen mit unterschiedlicher antiatherogener Wirkung. Statine können das HDL-Cholesterin-Untergruppenprofil signifikant verändern, indem sie die grossen Alpha-1- und Pre-alpha-1-Fraktionen erhöhen. Diese Subgruppen sind potentiell kardioprotektiv und der HDL-Cholesterin-regulierende Effekt der Statine könnte bedeutender sein als durch die bloss geringe Erhöhung angenommen wird.
Weitere Möglichkeiten zur therapeutischen HDL-Cholesterinerhöhung sind neben Lebensstiländerungen (vermehrte körperliche Aktivität, mässiger Alkoholkonsum, Omega-3-Fettsäuren) die Infusion von delipidiertem HDL [
18], von Apo-A-I oder Apo-A-I-Milano [
19], die Inhibition des Cholesterinester-Proteins (CETP) [
20] oder die Behandlung mit dem Cannabinoid-Rezeptor-1-Blocker Rimonabant [
21].
Eine bedeutende Erhöhung von HDL-Cholesterin lässt sich aber auch durch Niacin und durch Fibrate erzielen. Diese Medikamente gewinnen im Hinblick auf die Bedeutung von HDL-Cholesterin zunehmend wieder an Interesse.
Stellenwert Anderer Lipidmodulierender Therapie
Auch bei niedrigen LDL-Cholesterinwerten erhöht ein tiefes HDL-Cholesterin das kardiovaskuläre Risiko. Um den kardiovaskulären Schutz weiter zu verbessern, bietet sich an, neben dem LDL-Cholesterin auch die anderen Lipidparameter, insbesondere die beim metabolischen Syndrom tiefen HDL-Cholesterinund erhöhten Triglyzeridwerte ins Visier zu nehmen.
Neben Lebensstilveränderungen (Gewichtsabnahme, vermehrte körperliche Aktivität, Rauchstopp, mässiger Alkoholkonsum, Verzehr von Fisch reich an Omega-3-Fettsäuren) stehen dafür Fibrate und Nikotinsäure zu Verfügung.
Die erste Studie, welche gezeigt hat, dass eine Erhöhung des HDL-Cholesterins und eine Erniedrigung der Triglyzeride die kardiovaskulären Ereignisse reduzieren kann, ist die VA-HIT-Studie [
22] mit Gemfibrozil. Rund 2500 Patienten mit normalem bis tiefem LDLCholesterin, gleichzeitig erniedrigtem HDLCholesterin und normalen bis leicht erhöhten Triglyzeriden wurden in einer Gruppe mit Gemfibrozil und in einer mit Plazebo randomisiert. Die primären Endpunkte waren die nichtfatalen oder fatalen koronaren Ereignisse nach 5 Jahren. LDL-Cholesterin wurde durch Gemfibrozil überhaupt nicht verändert. Dagegen nahmen das HDL-Cholesterin um 6% signifikant zu und die Triglyzeride um 31% signifikant ab. Die Anzahl nichtfataler und fataler koronarer Ereignisse wurde signifikant um 22% reduziert, die Hirnschläge ebenfalls signifikant um 28% gesenkt. Es wurde eine klare inverse Relation zwischen HDL-Cholesterin und kardiovaskulären Ereignissen beobachtet.
Ein «Revival» erlebt heute die Nikotinsäure, dank einer neuen Formulierung mit protrahierter Abgabe (Niaspan®), welche viel besser toleriert wird und weniger zu «Flush» führt.
Nikotinsäure hat ihre gute Wirkung schon in den 1970er Jahren im «Coronary Drug Project» [
23] gezeigt. Vor kurzem ist die HATSStudie [
24] erschienen, welche die Kombination Simvastatin-Niacin vs. Plazebo bei Patienten mit praktisch normalem LDL-Cholesterin, sehr tiefem HDL-Cholesterin und normalen bis leicht erhöhten Triglyzeriden verglichen hat. Mit der medikamentösen Therapie liess sich das LDL-Cholesterin um 36–42% erniedrigen, das HDL-Cholesterin um 18–26% erhöhen und die Triglyzeride um 31–37% senken. Eine so starke Zunahme des HDL-Cholesterins wurde bis jetzt weder mit Statinen noch mit Fibraten erzielt. Leider wurde eine Kontrolle mit Simvastatin allein nicht durchgeführt. Unter Behandlung kam es zu einer noch nicht in einer Interventionsstudie beobachteten Reduktion der «major coronary events» um 90%. Eine vergleichbare Wirkung wurde bereits früher bei Patienten mit kombinierter Hyperlipidämie mit Hilfe der Kombination von Nikotinsäure und Colestipol in der FATS-Studie erreicht [
25]. Die klinischen Wirkungen verschiedener Mono- und Kombinationstherapien zur Senkung von LDL-Cholesterin und Erhöhung von HDL-Cholesterin sind in
Figure 4 dargestellt.
Neuerdings hat eine Studie belegt, dass die Kombination einer LDL-Cholesterinsenkung mit einem Statin und einer HDL-Cholesterinerhöhung mittels verzögert freigesetzter Nikotinsäure tatsächlich einen unabhängigen zusätzlichen Effekt auf die Atherosklerose hat. In der ARBITER-2-Studie [
26] hielt die zusätzliche Nikotinsäure-Gabe die Progression der Atherosklerose deutlich besser auf als die alleinige Statin-Therapie. Obwohl die KHK-Patienten nach derzeit gültigen Leitlinien mit einem Statin allein korrekt behandelt wurden und im Mittel das LDL-Cholesterinziel für diese Patientengruppe von unter 2,6 mmol/l klar erreicht wurde, zeigte sich über das Behandlungsjahr doch eine signifikante Zunahme der IMT («intima media thickness»), also eine deutliche Progression der Atherosklerose. Erhielten die Patienten aber zusätzlich Nikotinsäure, dann blieb diese Progredienz der atherosklerotischen Läsionen aus. Natürlich sind jetzt grössere Studien mit klinischen Endpunkten nötig.
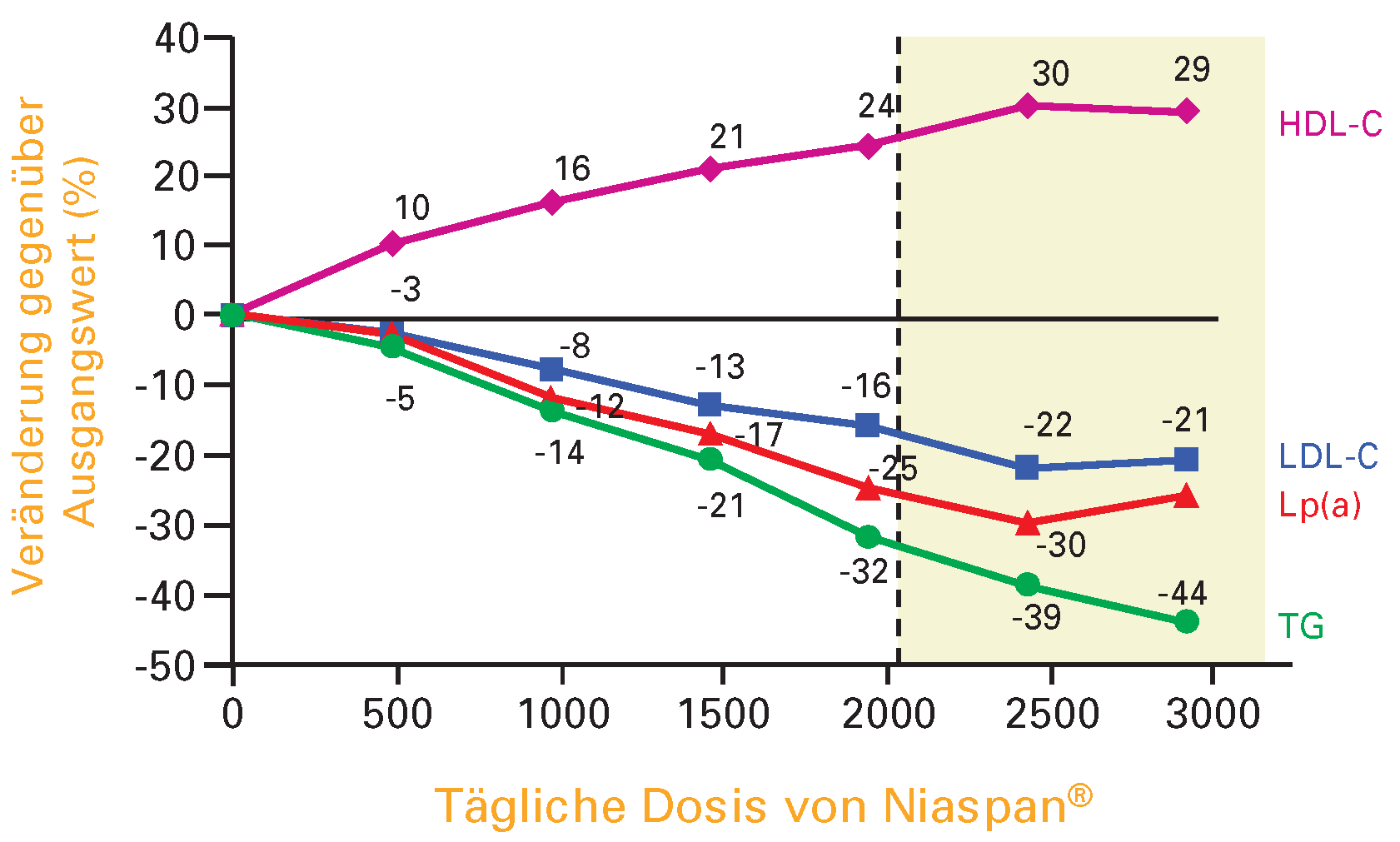
Die Kombination eines Statins mit Niaspan
® übt einen besseren Einfluss als Statin oder Nikotinsäure allein, auch auf die Zusammensetzung der LDL-Cholesterin-Partikel aus, indem die sehr atherogenen «small dense» LDL-Cholesterin-Partikel reduziert und die «large» LDL-Cholesterin-Partikel erhöht werden, eine Wirkung, welche besonders beim metabolischen Syndrom erwünscht ist. Ebenfalls wird das Lipoprotein Lp(a), welches normalerweise von den Statinen nicht beeinflusst wird, durch Nikotinsäure erniedrigt. Eine Übersicht über die Wirkung von Niaspan
® auf verschiedene Lipoproteine ist in
Figure 5 wiedergegeben.
Die gleichzeitige Senkung der LDL-Cholesterine und Erhöhung der HDL-Cholesterine wird für die Zukunft ein wichtiges Therapieziel darstellen. In dieser Hinsicht ist die Kombination eines Statins mit Nikotinsäure oder mit einem Fibrat von besonderem Interesse.
Neue Therapeutische Perspektiven
Neben der Möglichkeit der Infusion von delipidiertem HDL [
18] und von Apo-A-1 oder Apo-A-1-Milano [
19] eröffnen sich neue therapeutische Perspektiven mit Torcetrapib, einem Inhibitor des Cholesterin-Ester-Transport-Proteins (CETP), einer Substanz, welche eine Erhöhung des HDL-Cholesterins bis über 100% gezeigt hat [
20]. Die Bedeutung dieser HDLCholesterinerhöhung in bezug auf ihren protektiven Effekt ist indessen noch nicht belegt.
In Zukunft wird eine neue Klasse von Medikamenten, die sogenannten Cannabinoid-Rezeptoren-Hemmer, eine Hauptrolle in der Behandlung der mit dem metabolischen Syndrom verbundenen Dyslipidämie spielen. Rimonabant ist der erste selektive Inhibitor der Cannabinoid-Rezeptoren 1. Die Blockade dieser Rezeptoren normalisiert die infolge Überaktivierung des EC-Systems gesteigerte Nahrungsaufnahme und hemmt die Lipogenese. Durch den günstigen Effekt auf Körpergewicht, Lipolyse und Insulin-Resistenz korrigiert Rimonabant die mit dem metabolischen Syndrom assoziierte Dyslipidämie. Nach den Resultaten der ersten Studien (RIO-Lipid, RIO-Europe und RIO-North America [
21]) war in der mit 20 mg Rimonabant behandelten Gruppe ein signifikanter Anstieg der HDLCholesterinkonzentration von durchschnittlich 25% zu verzeichnen (Plazebogruppe: im Mittel 14%). Zudem wurden die Triglyzeridspiegel signifikant stärker gesenkt als unter Plazebo (10% vs. 1,5%). Ebenfalls nahm die Proportion des atherogenen «small dense» LDL-Cholesterins und des C-reaktiven Proteins unter Rimonabant 20 mg/Tag signifikant ab. Diese Resultate sind in Anbetracht der übermässigen Leibesfülle eines wachsenden Teils der Bevölkerung und der damit erwarteten Zunahme von Herz-Kreislauf-Erkrankungen sehr wahrscheinlich von grosser Bedeutung.