Myokarditis: Diagnostik und Verlauf
Summary
Zusammenfassung
Nosologie der Myokarditis
Epidemiologie
Ätiologie
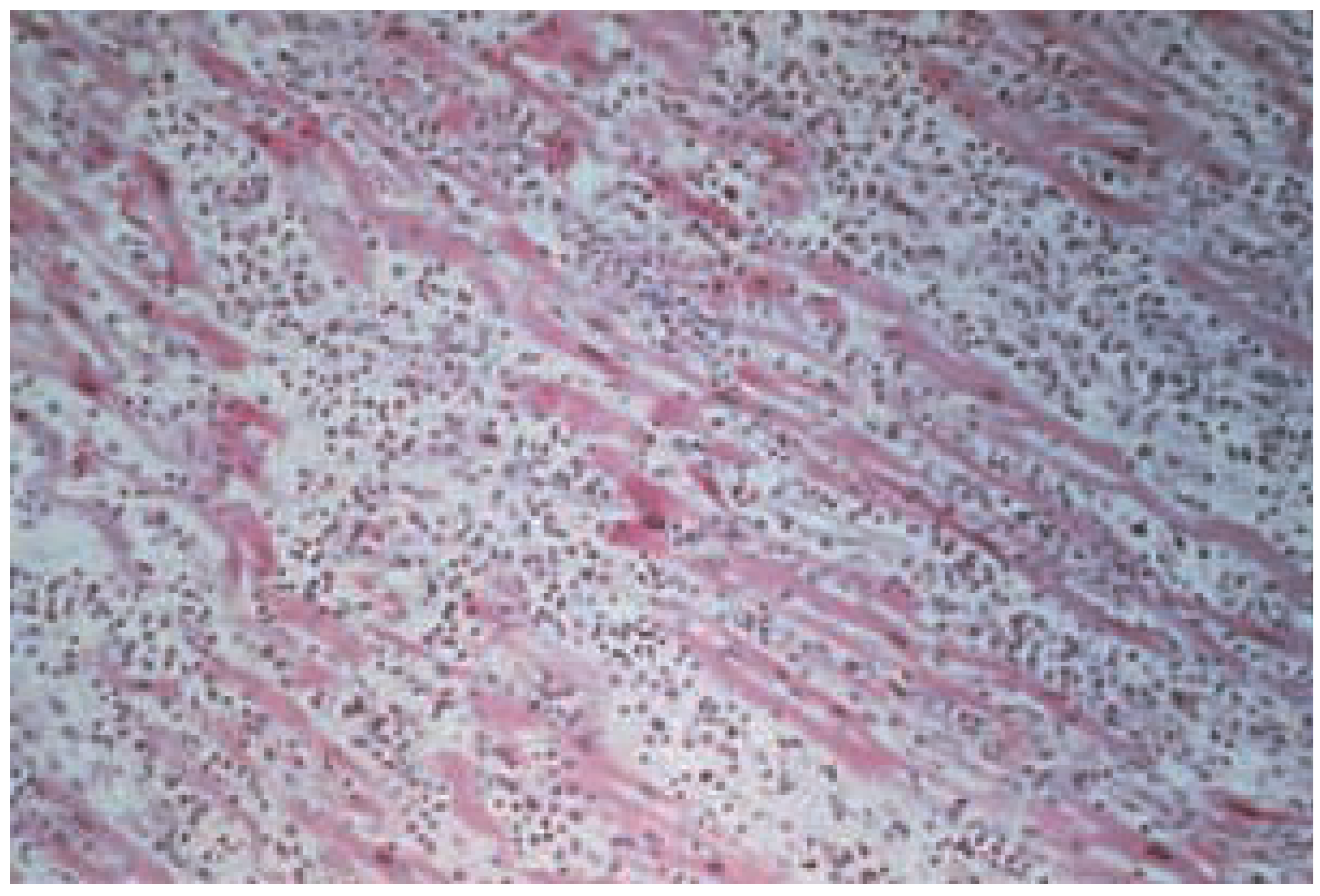
Histologie und Pathophysiologie
Klinische Präsentation der Myokarditis
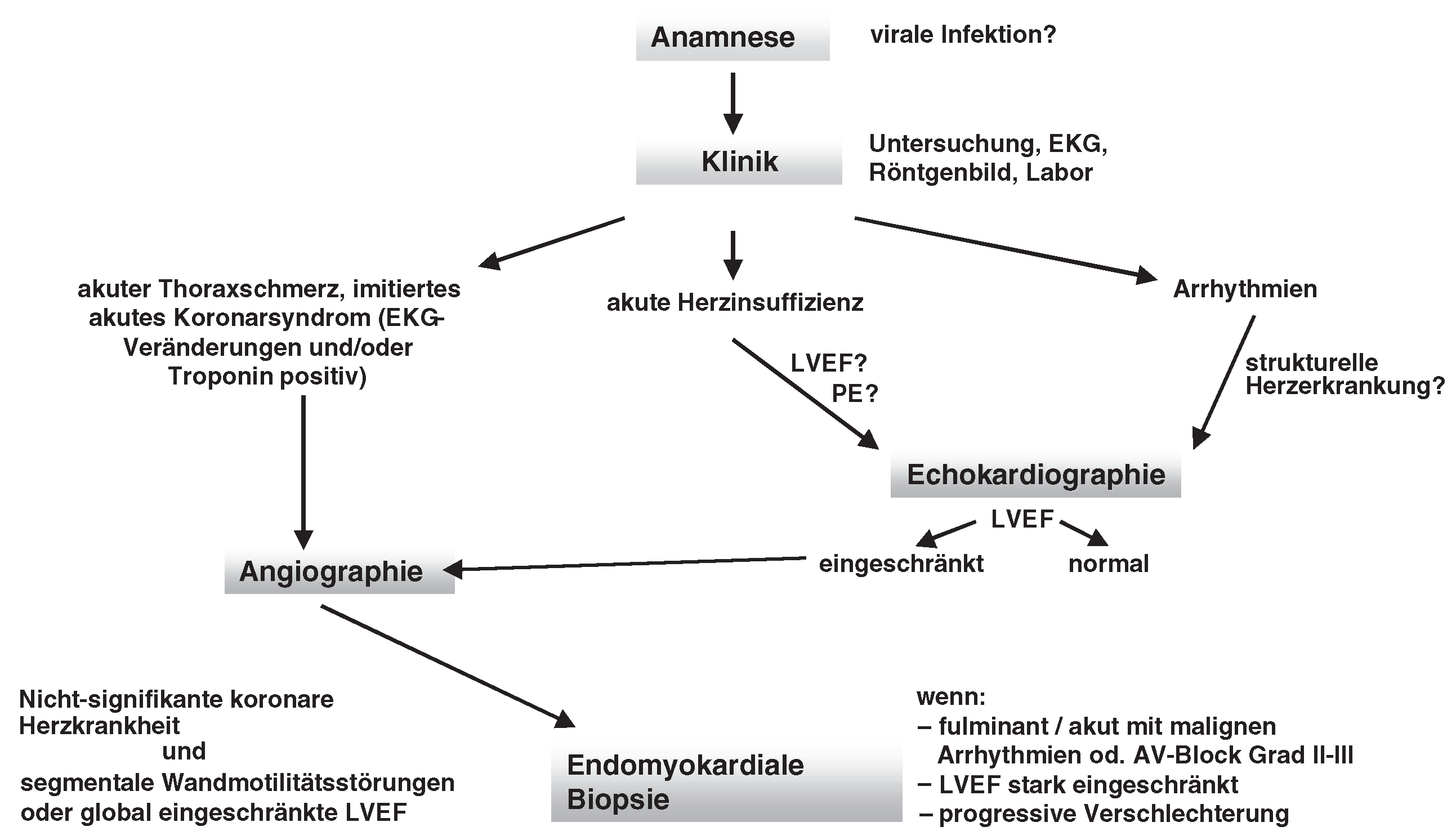
Diagnose der Myokarditis
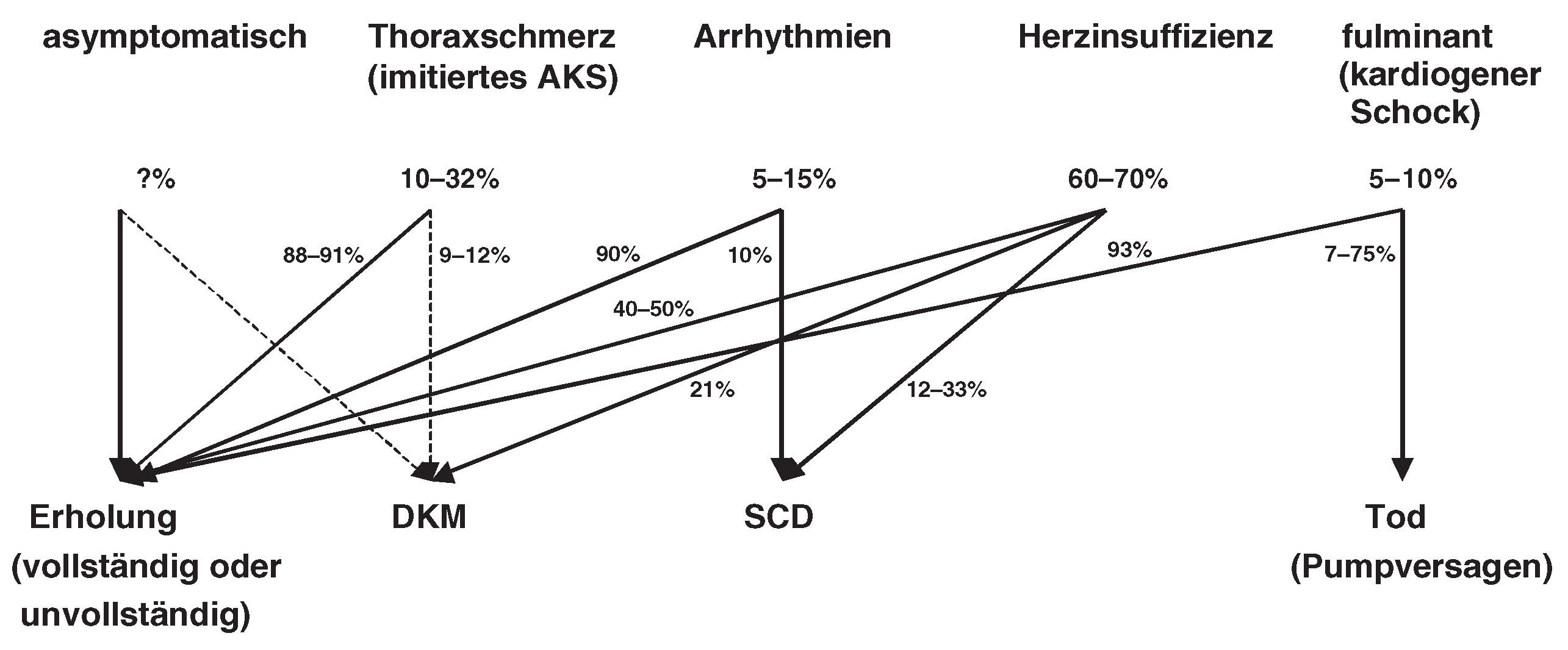
Verlauf der Myokarditis
Konklusion
Literatur
- Aretz, H.T.; Billingham, M.E.; Edwards, W.D.; Factor, S.M.; Fallon, J.T.; Fenoglio, J.J.; et al. Myocarditis. A histopathologic definition and classification. Am J Cardiovasc Pathol 1987, 1, 3–14. [Google Scholar]
- Lieberman, E.B.; Hutchins, G.M.; Herskowitz, A.; Rose, N.R.; Baughman, K.L. Clinicopathologic description of myocarditis. J Am Coll Cardiol 1991, 18, 1617–1626. [Google Scholar] [CrossRef]
- Gravanis, M.G.; Sternby, N.H. Incidence of myocarditis. Arch Pathol Lab Med 1991, 15, 390–392. [Google Scholar]
- Wakafuji, S.; Okada, R. Twenty year autopsy statistics of myocarditis incidence in Japan. Jpn Circ J 1986, 50, 1280–1293. [Google Scholar] [CrossRef]
- Karjalainen, J.; Heikkilä, J. Incidence of three presentations of acute myocarditis in young men in military service: a 20year experience. Eur Heart J 1999, 20, 1120–1125. [Google Scholar] [CrossRef]
- Mason, J.W.; O’Connell, J.B.; Herskowitz, A.; Rose, N.R.; McManus, B.M.; Billingham, M.E.; et al. A clinical trial of immunosuppressive therapy for myocarditis. N Engl J Med 1995, 333, 269–275. [Google Scholar] [CrossRef] [PubMed]
- Cooper, L.T.; Berry, G.J.; Shabetai, R. Idiopathic giant-cell myocarditis — natural history and treatment. N Enge J Med 1997, 336, 1860–1866. [Google Scholar] [CrossRef]
- Peters, N.S.; Poole-Wilson, P.A. Myocarditis — continuing clinical and pathologic confusion. Am Heart J 1991, 121, 942–947. [Google Scholar] [CrossRef]
- Liu, P.; Martino, T.; Opavsky, M.A.; Penninger, J. Viral myocarditis: balance between viral infection and immune response. Can J Cardiol 1996, 12, 935–943. [Google Scholar] [PubMed]
- Caiforo, A.L.; Mc Kenna, W.J. Recognition and optimum management of myocarditis. Drugs 1996, 52, 515–525. [Google Scholar] [CrossRef] [PubMed]
- Salvi, A.; Dreas, L.; Di Lenarda, A.; Silvestri, F.; Della Grazia, E.; Pinamonti, B.; et al. Clinical presentation and evolution in treated and untreated myocarditis. In Advances in Cardiomyopathies; Baroldi, G., Camerini, F., Goodwin, J.F., Eds.; Springer Verlag: Berlin, Germany, 1990; pp. 316–324. [Google Scholar]
- Lauer, B.; Niederau, C.; Kühl, U.; Schannwell, M.; Pauschinger, M.; Strauer, B.E.; et al. Cardiac troponin T in patients with clinically suspected myocarditis. J Am Coll Cardiol 1997, 30, 1354–1359. [Google Scholar] [CrossRef] [PubMed]
- Aretz, H.T.; Chapman, C.; Fallon, J.T. Morphologic and immunologic findings in patients with clinically suspected myocarditis (abstract). Circulation 1983, 68 (Suppl. S111), 111–127. [Google Scholar]
- Billingham, M.E. The diagnostic criteria of myocarditis by endomyocardial biopsy. In Myocarditis and Related Disorders; Sekiguchi, M., Olsen, E., Goodwin, J., Eds.; Springer Verlag: Berlin, Germany, 1985; pp. 133–137. [Google Scholar]
- Chow, L.C.; Dittrich, H.C.; Shabetai, R. Endomyocardial biopsy in patients with unexplained heart failure. Ann Intern Med 1988, 109, 535–539. [Google Scholar] [CrossRef]
- Leatherbury, L.; Chandra, R.S.; Shapiro, S.R.; Perry, L.W. Value of endomyocardial biopsy in infants, children with adolescents with dilated or hypertrophic cariomyopathy and myocarditis. J Am Coll Cardiol 1988, 12, 1547–1554. [Google Scholar] [CrossRef] [PubMed]
- Zee-Cheng, C.S.; Tsai, C.C.; Palmer, D.C.; Codd, J.E.; Pennington, D.G.; Williams, G.A. High incidence of myocarditis by endomyocardial biopsy in patients with idiopathic congenstive cardiomyopathy. J Am Coll Cardiol 1984, 3, 63–70. [Google Scholar] [CrossRef]
- Strauer, B.E.; Kandolf, R.; Mall, G.; Maisch, B.; Mertens Th Schwartzkopf, B.; et al. Myocarditis: cardiomyopathy. Consensus report of the German Association for Internal Medicine. Acta Cardiol 1996, 51, 347–371. [Google Scholar] [PubMed]
- Noutsias, M.; Pauschinger, M.; Schultheiss, H.P.; Kühl, U. Advances in immunohistological diagnosis of inflammatory cardiomyopathy. Eur Heart J 2002, 4 (Suppl. I), 54–62. [Google Scholar] [CrossRef]
- Billingham, M.E. Acute myocarditis: is sampling error a contraindication for diagnostic biopsy? J Am Coll Cardiol 1989, 14, 921–922. [Google Scholar] [CrossRef]
- Chow, L.H.; Radio, S.J.; Sears, T.D.; McManus, B.M. Insensitivity of right ventricular endomyocardial biopsy in the diagnosis of myocarditis. J Am Coll Cardiol 1989, 14, 915–920. [Google Scholar] [CrossRef] [PubMed]
- Shanes, J.G.; Ghali, J.; Billingham, M.E.; Ferrans, V.S.; Fenoglio, J.J.; Edwards, W.D.; et al. Interobserver variability in the pathologic interpretation of endomyocardial biopsy results. Circulation 1987, 75, 401–405. [Google Scholar] [CrossRef]
- Dec, G.W.; Palacios, I.F.; Fallon, J.T.; Aretz, H.T.; Mills, J.; Lee, D.; et al. Active myocarditis in the spectrum of acute dilated cardiomyopathies: clinical features, histologic correlates and clinical outcome. N Engl J Med 1985, 312, 885–890. [Google Scholar] [CrossRef]
- Cronin, M.E.; Love, L.A.; Miller, F.W.; Mc Clintock, P.R.; Plotz, P.H. The natural history of encephalomyocarditis virus-induced myositis and myocarditis in mice: viral persistence demonstrated by in situ hybridization. J Exp Med 1988, 168, 1639–1648. [Google Scholar] [CrossRef] [PubMed]
- Archard, L.C.; Bowles, N.E.; Cunningham, L.; Freeke, C.A.; Morgan-Capner, P.; Olsen, E.G.J.; et al. Enterovirus RNA sequences in hearts with dilated cardiomyopathy: a pathogenetic link between virus infection and dilated cardiomyopathy. In Advances in Cardiomyopathies; Baroldi, G., Camerini, F., Goodwin, J.F., Eds.; Springer Verlag: Berlin, Germany, 1990; pp. 194–198. [Google Scholar]
- Martin, A.B.; Webber, S.; Fricker, F.J.; Jaffe, R.; Demmler, G.; Kearney, D.; et al. Acute myocarditis: rapid diagnosis by PCR in children. Circulation 1994, 90, 330–339. [Google Scholar] [CrossRef] [PubMed]
- Wee, L.; Liu, P.; Penn, L.; Butany, J.W.; Mc Laughlin, P.R.; Sole, M.J.; et al. Persistence of viral genome into late stage of murine myocarditis detected by polymerase chain reaction. Circulation 1992, 86, 1605–1614. [Google Scholar] [CrossRef]
- Kühl, U.; Seeberg, B.; Schultheiss, H.P.; Strauer, B.E. Immunohistological characterization of infiltrating lymphocytes in biopsies of patients with clinically suspected dilated cardiomyopathy. Eur Heart J 1994, 15, 62–67. [Google Scholar] [CrossRef]
- Hufnagel, G.; Pankuweit, S.; Richter, A.; Schönian, U.; Maisch, B.; for the ESETCID investigators. The European study of epidemiology and treatment of cardiac inflammatory diseases (ESETCID). Herz 2000, 25, 279–285. [Google Scholar] [CrossRef]
- Nakamura, H.; Yamamura, T.; Umemoto, S.; Fukuta, S.; Shioi, T.; Matsumori, A.; et al. Autoimmune response in chronic ongoing myocarditis demonstrated by heterotopic cardiac transplantation in mice. Circulation 1996, 94, 3348–3354. [Google Scholar] [CrossRef]
- Afanasyeva, M.; Rose, N.R. Immunmediators in inflammatory heart disease: insights from a mouse model. Eur Heart J 2002, 4 (Suppl. I), 31–36. [Google Scholar] [CrossRef]
- Kawai, C. From myocarditis to cardiomyopathy: mechanisms of inflammation an cell death. Circulation 1999, 99, 1091–1100. [Google Scholar] [CrossRef] [PubMed]
- D’Ambrosio, A.; Patti, G.; Manzoli, A.; Sinagra, G.; Di Lenarda, A.; Silvestri, F.; et al. The fate acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart 2001, 85, 499–504. [Google Scholar]
- Dec, G.W.; Waldmann, H.; Southern, J.; Fallon, J.T.; Hutter, A.M.; Palacios, I.F. Viral myocarditis mimicking acute myocardial infarction. J Am Coll Cardiol 1992, 20, 85–89. [Google Scholar] [CrossRef] [PubMed]
- Narula, J.; Khaw, B.A.; Dec, G.W.; Palacios, I.F.; Southern, J.F.; Fallon, J.T.; et al. Recognition of acute myocarditis masquerading as acute myocardial infarction. N Engl J Med 1993, 328, 100–104. [Google Scholar] [PubMed]
- McCarthy, I.I.I.R.E.; Boehmer, J.P.; Hruban, R.H.; Hutchins, G.M.; Kasper, E.K.; Hare, J.M.; et al. Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis. N Engl J Med 2000, 342, 690–695. [Google Scholar] [CrossRef]
- Miklozek, C.L.; Crumpacker, C.S.; Royal, H.D.; Come, P.C.; Sullivan, J.L.; Abelmann, W.H. Myocarditis presenting as acute myocardial infarction. Am Heart J 1988, 115, 768–776. [Google Scholar] [CrossRef]
- Millaire, A.; De Groote, P.; Decoulx, E.; Leroy, O.; Ducloux, G. Outcome after thrombolytic therapy of nine cases of myopericarditis misdiagnosed as myocardial infarction. Eur Heart J 1995, 16, 333–338. [Google Scholar] [CrossRef]
- Sharma, O.P.; Maheshwari, A.; Thaker, K. Myocardial Sarcoidosis. Chest 1993, 103, 253–258. [Google Scholar] [CrossRef] [PubMed]
- Pinamonti, B.; Alberti, E.; Cigalotto, A.; Dreas, L.; Salvi, A.; Silvestri, F.; et al. Echocardiographic findings in myocarditis. Am J Cardiol 1988, 62, 285–291. [Google Scholar] [CrossRef]
- Sarda, L.; Colin, P.; Boccara, F.; Daon, D.; Lebtahi, R.; Faraggi, M.; et al. Myocarditis in patients with clinical presentation of myocardial infarction and normal coronary angiograms. J Am Coll Cardiol 2001, 37, 786–792. [Google Scholar] [CrossRef]
- Dec, G.W.; Palacios, I.F.; Yasuda, T.; Fallon, J.T.; Khaw, B.A.; Strauss, H.W.; et al. Antimyosin antibody cardiac imaging: its role in the diagnosis of myocarditis. J Am Coll Cardiol 1990, 16, 97–104. [Google Scholar] [CrossRef]
- Yasuda, T.; Palacios, I.F.; Dec, G.W.; Fallon, J.T.; Gold, H.K.; Leinbach, R.C.; et al. Indium 111-monoclonal antimyosin antibody imaging in the diagnosis of acute myocarditis. Circulation 1987, 76, 306–311. [Google Scholar] [CrossRef]
- Friedrich, M.G.; Strohm, O.; Schulz-Menger, J.; Marciniak, H.; Luft, F.C.; Dietz, R. Contrast media-enhanced magnetic resonance imaging visualizes myocardial changes in the course of viral myocarditis. Circulation 1998, 97, 1802–1809. [Google Scholar] [CrossRef]
- Laissy, J.P.; Messin, B.; Varenne, O.; Iung, B.; Karila-Cohen, D.; Schouman-Claeys, E.; et al. MRI of acute myocarditis. A comprehensive approach based on various imaging sequences. Chest 2002, 122, 1638–1648. [Google Scholar] [CrossRef]
- Quigley, P.J.; Richardson, P.J.; Meany, B.T.; Olsen, E.G.J.; Monaghan, M.J.; Jackson, G.; et al. Long-term follow-up of acute myocarditis. Correlation of ventricular function and outcome. Eur Heart 1987, 8 (Suppl. J), 39–42. [Google Scholar] [CrossRef]
- Matsumari, A.; Kawai, C. An animal model of congestive (dilated) cardiomyopathy: dilatation and hypertrophy of the heart in the chronic stage in DBA/2 mice with myocarditis caused by encephalomyocarditis virus. Circulation 1982, 66, 355–360. [Google Scholar] [CrossRef] [PubMed]
- Sinagra, G.; Maras, P.; D’Ambrosio, A.; Gregori, D.; Bussani, R.; Silvestri, F.; et al. Polimorfismo clinico di presentazione e storia naturale della miocardite attiva: esperienza su 60 casi. G Ital Cardiol 1997, 27, 758–774. [Google Scholar] [PubMed]
- Ammann, P.; Naegeli, B.; Schuiki, E.; Mury, R.; Frielingsdorf, J.; Bertel, O. Long-term outcome of acute myocarditis is independent of initial cardiac enzyme release. Int J Cardiol 2003, 89, 217–222. [Google Scholar] [CrossRef] [PubMed]
- Goldberg, L.R.; Suk, J.; Patton, K.K.; Semigran, M.J.; Dec, G.W.; Di Salvo, T.G. Predictors of adverse outcome in biopsy-proven myocarditis (abstract). J Am Coll Cardiol 1999, 33 (Suppl. A), 505A. [Google Scholar]
- Why, H.J.F.; Meany, B.T.; Richardson, P.J.; Olsen, E.G.J.; Bowles, N.E.; Cunningham, L.; et al. Clinical and prognostic significance of detection of enteroviral RNA in the myocardium of patients with myocarditis or dilated cardiomyopathy. Circulation 1994, 89, 2582–2589. [Google Scholar] [CrossRef]
- Dec, G.W.; Fallon, J.F.; Southern, J.F.; Palacios, I.F. Relation between histological findings on early repeat right ventricular biopsy and ventricular function in patients with myocarditis. Br Heart J 1988, 60, 332–337. [Google Scholar] [CrossRef]
- Fuse, K.; Kodama, M.; Okura, Y.; Ito, M.; Hirono, S.; Kato, K.; et al. Predictors of disease course in patients with acute myocarditis. Circulation 2000, 102, 2829–2835. [Google Scholar] [CrossRef]
- Lauer, B.; Schannwell, M.; Kühl, U.; Strauer, B.E.; Schultheiss, H.P. Antimyosin antoantibodies are associated with deterioration of systolic and diastolic left ventricular function in patients with chronic myocarditis. J Am Coll Cardiol 2000, 35, 11–18. [Google Scholar] [CrossRef] [PubMed]
- Parrillo, J.E.; Cunnion, R.E.; Epstein, S.E.; Parker, M.M.; Suffredini, A.F.; Brenner, M.; et al. A prospective, randomized, controlled trial of prednisone for dilated cardiomyopathy. N Engl J Med 1989, 321, 1061–1068. [Google Scholar] [CrossRef] [PubMed]
- Wojnicz, R.; Nowalany-Kozielska, E.; Wojciechowska, C.; Glanowska, G.; Wilczewski, P.; Niklewski, T.; et al. Randomized, placebo-controlled study for immunosuppressive treatment of inflammatory dilated cardiomyopathy. Circulation 2001, 104, 39–45. [Google Scholar] [CrossRef]
- Mc Namara, D.M.; Holubkov, R.; Starling, R.C.; Dec, G.W.; Loh, E.; Torre-Amione, G.; et al. Controlled trial of intravenous immune globulin in recent-onset dilated cardiomyopathy. IMAC Trial. Circulation 2001, 103, 2254–2259. [Google Scholar] [CrossRef] [PubMed]


© 2004 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Naegeli, B. Myokarditis: Diagnostik und Verlauf. Cardiovasc. Med. 2004, 7, 248. https://doi.org/10.4414/cvm.2004.01035
Naegeli B. Myokarditis: Diagnostik und Verlauf. Cardiovascular Medicine. 2004; 7(6):248. https://doi.org/10.4414/cvm.2004.01035
Chicago/Turabian StyleNaegeli, Barbara. 2004. "Myokarditis: Diagnostik und Verlauf" Cardiovascular Medicine 7, no. 6: 248. https://doi.org/10.4414/cvm.2004.01035
APA StyleNaegeli, B. (2004). Myokarditis: Diagnostik und Verlauf. Cardiovascular Medicine, 7(6), 248. https://doi.org/10.4414/cvm.2004.01035




