Summary
This article gives an overview on the practical management of device infections of chronically implanted pacemakers and implantable cardioverter-defibrillators. The main feature of such infections is the fact that the implanted materials have direct contact with the bloodstream, and therefore, may rapidly progress to systemic infection with serious septic complications. Apart from aggressive antibiotic treatment, in general, the infected material has to be explanted. Therefore, it is helpful to differentiate between the isolated pocket infection with the option of local surgical revision under preservation of the implanted leads and the systemic infection with the necessity of complete removal of all implanted materials using either the lead-extraction technique or open heart surgery.
Key words: device infections; pacemaker; implantable cardioverter-defibrillator; leadextraction
Zusammenfassung
Die vorliegende Arbeit gibt einen Überblick über das praktische Management von Infektionen chronisch implantierter SchrittmacherSysteme oder implantierbarer CardioverterDefibrillatoren. Hauptmerkmal dieser Infektionen stellt die Tatsache dar, dass das implantierte Material direkten Kontakt mit dem Blutstrom hat, womit sich lokalisierte Infekte schnell zu systemischen Infekten mit schwerwiegenden septischen Komplikationen ausweiten können. Neben einer aggressiven Antibiose muss das infizierte Material in aller Regel explantiert werden. Es ist deshalb sinn voll, den isolierten Logen-Infekt mit der Mög lichkeit der lokalen Sanierung unter Schonung der implantierten Elektroden von der Systeminfektion zu unterscheiden, wo das gesamte implantierte Material entfernt werden muss, was entweder mit der Lead-extraction-Technik oder mit der offenen Herzoperation erfolgt.
Key words: Device-Infektionen; Herzschrittmacher; implantierbarer Cardioverter-Defibrillator; Lead-extraction-Technik
Einleitung
Unter Device-Infektionen werden in der vorliegenden Arbeit die Infektion von chronisch implantierten Schrittmacher-Systemen oder von implantierbaren Cardioverter-Defibrillatoren (ICD) verstanden. Ein wesentliches Charakteristikum dieser Art von Infektionen stellt im Gegensatz zu anderen Fremdkörperinfektionen die Tatsache dar, dass das implantierte Material grossflächigen und direkten Kontakt mit dem Blutstrom hat. Lokalisierte Infektionen können deshalb jederzeit zu systemischen Infekten mit hämatogener Streuung und entsprechenden Organmanifestationen führen. Da es sich bei den genannten Materialien in der Regel um endovenös eingeführte Sonden handelt, kommt es primär zu einer Rechtsherz-Endokarditis mit septischen Embolien in den Lungenkreislauf, von wo aus eine schnelle Propagation in den Systemkreislauf möglich ist. Ein weiteres Merkmal dieser Infektionen ist das Erregerspektrum, welches typischerweise Hautkeime wie Koagulase-negative Staphylokokken oder Propioni bacterium acne beinhaltet. Entsprechend der niedrigen Virulenz dieser Keime kommt es primär häufig nur zu einer lokalen Infektion der Schrittmacherbzw. ICD-Loge. Es ist deshalb sinnvoll, den lokalen Logeninfekt mit guter Prognose von der komplikationsreichen systemischen Infektion zu unterscheiden.
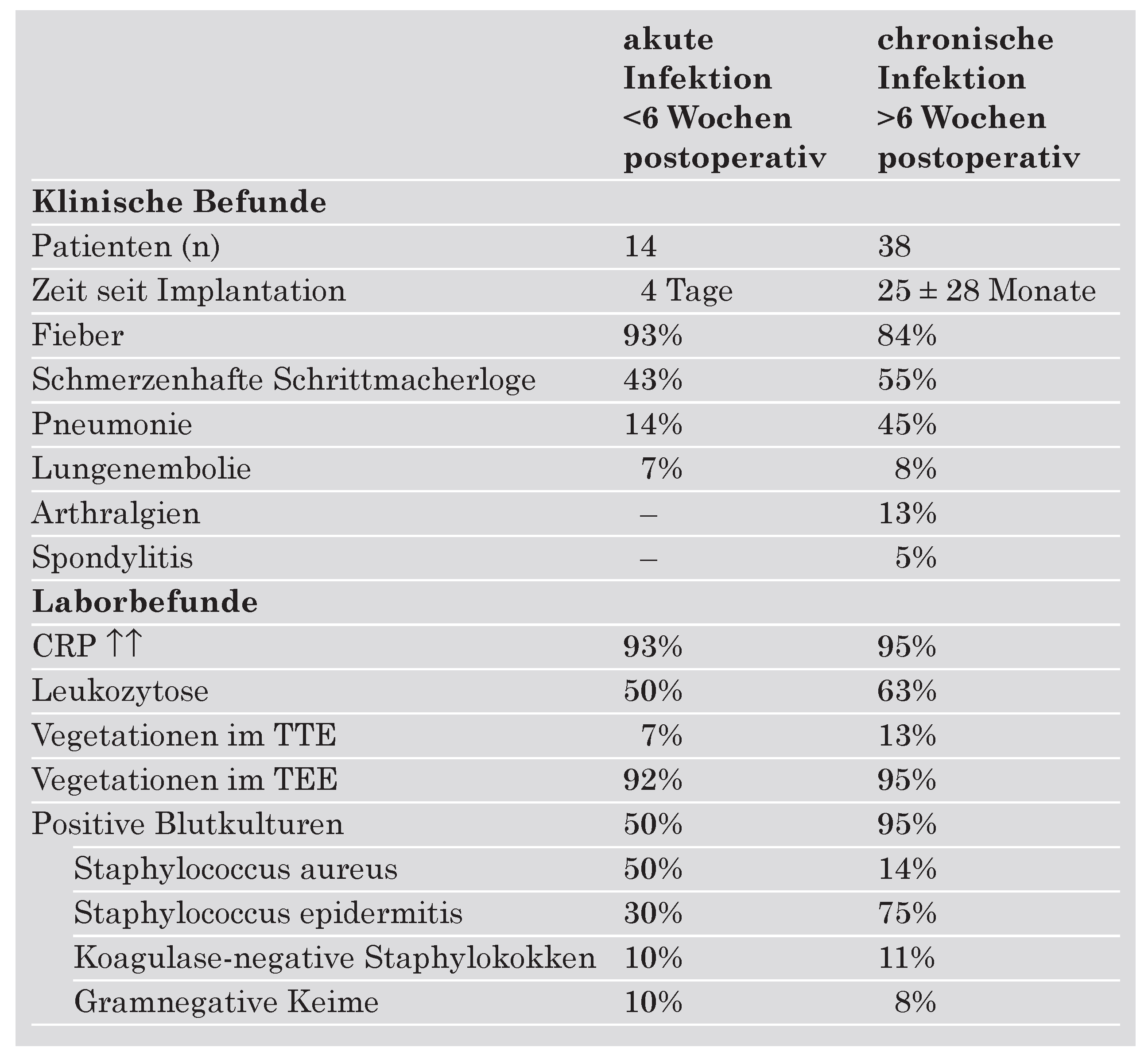
Klinisch kann eine akute und chronische Infektion unterschieden werden (
Tab. 1), wobei hier als Trennlinie 6 Wochen nach Implantation gelten. Typischerweise liegen bei der akuten Infektion Fieber (90%), eine lokale Entzündung der Schrittmachertasche (43%) und selten eine Pneumonie (14%) vor, währenddessen bei der chronischen Infektion Pneumonien bis zu 45% und Arthralgien bzw. Spondylitis-Symptome in bis zu 20% vorkommen [
1]. Wenn das Erregerspektrum verglichen wird, so fällt auf, dass bei der akuten Form Staphylococcus aureus mit 50% der häufigste Vertreter ist, währenddessen die chronischen Infektionen in 86% Koagulase-negative Staphylokokken bzw. Staphylococcus epidermitis aufweisen. Wichtig zu wissen ist, dass endokardiale Auflagerungen entlang der Schrittmacherkabel oder der Trikuspidalklappe mittels transthorakaler Echokardiographie (TTE) in nur 7–13% gesehen werden, währenddessen solche mit der wesentlich sensitiveren transösophagealen Echokardiographie (TEE) in bis zu 95% der Fälle nachgewiesen werden können [
1].
Lokalisierter Logeninfekt
Klassischerweise handelt es sich beim lokalen Infekt um eine subakute bis chronische Entzündung der Schrittmacherloge, die sich primär durch Rötung, Überwärmung und Schmerzhaftigkeit manifestiert. Da in der Mehrheit niedervirulente Hautkeime involviert sind, kann der Infekt subklinisch schleppend sein und nicht selten erst Jahre nach Implantation auftreten. Diagnostische Punktionen der Schrittmacherloge sind kontraindiziert, da sie einerseits die Diagnose nicht sichern, andererseits mit einem hohen Infektionsrisiko einer möglicherweise noch nicht infizierten Loge einhergehen. Nicht selten sind die Patienten afebril oder leiden nur gelegentlich an subfebrilen Temperaturen, währenddessen in der Regel eine Leukozytose oder eindeutige Erhöhung der Entzündungsparameter (CRP, BSG) fehlen. Blutkulturen sind in jedem Falle negativ. Die eigentlichen Leitsymptome sind die chronisch rezidivierenden Rötungen und Schmerzen der Schrittmacherloge, objektiv häufig mit einer Verdickung (Granulationsgewebe) und Abwanderung derselben verbunden.
Therapeutisch muss hier eine operative Logenrevision vorgenommen werden, wobei es Möglichkeiten gibt, die implantierten Elektroden in situ zu belassen [
2]. Dabei wird die chirurgische Revision primär über den Elektroden im Gesunden begonnen. Die frei präparierten Elektroden werden dann gekappt und mit neuen Konnektoren verbunden oder nach ausführlicher Reinigung auch direkt in eine neu angelegte, saubere Loge durchtunneliert [
2]. Nach lokaler Sanierung der Loge kommt es meist auch ohne Antibiotika innert Tagen zu einer spontanen Abheilung. Mit dieser Technik gelingt es, unter Schonug der Elektroden, in über 90% eine definitive Heilung zu erreichen [
2].
Systeminfektion
Im Gegensatz zum lokalen Infekt bestehen bei der systemischen Infektion typischerweise Fieber sowie erhöhte Entzündungsparamter (CRP, Leukozytose, BSG), wobei auch hier die klinische Manifestation in klarer Relation zur Virulenz des Erregers steht. Da auch diese Infektionen häufig durch niedervirulente Hautkeime verursacht sind, sind subklinische Verläufe mit rezidivierenden bilateralen Lungeninfekten, die erst im nachhinein als embolische Infekte erkannt werden, keine Seltenheit [
1]. Systeminfektionen sind fast immer mit einer Rechtsherz-Endokarditis vergesellschaftet. Entsprechend finden sich im Labor neben den genannten Entzündungsparametern häufig auch Zeichen einer Anämie sowie in über 90% positive Blutkulturen, wenn diese nicht durch vorgängige Antibiotika-Gabe kompromittiert wurden. Therapeutisch muss bei systemischer Infektion das gesamte implantierte Material inkl. der Elektroden entfernt werden, da sie ein Lumen und eine poröse Oberfläche aufweisen, welche von Bakterien besiedelt und auch durch langfristige intravenöse Antibiotika-Gabe nicht keimfrei zu be kommen sind. Die alleinige Entfernung des Schrittmacher-Systems mit Kappen der Elektroden ist ungenügend und führt zu Rezidivien mit häufig schwerwiegenden septischen Komplikationen.
Die Entfernung von chronisch implantiertem Elektrodenmaterial ist technisch aufwendig, da nicht nur die Spitze im Myokard eingewachsen ist, sondern auch der Elektrodenkörper selbst grossflächig durch Neointima bzw. Bindegewebe entlang der Venenwände eingescheidet ist. Da der Elektrodenkopf in der Regel einen grösseren Durchmesser als der Elektrodenkörper aufweist, führt der alleinige Zug dieser Elektroden zwar zu einer Mobilisation der Elektrodenspitze, gleichzeitig jedoch zu einem Verhaken der Elektroden innerhalb dieser Gewebescheiben. Bei massiven Zug kommt es zum Aufdehnen der Elektrodenwendel und zum Zerreissen derselben, wobei dann grössere Elektrodenteile endovenös verbleiben und mittels Schlingenkatheter transvenös entfernt werden müssen (
Abb. 1a, 1b). Mit der sogenannten Leadextraction-Technik können derartige Gewebescheiden, durch Vorführen einer steifen Plastikoder Metallhülse über die Elektrode selbst, stumpf von der Wand getrennt werden, ohne dass es dabei zu Perforationen kommt [
3,
4]. Dazu gibt es verschiedene Techniken bis hin zu sogenannten Lasersheaths, bei denen ein Eximer-Laser benutzt wird, um den adhärenten Gewebeschlauch von der Wand zu lösen [
5,
6]. Mit diesen Techniken gelingt es, unabhängig vom Elektrodentyp (passive/aktive Verankerung), in über 95% der Fälle sämtliches Elektrodenmaterial über einen trans venösen Weg zu entfernen. Eine wesentliche Limitierung dieser Technik stellen allerdings grössere endovenöse Auflagerungen dar, welche durch das Vorschieben dieser Sheaths mobilisiert werden und zu Lungenembolien führen können. Als maximal akzeptabler Durchmesser wird in der Literatur eine Grenze von 10 mm empfohlen [
1,
7]. Elektroden mit Vegetationen von mehr als 10 mm Durchmesser sollten wegen Emboliegefahr mit möglicherweise fatalem Ausgang chirurgisch entfernt werden. Es ist selbstredend, dass bei Durchführung einer endovenösen Lead-extraction sämtliche verfügbaren Techniken zur sofortigen Behebung einer Perikardtamponade oder einer Ventrikelperforation vorhanden sein müssen, was bedeutet, dass ein thoraxchirurgischer Standby im Hause gewährleistet sein muss [
7]. Angesichts des Komplikationsrisikos von 1,3% (Tamponade, Tod, Verletzung der Trikuspidalklappe, Thromboembolie), welches bei der schneller zum Erfolg führenden Laser-sheath-Technik tendenziell etwas höher liegt (3,3%), sollten aber nur Elektroden entfernt werden, die klinisch ein substantielles Risiko für den Patienten darstellen [
5,
7].
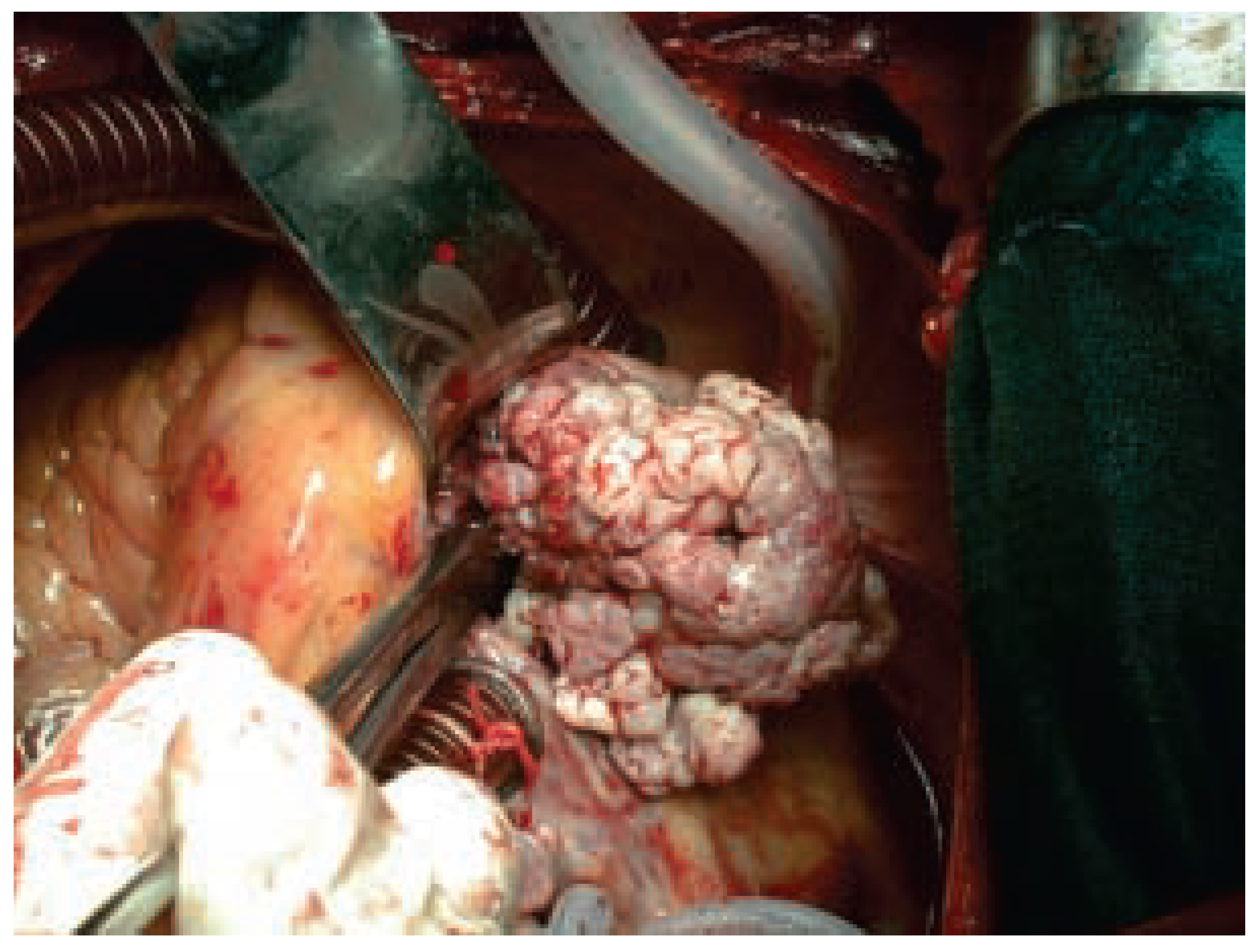
Bei Entfernung von mehreren Sonden, die häufig auf Vorhofniveau stark miteinander verwachsen sind und damit eine endovenöse Entfernung erschweren, muss eine chirurgische Entfernung vorgenommen werden. Diese kann bei anatomisch einfachen Verhältnissen in bikavaler Einflussstauung durchgeführt werden, häufiger aber erfordert sie eine offene Herzchirurgie an der Herz-Lungen-Maschine. Letztere ist auch dann notwendig, wenn echo kardiographisch eine schwere Verwachsung der endovenösen Kabel mit der Trikuspidalklappe oder gar eine hämodynamisch relevante Trikuspidalinsuffizienz vorliegt (
Abb. 2). In diesen Fällen müssen die Elektroden unter Sicht minutiös von der Trikuspidalklappe abgetrennt und gegebenenfalls die Trikuspidalklappe rekonstruiert werden. Der Vorteil der chirurgischen Technik liegt sicherlich darin, dass grosse endokarditische Auflagerungen und Thromben unter Sicht entfernt werden können (
Abb. 3). Dennoch kommt es auch bei der chirurgischen Technik in bis zu 17% der Fälle zu szintigraphisch nachweisbaren Embolien, was aber im Vergleich zu 30% mit der Lead-extraction-Technik ein geringeres Problem darstellt [
1]. Obwohl die Erfolgsrate der chirurgischen Technik annähernd 100% erreicht, sollte diese Methode nur angewandt werden, wenn eine endovenöse Entfernung mittels der Lead-extraction-Technik nicht möglich oder zu risikoreich ist, da die operative Mortalität bis zu 17% beträgt [
1]. Im Falle einer chirurgischen Entfernung sollte unbedingt eine vorgängie Koronarangiographie erfolgen, da perioperative Infarkte bei dieser Population keine Seltenheit darstellen. Bei Vorliegen hämodynamisch relevanter Koronarstenosen sollte in der gleichen Operation eine Myokardrevaskularisation vorgenommen werden.
Antibiotika müssen bei allen Modalitäten der Elektrodenentfernung intravenös verabreicht werden, wobei bei bekanntem Erregerspektrum eine resistenzgerechte Substanz in bakterizider Dosis, bei nicht bekanntem Erreger eine Kombination mit breitem Spektrum gegen grampositive Erreger gewählt werden sollte. In der Regel werden die Antibiotika während mindestens 2 Wochen, bei Vorliegen einer Rechtsherz-Endokarditits über 4–6 Wochen fortgeführt. Im weiteren muss natürlich sichergestellt sein, dass nach Elektrodenentfernung ein suffizienter Eigenrhythmus vorliegt. Sollte dies nicht der Fall sein, muss ein temporärer Schrittmacher vor der geplanten Elektrodenentfernung eingelegt werden. Bei kompletter Schrittmacher-Abhängigkeit und operativer Systementfernung kann auch eine epikardiale Elektrodenimplantation mit gleichzeitigem Einbau eines definitiven Schrittmacher-Systems subkostal erwogen werden. Hier ist allerdings auf eine grösstmögliche Sterilität nach Entfernung des kontaminierten Materials zu achten, um nicht das neue Schrittmacher-System zu infizieren.
Von der Antibiotika-Gabe ohne klare Diagnose ist abzuraten, da sie nie zu einer Heilung führt und der Verlauf dadurch maskiert wird. In ganz seltenen Fällen kann bei sensiblen Keimen und polymorbiden Patienten, bei denen eine chirurgische Sanierung nicht mehr in Frage kommt, eine Dauer-Antibiotika-Therapie zur chronischen Suppression erwogen werden. Solche Situationen stellen aber die Ausnahme dar und sind als palliative Lösungen zu betrachten.
Praktisches Vorgehen
Da es sich bei den Device-Infektionen meist um niedervirulente Hautkeime handelt, wird die Diagnose im Frühstadium häufig verpasst. Rezidivierende Fieberschübe (90%), Schmerzen und Schwellungen der Schrittmacherloge (60%) sowie rezidivierende bilaterale Pneumonien (15%) sollten an die Möglichkeit eines Infekts denken lassen. Als minimaler Work-up müssen der Lokalbefund erhoben, Blutkulturen in Serie abgenommen (positiv in 95% bei systemischem Infekt), die Infektparameter bestimmt (BSG, CRP, Leukozyten) sowie ein Thorax-Röntgenbild angefertigt werden. Erhärtet sich der klinische Verdacht eines Infekts, empfiehlt sich zur weiteren Abklärung eine transthorakale Echokardiographie mit der Frage nach Rechtsherz-Endokarditis bzw. Vegetationen an den endovenösen Sonden.
Bei bestätigter Diagnose ist der Patient stationär einzuweisen, wo in aller Regel ein TEE zum Festlegen des weiteren Prozederes erfolgt. Wenn echokardiographisch nachgewiesene Vegetationen grösser als 10 mm im Durchmesser sind, ist die operative Entfernung zu empfehlen. Ebenso ist die chirurgische Technik bei schwerer Trikuspidalinsuffizienz und/oder starker Verwachsung der Elektroden mit der Trikuspidalklappe zu bevorzugen. Bei Vegetationen unter 10 mm und mobilen, frei zugänglichen Elektroden stellt die transvenöse Elektroden-Extraktion die Therapie der Wahl dar, wobei auch hier wegen dem Risiko einer Perforation und/oder Tamponade ein Thorax-chirurgischer Stand-by gewährleistet sein muss. Wenn keine Zeichen einer Systeminfektion vorliegen (negatives CRP, negative Blutkulturen, negative Entzündungsparameter), kann die alleinige Revision der Schrittmacherloge unter Schonung der implantierten Elektroden in Betracht gezogen werden. Im Falle einer erfolgreichen Logenrevision sollte diese aber während mehrerer Monate klinisch nachverfolgt werden, da vor allem niedervirulente Infekte auch spät nach Absetzen von Antibiotika noch rezidivieren können.
Typische Fehler, die unbedingt vermieden werden sollten, beinhalten die Gabe von Antibiotika ohne klare Diagnose, Antibiotika-Verabreichung vor Sicherstellen von Blutkulturen, Antibiotika-Verabreichung bei Systeminfekt ohne Elektrodenentfernung sowie die diagnostische Punktion einer fraglich infizierten Schrittmachertasche.