Stickfluss des Dichters
Am Anfang gab es nicht einmal das Wort. Als der Dichterfürst und Troubadour des Herzens Johann Wolfgang von Goethe 1832 starb, sah sein Leibarzt verzweifelt dem Geschehen zu, er kannte weder die Ursache seines Leidens noch hatte er Mittel zur Behandlung zur Hand (Abb. 1). Bereits im Frühjahr 1823, im Alter von 74 Jahren, litt Goethe unter qualvollen Brustschmerzen, die er «als Hindernis zu le ben und zu sterben» erlebte. Neun Tage und Nächte verbrachte der Dichter, zunächst un ter Schmerzen, dann mit Atemnot und Hu sten, fast ununterbrochen im Lehnstuhl sit zend. Seinen Ärzten traute er mit Recht nicht viel zu und schalt sie: «Ihr seid zu furchtsam mit Euren Mitteln, ihr schont mich zu sehr! Wenn man einen Kranken vor sich hat, wie ich es bin, so muss man ein wenig napoleonisch mit ihm zu Werke gehen!» Wie wahr – ausser Empathie, Arnika und Aderlass hatten die Ärzte seiner Zeit nicht viel zu bieten [
1]. Sie verstanden weder die Krankheit noch kannten sie ein Kraut, das gegen diese Beschwerden ge wachsen gewesen wäre. Goethe ahnte wohl, dass eines Tages napoleonisch zu Werke gegangen würde, das Problem bei der Wurzel zu packen wie es die Wiedereröffnung der Herz kranzgefässe mit modernen Ballon-Kathetern heute erlaubt. Doch Goethe überstand die Ge fahr – nicht wegen seiner Ärzte. Neun Jahre später am 23. März 1832 meldete sich die Krankheit zurück: Was in der Todesanzeige im Geiste seiner Zeit als «Stickfluss infolge eines nervös gewordenen Katarrhalfiebers» bezeichnet wurde, war die letzte Offenbarung seiner koronaren Herzkrankheit: Nach einer schrecklichen Nacht liess der sterbende Goethe nach seinem Arzt rufen. Als Doktor Vo gel eintraf, fand er den Dichterfürsten in jäm-merlichem Zustande vor:
Figure 1.
Johann Wolfgang von Goethe (1749–1832), der Meisterdichter der deut schen Literatur, ein Jahr vor seinem Tod. Im Hintergrund Carl Vogel (1798–1864), Goethes Arzt und seit 1826 Hofmedicus Weimars. Modifiziert nach [
2].
Figure 1.
Johann Wolfgang von Goethe (1749–1832), der Meisterdichter der deut schen Literatur, ein Jahr vor seinem Tod. Im Hintergrund Carl Vogel (1798–1864), Goethes Arzt und seit 1826 Hofmedicus Weimars. Modifiziert nach [
2].
«Der Schmerz, welcher sich mehr und mehr auf der Brust festsetzte, presste dem Ge-folterten bald Stöhnen, bald lautes Geschrei aus. (...) Der ganze, eiskalte Körper triefte vor Schweiss, den ungemein häufigen, schnellen und härtlichen Puls konnte man kaum fühlen. (...) Dann und wann lies sich ein leises Rasseln in der Brust vernehmen, das sich nach einer vorübergehenden Besserung in lauteres Röcheln verwandelte.»
Kein Zweifel, Goethe starb den Herztod: Angina pectoris, kalter Schweiss, Blutdruck-abfall mit kalten Gliedern, Zentralisierung des Kreislaufs, schnelle Rhythmusstörungen der Herzkammer, wie dem Infarkt eigen, und schliesslich Herzversagen mit Lungenstauung und erstickender Atemnot sind die klassischen Beschwerden des im Kreislaufversagen Ster benden. Machtlos sah sein Leibarzt zu – er kannte weder Ursachen noch Mittel, um ihm zu helfen [
2].
Infarkt des Präsidenten
Als Dwight D. Eisenhower, der Sieger des Zweiten Weltkrieges, als Präsident der USA 1955 einen Herzinfarkt erlitt, hatte man das Krankheitsbild zwischenzeitlich kennenge lernt. In der Tat hatten die englischen Klini-ker des 19. Jahrhunderts um Jenner und Hun ter verkalkte Herzkranzgefässe mit dem plötz lichen Herztod in Verbindung gebracht und die Entwicklung der Elektrokardiographie durch Einthoven anfangs des 20. Jahrhunderts hatte auch die Möglichkeit mit sich gebracht, akute Ischämien zu diagnostizieren.
Im Falle von Dwight D. Eisenhower be gannen die Beschwerden während des Golf-spielens im Cherry Hills Country Club in Den ver, Colorado, am 23. September 1955, als erst mals der Präsident über Beschwerden klagte, welche er selbst mit einer Verdauungsstörung in Zusammenhang brachte. Er begab sich dar auf ins Haus seiner Schwiegermutter, wo er mit seinem persönlichen Arzt, Dr. Howard Snyder, dinierte. Seine Vorliebe für’s kräftige Essen war bekannt. So hatte er am Tag seines Infarktes zum Frühstück Wurst, Schinken, Pilze und Hot Cakes zu sich genommen, zum Lunch in amerikanischer Tradition einen Hamburger mit Zwiebeln und zum erwähnten Abendessen grilliertes Lamm mit Kartoffeln. Auch Dr. Snyder, als Arzt auf dem Stand der Medizin seiner Zeit, erkannte das Problem nicht und diagnostizierte ein gastrointestina-les Problem – wir dürfen aufgrund der Schil-derungen annehmen, dass er wahrscheinlich einen akuten inferioren Myokardinfarkt erlitt, welcher auch heute noch gelegentlich diagno stische Probleme aufwirft. Entsprechend war tete er lange, ja allzu lange, bevor er den Prä sidenten hospitalisierte. Um zwei Uhr nachts rief Mammie Eisenhower Dr. Snyder ins Weisse Haus, aber er konnte sich erst spät morgens dazu entschliessen, den Präsidenten ins Spital einzuliefern.
Hilflosigkeit der Experten
Einmal im Spital holte man die besten Herz-spezialisten des Landes, so den berühmten Kardiologieprofessor Paul Dudley White vom Massachussetts General Hospital der Har vard University, ans Bett des Präsidenten; sie kannten inzwischen die Erkrankung, stellten aufgrund der EKG-Veränderungen die Dia gnose; doch auch sie hatten nichts zur Hand, und verordneten nur strikte Bettruhe während sechs Wochen, später setzte man den Präsidenten in den Rollstuhl (Abb. 2) – das eine wie das andere war unwirksam oder falsch. Auch konnten sie den zweiten Infarkt des Prä sidenten nicht verhindern; sie kannten weder Aspirin noch standen Blutdruckmittel oder Cholesterin-Senker zur Verfügung. Immerhin, beim dritten liess sich Eisenhowers Leben trotz Auftreten des gefürchteten Kammerflim-merns mittels der inzwischen von Bernard Lown 1962 eingeführten Defibrillation retten. Wie für die Zeit typisch wurde Eisenhower bei allen seinen Infarkten langfristig hospitali-siert. So liess man ihn bei seinem ersten Herz infarkt erst nach 14 Tagen eines seiner Kabi-netsmitglieder sehen, und erst nach einem Monat war es ihm erlaubt, für einige Stunden in einem Stuhl sitzend zu verbringen. Eine wirkliche Mobilisation erfolgte erst eineinhalb Monate nach dem Ereignis.
Figure 2.
Dwight D. Eisenhower (1890–1969), Sieger des zweiten Weltkriegs und Präsident der Vereinigten Staaten 1952–1960 (rechts) mit seinem Arzt, dem zu dieser Zeit führenden amerikanischen Kardiologen Dr. Paul Dudley White (1866–1973, links) aus Boston (modifiziert nach N Engl J Med 1998, 338, 1703–4).
Figure 2.
Dwight D. Eisenhower (1890–1969), Sieger des zweiten Weltkriegs und Präsident der Vereinigten Staaten 1952–1960 (rechts) mit seinem Arzt, dem zu dieser Zeit führenden amerikanischen Kardiologen Dr. Paul Dudley White (1866–1973, links) aus Boston (modifiziert nach N Engl J Med 1998, 338, 1703–4).
Vom Schicksal zur Krankheit
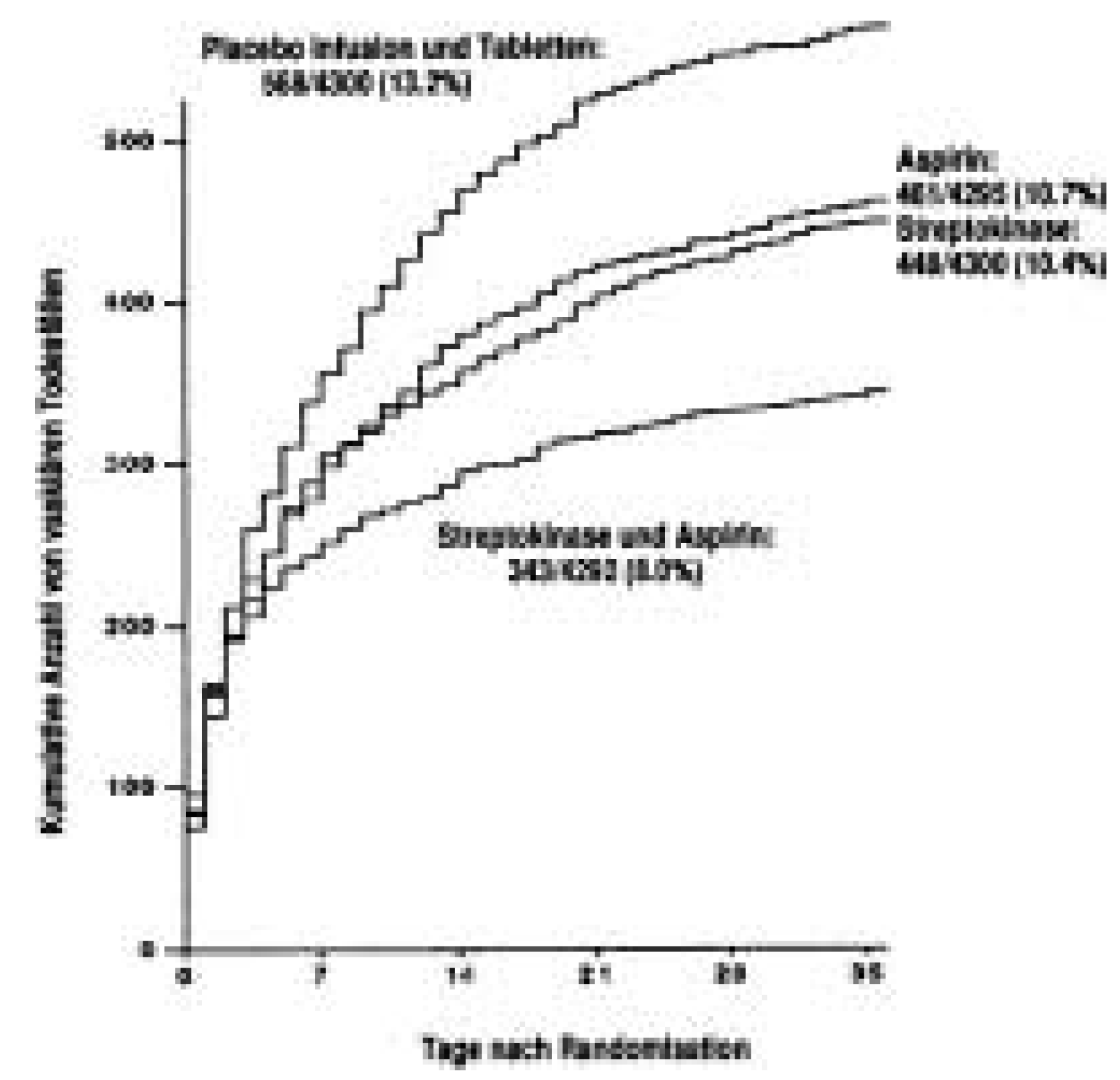
Die Krankengeschichte von Eisenhower, wel che knapp 50 Jahre zurückliegt, dokumentiert die enormen Fortschritte in der Diagnostik und Behandlung des akuten Myokardinfark tes. Während zu Eisenhowers Zeit praktisch nichts zur Verfügung stand, kamen seither Aspirin, Betablocker und schliesslich Throm-bolytika hinzu. Die Wirksamkeit von Aspirin und Streptokinase wurde allerdings erst in der ISIS-2-Studie [
3] belegt (Abb. 3). Die 1980er Jahre standen daher im Zeichen der Ein führung der Thrombolyse, zunächst mit Aspi rin und Streptokinase, später mit Gewebe-plasminogen-Aktivator und seinen Derivaten (Tab. 1) [
4]. Die akute Intervention mit Ballon-Kathetern und Stents galt damals noch als zu riskant, da für die Akutintervention wichtige Begleitmedikamente, wie die erst in den 1990er Jahren verfügbar werdenden Glyko-protein-IIb/IIIa-Antagonisten, fehlten [5, 6]. In den letzten 10 Jahren allerdings hat sich die akute perkutane Koronarintervention [7, 8] zur Therapie der ersten Wahl entwickelt (Abb. 4). Damit hat sich die Sterblichkeit des Herz infarktes im Spital von ursprünglich 50% zu Eisenhowers Zeiten auf rund 30% in den 1960er Jahren auf heute schliesslich unter 10% vermindert – ein unglaublicher Erfolg der modernen kardiovaskulären Medizin.
Figure 3.
International Study on Infarct Survival-2-Studie (ISIS-2). Dargestellt ist die Wirkung von Streptokinase und/oder Aspirin bei Patienten mit einem akuten ST-Hebungsinfarkt oder neu aufgetretenem Links-schenkelblock. Deutlich sichtbar ist die additive Mortalitätsreduktion durch beide Substanzen. Modifiziert nach [
3].
Figure 3.
International Study on Infarct Survival-2-Studie (ISIS-2). Dargestellt ist die Wirkung von Streptokinase und/oder Aspirin bei Patienten mit einem akuten ST-Hebungsinfarkt oder neu aufgetretenem Links-schenkelblock. Deutlich sichtbar ist die additive Mortalitätsreduktion durch beide Substanzen. Modifiziert nach [
3].
Figure 4.
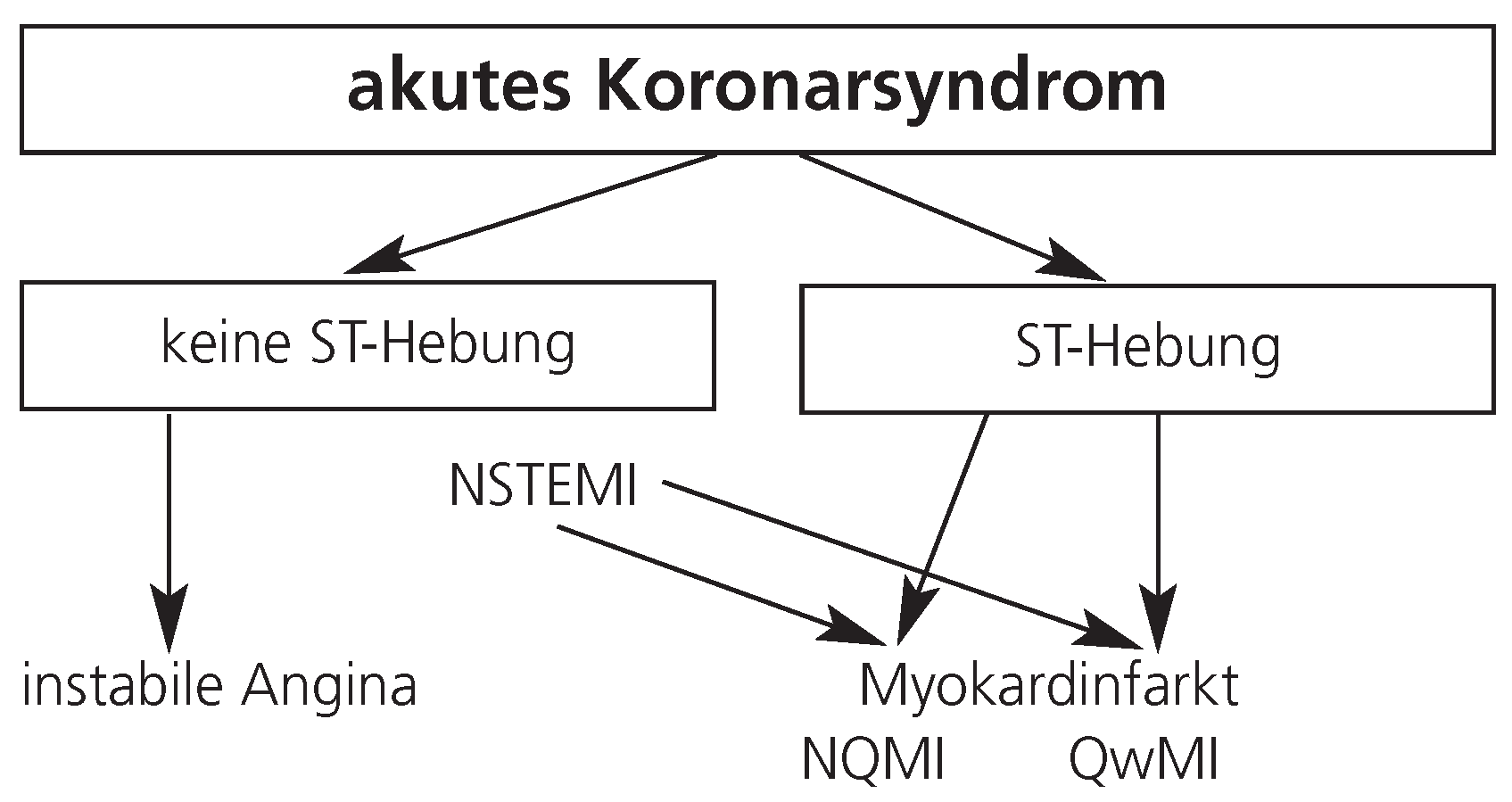
Aktuelle Definition des aku ten Koronarsyndroms ent sprechend den Richtlinien der European Society of Cardiology und des Ameri can College of Cardiology. Nach [
9]. NQMI = Non-Q-wave-Myokardinfarkt; NSTEMI = Non-ST-elevation-Myokardinfarkt; QwMI = Q-wave-Myokardinfarkt; ST = ST-Segment im EKG.
Figure 4.
Aktuelle Definition des aku ten Koronarsyndroms ent sprechend den Richtlinien der European Society of Cardiology und des Ameri can College of Cardiology. Nach [
9]. NQMI = Non-Q-wave-Myokardinfarkt; NSTEMI = Non-ST-elevation-Myokardinfarkt; QwMI = Q-wave-Myokardinfarkt; ST = ST-Segment im EKG.
Figure 5.
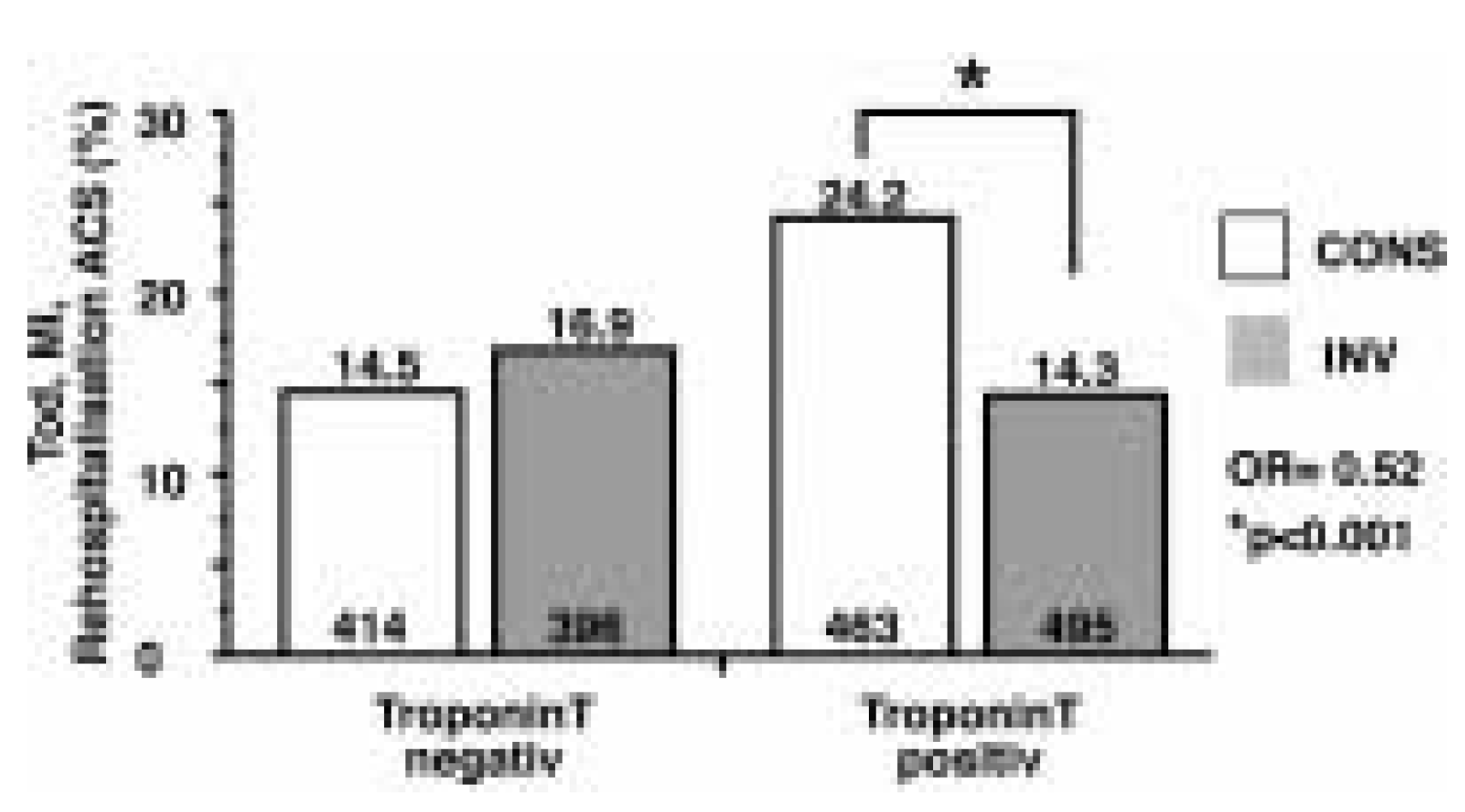
Auswirkungen eines positi ven Troponin T auf klinische Ereignisse nach einer perku tanen koronaren Interven tion bei Patienten mit akutem Koronarsyndrom. Sichtbar ist die deutlichere Wirksamkeit der Akutinter vention (INV) bei Patienten mit positivem Troponin T. Modifiziert nach [
5].
Figure 5.
Auswirkungen eines positi ven Troponin T auf klinische Ereignisse nach einer perku tanen koronaren Interven tion bei Patienten mit akutem Koronarsyndrom. Sichtbar ist die deutlichere Wirksamkeit der Akutinter vention (INV) bei Patienten mit positivem Troponin T. Modifiziert nach [
5].
Table 1.
Verfügbarkeit therapeutischer Massnahmen im Laufe der Zeit bei Patienten mit akutem Koronarsyndrom.
Table 1.
Verfügbarkeit therapeutischer Massnahmen im Laufe der Zeit bei Patienten mit akutem Koronarsyndrom.
Die Neu-Definition des Infarkts als Grundlage des Managements
Die Definition des Herzinfarktes wurde vor kurzem durch die Europäische Gesellschaft für Kardiologie [
9] neu definiert (Abb. 5). Heute wird nicht mehr eigentlich von einem Herzinfarkt, sondern von einem akuten Koro narsyndrom («acute coronary syndrome» [ACS]) gesprochen, welches durch Ruhe schmerzen oder Schmerzen bei geringster An strengung (crescendo angina), EKG-Verände-rungen und / oder Anstiege der Herzenzyme gekennzeichnet ist (Tab. 2). In der biochemi-schen Diagnostik hat sich die Bestimmung der Troponine, in der Regel «Troponin I» oder «Troponin T», durchgesetzt.
Ist die Diagnose – gemäss der neuen Klas sifikation – erst einmal gestellt, so steht heute bei den allermeisten Patienten eine rasche interventionelle Therapie im Vordergrund. Bei Patienten mit ST-Hebungen im EKG, dem früheren transmuralen oder Q-Wellen-Infarkt, bei welchem in aller Regel ein Ver schluss einer grösseren epikardialen Koronar arterie vorliegt, sollte dieser Eingriff mög lichst rasch erfolgen («time is myocardium»).
Bei Patienten mit akutem Koronarsyndrom und anderen Veränderungen im EKG (ST-Senkungen, T-Inversionen) oder nur vorüber gehenden Ruheschmerzen, kann die Interven tion in Ruhe, aber doch möglichst innerhalb der nächsten 24 Stunden erfolgen. Verschiedene Studien haben gezeigt, dass der Vorteil einer interventionellen Therapie vor allem bei Patienten mit einer Erhöhung des Troponins nachweisbar ist (Abb. 5) [
10,
11,
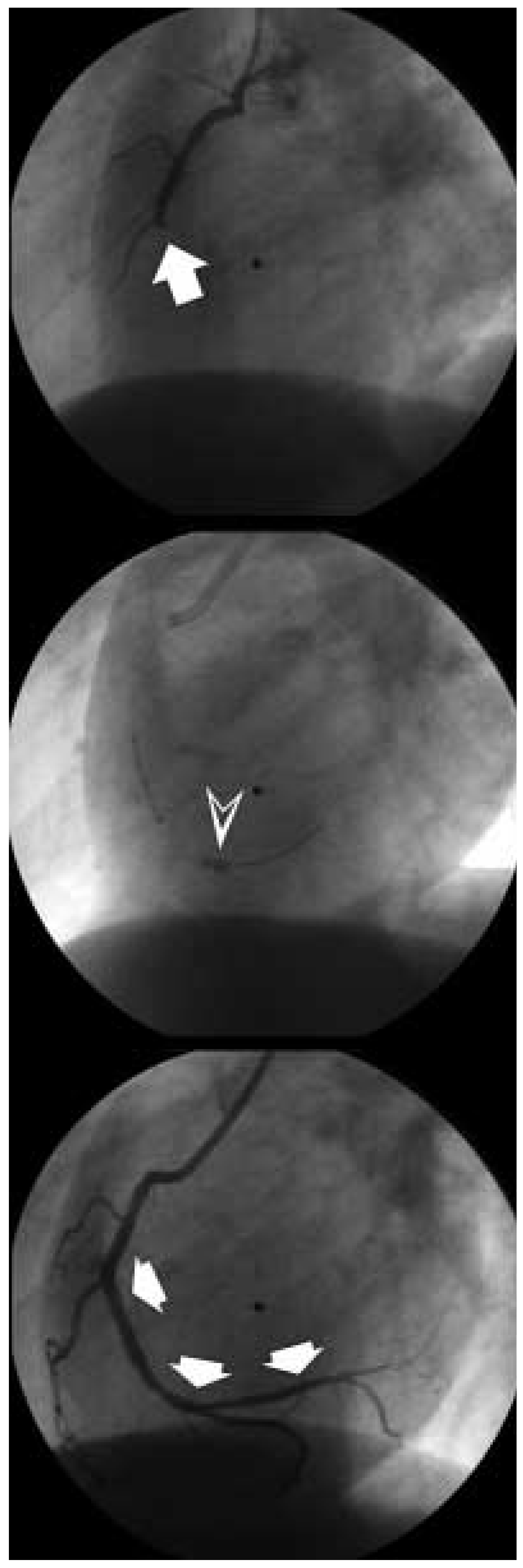
12]. Eine perku tane koronare Intervention erfolgt heute di rekt nach angiographischer Darstellung der infarktbezogenen Arterie. Bei Patienten mit Totalverschluss der Herzkranzarterie und sichtbaren Thromben empfiehlt sich ein Ab saugen des Thrombusmaterials mittels eines intrakoronaren Saugkatheters (Abb. 6) [
13]. Verschiedene Untersuchungen haben gezeigt, dass ein guter Koronarfluss nach der Inter vention prognostisch für den weiteren Verlauf des Patienten bedeutsam ist [14, 15]. Der Erfolg akuter perkutaner Interventionen – bis in die 1990er Jahre noch ein Tabu der inter ventionellen Kardiologie – wurde nur möglich durch die Einführung der Glykoprotein-IIb/IIIa-Antagonisten, welche den «final com mon pathway» der Thrombozytenaktivierung praktisch komplett hemmen [16, 17]. Dazu stehen neben Antikörpern wie Abciximab, der «lead compound» dieser Klasse, heute auch synthetische Moleküle wie Tirofiban und Eptifibatide zur Verfügung.
Figure 6.
Perkutane koronare Inter vention bei einer verschlos senen rechten Koronararterie (Pfeil oben). Das temporäre Occlusions- und Aspirations-Device (PercuSurge®, Guard-Wire®) ermöglicht aufgrund eines kleinen aufblasbaren Ballons an der Spitze des Führungsdrahtes (™) eine Thrombusaspiration unter Protektion peripherer Koro-naräste (Pfeil Mitte). Nach der Intervention besteht ein guter Fluss (Pfeile unten).
Figure 6.
Perkutane koronare Inter vention bei einer verschlos senen rechten Koronararterie (Pfeil oben). Das temporäre Occlusions- und Aspirations-Device (PercuSurge®, Guard-Wire®) ermöglicht aufgrund eines kleinen aufblasbaren Ballons an der Spitze des Führungsdrahtes (™) eine Thrombusaspiration unter Protektion peripherer Koro-naräste (Pfeil Mitte). Nach der Intervention besteht ein guter Fluss (Pfeile unten).
Table 2.
Diagnostische Kriterien.
Table 2.
Diagnostische Kriterien.
Der Verlauf danach
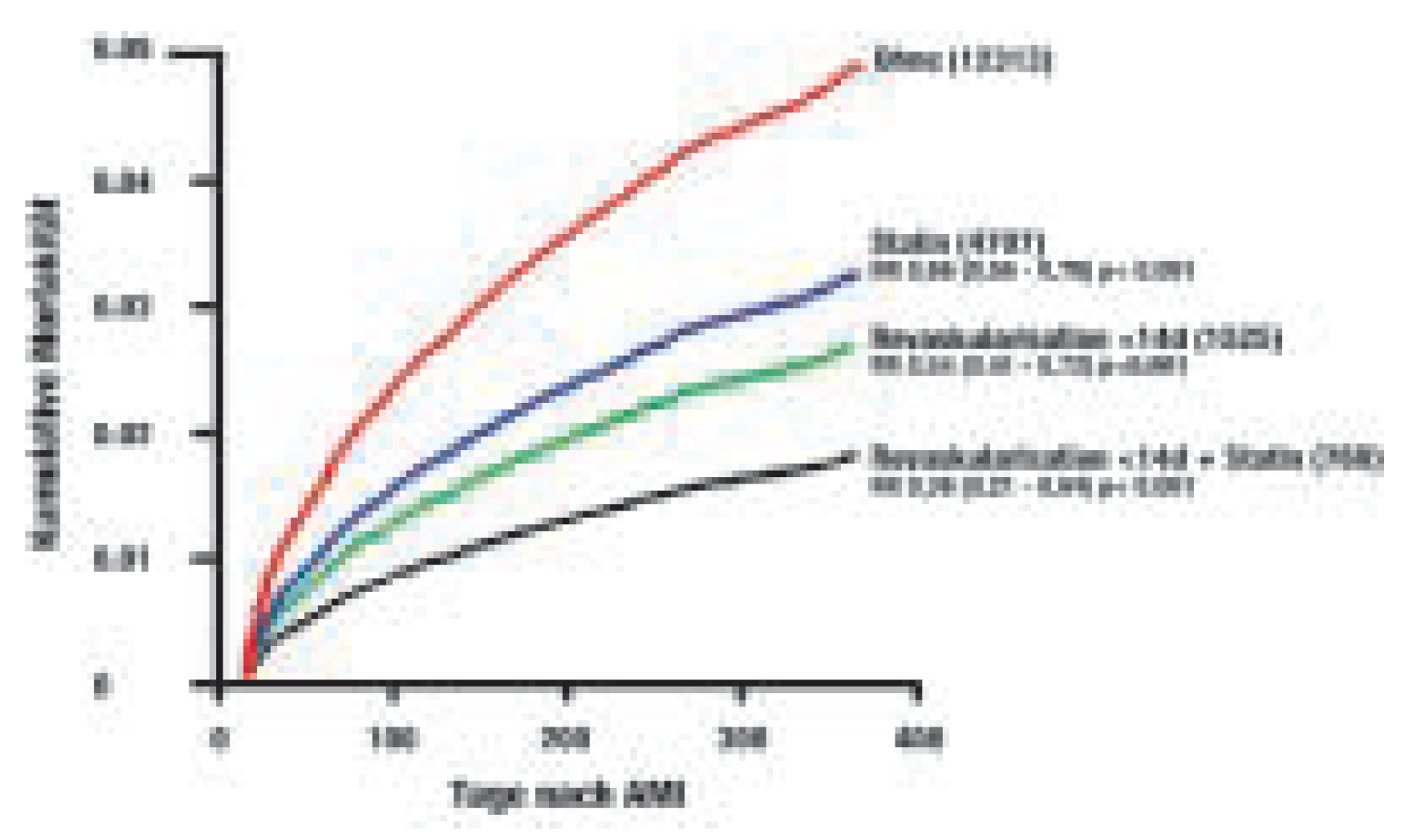
Der Verlauf nach Herzinfarkt bleibt trotz mo-dernster Therapie einschliesslich perkutaner Intervention und Wiedereröffnung des ver schlossenen Gefässes von zahlreichen kardio vaskulären Ereignissen gekennzeichnet (Abb. 7) [
18]. In der Tat erleiden rund 20% der Pa tienten nach dem akuten Ereignis innerhalb eines Jahres einen Reinfarkt, Hirnschlag oder müssen aufgrund von neuauftretenden Sym ptomen erneut untersucht und revaskulari-siert werden. Diese klinische Ereignisrate kann durch die Verwendung von potenten Thrombozytenhemmern wie Aspirin und Clopidogrel, Cholesterin-Senkern sowie den Statinen und Blockern des Renin-Angioten-sin-Systems wie ACE-Hemmer oder Angioten-sin-Rezeptor-Antagonisten reduziert werden. Auch mit optimaler Therapie muss heute noch von einer Ereignisrate von 17% innerhalb von zwei Jahren ausgegangen werden.
Figure 7.
Klinische Ereignisse nach einem akuten Koronarsyndrom über eine Zeitperiode von drei Jahren: Dargestellt sind die kumulativen Ereignisse unter verschiedenen Behandlungen. Modifiziert nach [
18].
Figure 7.
Klinische Ereignisse nach einem akuten Koronarsyndrom über eine Zeitperiode von drei Jahren: Dargestellt sind die kumulativen Ereignisse unter verschiedenen Behandlungen. Modifiziert nach [
18].
Visionen für die Zukunft
Mit der modernen Therapie sind Patienten mit schwer eingeschränkter linksventrikulärer Funktion nach Infarkt seltener geworden. Dennoch entsteht auch bei sehr rasch erfolg ter Revaskularisation immer ein gewisser myokardialer Schaden mit vorerst asympto-matischer linksventrikulärer Dysfunktion, aus der sich über Monate bis Jahre durch Ver-grösserung des linken Ventrikels und Ab nahme der Pumpfunktion eine Herzinsuffizi enz entwickeln kann. Wenn auch ACE-Hem-mer und Angiotensin-Antagonisten dieses Re-modelling, welches zur Herzinsuffizienz führt, mindern, so bleibt die Behandlung doch häu fig palliativ. Entsprechend gehen die moder nen Forschungsbemühungen dahin, eine Regeneration des abgestorbenen Myokards anzustreben. Versuche mit Progenitorzellen aus dem Knochenmark oder aus dem zirkulie-renden Blut haben in unkontrollierten und kleineren randomisierten Studien einen Anstieg der ventrikulären Funktion nach Zelltherapie ergeben. Grosse randomisierte Untersuchungen sind im Moment am laufen, welche die klinische Bedeutung dieser neuen Therapieform etablieren sollen.
Das vorliegende Heft der Kardiovas kulären Medizin befasst sich mit wichtigen Teilaspekten des Myokardinfarktes, nämlich dem Diabetes und seiner Prävention durch körperliches Training, wie es in Finnland erfolgreich verwendet wurde [
19] sowie der Behandlung des Herzinfarktes mittels Glu-kose-Insulin-Kalium-Infusionen [
20]. Schliess lich wird durch Thomas Szucs und Bernhard Meier noch eine Kosten-Nutzen-Analyse der Statin-Therapie nach akutem Koronarsyn drom vorgestellt [
21].