Grimmige Märchen – Alternative Facts über das böse Cholesterin
«Man kann seine eigene Meinung haben, aber nicht seine eigenen Tatsachen»Deborah Lipstadt
Ungewöhnliche Lektüre
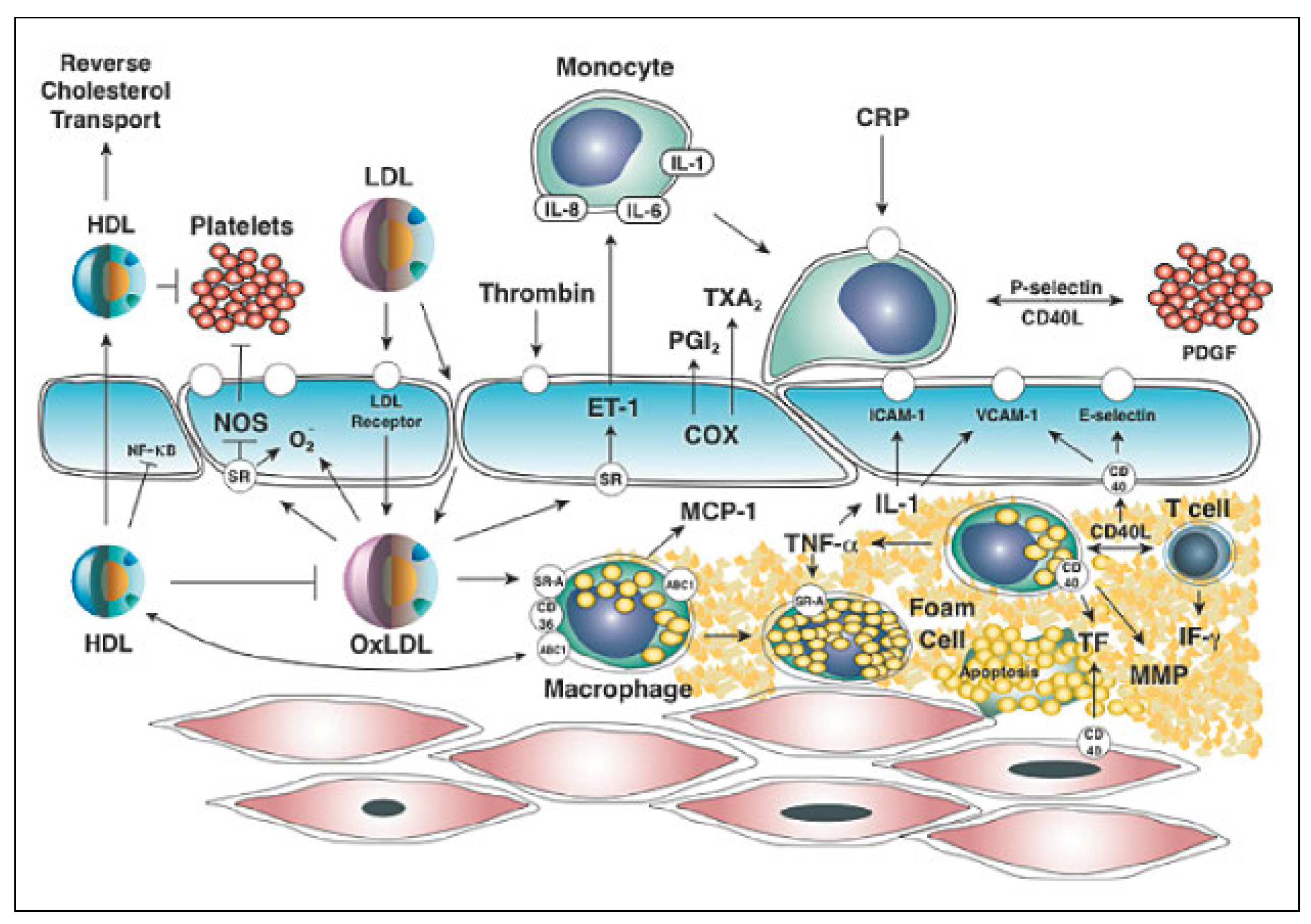
Cholesterin verursacht arteriosklerotische Plaques
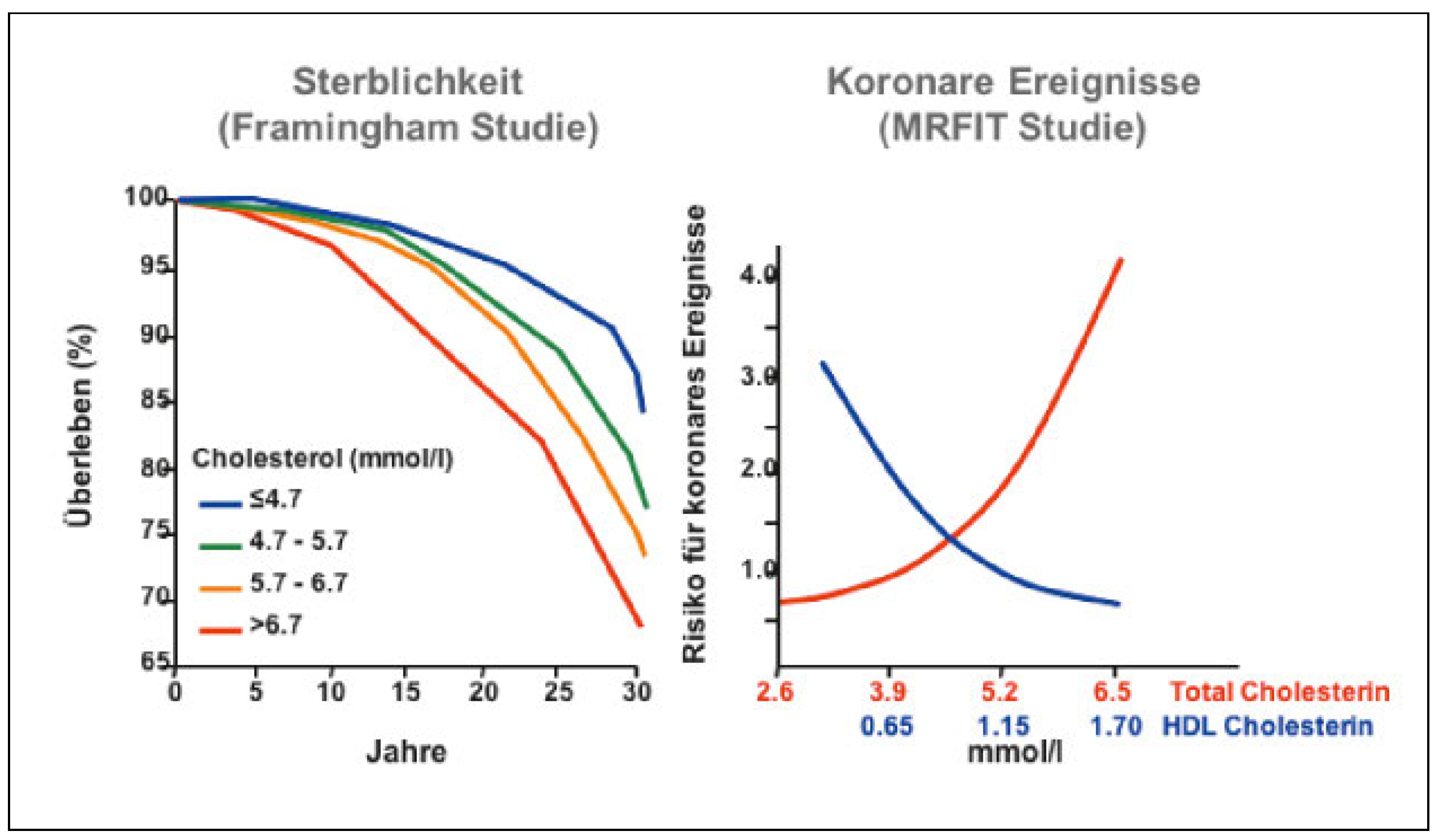
Cholesterin korrelliert mit Infarkt und Tod
Genetik des Cholesterinmetabolismus
Cholesterinsenkung reduziert Infarkt und Herztod
Medienberichte und kardiovaskuläre Sterblichkeit
Cholesterinhypothese und die Kochschen Postulate
- Cholesterin in arteriosklerotischen Plaques findet;
- eine diätetische und/oder genetische Erhöhung des Cholesterinspiegels experimentell und beim Menschen die Ausbildung arteriosklerotischer Plaques fördert;
- die Höhe der Cholesterinspiegel bei Gesunden das Auhreten von Herzinfarkt und Herztod voraussagt;
- in Mendellian Randomization Studies genetisch tiefe bzw. hohe LDL-Cholesterinwerte mit einer tiefen bzw. hohen Rate an Herzinfarkt und Tod einhergehen;
- eine pharmakologische Senkung des LDL-Cholesterins durch Statine, durch Hemmung des NiemannPieck Transporters im Darm oder durch Inaktivierung von PCSK9 das Auhreten von Herzinfarkt, Hirnschlag und Tod vermindert;
- umgekehrt das spontane, aufgrund von Nebenwirkungen oder durch Medienberichte verursachte Absetzen cholesterinsenkender Medikamente das Auhreten kardiovaskulärer Ereignisse erhöht.
Die Rückseite der Medaille
Von der Evidenz zu Empfehlungen
Interessenskonflikte und Evidenz
Schlussfolgerung
Disclosure Statement
References
- Gossweiler, A. Das Märchen vom bösen Cholesterin. Gesundheitstipp 03/2017 vom 16. März 2017, aktualisiert am 3. 17. 20 April. Available online: https://www.gesundheitstipp.ch/artikel/d/das-maerchen-vom-boesen-cholesterin/.
- Osler, W. Lectures on Angina Pectoris and Allied States; Young. J. Pentland: Edinburgh and London.
- Anitschkov, N.N. A history of experimentation on arterial atherosclerosis in animals. In Cowdry’s Atherosclerosis. A Survey of the Problem; Chalres C. Thomas, Springfield, Ill.; Blumenthal, H.T., Ed.; 1933; pp. 21–44. [Google Scholar]
- Akhmedov, A.; Rozenberg, I.; Paneni, P.; Camici, G.G.; Shi, Y.; Doerries, C.; et al. Endothelial overexpression of LOX-1 increases plaque formation and promotes atherosclerosis in vivo. Eur. Heart J. 2014, 35, 2839–2848. [Google Scholar] [CrossRef]
- Libby, P.; Lichtman, H.; Hansson, G.K. Immune Effector Mechanisms Implicated in Atherosclerosis: From Mice to Humans. Immunity 2013, 38, 1092–1104. [Google Scholar] [CrossRef] [PubMed]
- Tanner, F.C.; Noll, G.; Boulanger, C.M.; Lüscher, T.F. Oxidized low-density lipoproteins inhibit relaxations of porcine coronary arteries: Role of scavenger receptor and endothelium-derived nitric oxide. Circulation 1991, 83, 2012–2020. [Google Scholar] [CrossRef]
- Gresham, G.A.; Howard, A.N.; McQueenando, J.; Bowyer, E. Atherosclerosis in primates. Br. J. Exp. Pathol. 1965, 46, 94–103. [Google Scholar]
- Boulanger, C.M.; Tanner, F.C.; Hahn, A.W.A.; Werner, A.; Lüscher, T.F. Oxidized low-density lipoproteins induce mRNA expression and release of endothelin from human and porcine endothelium. Circ. Res. 1992, 70, 1191–1197. [Google Scholar] [CrossRef]
- Libby, P. Inflammation and atherosclerosis. Nature 2002, 420, 869–874. [Google Scholar] [CrossRef]
- Tsao, C.W.; Rosner Preis, S.; Peloso, G.M.; Hwang, S.J.; Kathiresan, S.; Fox, C.S.; et al. Relations of long-term and contemporary lipid levels and lipid genetic risk scores with coronary artery calcium in the Framingham Heart Study. J. Am. Coll. Cardiol. 2012, 60, 2364–2371. [Google Scholar] [CrossRef]
- Assmann, G.; Cullen, P.; Schulte, H. Simple scoring scheme for calculating the risk of acute coronary events based on the 10-year follow-up of the prospective cardiovascular Münster (PROCAM) study. Circulation 2002, 105, 310–315. [Google Scholar] [CrossRef] [PubMed]
- Emerging Risk Factors Collaboration. Lipid-related markers and cardiovascular disease prediction. JAMA 2012, 307, 2499–2506. [Google Scholar] [CrossRef] [PubMed]
- Lewington, S.; Whitlock, G.; Clarke, R.; Sherliker, P.; Emberson, J.; Halsey, J.; Qizilbash, N.; Peto, R.; Collins, R.; Prospective Studies Collaboration. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet 2007, 370, 1829–1839. [Google Scholar]
- Castelli, W.P.; Garrison, R.J.; Wilson, P.W.F.; Abbott, R.D.; Kalousdian, S.; Kannel, W.B. Incidence of coronary heart disease and lipoprotein cholesterol levels: The Framingham Study. JAMA 1986, 256, 2835–2838. [Google Scholar] [CrossRef] [PubMed]
- The Multiple Risk Factor Intervention Trial (MRFIT): A national study of primary prevention of coronary heart disease. JAMA 1976, 235, 825–827. [CrossRef]
- Brown, M.S.; Goldstein, J.L. A receptor-mediated pathwayfor cholesterol homeostasis. Science 1986, 232, 34–47. [Google Scholar] [CrossRef]
- Global Lipids Genetics Consortium. Discovery and refinement of loci associated with lipid levels. Nat. Genet. 2013, 45, 1274–1283. [Google Scholar] [CrossRef]
- Cohen, J.C.; Boerwinkle, E.; Mosley, T.H., Jr.; Hobbs, H.H. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N. Engl. J. Med. 2006, 354, 1264–1272. [Google Scholar] [CrossRef]
- Hopkins, P.N.; Defesche, J.; Fouchier, S.W.; Bruckert, E.; Luc, G.; Cariou, B.; et al. Characterization of Autosomal Dominant Hypercholesterolemia Caused by PCSK9 Gain of Function Mutations and Its Specific Treatment With Alirocumab, a PCSK9 Monoclonal Antibody. Circ. Cardiovasc. Genet. 2015, 8, 823–831. [Google Scholar] [CrossRef]
- Hobbs, H.H.; Brown, M.S.; Russell, D.W.; Davignon, J.; Goldstein, J.L. Deletion in the gene for the low-density-lipoprotein receptor in a majority of French Canadians with familial hypercholesterolemia. N. Engl. J. Med. 1987, 317, 734–737. [Google Scholar] [CrossRef]
- Holmes, M.V.; Asselbergs, F.W.; Palmer, T.M.; et al. Mendellian randomization of blood lipids for coronary artery disease. Eur. Heart J. 2015, 36, 539–550. [Google Scholar] [CrossRef] [PubMed]
- Mabuchi, H.; Koizumi, J.; Shimizu, M.; Kajinami, K.; Miyamoto, S.; Ueda, K.; Takegoshi, T. Long-term efficacy of low-density lipoprotein apheresis on coronary heart disease in familial hypercholesterolemia. Hokuriku-FH-LDL-Apheresis Study Group. Am. J. Cardiol. 1998, 82, 1489–1495. [Google Scholar] [CrossRef]
- Akiro, A.E. A gift from nature: the birth of the statins. Nat. Med. 2008, 10, 1050–1052. [Google Scholar] [CrossRef]
- Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994, 344, 1383–1389. [CrossRef]
- Mihaylova, B.; Emberson, J.; Blackwell, L.; Keech, A.; Simes, J.; Barnes, E.H.; et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Cholesterol Treatment Trialists’ (CTT) Collaborators, Lancet 2012, 380, 581–590. [Google Scholar] [PubMed]
- LaRosa, J.C.; Grundy, S.M.; Waters, D.D.; Shear, C.; Barter, P.; Fruchart, J.C.; Treating to New Targets (TNT) Investigators; et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N. Engl. J. Med. 2005, 352, 1425–1435. [Google Scholar] [CrossRef]
- Cannon, C.P.; Blazing, M.A.; Giugliano, R.P.; McCagg, A.; White, J.A.; Theroux, P.; Darius, H.; for the IMPROVE-IT Investigators; et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N. Engl. J. Med. 2015, 372, 2387–2397. [Google Scholar] [CrossRef]
- Thompson, R.C.; Allam, A.H.; Lombardi, G.P.; Wann, L.S.; Sutherland, M.L.; Sutherland, J.D.; et al. Atherosclerosis across 4000 years of human history: the Horus study of four ancient populations. Lancet. 2013, 381, 1211–1222. [Google Scholar] [CrossRef]
- Sabatine, M.S.; Giugliano, R.P.; Keech, A.C.; Honarpour, N.; Wiviott, S.D.; Murphy, S.A.; FOURIER Steering Committee and Investigators; et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N. Engl. J. Med. 2017, 376, 1713–1722. [Google Scholar] [CrossRef]
- Ridker, P.M.; Revkin, J.; Amarenco, P.; Brunell, R.; Curto, M.; Civeira, F.; SPIRE Cardiovascular Outcome Investigators; et al. Cardiovascular Efficacy and Safety of Bococizumab in High-Risk Patients. N. Engl. J. Med. 2017, 376, 1527–1539. [Google Scholar] [CrossRef]
- Ference, B.A.; Cannon, C.P.; Landmesser, U.; Lüscher, T.F.; Catapano, A.L.; Ray, K.K. A comparison of the efficacy of PCSK9 inhibitors and statins for reducing cardiovascular events. Eur. Heart J. 2017, in press. [Google Scholar]
- Nielsen, S.F.; Nordestgaard, B.G. Negative statin-related news stories decrease statin persistence and increase myocardial infarction and cardiovascular mortality: a nationwide prospective cohort study. Eur. Heart J. 2016, 37, 908–916. [Google Scholar] [CrossRef]
- Lüscher, T.F. Gibt es Dogmen in der Medizin? Cardiovasc. Med. 2017, 20, 111–114. [Google Scholar] [CrossRef]
- Ference, B.A.; Ginsberg, H.N.; Graham, I.; Ray, K.K.; Packard, C.J.; Bruckert, E.; et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur. Heart J. 2017. Epub ahead of print. [Google Scholar] [CrossRef] [PubMed]
- Stroes, E.S.; Thompson, P.D.; Corsini, A.; Vladutiu, G.D.; Raal, F.J.; Ray, K.K.; European Atherosclerosis Society Consensus Panel; et al. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur. Heart J. 2015, 36, 1012–1022. [Google Scholar] [CrossRef]
- Kant, I. Die Kritik der praktischen Vernunft. In Immanuel Kant: Die drei Kritiken; Alfred Kröner Verlag: Stuttgart, Germany, 1969. [Google Scholar]
- Lüscher, T.F. Gedankenmedizin. Heilkunst zwischen Philosophie, Wirtschaft und Wissenschaft – Von den Anfängen bis ins 21. Jahrhundert; Springer: Heidelberg, Germany, 2015. [Google Scholar]
- Landmesser, U.; John Chapman, M.; Farnier, M.; Gencer, B.; Gielen, S.; Hovingh, G.K.; European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS); et al. European Society of Cardiology/European Atherosclerosis Society Task Force consensus statement on proprotein convertase subtilisin/kexin type 9 inhibitors: practical guidance for use in patients at very high cardiovascular risk. Eur. Heart J. 2016. Epub ahead of print. [Google Scholar] [CrossRef] [PubMed]
- Catapano, A.L.; Graham, J.; de Backer, G.; et al. ESC/EAS Guidelines for the managment of dyslipidemias. Eur. Heart J. 2016, 37, 2999–3058. [Google Scholar] [CrossRef]
- Ray, K.K.; Kastelein, J.J.; Matthijs Boekholdt, S.; Nicholls, S.J.; Khaw, K.T.; Ballantyne, C.M.; et al. The ACC/AHA 2013 guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: the good the bad and the uncertain: a comparison with ESC/EAS guidelines for the management of dyslipidaemias 2011. Eur. Heart J. 2014, 35, 960–968. [Google Scholar] [CrossRef] [PubMed]
- Berry, J.D.; Dyer, A.; Cai, X.; Garside, D.B.; Ning, H.; Thomas, A.; et al. Lifetime risks of cardiovascular disease. N. Engl. J. Med. 2012, 366, 321–329. [Google Scholar] [CrossRef]
- Schwartz, G.G.; Olsson, A.G.; Abt, M.; Ballantyne, C.M.; Barter, P.J.; Brumm, J.; dal-OUTCOMES Investigators; et al. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N. Engl. J. Med. 2012, 367, 2089–2099. [Google Scholar] [CrossRef]
- Nicholls, S.J.; Ray, K.K.; Ballantyne, C.M.; Beacham, L.A.; Miller, D.L.; Ruotolo, G.; ACCENTUATE Investigators; et al. Comparative effects of cholesteryl ester transfer protein inhibition, statin or ezetimibe on lipid factors: The ACCENTUATE trial. Atherosclerosis 2017, 261, 12–18. [Google Scholar] [CrossRef]
- Barter, P.J.; Caulfield, M.; Eriksson, M.; Grundy, S.M.; Kastelein, J.J.; Komajda, M.; et al. ILLUMINATE Investigators. Effects of torcetrapib in patients at high risk for coronary events. N. Engl. J. Med. 2007, 357, 2109–2122. [Google Scholar] [CrossRef]
- Lüscher, T.F. Conflicts of interest and the truth of scientific discovery: an editor’s perspective. Eur. Heart J. 2016, 37, 738–740. [Google Scholar] [CrossRef][Green Version]
- Popper, K. Conjectures and refutations.The growth of scientific knowledge; Routledge and Kegan Paul: London, UK, 1974. [Google Scholar][Green Version]

© 2017 by the author. Attribution-Non-Commercial-NoDerivatives 4.0.
Share and Cite
Lüscher, T.F. Grimmige Märchen – Alternative Facts über das böse Cholesterin. Cardiovasc. Med. 2017, 20, 141. https://doi.org/10.4414/cvm.2017.00487
Lüscher TF. Grimmige Märchen – Alternative Facts über das böse Cholesterin. Cardiovascular Medicine. 2017; 20(6):141. https://doi.org/10.4414/cvm.2017.00487
Chicago/Turabian StyleLüscher, Thomas F. 2017. "Grimmige Märchen – Alternative Facts über das böse Cholesterin" Cardiovascular Medicine 20, no. 6: 141. https://doi.org/10.4414/cvm.2017.00487
APA StyleLüscher, T. F. (2017). Grimmige Märchen – Alternative Facts über das böse Cholesterin. Cardiovascular Medicine, 20(6), 141. https://doi.org/10.4414/cvm.2017.00487



