EKG bei akuten Koronarsyndromen
Abstract
Einleitung
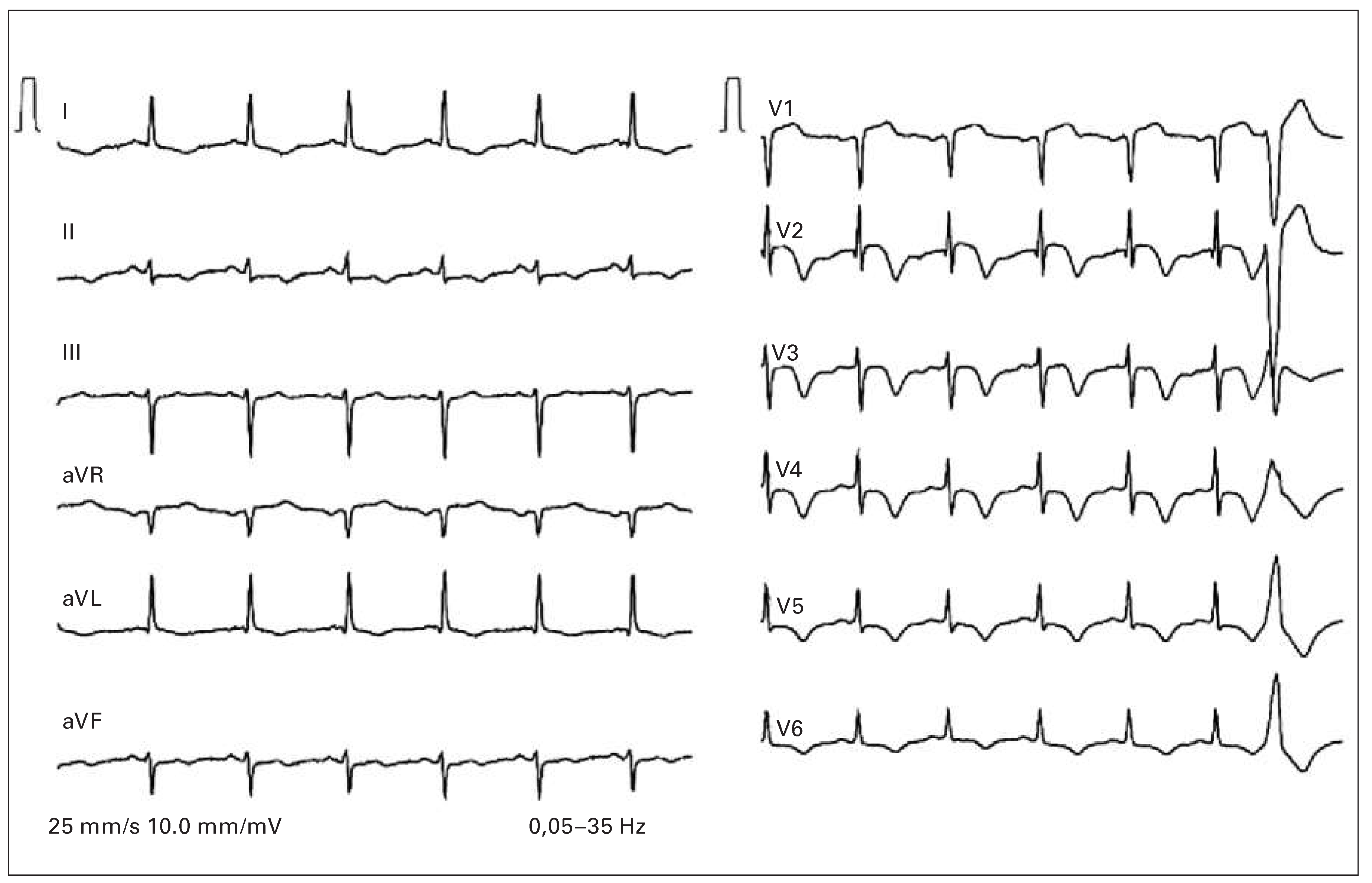
ST-Hebungen
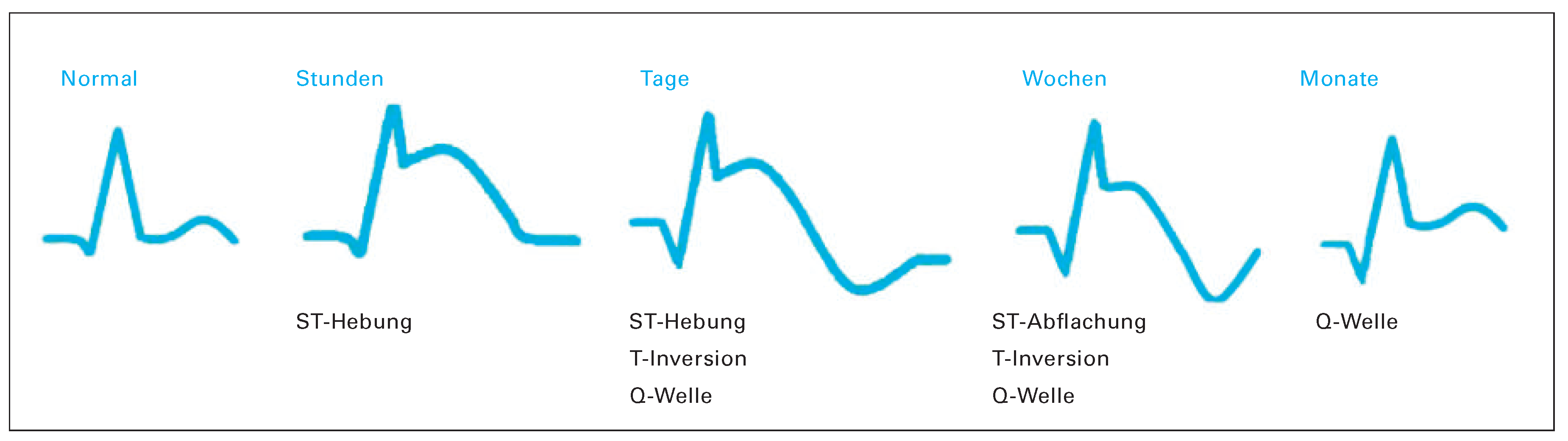
ST-Senkungen
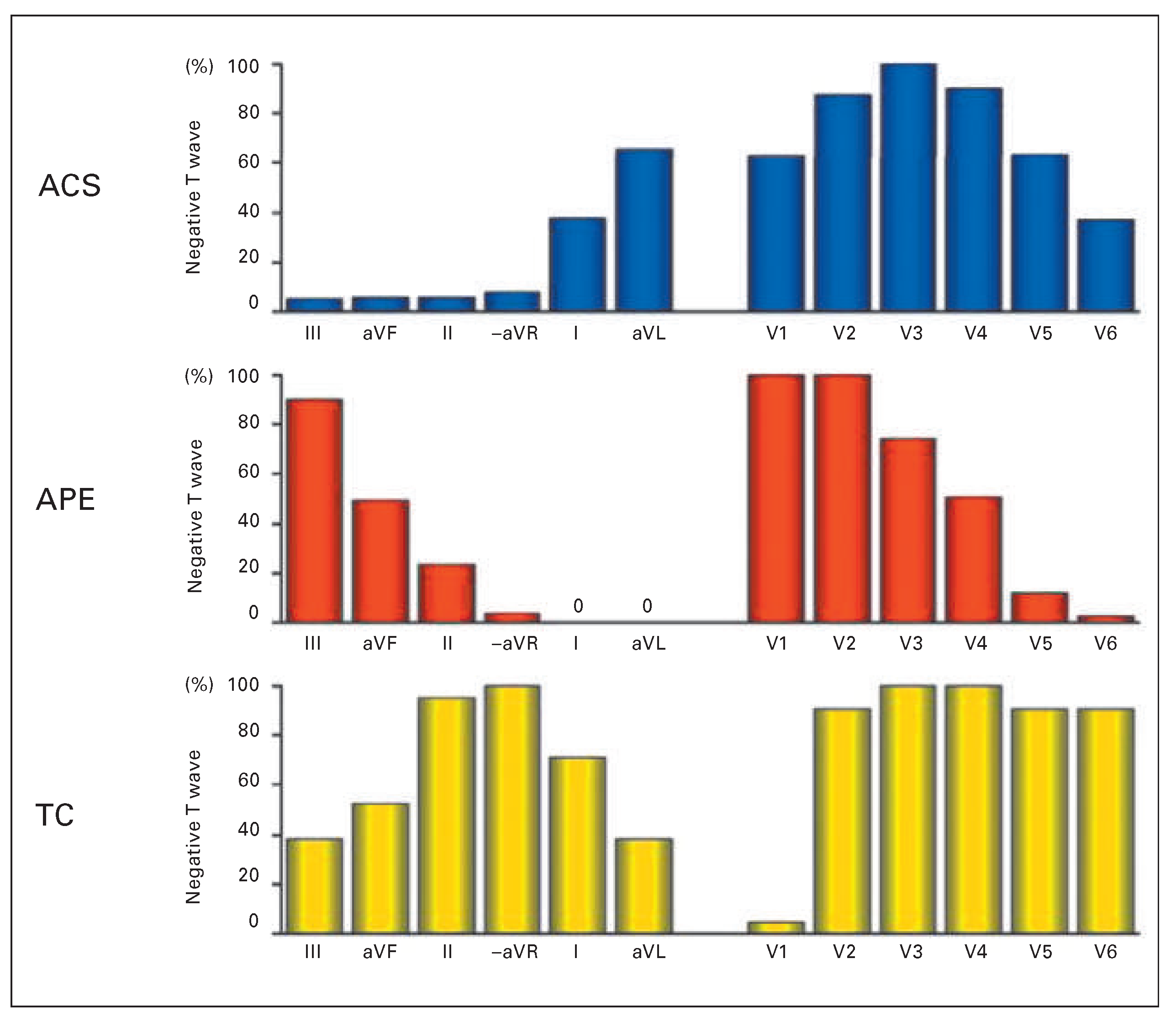
T-Inversionen
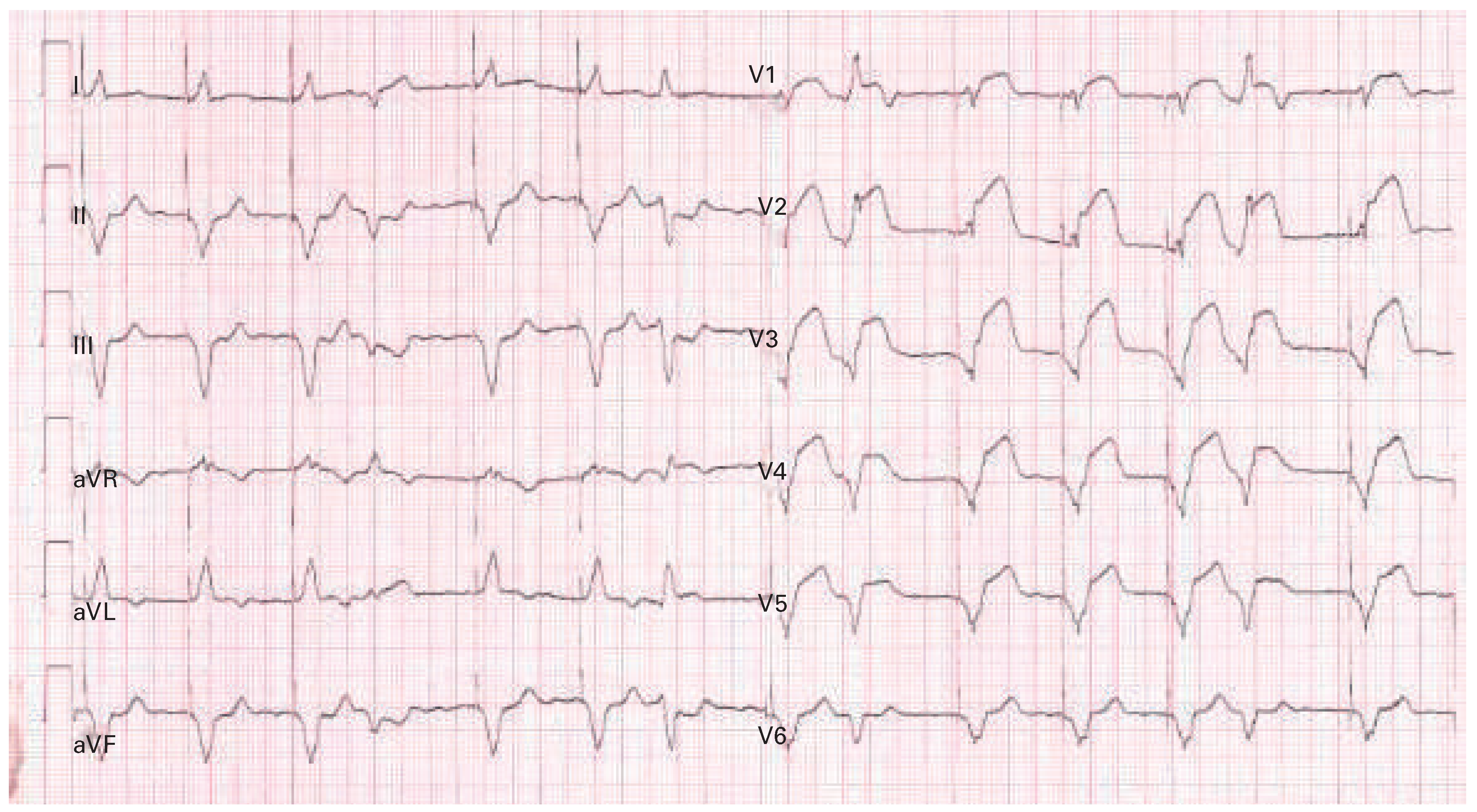
Atypische EKG-Präsentationen
ST-Hebungen in aVR
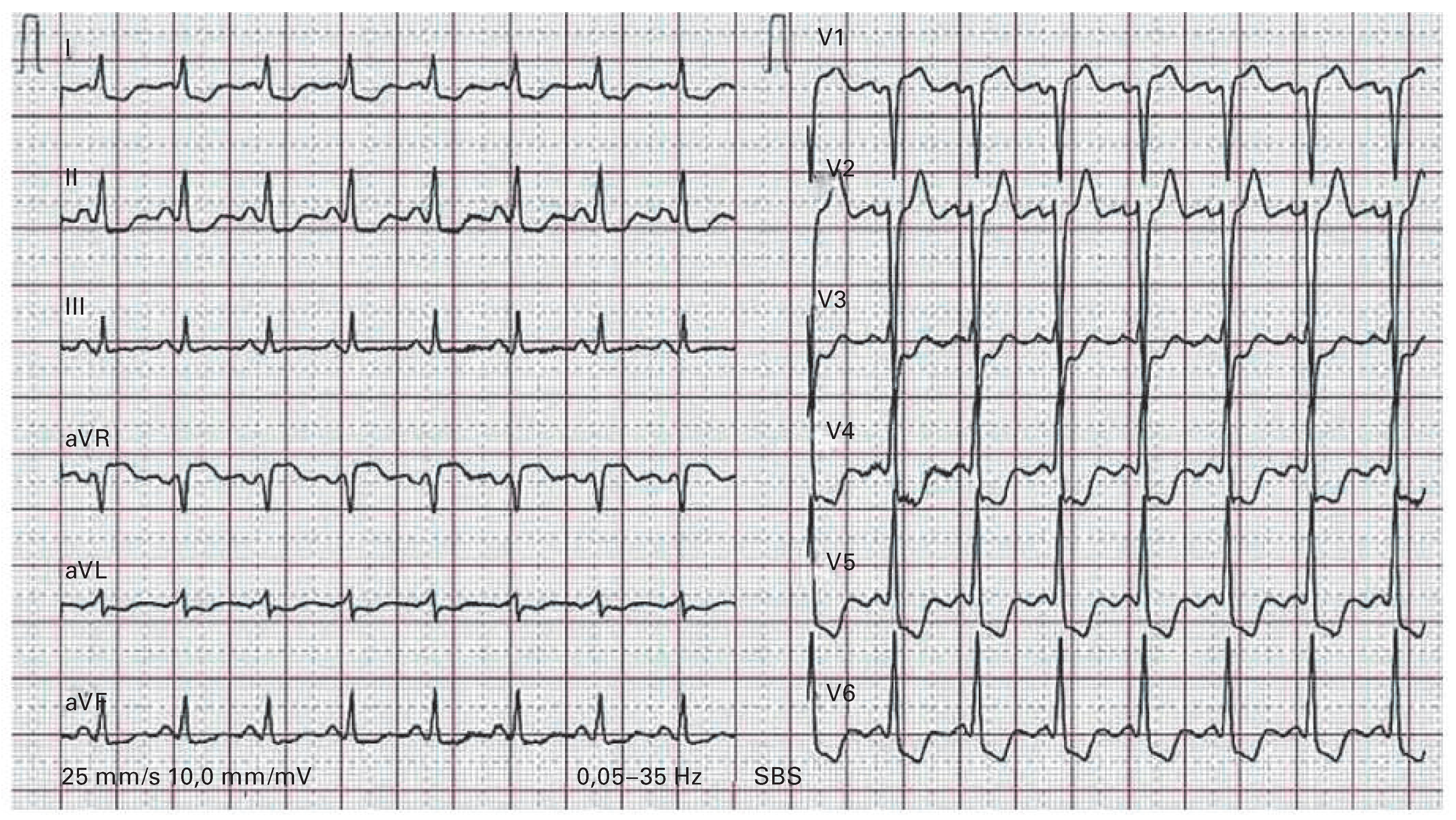
ST-Senkungen in V1–V3
Ischämische Symptome ohne diagnostische EKG-Veränderungen
Neuaufgetretener Linksschenkelblock (LSB)
Bekannter Linksschenkelblock / ventrikuläre Schrittmacherstimulation
Telemedizinische EKG-Übertragungen in der Akutmedizin (Prehospital-ECG)
Schlussfolgerungen
Finanzierung/Interessenkonflikte
Literatur
- -
- Die vollständige nummerierte Literaturliste finden Sie an die Online-Version angehängt unter www.cardiovascmed.ch.
References
- Smith, F.M. The ligation of coronary arteries with electrocardiographic study. Arch Intern Med. 1918, 22, 8–27. [Google Scholar] [CrossRef]
- Pardee, H.E.B. An electrocardiographic sign of coronary artery obstruction. Arch Intern Med. 1920, 26, 244–57. [Google Scholar] [CrossRef]
- Sterblichkeit und deren Hauptursachen in der Schweiz. Bundesamt für Statistik, 29.4.2013.
- Steg, P.G.; James, S.K.; Atar, D.; Badano, L.P.; BlomstromLundqvist, C.; Borger, M.A.; et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012, 33, 2569–619. [Google Scholar] [CrossRef]
- Hamm, C.W.; Bassand, J.P.; Agewall, S.; Bax, J.; Boersma, E.; Bueno, H.; et al. and Guidelines ESCCfP. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2011, 32, 2999–3054. [Google Scholar]
- Otto, L.A.; Aufderheide, T.P. Evaluation of ST segment elevation criteria for the prehospital electrocardiographic diagnosis fo acute myocardial infarction. Ann Emerg Med. 1994, 23, 17–24. [Google Scholar] [CrossRef]
- Zehender, M.; Kasper, W.; Kauder, E.; Schonthaler, M.; Geibel, A.; Olschewski, M.; et al. Right ventricular infarction as an independent predictor of prognosis after acute inferior myocardial infarction. N Engl J Med. 1993, 328, 981–8. [Google Scholar] [CrossRef]
- Lee, H.S.; Cross, S.J.; Rawles, J.M.; Jennings, K.P. Patients with suspected myocardial infarction who present with ST depression. Lancet. 1993, 342, 1204–7. [Google Scholar] [CrossRef]
- Hyde, T.A.; French, J.K.; Wong, C.K.; Straznicky, I.T.; Whitlock, R.M.; White, H.D. Four-year survival of patients with acute coronary syndromes without ST-segment elevation and prognostic significance of 0.5–mm ST-segment depression. Am J Cardiol. 1999, 84, 379–85. [Google Scholar] [CrossRef] [PubMed]
- Kaul, P.; Fu, Y.; Chang, W.C.; Harrington, R.A.; Wagner, G.S.; Goodman, S.G.; et al. and Network GIIPIIAftRoAGO. Prognostic value of ST segment depression in acute coronary syndromes: insights from PARAGON-A applied to GUSTO-IIb. PARAGON-A and GUSTO IIb Investigators. Platelet IIb/IIIa Antagonism for the Reduction of Acute Global Organization Network. J Am Coll Cardiol. 2001, 38, 64–71. [Google Scholar]
- Stephan, F.; Kühne, M. Wellens-Zeichen im EKG. Cardiovascular Medicine. 2013, 16, 155–6. [Google Scholar]
- de Zwaan, C.; Bar, F.W.; Wellens, H.J. Characteristic electrocardiographic pattern indicating a critical stenosis high in left anterior descending coronary artery in patients admitted because of impending myocardial infarction. Am Heart J. 1982, 103, 730–6. [Google Scholar]
- Haines, D.E.; Raabe, D.S.; Gundel, W.D.; Wackers, F.J. Anatomic and prognostic significance of new T-wave inversion in unstable angina. Am J Cardiol. 1983, 52, 14–8. [Google Scholar] [CrossRef] [PubMed]
- de Zwaan, C.; Bar, F.W.; Janssen, J.H.; Cheriex, E.C.; Dassen, W.R.; Brugada, P.; et al. Angiographic and clinical characteristics of patients with unstable angina showing an ECG pattern indicating critical narrowing of the proximal LAD coronary artery. Am Heart J. 1989, 117, 657–65. [Google Scholar] [CrossRef] [PubMed]
- Kosuge, M.; Ebina, T.; Hibi, K.; Tsukahara, K.; Iwahashi, N.; Gohbara, M.; et al. Differences in negative T waves among acute coronary syndrome, acute pulmonary embolism, and Takotsubo cardiomyopathy. Eur Heart J Acute Cardiovasc Care. 2012, 1, 349–57. [Google Scholar] [CrossRef] [PubMed]
- Isbary, M.; Schreen, C.; Christen, S. Aschenputtel. Cardiovascular Medicine. 2011, 14, 165–166. [Google Scholar]
- Knotts, R.J.; Wilson, J.M.; Kim, E.; Huang, H.D.; Birnbaum, Y. Diffuse ST depression with ST elevation in aVR: Is this pattern specific for global ischemia due to left main coronary artery disease? J Electrocardiol. 2013, 46, 240–8. [Google Scholar] [CrossRef]
- Sgarbossa, E.B.; Pinski, S.L.; Barbagelata, A.; Underwood, D.A.; Gates, K.B.; Topol, E.J.; et al. Electrocardiographic diagnosis of evolving acute myocardial infarction in the presence of left bundle-branch block. GUSTO-1 (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries) Investigators. N Engl J Med. 1996, 334, 481–7. [Google Scholar] [CrossRef]
- Sgarbossa, E.B.; Pinski, S.L.; Gates, K.B.; Wagner, G.S. Early electrocardiographic diagnosis of acute myocardial infarction in the presence of ventricular paced rhythm. GUSTO-I investigators. Am J Cardiol. 1996, 77, 423–4. [Google Scholar] [CrossRef]
- Maloy, K.R.; Bhat, R.; Davis, J.; Reed, K.; Morrissey, R. Sgarbossa criteria are highly specific for acute myocardial infarction with pacemakers. West J Emerg Med. 2010, 11, 354–7. [Google Scholar]
- Smith, S.W.; Dodd, K.W.; Henry, T.D.; Dvorak, D.M.; Pearce, L.A. Diagnosis of ST-elevation myocardial infarction in the presence of left bundle branch block with the ST-elevation to S-wave ratio in a modified Sgarbossa rule. Ann Emerg Med. 2012, 60, 766–76. [Google Scholar] [CrossRef]
- Li, S.F.; Walden, P.L.; Marcilla, O.; Gallagher, E.J. Electrocardiographic diagnosis of myocardial infarction in patients with left bundle branch block. Ann Emerg Med. 2000, 36, 561–5. [Google Scholar] [CrossRef] [PubMed]
- Sokolove, P.E.; Sgarbossa, E.B.; Amsterdam, E.A.; Gelber, R.; Lee, T.C.; Maynard, C.; et al. Interobserver agreement in the electrocardiographic diagnosis of acute myocardial infarction in patients with left bundle branch block. Ann Emerg Med. 2000, 36, 566–71. [Google Scholar] [CrossRef] [PubMed]
- Quinn, T.; Johnsen, S.; Gale, C.P.; Snooks, H.; McLean, S.; Woollard, M.; et al. and Myocardial Ischaemia National Audit Project Steering G. Effects of prehospital 12-lead ECG on processes of care and mortality in acute coronary syndrome: a linked cohort study from the Myocardial Ischaemia National Audit Project. Heart 2014, 100, 944–50. [Google Scholar]
- Squire, B.T.; Tamayo-Sarver, J.H.; Rashi, P.; Koenig, W.; Niemann, J.T. Effect of prehospital cardiac catheterization lab activation on door-to-balloon time, mortality, and falsepositive activation. Prehosp Emerg Care. 2014, 18, 1–8. [Google Scholar] [CrossRef]
- Noc, M.; Fajadet, J.; Lassen, J.F.; Kala, P.; MacCarthy, P.; Olivecrona, G.K.; et al. European Association for Percutaneous Cardiovascular I and Stent for Life G. Invasive coronary treatment strategies for out-of-hospital cardiac arrest: a consensus statement from the European association for percutaneous cardiovascular interventions (EAPCI)/stent for life (SFL) groups. EuroIntervention 2014, 10, 31–7. [Google Scholar]
| ST-Hebungen | Fixiert/chronisch | Dynamisch/akut |
| Normalvarianten, z.B. frühe Repolarisation | Akute intrakranielle Prozesse | |
| Blockbilder | Akute Peri(myo)karditis | |
| Linksventrikuläre Hypertrophie | Akute Lungenembolien | |
| Hypertrophe Kardiomyopathie | Elektrolytstörungen | |
| Ventrikuläre Schrittmacherstimulation | Tako-Tsubo-Kardiomyopathie | |
| ST-Senkungen | Fixiert/chronisch | Dynamisch/akut |
| Blockbilder | Akute Peri(myo)karditis | |
| Linksventrikuläre Hypertrophie | Akute Lungenembolien | |
| Hypertrophe Kardiomyopathie | Elektrolytstörungen | |
| Chronische Ischämie | Hypertensive Krise | |
| Ventrikuläre Schrittmacherstimulation | Hyperventilation | |
| Pankreatitis | ||
| Post-Tachykardie / Konversion | ||
| Tako-Tsubo-Kardiomyopathie | ||
| Negative T-Wellen | Fixiert/chronisch | Dynamisch/akut |
| Normalvarianten, z.B. Frauen, Jugendliche | Akute Peri(myo)karditis | |
| Stattgehabter Herzinfarkt | Akute Lungenembolien | |
| Chronische Ischämie | Tako-Tsubo-Kardiomyopathie | |
| Kardiomyopathien | Elektrolytstörungen | |
| Blockbilder | Post-Tachykardie / Konversion | |
| Linksventrikuläre Hypertrophie | ||
| Ventrikuläre Schrittmacherstimulation | ||
| Prominente T-Wellen | Fixiert/chronisch | Dynamisch/akut |
| Normalvarianten, z.B. frühe Repolarisation | Elektrolytstörungen | |
| Akute intrakranielle Prozesse (Stroke, Subarachnoidalblutung) |
© 2015 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Wyss, C. EKG bei akuten Koronarsyndromen. Cardiovasc. Med. 2015, 18, 163. https://doi.org/10.4414/cvm.2015.00321
Wyss C. EKG bei akuten Koronarsyndromen. Cardiovascular Medicine. 2015; 18(5):163. https://doi.org/10.4414/cvm.2015.00321
Chicago/Turabian StyleWyss, Christophe. 2015. "EKG bei akuten Koronarsyndromen" Cardiovascular Medicine 18, no. 5: 163. https://doi.org/10.4414/cvm.2015.00321
APA StyleWyss, C. (2015). EKG bei akuten Koronarsyndromen. Cardiovascular Medicine, 18(5), 163. https://doi.org/10.4414/cvm.2015.00321




