Schweizer Alpkäse, Alpha-Linolensäure und kardiovaskuläre Protektion
Abstract
Mythos der alpinen Langlebigkeit
Vom Mythos zu positiven Assoziationen und pathophysiologischen Mechanismen
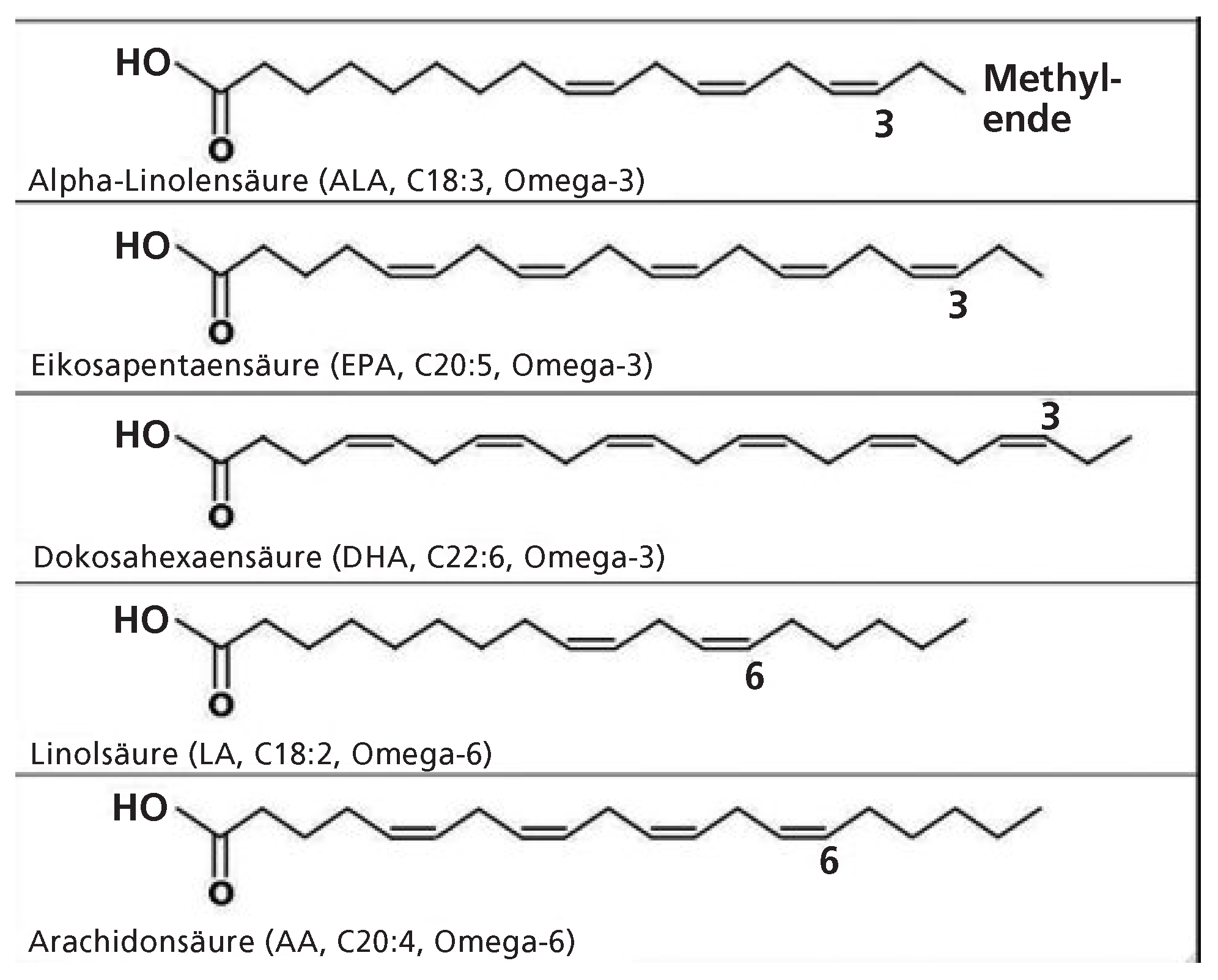
Biochemie der Omega-3-Fettsäuren
Wirkungsmechanismen
Klinische Effekte der Omega-3-Fettsäuren
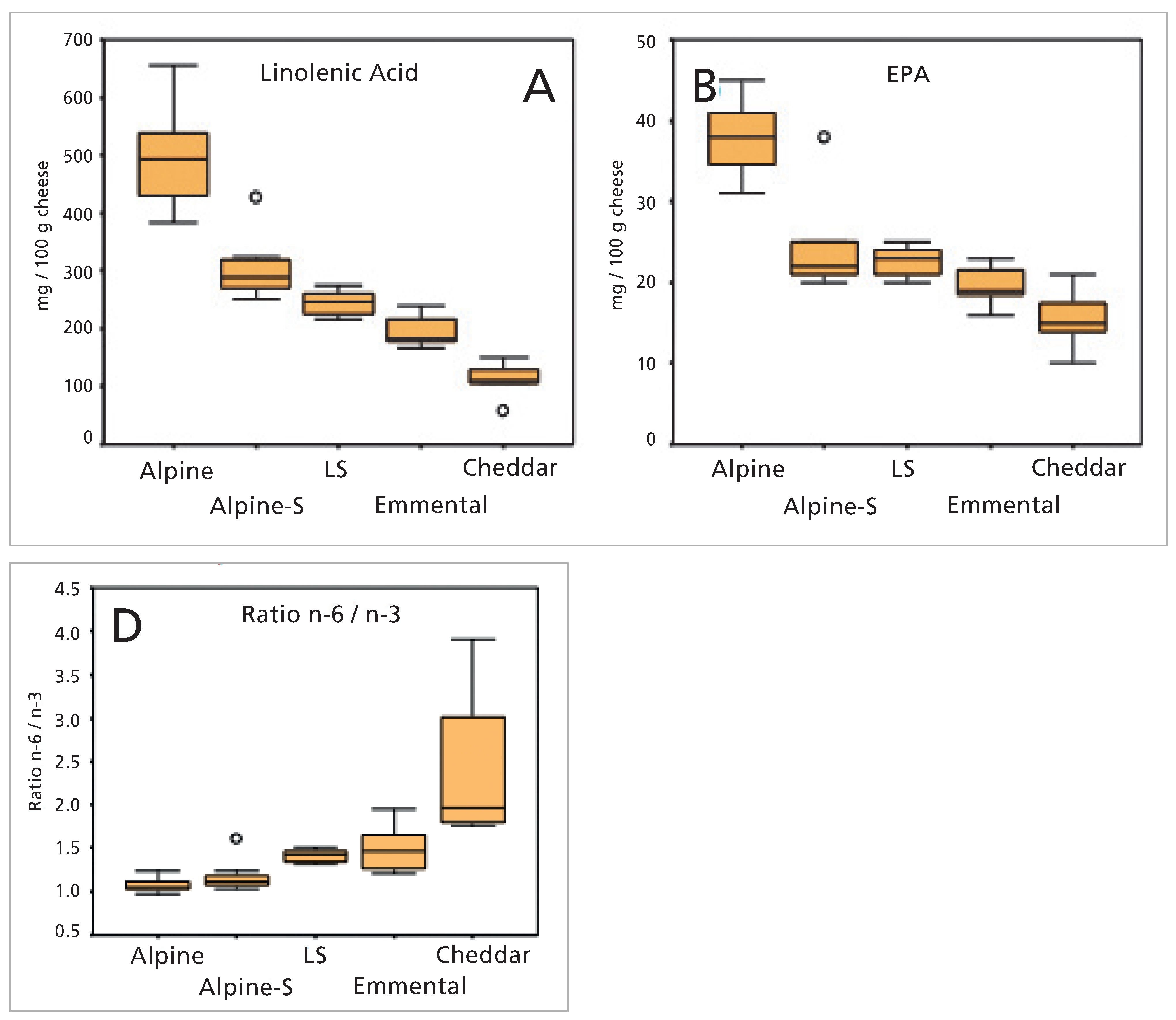
Vorteile des Alpkäse-Fett-Profils
- (a)
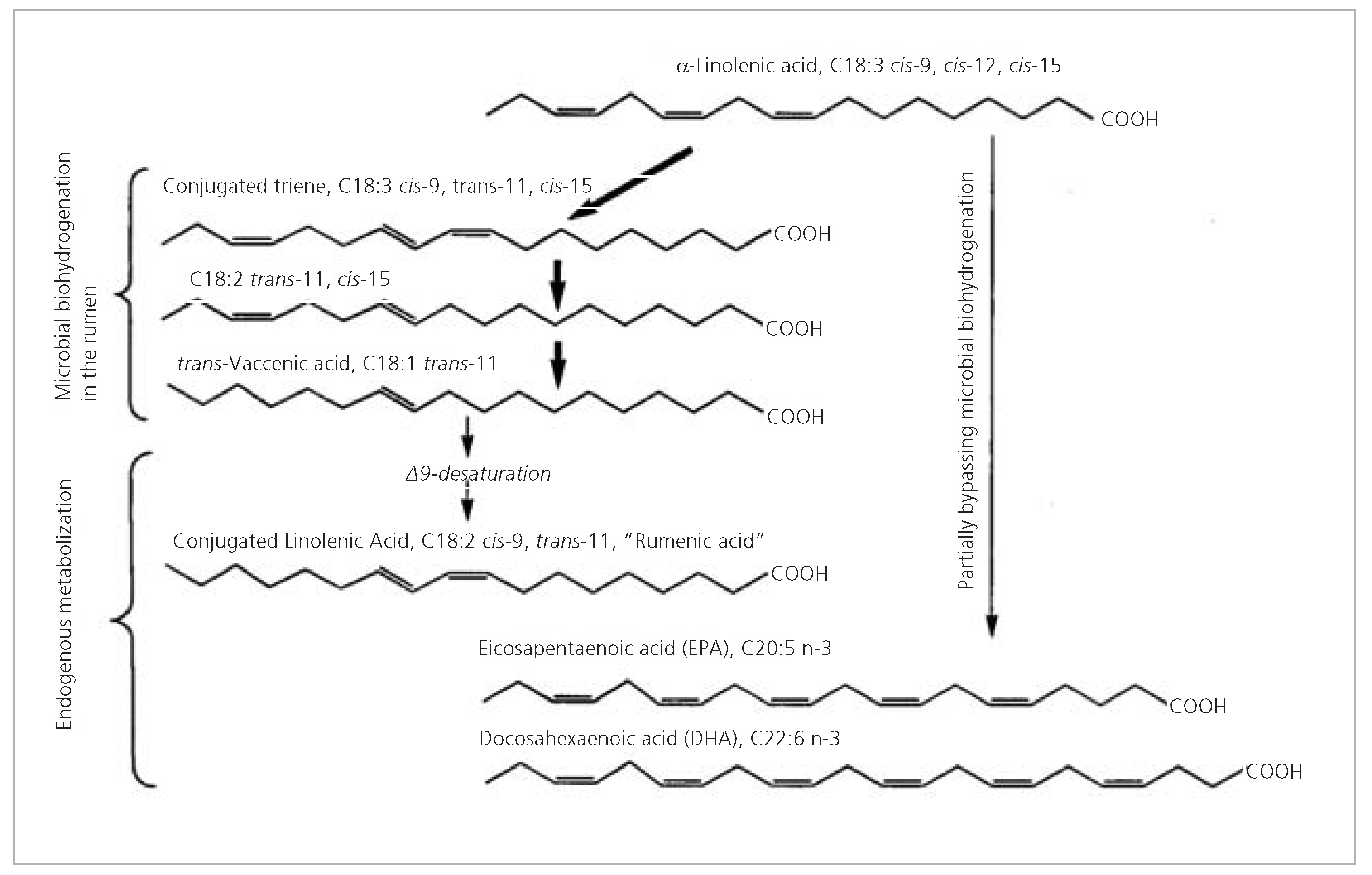
- Durch Biohydrierung von Alphalinolensäure im Pansenmagen der Kuh durch das Bakterium Butyriovibrio fibrisolvens entsteht konjugierte Linolsäure (CLA). CLA zeigt in vitro und im Tierversuch antiatherogene, antidiabetische und antikarzinogene Effekte [49]. Somit trägt möglicherweise der erhöhte CLA-Gehalt zum günstigen Fettsäureprofil des Alpkäses bei (Abb. 6).
- (b)
- (c)
- Der Verzicht auf Kraftfutter und die Verfütterung von Gras als ausschliessliche Futterbasis führt zu einer signifikanten Zunahme des Gesamtgehaltes an mehrfach ungesättigten Fettsäuren (PUFA, polyunsaturated fatty acids) in der Milch.
- (d)
- Bei einer alleinigen Grasfütterung sinkt der Omega-6-Fettsäurengehalt der Milch, wodurch wiederum der Ratio von Omega-6 zu Omega-3 sinkt [52].
- (e)
- Die Alp-Sömmerung per se bewirkt aber unabhängig vom Omega-3-Fettsäurengehalt bzw. Alphalinolensäure-Gehalt des Futters einen zusätzlichen Anstieg der mehrfach ungesättigten Fettsäuren, der Gesamt-Omega-3-Fettsäuren und der Alphalinolensäure in der Alpenmilch. Ursache ist eine vermehrte endogene Mobilisation von Omega-3-Fettsäuren aufgrund des Energiedefizites von alpweidenden Kühen.
- (f)
- Ein verändertes mikrobielles Pansenklima mit entsprechend anderer Stoffwechsellage [53].
Empfehlungen für die Ernährung und die Praxis
Schlussfolgerungen
Funding/Potential Competing Interests
References
- Pefg, D.; Gutzwiller, F.; Bopp, M. Lower mortality from coronary heart disease and stroke at higher altitudes in Switzerland. Circulation. 2009, 120, 495–501. [Google Scholar]
- Hauswirth, C.B.; Scheeder, M.R.; Beer, J.H. High omega-3 fatty acid content in alpine cheese: the basis for an alpine paradox. Circulation. 2004, 109, 103–107. [Google Scholar] [CrossRef] [PubMed]
- Wyder, M. Kräuter, Köpfe, Höhenkuren—die Alpen in der Medizin. NZZ 2003. [Google Scholar]
- Zittermann, A.; Schleithoff, S.S.; Koerfer, R. Putting cardiovascular disease and vitamin D insufficiency into perspective. Br J Nutr. 2005, 94, 483–492. [Google Scholar] [CrossRef] [PubMed]
- Engelsen, O.; Brustad, M.; Aksnes, L.; Lund, E. Daily duration of vitamin D synthesis in human skin with relation to latitude, total ozone, altitude, ground cover, aerosols and cloud thickness. Photochem Photobiol. 2005, 81, 1287–1290. [Google Scholar] [CrossRef]
- Scragg, R. Seasonality of cardiovascular disease mortality and the possible protective effect of ultra-violet radiation. Int J Epidemiol. 1981, 10, 337–341. [Google Scholar] [CrossRef]
- Ackermann-Liebrich, U. Schweizer Studie Luftverschmutzung und Atemwegserkrankungen bei Erwachsenen. Atemwegs Lungenerkrank. 1993; 5, 190–194. [Google Scholar]
- Downs, S.H.; Schindler, C.; Liu, L.J.; et al. Reduced exposure to PM10 and attenuated age-related decline in lung function. N Engl J Med. 2007, 357, 2338–2347. [Google Scholar] [CrossRef]
- Farzaneh-Far, R.; Lin, J.; Epel, E.S.; Harris, W.S.; Blackburn, E.H.; Whooley, M.A. Association of marine omega-3 fatty acid levels with telomeric aging in patients with coronary heart disease. JAMA. 2010, 303, 250–257. [Google Scholar] [CrossRef]
- Brenna, J.T.; Salem NJr Sinclair, A.J.; Cunnane, S.C. alpha-Linolenic acid supplementation and conversion to n-3 long-chain polyunsaturated fatty acids in humans. Prostaglandins Leukot Essent Fatty Acids. 2009, 80, 85–91. [Google Scholar] [CrossRef]
- Kris-Etherton, P.M.; Taylor, D.S.; Yu-Poth, S.; et al. Polyunsaturated fatty acids in the food chain in the United States. Am J Clin Nutr. 2000, 71 (Suppl. S1), 179S–188S. [Google Scholar] [CrossRef]
- Harris, W.S.; Mozaffarian, D.; Rimm, E.; et al. Omega-6 fatty acids and risk for cardiovascular disease: a science advisory from the American Heart Association Nutrition Subcommittee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Cardiovascular Nursing; and Council on Epidemiology and Prevention. Circulation. 2009, 119, 902–907. [Google Scholar]
- Guallar, E.; Sanz-Gallardo, M.I.; van’t Veer, P.; et al. Mercury, fish oils, and the risk of myocardial infarction. N Engl J Med. 2002, 347, 1747–1754. [Google Scholar]
- Adkins, Y.; Kelley, D.S. Mechanisms underlying the cardioprotective effects of omega-3 polyunsaturated fatty acids. J Nutr Biochem. 2010, 21, 781–792. [Google Scholar] [CrossRef] [PubMed]
- Mori, T.A.; Beilin, L.J.; Burke, V.; Morris, J.; Ritchie, J. Interactions between dietary fat, fish, and fish oils and their effects on platelet function in men at risk of cardiovascular disease. Arterioscler Thromb Vasc Biol. 1997, 17, 279–286. [Google Scholar] [PubMed]
- Knapp, H.R. Dietary fatty acids in human thrombosis and hemostasis. Am J Clin Nutr. 1997, 65 (Suppl. S5), 1687S–1698S. [Google Scholar]
- Harris, W.S. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997, 65 (Suppl. S5), 1645S–1654S. [Google Scholar] [CrossRef] [PubMed]
- Winnik, S.; Lohmann, C.; Richter, E.K.; et al. Dietary {alpha}-linolenic acid diminishes experimental atherogenesis and restricts T cell-driven inflammation. Eur Heart J. 2011. 2011 Feb 9. [Epub ahead of print]. [Google Scholar] [CrossRef]
- Ruggeri, Z.M. Old concepts and new developments in the study of platelet aggregation. J Clin Invest. 2000, 105, 699–701. [Google Scholar] [CrossRef]
- Holy, E.W.; Forestier, M.; Richter, E.K.; et al. Dietary {alpha}-linolenic acid inhibits arterial thrombus formation, tissue factor expression, and platelet activation. 2011 May 12. [Epub ahead of print].
- Sala-Vila, A.; Cofan, M.; Nunez, I.; Gilabert, R.; Junyent, M.; Ros, E. Carotid and femoral plaque burden is inversely associated with the alphalinolenic acid proportion of serum phospholipids in Spanish subjects with primary dyslipidemia. Atherosclerosis. 2010. [Google Scholar]
- Oh da, Y.; Talukdar, S.; Bae, E.J.; et al. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects. Cell. 2010, 142, 687–698. [Google Scholar]
- Burr, M.L.; Fehily, A.M.; Gilbert, J.F.; et al. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet. 1989, 2, 757–761. [Google Scholar] [CrossRef] [PubMed]
- Hu, F.B.; Stampfer, M.J.; Manson, J.E.; et al. Dietary intake of alpha-linolenic acid and risk of fatal ischemic heart disease among women. Am J Clin Nutr. 1999, 69, 890–897. [Google Scholar] [CrossRef] [PubMed]
- Hu, F.B.; Bronner, L.; Willett, W.C.; et al. Fish and omega-3 fatty acid intake and risk of coronary heart disease in women. JAMA. 2002, 287, 1815–1821. [Google Scholar] [CrossRef] [PubMed]
- Albert, C.M.; Campos, H.; Stampfer, M.J.; et al. Blood levels of long-chain n-3 fatty acids and the risk of sudden death. N Engl J Med. 2002, 346, 1113–1118. [Google Scholar]
- Albert, C.M.; Hennekens, C.H.; O’Donnell, C.J.; et al. Fish consumption and risk of sudden cardiac death. JAMA. 1998, 279, 23–28. [Google Scholar] [CrossRef]
- Ascherio, A.; Rimm, E.B.; Stampfer, M.J.; Giovannucci, E.L.; Willett, W.C. Dietary intake of marine n-3 fatty acids, fish intake, and the risk of coronary disease among men. N Engl J Med. 1995, 332, 977–982. [Google Scholar] [CrossRef]
- Virtanen, J.K.; Mursu, J.; Voutilainen, S.; Tuomainen, T.P. Serum long-chain n-3 polyunsaturated fatty acids and risk of hospital diagnosis of atrial fibrillation in men. Circulation. 2009, 120, 2315–2321. [Google Scholar] [CrossRef]
- Knapp, H.R.; FitzGerald, G.A. The antihypertensive effects of fish oil. A controlled study of polyunsaturated fatty acid supplements in essential hypertension. N Engl J Med. 1989, 320, 1037–1043. [Google Scholar]
- Bays, H.E.; Tighe, A.P.; Sadovsky, R.; Davidson, M.H. Prescription omega-3 fatty acids and their lipid effects: physiologic mechanisms of action and clinical implications. Expert Rev Cardiovasc Ther. 2008, 6, 391–409. [Google Scholar] [CrossRef]
- Harris, W.S.; Ginsberg, H.N.; Arunakul, N.; et al. Safety and efficacy of Omacor in severe hypertriglyceridemia. J Cardiovasc Risk. 1997, 4, 385–391. [Google Scholar]
- Albert, C.M.; Oh, K.; Whang, W.; et al. Dietary alpha-linolenic acid intake and risk of sudden cardiac death and coronary heart disease. Circulation. 2005, 112, 3232–3238. [Google Scholar] [CrossRef] [PubMed]
- Campos, H.; Baylin, A.; Willett, W.C. Alpha-linolenic acid and risk of nonfatal acute myocardial infarction. Circulation. 2008, 118, 339–345. [Google Scholar] [CrossRef] [PubMed]
- Djoussé, L.; Arnett, D.K.; Carr, J.J.; et al. Dietary linolenic acid is inversely associated with calcified atherosclerotic plaque in the coronary arteries: the National Heart, Lung, and Blood Institute Family Heart Study. Circulation. 2005, 111, 2921–2926. [Google Scholar] [CrossRef] [PubMed]
- Kang, J.X.; Leaf, A. Effects of long-chain polyunsaturated fatty acids on the contraction of neonatal rat cardiac myocytes. Proc Natl Acad Sci USA. 1994, 91, 9886–9890. [Google Scholar] [CrossRef]
- McLennan, P.L.; Dallimore, J.A. Dietary canola oil modifies myocardial fatty acids and inhibits cardiac arrhythmias in rats. J Nutr. 1995, 125, 1003–1009. [Google Scholar] [CrossRef]
- von Schacky, C.; Angerer, P.; Kothny, W.; Theisen, K.; Mudra, H. The effect of dietary omega-3 fatty acids on coronary atherosclerosis. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 1999, 130, 554–562. [Google Scholar]
- Marchioli, R. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction:results of the GISSIPrevenzione trial. Lancet. 1999, 354, 447–55. [Google Scholar]
- Tavazzi, L.; Maggioni, A.P.; Marchioli, R.; et al. Effect of n-3 polyunsaturated fatty acids in patients with chronic h eart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet. 2008, 372, 1223–1230. [Google Scholar]
- de Lorgeril, M.; Salen, P.; Martin, J.L.; Monjaud, I.; Delaye, J.; Mamelle, N. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation. 1999, 99, 779–785. [Google Scholar] [CrossRef]
- Singh, R.B.; Dubnov, G.; Niaz, M.A.; et al. Effect of an Indo-Mediterranean diet on progression of coronary artery disease in high risk patients (Indo-Mediterranean Diet Heart Study): a randomised single-blind trial. Lancet. 2002, 360, 1455–1461. [Google Scholar] [CrossRef]
- Kromhout, D.; Giltay, E.J.; Geleijnse, J.M. n-3 Fatty Acids and Cardiovascular Events after Myocardial Infarction. N Engl J Med. 2010. [Google Scholar] [CrossRef]
- Patel, J.V.; Tracey, I.; Hughes, E.A.; Lip, G.Y. Omega-3 polyunsaturated acids and cardiovascular disease: notable ethnic differences or unfulfilled promise? J Thromb Haemost. 2010. [Google Scholar] [CrossRef] [PubMed]
- Rauch, B.; Schiele, R.; Schneider, S.; et al. OMEGA, a Randomized, Placebo- Controlled Trial to Test the Effect of Highly Purified Omega-3 Fatty Acids on Top of Modern Guideline-Adjusted Therapy After Myocardial Infarction. Circulation. 2010. [Google Scholar] [CrossRef] [PubMed]
- Analysis SIfM. The Average Consumption of 55 g Cheese/Day by Western Population; GfK: Switzerland, 2002. [Google Scholar]
- Gibson, R.A.; Neumann, M.A.; James, M.J.; Hawkes, J.S.; Hall, C.; Cleland, L.G. Effect of n-3 and n-6 dietary fats on the lipoxygenase products from stimulated rat neutrophils. Prostaglandins Leukot Essent Fat. Acids. 1992, 46, 87–91. [Google Scholar] [CrossRef]
- Baylin, A.; Kabagambe, E.K.; Ascherio, A.; Spiegelman, D.; Campos, H. Adipose tissue alpha-linolenic acid and nonfatal acute myocardial infarction in Costa Rica. Circulation. 2003, 107, 1586–1591. [Google Scholar] [CrossRef] [PubMed]
- MacDonald, H.B. Conjugated linoleic acid and disease prevention: a review of current knowledge. J Am Coll Nutr. 2000, 19 (Suppl. S2), 111S–118S. [Google Scholar] [CrossRef]
- Collomb, M.; Butikofer, U.; Sieber, R.; Bosset, O.; Jeangros, B. Conjugated linoleic acid and trans fatty acid composition of cows’ milk fat produced in lowlands and highlands. J Dairy Res. 2001, 68, 519–523. [Google Scholar] [CrossRef]
- Collomb, M. Correlation between fatty acids in cow’s milk fat produced in the lowlands, mountains and highlands of Switzerland and botanical composition of the fodder. Int. Dairy j., 2002, 12, 661–666. [Google Scholar] [CrossRef]
- Leiber, F. milk fatty acid profile of cows under the influence of alpine hypoxia and high mountainous forage quality. J. Anim. Feed. Sci. 2004, 13, 693–696. [Google Scholar] [CrossRef][Green Version]
- Leiber, F. Dietetically relevant polyunsaturated fatty acids in th emilk of cows grazing pastures at different altitudes. Grassland Science in Europe. 2004, 9. [Google Scholar][Green Version]
- Lichtenstein, A.H.; Appel, L.J.; Brands, M.; et al. Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee. Circulation. 2006, 114, 82–96. [Google Scholar] [CrossRef]
- Kris-Etherton, P.M.; Harris, W.S.; Appel, L.J. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular d isease. Circulation. 2002, 106, 2747–2757. [Google Scholar] [CrossRef]
- Gesundheit, B.f. Fett in unserer Ernährung—Empfehlungen des Bundes- amtes für Gesundheit. 2006. Published Last Modified Date|. Accessed Dated Accessed|.
- 57, A.g.r.o.s.c.o.p.e. O mega-3-Fettsäuren genau betrachtet. Alimenta. 2008, 32–33. [Google Scholar]
- Kowey, P.R.; Reiffel, J.A.; Ellenbogen, K.A.; Naccarelli, G.V.; Pratt, C.M. Efficacy and safety of prescription omega-3 fatty acids for the prevention of recurrent symptomatic atrial fibrillation: a randomized controlled trial. JAMA. 2010, 304, 2363–2372. [Google Scholar] [CrossRef]
- Eckel, R.H. The Fish Oil Story Remains Fishy. Circulation. 2010, 122, 2110. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Rupp, H. Omacor (prescription omega-3-acid ethyl esters 90): From severe rhythm disorders to hypertriglyceridemia. Adv Ther. 2009, 26, 675–690. [Google Scholar] [CrossRef] [PubMed]
- de Lorgeril, M.; Salen, P. Alpha-linolenic acid and coronary heart disease. Nutr Metab Cardiovasc Dis. 2004, 14, 162–169. [Google Scholar] [CrossRef]
- von Schacky, C.; Weber, P.C. Metabolism and effects on platelet function of the purified eicosapentaenoic and docosahexaenoic acids in humans. J Clin Invest. 1985, 76, 2446–2450. [Google Scholar] [CrossRef]
- Stirban, A.; Nandrean, S.; Gotting, C.; et al. Effects of n-3 fatty acids on macro- and microvascular function in subjects with type 2 diabetes mellitus. Am J Clin Nutr. Mar. 2010, 91, 808–813. [Google Scholar] [CrossRef]
- Mori, T.A.; Watts, G.F.; Burke, V.; Hilme, E.; Puddey, I.B.; Beilin, L.J. Differential effects of eicosapentaenoic acid and docosahexaenoic acid on vascular reactivity of the forearm microcirculation in hyperlipidemic, overweight men. Circulation. 2000, 102, 1264–1269. [Google Scholar] [CrossRef]
- Mori, T.A.; Woodman, R.J.; Burke, V.; Puddey, I.B.; Croft, K.D.; Beilin, L.J. Effect of eicosapentaenoic acid and docosahexaenoic acid on oxidative stress and inflammatory markers in treated-hypertensive type 2 diabetic subjects. Free Radic Biol Med. 2003, 35, 772–781. [Google Scholar] [CrossRef]
- Larson, M.K.; Ashmore, J.H.; Harris, K.A.; et al. Effects of omega-3 acid ethyl esters and aspirin, alone and in combination, on platelet function in healthy subjects. Thromb Haemost. 2008, 100, 634–641. [Google Scholar] [CrossRef]
- De Caterina, R. n-3 fatty acids in cardiovascular disease. N Engl J Med. 2011, 364, 2439–2450. [Google Scholar] [CrossRef]


| Reduktion der Triglyzeride um 20–50% | Verminderung des oxidativen Stress | Reduktion der Plättchenaggregation mit Kollagen | Verstärkung der NO-induzierten Gefäss-Relaxation | |
|---|---|---|---|---|
| LC-Omega3-FA tägliche Dosis in g | 4 g | 4 g | 6 g | 4 g |
| pro 100 g | ALA (g) |
| Walnuss | 9,1 |
| Haselnuss | 0,1 |
| Leinsamen | 23,4 |
| Erdnuss | 0 |
| Butternuss | 8,7 |
| Mandeln | 0,4 |
| Pekannuss | 0,7 |
| Pinienkerne | 0,8 |
| Macadamia | 0 |
| Makrele | 0,5 |
| Lachs | 0,2 |
| Rind | 0,2 |
| Schwein | 0 |
© 2011 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Vontobel, J.; Stivala, S.; Winnik, S.; Beer, J.H. Schweizer Alpkäse, Alpha-Linolensäure und kardiovaskuläre Protektion. Cardiovasc. Med. 2011, 14, 205. https://doi.org/10.4414/cvm.2011.01604
Vontobel J, Stivala S, Winnik S, Beer JH. Schweizer Alpkäse, Alpha-Linolensäure und kardiovaskuläre Protektion. Cardiovascular Medicine. 2011; 14(7):205. https://doi.org/10.4414/cvm.2011.01604
Chicago/Turabian StyleVontobel, Jan, Simona Stivala, Stephan Winnik, and Jürg H. Beer. 2011. "Schweizer Alpkäse, Alpha-Linolensäure und kardiovaskuläre Protektion" Cardiovascular Medicine 14, no. 7: 205. https://doi.org/10.4414/cvm.2011.01604
APA StyleVontobel, J., Stivala, S., Winnik, S., & Beer, J. H. (2011). Schweizer Alpkäse, Alpha-Linolensäure und kardiovaskuläre Protektion. Cardiovascular Medicine, 14(7), 205. https://doi.org/10.4414/cvm.2011.01604




