Einleitung
Im Laufe der letzten 20 Jahre wurden die kardiovaskulären Nebenwirkungen von anabolen androgenen Steroiden (AAS) verstärkt öffentlich wahrgenommen. Dies ist nicht zuletzt auf die steigende Anzahl von Publikationen zu diesem Thema zurückzuführen. Der Missbrauch von AAS wurde erstmals in den 1980er Jahren mit kardiovaskulären Komplikationen in Verbindung gebracht [
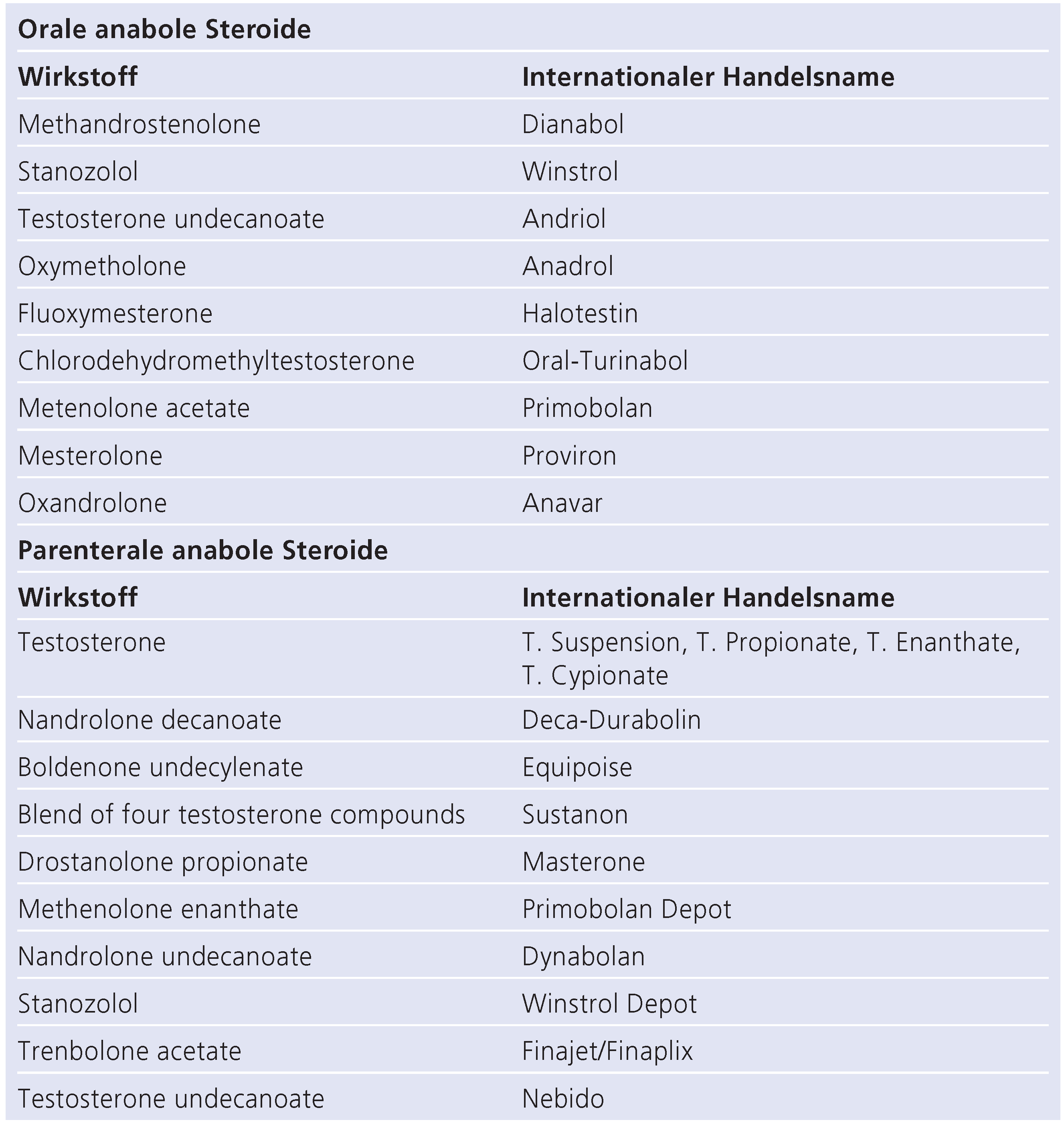
1]. Tabelle 1 gibt eine Übersicht über gängige anabole Steroide, die von Bodybuildern verwendet werden. Die ersten Fallstudien beschrieben einen Zusammenhang zwischen AAS und juveniler koronarer Herzkrankheit (KHK), linksventrikulärer Hypertrophie (LVH), Kardiomyopathie sowie Schlaganfall [
2,
3]. Seither wurden etwa 40 Fallstudien zum Thema publiziert, wobei die juvenile KHK das am häufigsten beobachtete klinische Phänomen ist. Die anderen Studien beschreiben Personen mit LVH, reduzierter linksventrikulärer Funktion (LVF), Schlaganfall, Vorhofflimmern (VHF), arteriellen Thrombosen, Lungenembolie, Herzklappenfehlern, Herztransplantation und plötzlichem Herztod [
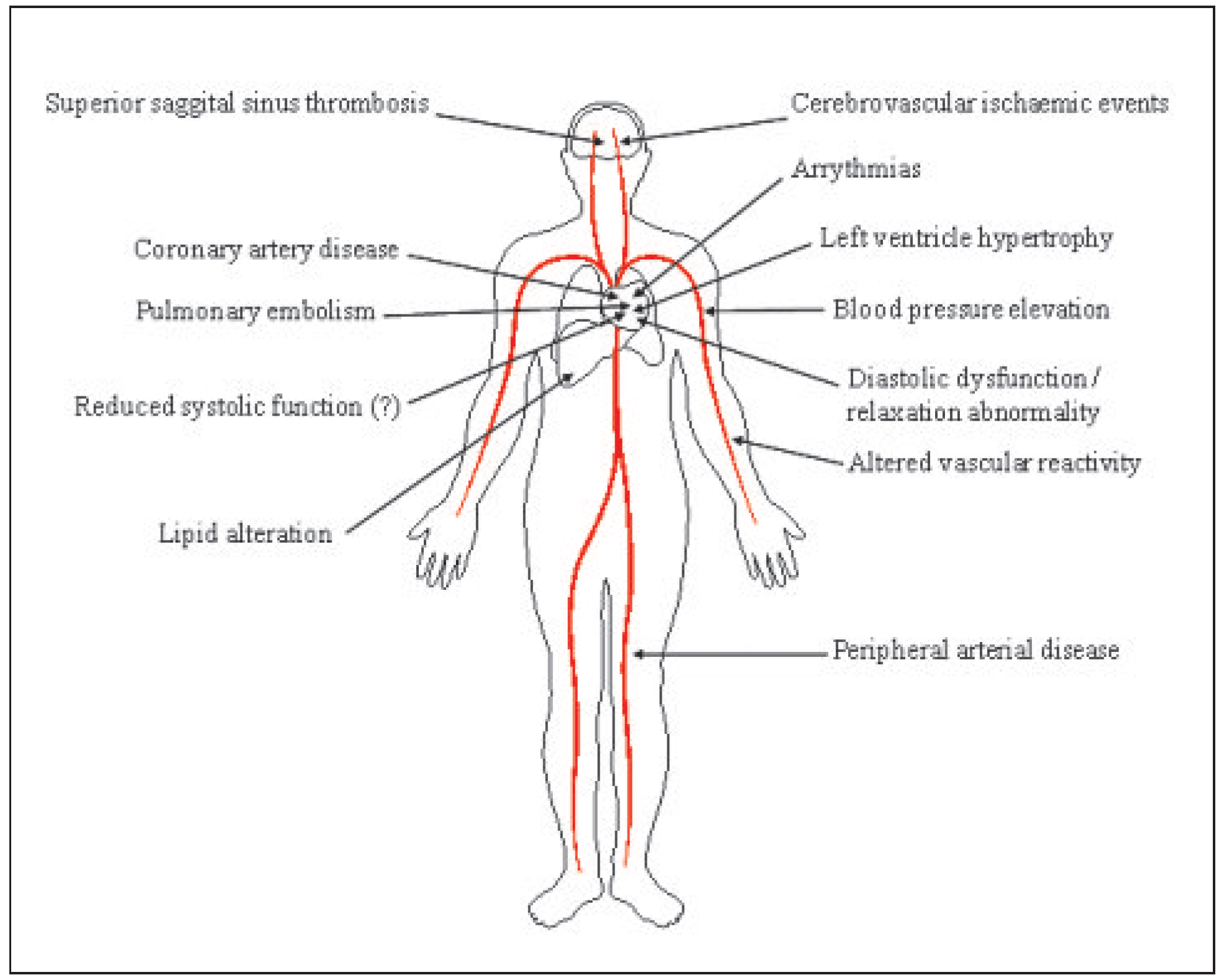
1]. Auffällig ist, dass bei Personen, die AAS missbräuchlich einnahmen und einen Myokardinfarkt erlitten, die Koronararterien oft nicht atherosklerotisch verändert waren. Abbildung 1 gibt einen Überblick über potentielle kardiovaskuläre Komplikationen bei AAS-Missbrauch [
1].
Abbildung 1.
Ungünstige kardiovaskuläre Effekte bei AAS-Missbrauch. (Erstmals publiziert in: Vanberg P, Atar D. Androgenic anabolic steroid abuse and the cardiovascular system. Handb Exp Pharmacol. 2010;(195):411–57. Copyright mit freundlicher Genehmigung von Springer-Verlag, New York/Heidelberg, USA/Deutschland.).
Abbildung 1.
Ungünstige kardiovaskuläre Effekte bei AAS-Missbrauch. (Erstmals publiziert in: Vanberg P, Atar D. Androgenic anabolic steroid abuse and the cardiovascular system. Handb Exp Pharmacol. 2010;(195):411–57. Copyright mit freundlicher Genehmigung von Springer-Verlag, New York/Heidelberg, USA/Deutschland.).
Die Autoren einer schwedischen Autopsie-Studie beschreiben bei 30 Prozent aller untersuchten AASKonsumenten pathologische Veränderungen des Herzens, obwohl die Personen nicht aufgrund eines kardialen Ereignisses verstarben [
1]. Auch mehrere Tierstudien zeigen ungünstige Effekte von AAS auf das Herz-Kreislauf-System: LVH, reduzierte Auswurffraktion (EF) und Kontraktilität, Endotheldysfunktion, Destruktion von Mitochondrien und Myofibrillen, Störungen der morphologischen Integrität und Apoptose von Kardiomyozyten [
1].
Aufgrund dieser klaren Datenlage gibt es aus ethischen Gründen keine grosse prospektive, randomisierte klinische Studie über Langzeiteffekte bei AASMissbrauch. Unser Wissen zum Thema beruht daher im Wesentlichen auf Fallbeispielen und Beobachtungsstudien. Aus formal-wissenschaftlicher Sicht ist die Beweislage für eine negative Wirkung von AAS auf das Herz-Kreislauf-System damit äusserst dürftig.
Diese Übersichtsarbeit versucht die vorhandene Literatur zum Thema zusammenzufassen und eventuelle Zusammenhänge zwischen AAS-Missbrauch bei Bodybuildern und kardiovaskulären Erkrankungen aufzuzeigen.
Tabelle 1.
Gängige anabole Steroide.
Tabelle 1.
Gängige anabole Steroide.
Strukturelle und funktionelle Veränderungen des linken Ventrikels
Die rasante technische Entwicklung im letzten Jahrzehnt macht eine Interpretation von über einen langen Zeitraum hinweg erhobenen echokardiographischen Daten schwierig. Dieser Einschränkung zum Trotz gibt es deutliche Hinweise, dass AAS-Missbrauch sowohl zu morphologischen als auch funktionellen Veränderungen führt [
1].
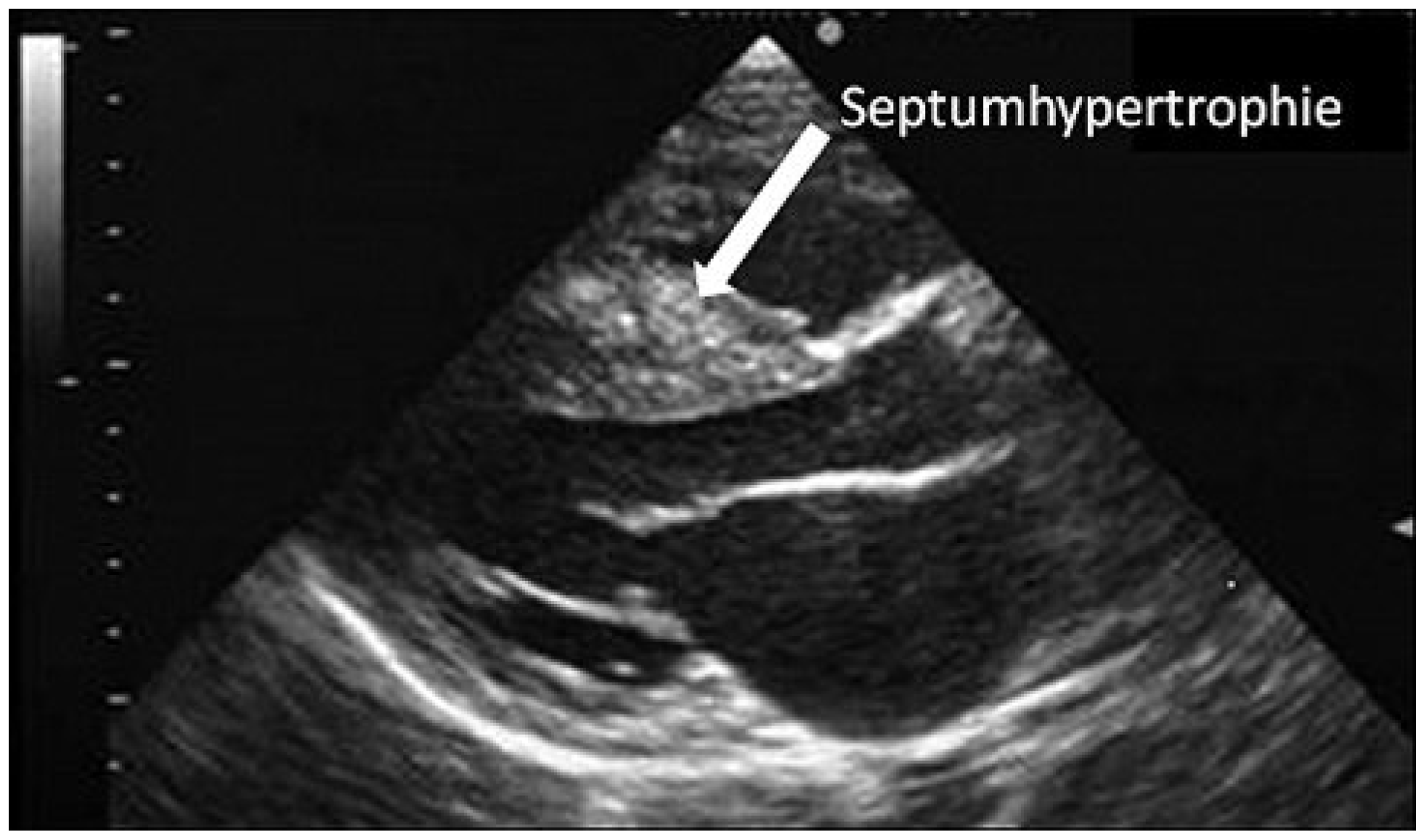
In mehreren Fallstudien wird einerseits eine Hypertrophie des Myokards, insbesondere des Septums (Abbildung 2), beschrieben, wobei diese Veränderungen zum Teil auch auf den Trainingseffekt von Kraftsport (AAS-Missbrauch vor allem bei Bodybuildern) zurückzuführen sein dürften [
1,
4,
5]. Des Weiteren werden eine Ventrikeldilatation sowie Beeinträchtigungen der systolischen und diastolischen Funktion beschrieben [
6]. Generell ist die LVH als ein Prädiktor für erhöhte kardiovaskuläre Morbidität und Mortalität zu betrachten [
7]. Welche Bedeutung diese spezifischen Veränderungen jedoch auf die individuelle Prognose eines Patienten haben, bleibt unklar, wenn diese Veränderungen auch im Allgemeinen mit einer Aggravierung des klinischen Zustandsbildes einhergehen.
Abbildung 2.
Echokardiographie. Konzentrische Hypertrophie des linken Ventrikels eines 37-jährigen Bodybuilders mit AAS-Missbrauch.
Abbildung 2.
Echokardiographie. Konzentrische Hypertrophie des linken Ventrikels eines 37-jährigen Bodybuilders mit AAS-Missbrauch.
Hypertonie
Arterielle Hypertonie ist ein anerkannter Risikofaktor für kardiovaskuläre Erkrankungen. In Tierstudien konnte gezeigt werden, dass AAS zur Entwicklung einer arteriellen Hypertonie beitragen können [
1]. Beim Menschen ist die Datenlage weniger klar (Studien klein, meist Cross-sectional-Design). Einige Studien weisen einen geringfügigen Anstieg des systolischen Blutdrucks nach, andere des diastolischen Blutdrucks [
8,
9,
10]. Zu erwähnen ist, dass einige Untersuchungen keine Auswirkungen auf den Blutdruck feststellen konnten [
1,
4,
11,
12]. Einige klinische Studien haben die Reversibilität des hypertensiven Effektes untersucht und kommen zu dem Schluss, dass der Blutdruck durch AAS nur wenig erhöht wird und nur wenige Monate nach Absetzen der jeweiligen Substanz wieder auf Normalwerte zurückgeht. Zusammenfassend lässt sich sagen, dass AAS-Konsumenten zu geringfügig erhöhten Blutdruckwerten tendieren [
1]. Die klinische Relevanz einer transienten, geringen Blutdruckerhöhung ist jedoch fraglich.
Koronarsklerose
Die native Untersuchung des Herzens mittels Computertomographie (CT) mit Bestimmung der Koronararterienkalklast (coronary artery calcium content) ist neben der Bestimmung konventioneller Risikofaktoren eine mittlerweile anerkannte Methode zur Risikostratifizierung von asymptomatischen Patienten [
13].
Eine kürzlich erschienene Studie mit Bodybuildern zwischen 28 und 55 Jahren mit langjährigem AAS-Missbrauch fand eine erhöhte Koronararterien-kalklast bei der Hälfte der teilnehmenden Probanden, deutlich mehr als in dieser Altersgruppe zu erwarten wäre. Darüber hinaus hatten alle Teilnehmer der Studie deutlich erniedrigte HDL-Werte. Keiner der Teilnehmer hatte Symptome einer koronaren Herzkrankheit. Auch die linksventrikuläre Auswurffraktion war im Normbereich. Die Autoren ziehen daraus den Schluss, dass AAS die Entstehung von Atherosklerose begünstigen. Ob dies ein direkter Effekt ist oder durch Veränderungen im Lipidprofil verursacht wird, bleibt unklar [
14]. Es wird jedoch vermutet, dass nicht Koronarstenosen, sondern Vasospasmen und thrombotische Okklusionen hauptverantwortlich für das Auftreten von akuten Myokardinfarkten bei Bodybuildern sind [
15]. Studien mit Multi-Detektor-CT sind in Planung, um eine mögliche Beziehung zwischen langfristigem AAS-Missbrauch und Atherosklerose zu bestätigen.
Thrombozytenfunktion und Hämostase
In der Literatur finden sich zahlreiche Fallberichte über AAS-Missbrauch betreibende Patienten, die mit einem thromboembolischen Ereignis in der Notaufnahme vorstellig wurden [
1]. Darunter sind Fälle mit tiefer Beinvenenthrombose (DVT), Lungenembolie, Thrombose des Sinus sagittalis superior, zerebrovaskulären Ereignissen, Myokardinfarkten, akuten thrombotischen Verschlüssen von peripheren Arterien sowie Thromben im linken Ventrikel [
16,
17,
18,
19,
20]. Es sind weit mehr Fälle mit thrombo-embolischen Ereignissen im arteriellen als im venösen Stromgebiet beschrieben. Es sei jedoch erwähnt, dass bei keinem dieser Fallstudien ein kausaler Zusammenhang bewiesen werden konnte.
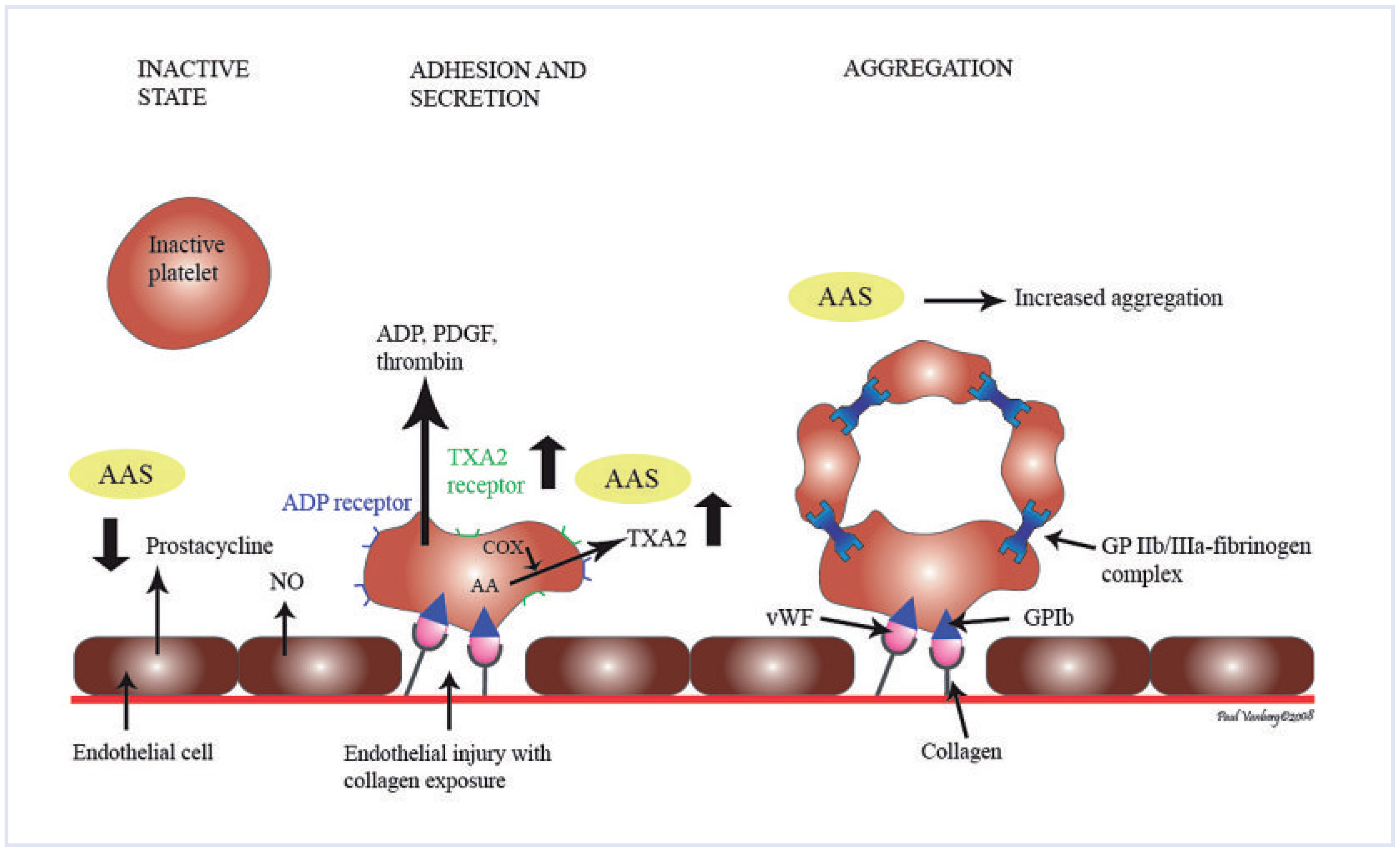
Abbildung 3.
Schematische Darstellung der Effekte von AAS auf die Thrombozytenaggregation. Dargestellt sind die Effekte auf Prostazyklin-, Thromboxan- und Thromboxanrezeptorsynthese. (Erstmals publiziert in: Vanberg P, Atar D. Androgenic anabolic steroid abuse and the cardiovascular system. Handb Exp Pharmacol. 2010;(195):411–57. Copyright mit freundlicher Genehmigung von Springer-Verlag, New York/Heidelberg, USA/Deutschland.). ADP = Adenosindiphosphat; COX = Cyclo-oxygenase; NO = Stickoxid; AA = Arachidonsäure; PDGF = Platelet Derived Growth Factor; TXA2 = Thromboxan A2; vWF = Von-Willebrand-Faktor; GP = Glykoprotein.
Abbildung 3.
Schematische Darstellung der Effekte von AAS auf die Thrombozytenaggregation. Dargestellt sind die Effekte auf Prostazyklin-, Thromboxan- und Thromboxanrezeptorsynthese. (Erstmals publiziert in: Vanberg P, Atar D. Androgenic anabolic steroid abuse and the cardiovascular system. Handb Exp Pharmacol. 2010;(195):411–57. Copyright mit freundlicher Genehmigung von Springer-Verlag, New York/Heidelberg, USA/Deutschland.). ADP = Adenosindiphosphat; COX = Cyclo-oxygenase; NO = Stickoxid; AA = Arachidonsäure; PDGF = Platelet Derived Growth Factor; TXA2 = Thromboxan A2; vWF = Von-Willebrand-Faktor; GP = Glykoprotein.
Thrombozyten und das fibrinolytische System haben wichtige Funktionen in der Regulation der Thrombogenität im arteriellen Stromgebiet [
21]. AAS haben einen verstärkenden Effekt auf Thrombozytenaggregation. Experimentelle Tierstudien zeigten auch ein erhöhtes Vorkommen von arteriellen Thromben bei Gabe von AAS [
1].
Die Thrombozytenaggregation wird durch spezifische Mediatoren reguliert (Abbildung 3). Eine wichtige Rolle spielen Metaboliten der Arachidonsäure. Hohe Dosen von AAS bewirken eine verstärkte Plättchenaggregation, die durch eine erhöhte Aktivität der Cyclo-oxygenase (COX) vermittelt wird [
1]. Die Produktion von Prostaglandin I
2 (PGI
2), einem wichtigen Plättchenaggregationshemmer, ist beim Missbrauch von AAS deutlich herabgesetzt. Männliche Patienten mit Hypogonadismus haben umgekehrt eine herabgesetzte Plättchenfunktion. Testosteron hat in einer prospektiven, randomisierten Doppelblindstudie zu einer signifikanten Erhöhung von Thromboxan A
2 (TXA
2) geführt. TXA
2 ist ein Arachidonsäuremetabolit, der zu einer Verstärkung der Plättchenaggregation führt und zudem ein potenter Vasokonstriktor ist [
1]. Diese direkten Effekte auf die Plättchenaggregation bieten eine mögliche Erklärung für die prothrombotische Wirkung von AAS.
Mehrere Studien zeigen bei AAS-Konsumenteneinen Trend zur Hyperkoagulabilität bei gleichzeitig gesteigerter fibrinolytischer Aktivität [
1]. Die Beeinflussung von mehreren Hämostase- und Fibrinolysefaktoren ist beschrieben, unter anderem von Fibrinogen, D-Dimer, gewebespezifischem Plasminogenaktivator (t-PA), Plasminogenaktivator-Inhibitor Typ 1 (PAI-1) und der Aktivität von Antithrombin III (AT III), Protein C, Plasminogen sowie Faktor VII und VIII [
1].
Ein anderer Mechanismus für eine eventuelle prothrombotische Wirkung von AAS könnte die Erhöhung des Hämatokrits sein. Eine Erhöhung der Hämatokritwerte geht mit einer Erhöhung des Risikos für thrombo-embolische und zerebrovaskuläre Ereignisse einher. Welcher Mechanismus für die Erhöhung des Hämatokrits verantwortlich ist, ist unklar [
22].
Zusammenfassend lässt sich sagen, dass AASMissbrauch zu einem prothrombotischen Milieu führt, wahrscheinlich aufgrund einer verstärkten Thrombozytenaggregation und möglicherweise erhöhter Hämatokritwerte. Die Wirkungen von AAS auf Hämostase und Fibrinolyse sind komplex und aufgrund der verfügbaren Daten nicht eindeutig interpretierbar.
Lipide
Die vermutlich am besten untersuchten kardiovaskulären Wirkungen von AAS sind diejenigen auf den Lipidstoffwechsel. In den letzten 25 Jahren wurden zahlreiche Studien publiziert, die – im Gegensatz zu vielen anderen Effekten von AAS auf das kardiovaskuläre System – übereinstimmend eine Veränderung des Lipidprofils beschreiben [
1].
In epidemiologischen Studien gibt es einen Zusammenhang zwischen erhöhten Werten von Low-density-Lipoprotein (LDL) und entsprechender Atherosklerose-Inzidenz [
23]. Darüber hinaus gilt es in Bezug auf das kardiovaskuläre Risiko als günstig, erhöhte LDLSpiegel zu senken [
24]. Des Weiteren gibt es ein umgekehrt proportionales Verhältnis zwischen Werten von High-density-Lipoprotein (HDL) und kardiovaskulärem Risiko [
25,
26].
AAS führen zu einer Alteration des Lipidstoffwechsels. Es kommt zu einer markanten Reduktion von HDL, vor allem der Subfraktion HDL 2, die möglicherweise eine Rolle in der Regulation der Plaque-Stabilität spielt [
1]. Einige Studien konnten auch einen Effekt auf LDL-Werte zeigen, diese sind allerdings bescheiden und von vermutlich geringerer klinischer Relevanz [
1]. Obwohl es bisher keine Studien gibt, die einen Effekt dieser Veränderungen des Lipidstoffwechsels auf die Koronare Herzkrankheit zeigen, ist ein Zusammenhang naheliegend.
Zusammenfassend lässt sich feststellen, dass es eine grosse Anzahl von eleganten und überzeugenden Studien gibt, die einen negativen Effekt von AAS auf das Lipidprofil zeigen. Die Steigerung von LDL bei gleichzeitiger Reduktion von HDL ist die denkbar ungünstigste Kombination in Bezug auf das kardiovaskuläre Risiko.
Arrhythmie und plötzlicher Herztod
Obwohl die Inzidenz des plötzlichen Herztods bei AAS-Konsumenten nicht genau bestimmbar ist, herrscht Einigkeit darüber, dass AASMissbrauch mit einem erhöhten Risiko für plötzlichen Herztod einhergeht. Tatsächlich sind sich viele AAS-Konsumenten dieses Risikos bewusst [
1]. Welche pathophysiologischen Mechanismen für diesen Zusammenhang verantwortlich sind, ist unbekannt. Aus offensichtlichen ethischen Gründen ist eine klinische Studie, die diesem Zusammenhang auf den Grund gehen könnte, nicht durchführbar. Man kann daher nur spekulieren, ob es einen direkten proarrhythmogenen Effekt von anabolen Steroiden gibt oder ob das vermehrte Vorkommen von plötzlichem Herztod als Folge von begleitenden Veränderungen auftritt, etwa einer Hypertrophie des linken Ventrikels. Ein weiterer komplizierender Faktor ist die Tatsache, dass AAS-Konsumenten häufig auch andere Substanzen zu sich nehmen, insbesondere Marihuana, Kokain, Alkohol sowie Diuretika [
1] und darüber hinaus Insulin, das die Gefahr einer letalen Hypoglykämie mit sich bringt. Proarrhythmogene Substanzen in diesem Zusammenhang sind Ephedrin, Koffein und vor allem Amphetamin. Auch wenn die Evidenz für einen direkten Zusammenhang zwischen AAS und plötzlichem Herztod gering ist, stellt die Polytoxikomanie mit den genannten Substanzen, in Verbindung mit einem harten physischen Training, auf jeden Fall ein erhöhtes Risiko für maligne Arrhythmien dar.
In der Literatur findet man einige Fälle, die einen proarrhythmogenen Effekt von AAS v.a. bei besonders jungen Patienten nahelegen, z.B. der Fall eines 22-jährigen Mannes mit tachykardem Vorhofflimmern oder einige Fälle von ventrikulärer Tachykardie [
27,
28,
29,
30]. In elektrophysiologischen Studien fand man einen Zusammenhang zwischen AAS-Missbrauch und erhöhter QT-Dispersion, einem Mass für Heterogenität der ventrikulären Repolarisation und einem Risikofaktor für lebensbedrohliche ventrikuläre Arrhythmien [
31]. Eine kürzlich erschienene Studie konnte in einem experimentellen Tiermodell zeigen, dass hohe Dosen von AAS zu einer erhöhten Konzentration und Ablagerung von Kollagen im Herzmuskel führen [
1]. Dies stellt ohne Zweifel ein proarrhythmogenes Substrat dar.
Zusammenfassend lässt sich sagen, dass bei Missbrauch von AAS zumindest ein Trend zu einem erhöhten Risiko für lebensbedrohliche Arrhythmien und plötzlichen Herztod zu erkennen ist, auch wenn die zugrunde liegenden pathophysiologischen Mechanismen noch unklar sind.
Die Autoren sind Dr. M. Thalhammer und Dr. F. Streifenhorn für den Einsatz ihrer semantischen und fachlichen Kompetenz bei der Korrektur dieses Artikels zu tiefem Dank verpflichtet.