Die Arrhythmogene Rechtsventrikuläre Dysplasie/Kardiomyopathie
Summary
Einleitung
Epidemiologie
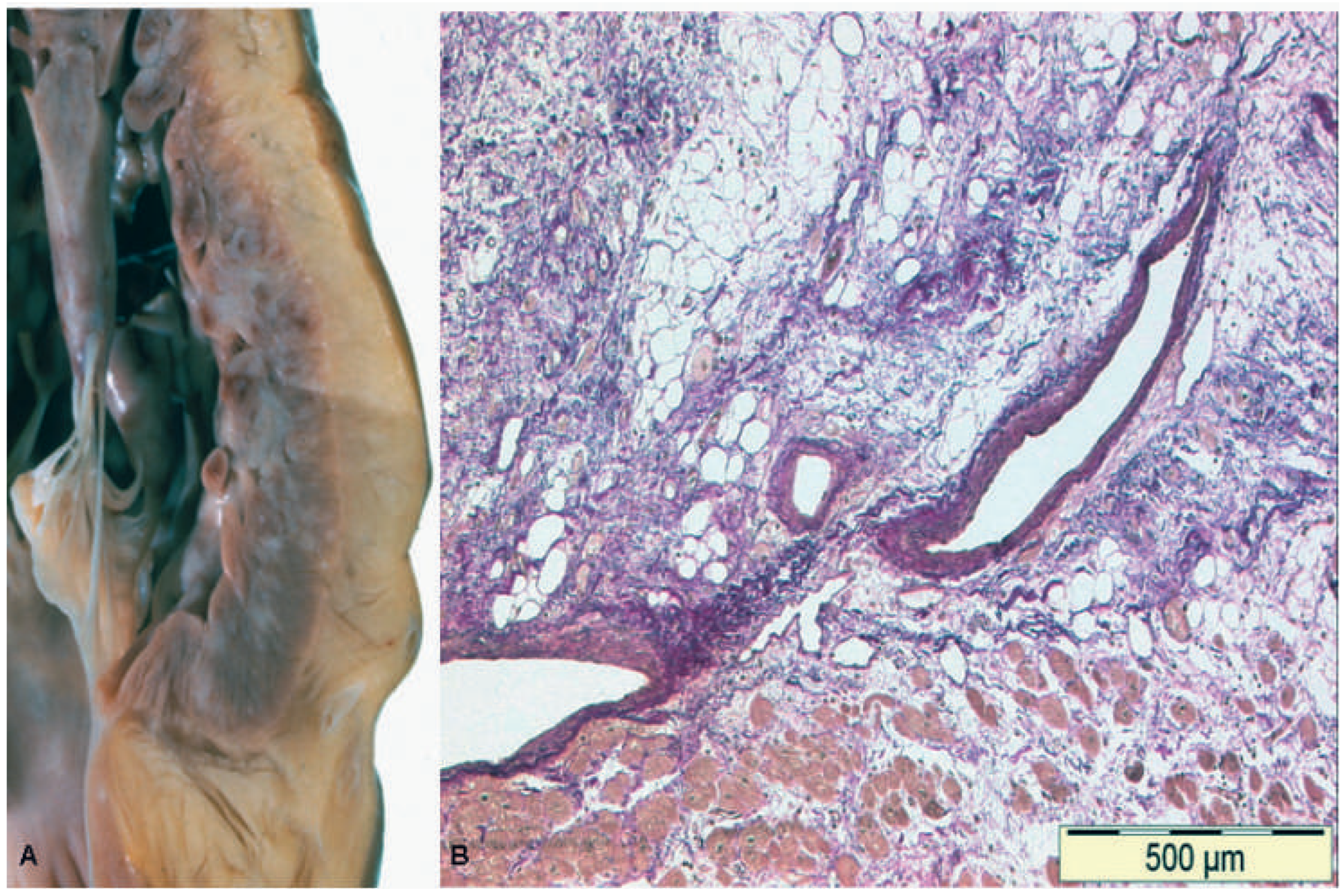
Pathologie und Histopathologie
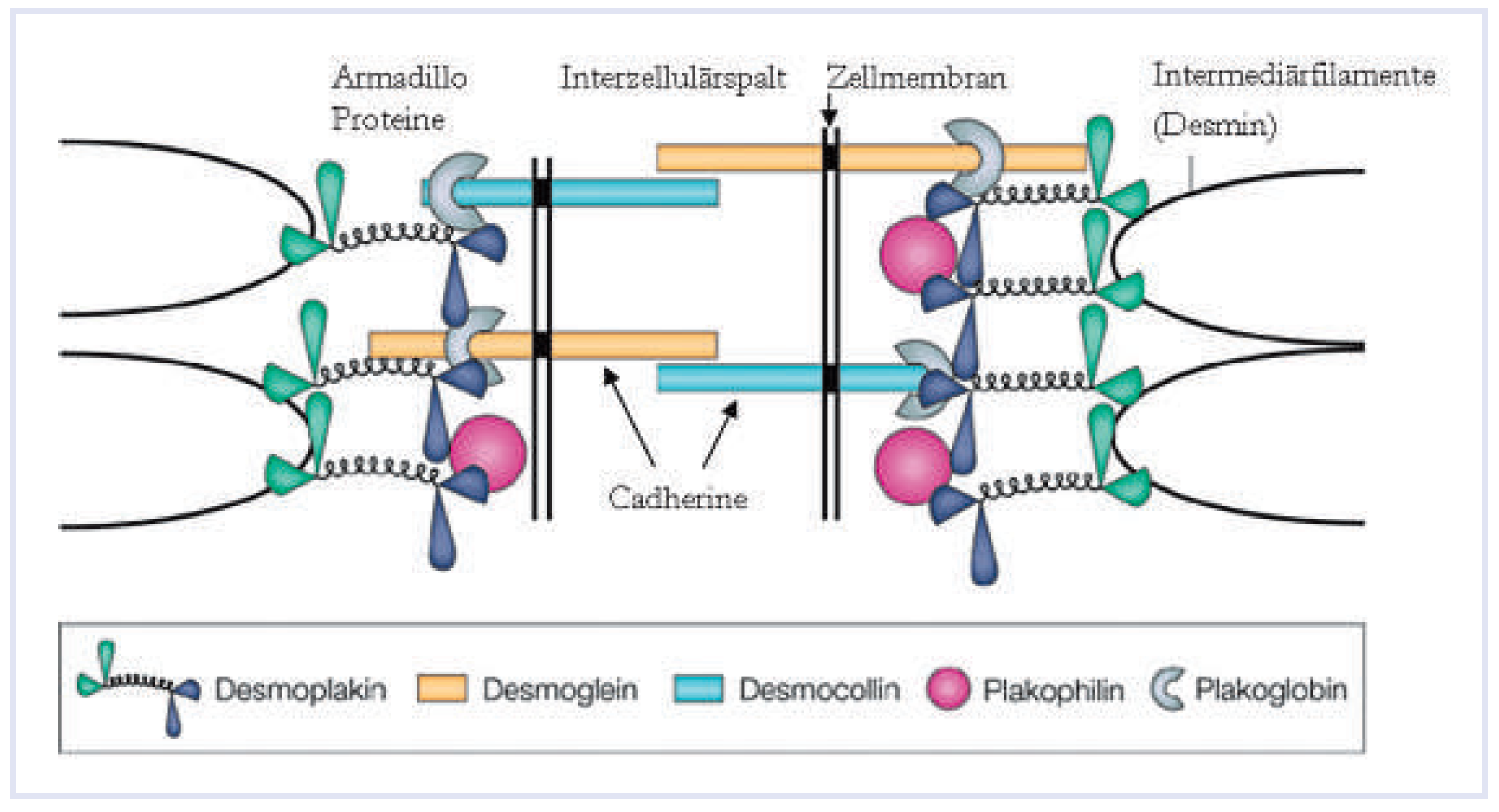
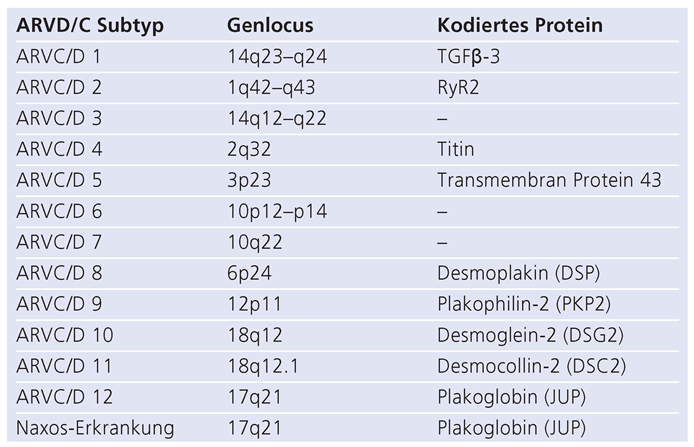
Genetik
 |
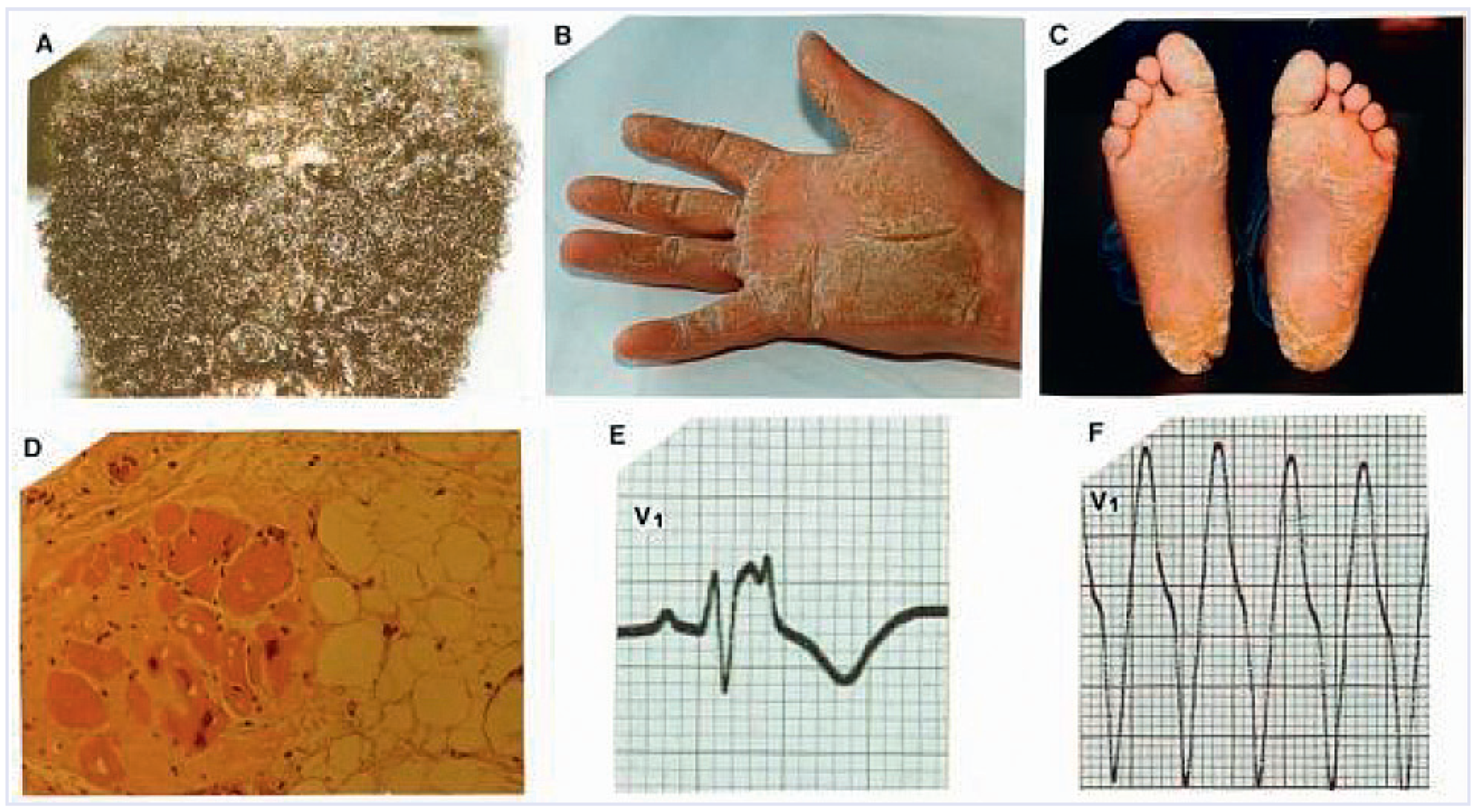
Klinik
Diagnostik
Modifizierte 2010-Task-Force-Kriterien (Tab. 2) [25]
- –
- Globale und regionale myokardiale Dysfunktion und strukturelle Veränderungen.
- –
- Histologische Charakterisierung.
- –
- Repolarisationsstörungen im 12-Kanal-Oberflächen-EKG.
- –
- Depolarisationsstörungen im 12-Kanal-Oberflächen-EKG.
- –
- Arrhythmien.
- –
- Positive Familienanamnese.
Klinische Untersuchung
12-Kanal-Oberflächen-EKG und Signal gemitteltes EKG (SAECG)
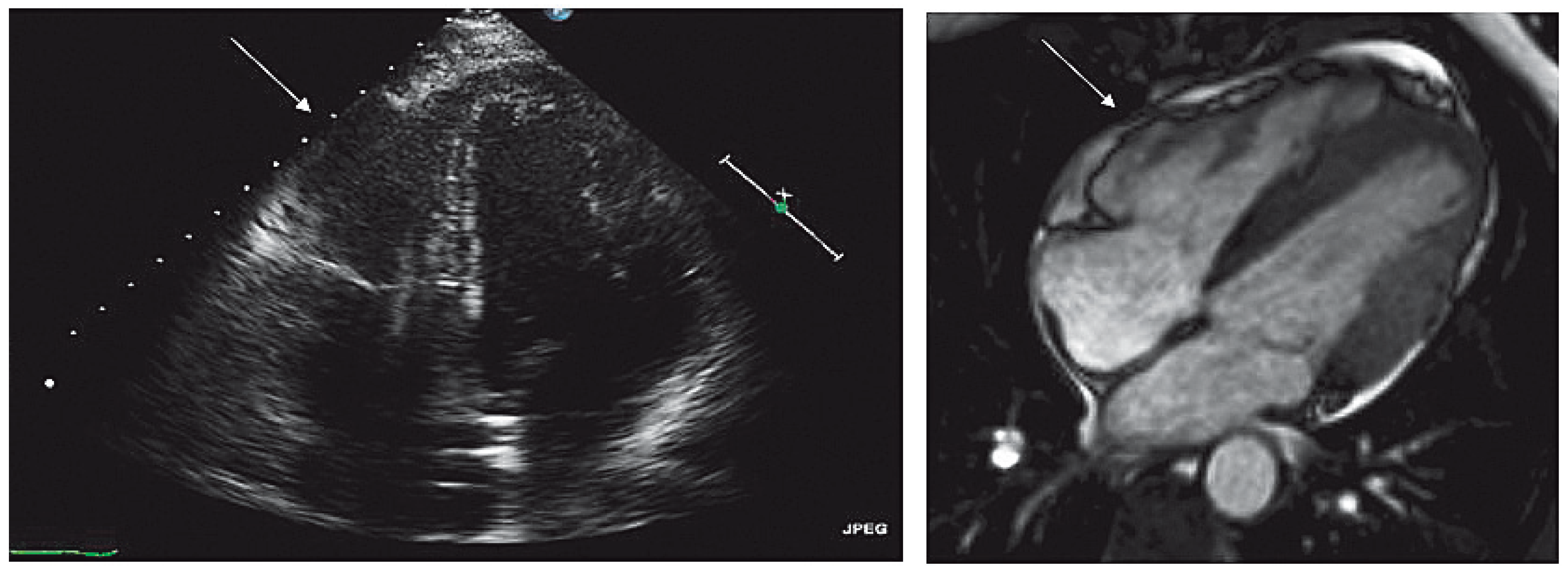
Echokardiographie, kardiale Magnetresonanz (CMR) und RV-Angiographie
 |
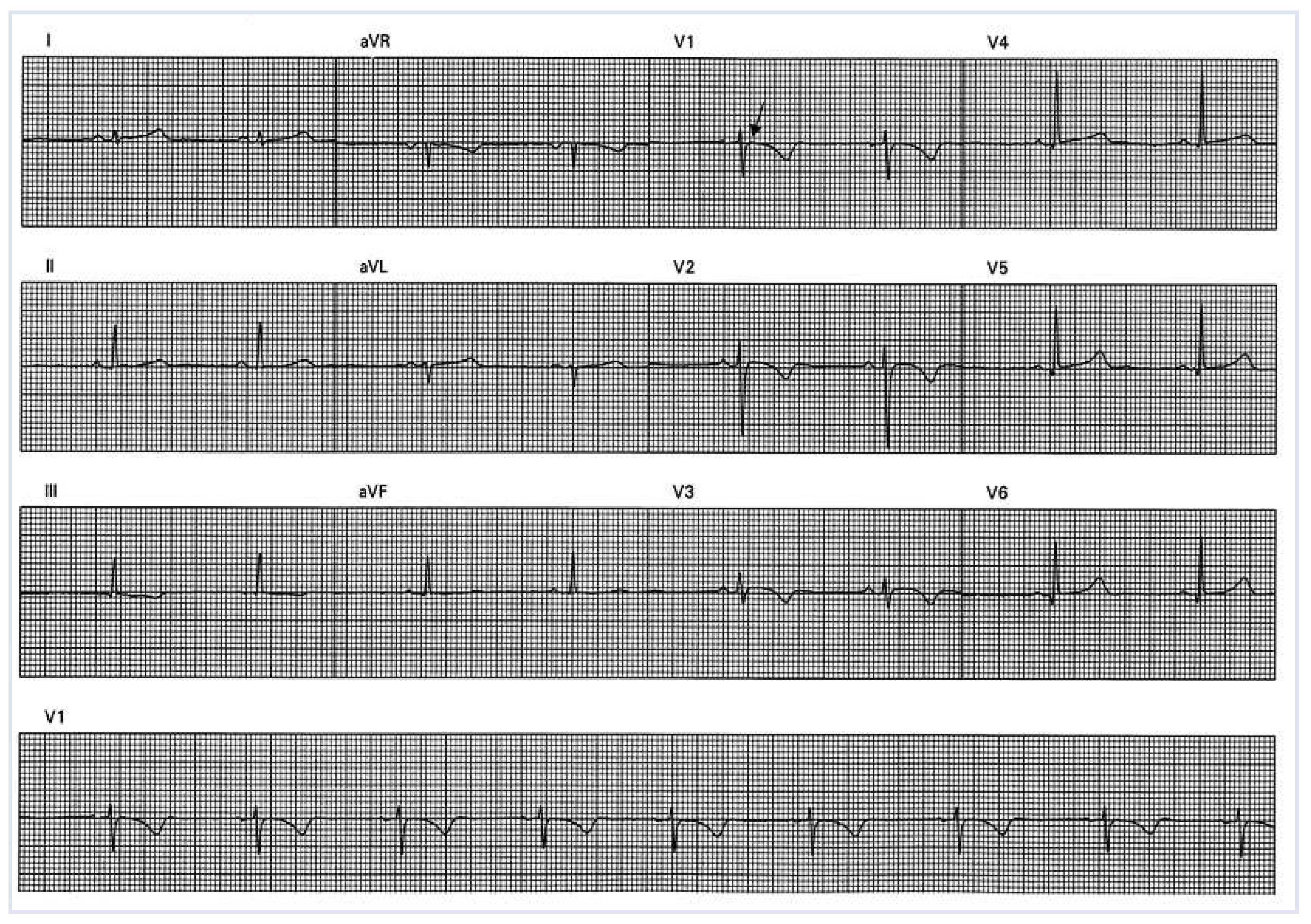
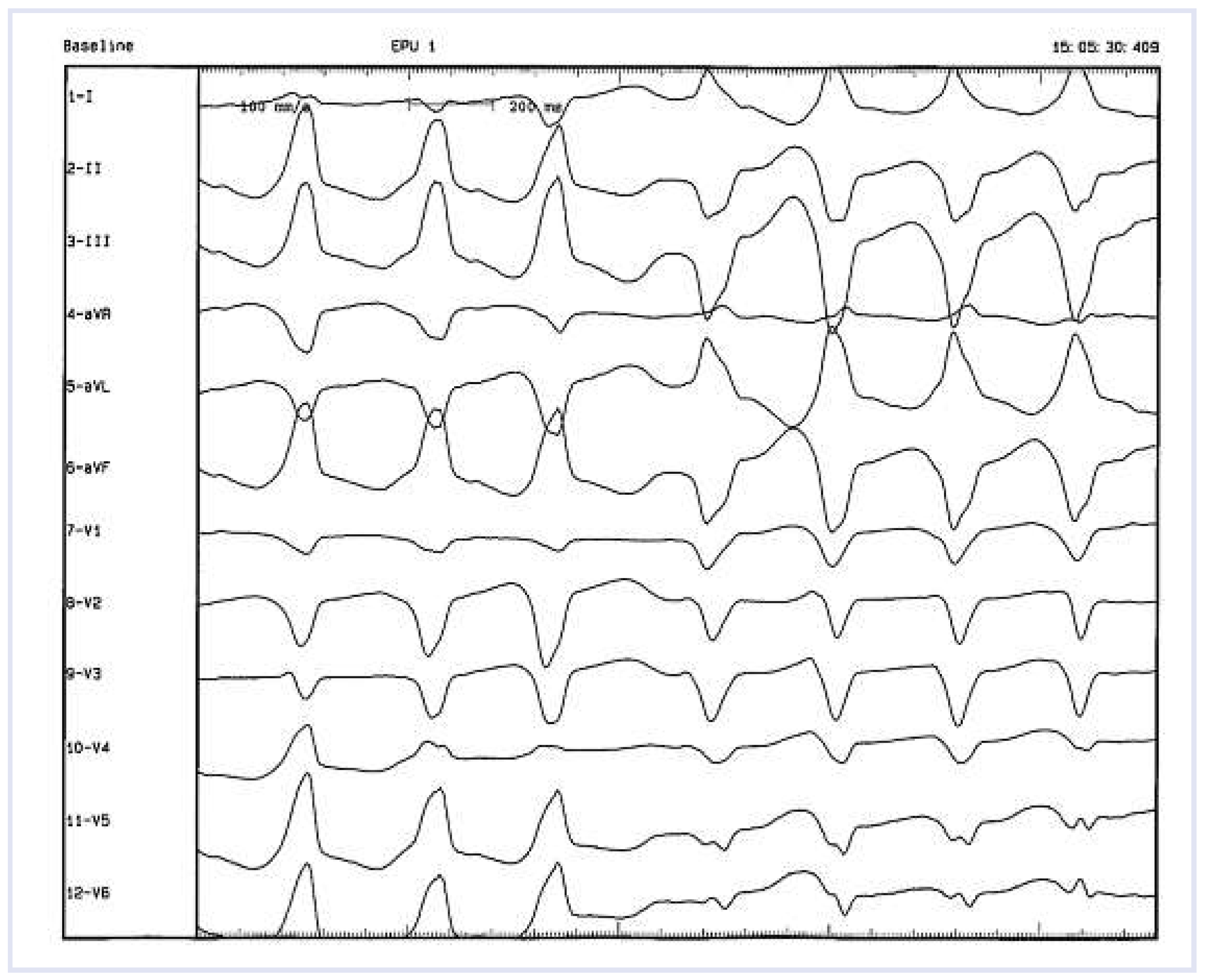
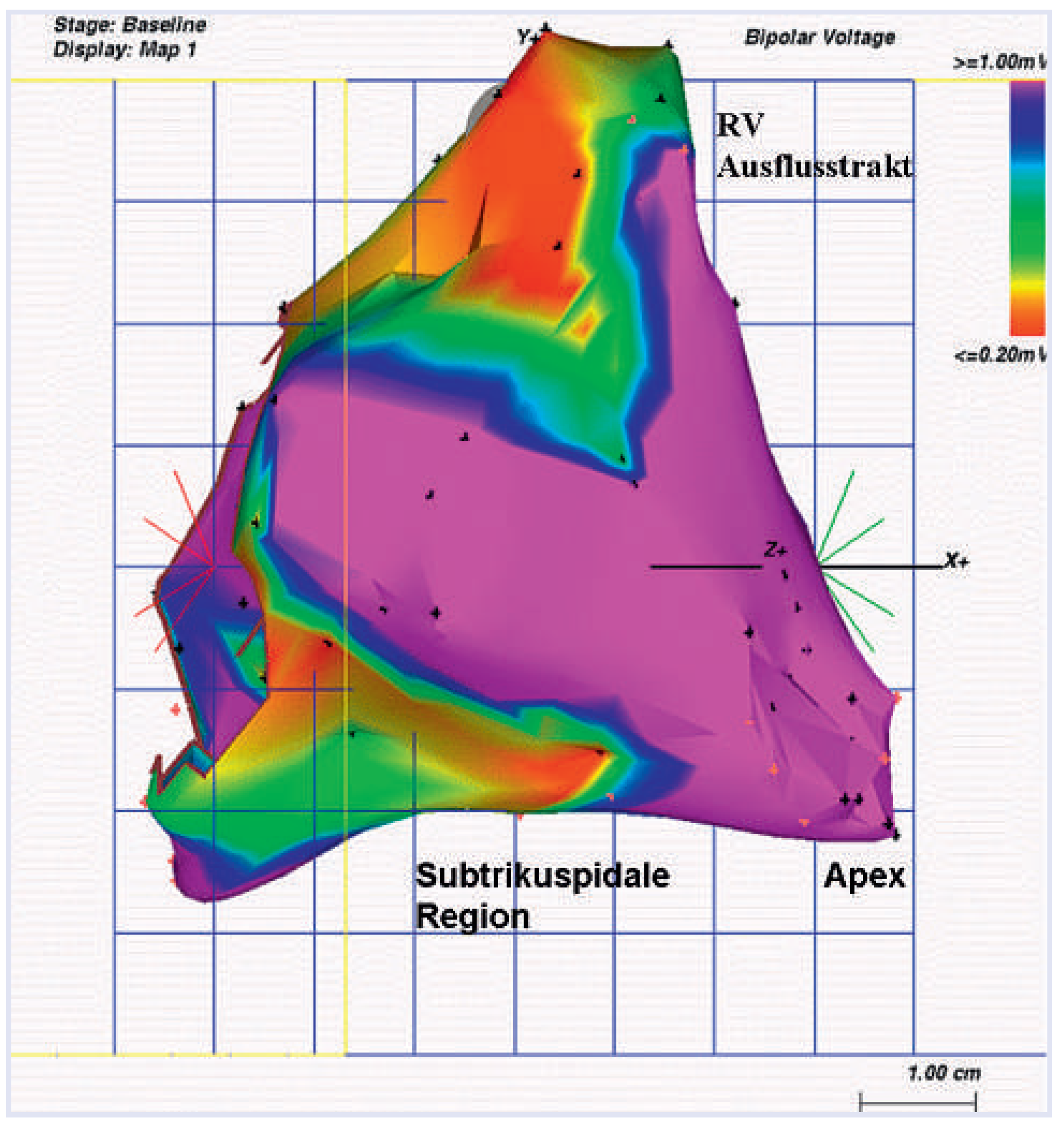
Elektrophysiologische Untersuchung (EPU) und elektroanatomisches Voltage-Mapping
Genetische Testung
 |
Endomyokardiale Biopsie (EMB)
Differentialdiagnosen
Krankheitsverlauf
Es können vier Krankheitsphasen unterschieden werden [1].
- Subklinische Phase, in der bereits diskrete strukturelle Abnormalitäten sichtbar sind, der Patient jedoch vollständig asymptomatisch ist. Dennoch kann es in dieser Phase ohne Prodromi zum SCD als Erstmanifestation kommen. Ein junges Alter per se gilt als Risikofaktor für den SCD [19].
- Auftreten von symptomatischen Arrhythmien aus dem RV (vereinzelte VES bis hin zu anhaltenden KT mit LSB-Morphologie und Kammerflimmern (Abb. 5), die zu Palpitationen, Synkopen und SCD führen können.
- Rechtsherzinsuffizienz mit erhaltener linksventrikulärer Funktion
- Biventrikuläre Herzinsuffizienz in der Spätphase, die einer ausgeprägten dilatativen Kardiomyopathie ähnelt und bis zu einem Herzersatzverfahren führen kann. In dieser Phase werden auch endokardiale Thromben beobachtet, die zu pulmonalen und systemischen Embolien führen können [40].
Behandlung
Appendix
Etablierung eines universitären Programms mit Schwerpunkt ARVD/C
- spezialsprechstunde für arvD/c-Patienten
- 2.
- arvD/c-register
- 3.
- wissenschaftliche und klinische forschungsprojekte
- 4.
- arvD/c wissenschaftliche veranstaltungen
References
- Basso, C.; Corrado, D.; Marcus, F.I.; Nava, A.; Thiene, G. Arrhythmogenic right ventricular cardiomyopathy. Lancet. 2009, 373, 1289–300. [Google Scholar] [CrossRef] [PubMed]
- Frank, R.; Fontaine, G.; Vedel, J.; Mialet, G.; Sol, C.; Guiraudon, G.; et al. Electrocardiology of 4 cases of right ventricular dysplasia inducing arrhythmia. Arch Mal Cœur Vaiss. 1978, 71, 963–72. [Google Scholar]
- Richardson, P.; McKenna, W.; Bristow, M.; Maisch, B.; Mautner, B.; O’Connell, J.; et al. Report of the 1995 world health organization/international society and federation of cardiology task force on the definition and classification of cardiomyopathies. Circulation. 1996, 93, 841–2. [Google Scholar]
- Coonar, A.S.; Protonotarios, N.; Tsatsopoulou, A.; Needham, E.W.A.; Houlston, R.S.; Cliff, S.; et al. Gene for arrhythmogenic right ventricular cardiomyopathy with diffuse nonepidermolytic palmoplantar keratoderma and woolly hair (naxos disease) maps to 17q21. Circulation. 1998, 97, 2049–58. [Google Scholar] [CrossRef]
- Herren, T.; Gerber, P.A.; Duru, F. Arrhythmogenic right ventricular cardio myopathy/dysplasia: A not so rare “disease of the desmosome” with multiple clinical presentations. Clin Res Cardiol. 2009, 98, 141–58. [Google Scholar] [CrossRef]
- Smith, W. Guidelines for the diagnosis and management of arrhythmogenic right ventricular cardiomyopathy. Heart Lung Circ. 2011. [CrossRef]
- Marcus, F.I.; Fontaine, G. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: A review. Pacing Clin Electrophysiol. 1995, 18, 1298–314. [Google Scholar] [CrossRef]
- Nava, A.; Bauce, B.; Basso, C.; Muriago, M.; Rampazzo, A.; Villanova, C.; et al. Clinical profile and long-term follow-up of 37 families with arrhythmogenic right ventricular cardiomyopathy. J Am Coll Cardiol. 2000, 36, 2226–33. [Google Scholar] [CrossRef] [PubMed]
- Corrado, D.; Basso, C.; Schiavon, M.; Thiene, G. Screening for hypertrophic cardiomyopathy in young athletes. N Engl J Med. 1998, 339, 364–9. [Google Scholar] [CrossRef]
- Corrado, D.; Fontaine, G.; Marcus, F.I.; McKenna, W.J.; Nava, A.; Thiene, G.; et al. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: Need for an international registry. Study group on arrhythmogenic right ventricular dysplasia/cardiomyopathy of the working groups on myocardial and pericardial disease and arrhythmias of the european society of cardiology and of the scientific council on cardiomyopathies of the world heart federation. Circulation. 2000, 101, E101–E106. [Google Scholar] [PubMed]
- Burke, A.P.; Farb, A.; Tashko, G.; Virmani, R. Arrhythmogenic right ventricular cardiomyopathy and fatty replacement of the right ventricular myocardium: Are they different diseases? Circulation. 1998, 97, 1571–80. [Google Scholar] [CrossRef]
- Thiene, G.; Corrado, D.; Basso, C. Arrhythmogenic right ventricular cardiomyopathy/dysplasia. Orphanet J Rare Dis. 2007, 2, 45. [Google Scholar] [CrossRef]
- Bowles, N.E.; Ni, J.; Marcus, F.; Towbin, J.A. The detection of cardiotropic viruses in the myocardium of patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy. J Am Coll Cardiol. 2002, 39, 892–5. [Google Scholar] [CrossRef]
- Basso, C.; Czarnowska, E.; Della Barbera, M.; Bauce, B.; Beffagna, G.; Wlodarska, E.K.; et al. Ultrastructural evidence of intercalated disc remodelling in arrhythmogenic right ventricular cardiomyopathy: An electron microscopy investigation on endomyocardial biopsies. Eur Heart J. 2006, 27, 1847–54. [Google Scholar] [CrossRef]
- Asimaki, A.; Tandri, H.; Huang, H.; Halushka, M.K.; Gautam, S.; Basso, C.; et al. A new diagnostic test for arrhythmogenic right ventricular cardiomyopathy. N Engl J Med. 2009, 360, 1075–84. [Google Scholar] [CrossRef] [PubMed]
- Zipes, D.P.; Camm, A.J.; Borggrefe, M.; Buxton, A.E.; Chaitman, B.; Fromer, M.; et al. Acc/aha/esc 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: A report of the american college of cardiology/american heart association task force and the european society of cardiology committee for practice guidelines (writing committee to develop guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death). J Am Coll Cardiol. 2006, 48, e247–346. [Google Scholar] [PubMed]
- Protonotarios, N.; Tsatsopoulou, A. Naxos disease. Indian Pacing Electrophysiol J. 2005, 5, 76–80. [Google Scholar] [PubMed]
- Protonotarios, N.; Tsatsopoulou, A. Naxos disease: Cardiocutaneous syndrome due to cell adhesion defect. Orphanet J Rare Dis. 2006, 1, 4. [Google Scholar] [CrossRef]
- Corrado, D.; Basso, C.; Pilichou, K.; Thiene, G. Molecular biology and clinical management of arrhythmogenic right ventricular cardiomyopathy/dysplasia. Heart. 2011, 97, 530–9. [Google Scholar] [CrossRef]
- Hulot, J.S.; Jouven, X.; Empana, J.P.; Frank, R.; Fontaine, G. Natural history and risk stratification of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Circulation. 2004, 110, 1879–84. [Google Scholar] [CrossRef]
- Tabib, A.; Loire, R.; Chalabreysse, L.; Meyronnet, D.; Miras, A.; Malicier, D.; et al. Circumstances of death and gross and microscopic observations in a series of 200 cases of sudden death associated with arrhythmogenic right ventricular cardiomyopathy and/or dysplasia. Circulation. 2003, 108, 3000–5. [Google Scholar] [CrossRef]
- Tonet, J.L.; Castro-Miranda, R.; Iwa, T.; Poulain, F.; Frank, R.; Fontaine, G.H. Frequency of supraventricular tachyarrhythmias in arrhythmogenic right ventricular dysplasia. Am J Cardiol. 1991, 67, 1153. [Google Scholar] [CrossRef]
- Shen, W.K.; Edwards, W.D.; Hammill, S.C.; Bailey, K.R.; Ballard, D.J.; Gersh, B.J. Sudden unexpected nontraumatic death in 54 young adults: A 30year population-based study. Am J Cardiol. 1995, 76, 148–52. [Google Scholar] [CrossRef]
- Tiso, N.; Stephan, D.A.; Nava, A.; Bagattin, A.; Devaney, J.M.; Stanchi, F.; et al. Identification of mutations in the cardiac ryanodine receptor gene in families affected with arrhythmogenic right ventricular cardiomyopathy type 2 (arvd2). Hum Mol Genet. 2001, 10, 189–94. [Google Scholar] [CrossRef]
- Marcus, F.I.; McKenna, W.J.; Sherrill, D.; Basso, C.; Bauce, B.; Bluemke, D.A.; et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: Proposed modification of the task force criteria. Eur Heart J. 2010, 31, 806–14. [Google Scholar] [CrossRef]
- Ananthasubramaniam, K.; Khaja, F. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: Review for the clinician. Prog Cardiovasc Dis. 1998, 41, 237–46. [Google Scholar] [CrossRef]
- Piccini, J.P.; Nasir, K.; Bomma, C.; Tandri, H.; Dalal, D.; Tichnell, C.; et al. Electrocardiographic findings over time in arrhythmogenic right ventricular dysplasia/cardiomyopathy. Am J Cardiol. 2005, 96, 122–6. [Google Scholar] [CrossRef]
- Kobza, R.; Zuber, M.; Erne, P. Ursprung der extrasystolen. Cardiovascular Medicine. 2008, 11, 387–9. [Google Scholar]
- Bluemke, D.A.; Krupinski, E.A.; Ovitt, T.; Gear, K.; Unger, E.; Axel, L.; et al. Mr imaging of arrhythmogenic right ventricular cardiomyopathy: Morphologic findings and interobserver reliability. Cardiology. 2003, 99, 153–62. [Google Scholar] [CrossRef] [PubMed]
- Bomma, C.; Rutberg, J.; Tandri, H.; Nasir, K.; Roguin, A.; Tichnell, C.; et al. Misdiagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. J Cardiovasc Electrophysiol. 2004, 15, 300–6. [Google Scholar] [CrossRef] [PubMed]
- Santangeli, P.; Pieroni, M.; Dello Russo, A.; Casella, M.; Pelargonio, G.; Macchione, A.; et al. Noninvasive diagnosis of electroanatomic abnormalities in arrhythmogenic right ventricular cardiomyopathy. Circ Arrhythm Electrophysiol. 2010, 3, 632–8. [Google Scholar] [CrossRef]
- Corrado, D.; Basso, C.; Leoni, L.; Tokajuk, B.; Bauce, B.; Frigo, G.; et al. Threedimensional electroanatomic voltage mapping increases accuracy of diagnosing arrhythmogenic right ventricular cardiomyopathy/dysplasia. Circulation. 2005, 111, 3042–50. [Google Scholar] [CrossRef]
- Corrado, D.; Basso, C.; Leoni, L.; Tokajuk, B.; Turrini, P.; Bauce, B.; et al. Threedimensional electroanatomical voltage mapping and histologic evaluation of myocardial substrate in right ventricular outflow tract tachycardia. J Am Coll Cardiol. 2008, 51, 731–9. [Google Scholar] [CrossRef]
- Ackerman, M.J.; Priori, S.G.; Willems, S.; Berul, C.; Brugada, R.; Calkins, H.; et al. Hrs/ehra expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies: This document was developed as a partnership between the heart rhythm society (hrs) and the european heart rhythm association (ehra). Europace. 2011, 13, 1077–109. [Google Scholar] [CrossRef] [PubMed]
- Charron, P.; Arad, M.; Arbustini, E.; Basso, C.; Bilinska, Z.; Elliott, P.; et al. Genetic counselling and testing in cardiomyopathies: A position statement of the european society of cardiology working group on myocardial and pericardial diseases. Eur Heart J. 2010, 31, 2715–26. [Google Scholar] [CrossRef] [PubMed]
- McNally, E.; MacLeod, H.; Dellefave, L. Arrhythmogenic right ventricular dysplasia/cardiomyopathy, autosomal dominant. 1993.
- Jacoby, D.; McKenna, W.J. Genetics of inherited cardiomyopathy. Eur Heart J. 2011. [Google Scholar] [CrossRef]
- Awad, M.M.; Calkins, H.; Judge, D.P. Mechanisms of disease: Molecular genetics of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Nat Clin Pract Cardiovasc Med. 2008, 5, 258–67. [Google Scholar] [CrossRef] [PubMed]
- Muthappan, P.; Calkins, H. Arrhythmogenic right ventricular dysplasia. Prog Cardiovasc Dis. 2008, 51, 31–43. [Google Scholar] [CrossRef]
- Wlodarska, E.K.; Wozniak, O.; Konka, M.; Rydlewska-Sadowska, W.; Biederman, A.; Hoffman, P. Thromboembolic complications in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy. Europace. 2006, 8, 596–600. [Google Scholar] [CrossRef]
- Bauce, B.; Nava, A.; Rampazzo, A.; Daliento, L.; Muriago, M.; Basso, C.; et al. Familial effort polymorphic ventricular arrhythmias in arrhythmogenic right ventricular cardiomyopathy map to chromosome 1q42-43. Am J Cardiol. 2000, 85, 573–9. [Google Scholar] [CrossRef]
- Corrado, D.; Leoni, L.; Link, M.S.; Della Bella, P.; Gaita, F.; Curnis, A.; et al. Implantable cardioverter-defibrillator therapy for prevention of sudden death in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia. Circulation. 2003, 108, 3084–91. [Google Scholar] [CrossRef]
- Lemola, K.; Brunckhorst, C.; Helfenstein, U.; Oechslin, E.; Jenni, R.; Duru, F. Predictors of adverse outcome in patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy: Long term experience of a tertiary care centre. Heart. 2005, 91, 1167–72. [Google Scholar] [CrossRef]
- Merner, N.D.; Hodgkinson, K.A.; Haywood, A.F.; Connors, S.; French, V.M.; Drenckhahn, J.D.; et al. Arrhythmogenic right ventricular cardiomyopathy type 5 is a fully penetrant, lethal arrhythmic disorder caused by a missense mutation in the tmem43 gene. Am J Hum Genet. 2008, 82, 809–21. [Google Scholar] [CrossRef]
- Corrado, D.; Basso, C.; Thiene, G. Comparison of united states and italian experiences with sudden cardiac deaths in young competitive athletes: Are the athletic populations comparable? Am J Cardiol. author reply 422. 2010, 105, 421–2. [Google Scholar] [CrossRef] [PubMed]
- Sen-Chowdhry, S.; Syrris, P.; Ward, D.; Asimaki, A.; Sevdalis, E.; McKenna, W.J. Clinical and genetic characterization of families with arrhythmogenic right ventricular dysplasia/cardiomyopathy provides novel insights into patterns of disease expression. Circulation. 2007, 115, 1710–20. [Google Scholar] [CrossRef] [PubMed]
- Wichter, T.; Borggrefe, M.; Haverkamp, W.; Chen, X.; Breithardt, G. Efficacy of antiarrhythmic drugs in patients with arrhythmogenic right ventricular disease. Results in patients with inducible and noninducible ventricular tachycardia. Circulation. 1992, 86, 29–37. [Google Scholar] [CrossRef]
- Calkins, H. Arrhythmogenic right-ventricular dysplasia/cardiomyopathy. Curr Opin Cardiol. 2006, 21, 55–63. [Google Scholar] [CrossRef] [PubMed]
- Hiroi, Y.; Fujiu, K.; Komatsu, S.; Sonoda, M.; Sakomura, Y.; Imai, Y.; et al. Carvedilol therapy improved left ventricular function in a patient with arrhythmogenic right ventricular cardiomyopathy. Jpn Heart J. 2004, 45, 169–77. [Google Scholar] [CrossRef]
- Marcus, G.M.; Glidden, D.V.; Polonsky, B.; Zareba, W.; Smith, L.M.; Cannom, D.S.; et al. Efficacy of antiarrhythmic drugs in arrhythmogenic right ventricular cardiomyopathy: A report from the north american arvc registry. J Am Coll Cardiol. 2009, 54, 609–15. [Google Scholar] [CrossRef]
© 2011 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Saguner, A.M.; Brunckhorst, C.; Duru, F. Die Arrhythmogene Rechtsventrikuläre Dysplasie/Kardiomyopathie. Cardiovasc. Med. 2011, 14, 303. https://doi.org/10.4414/cvm.2011.01623
Saguner AM, Brunckhorst C, Duru F. Die Arrhythmogene Rechtsventrikuläre Dysplasie/Kardiomyopathie. Cardiovascular Medicine. 2011; 14(11):303. https://doi.org/10.4414/cvm.2011.01623
Chicago/Turabian StyleSaguner, Ardan M., Corinna Brunckhorst, and Firat Duru. 2011. "Die Arrhythmogene Rechtsventrikuläre Dysplasie/Kardiomyopathie" Cardiovascular Medicine 14, no. 11: 303. https://doi.org/10.4414/cvm.2011.01623
APA StyleSaguner, A. M., Brunckhorst, C., & Duru, F. (2011). Die Arrhythmogene Rechtsventrikuläre Dysplasie/Kardiomyopathie. Cardiovascular Medicine, 14(11), 303. https://doi.org/10.4414/cvm.2011.01623




