Moderne Technologien in der Ablation des Vorhofflimmerns
Abstract
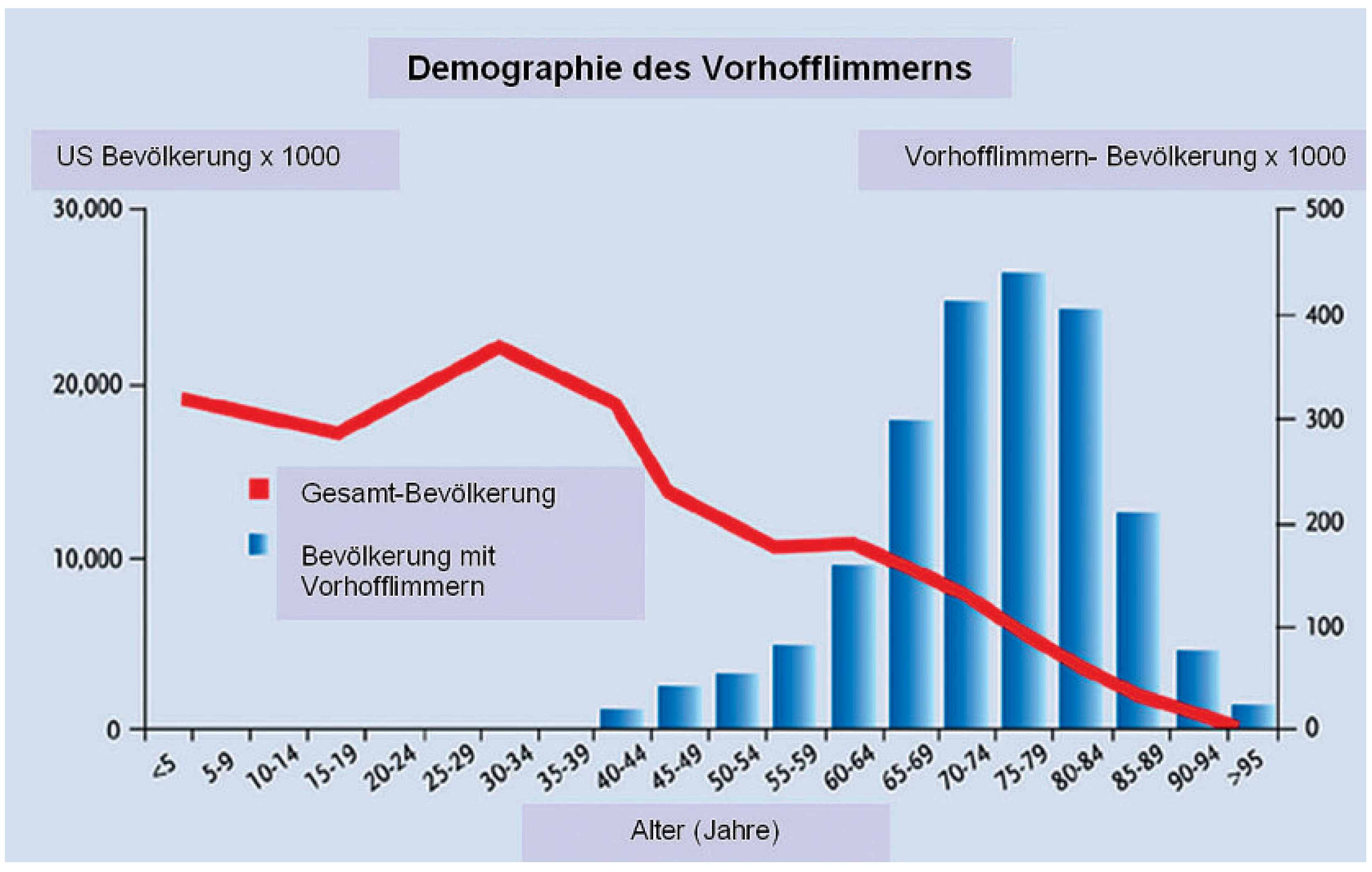
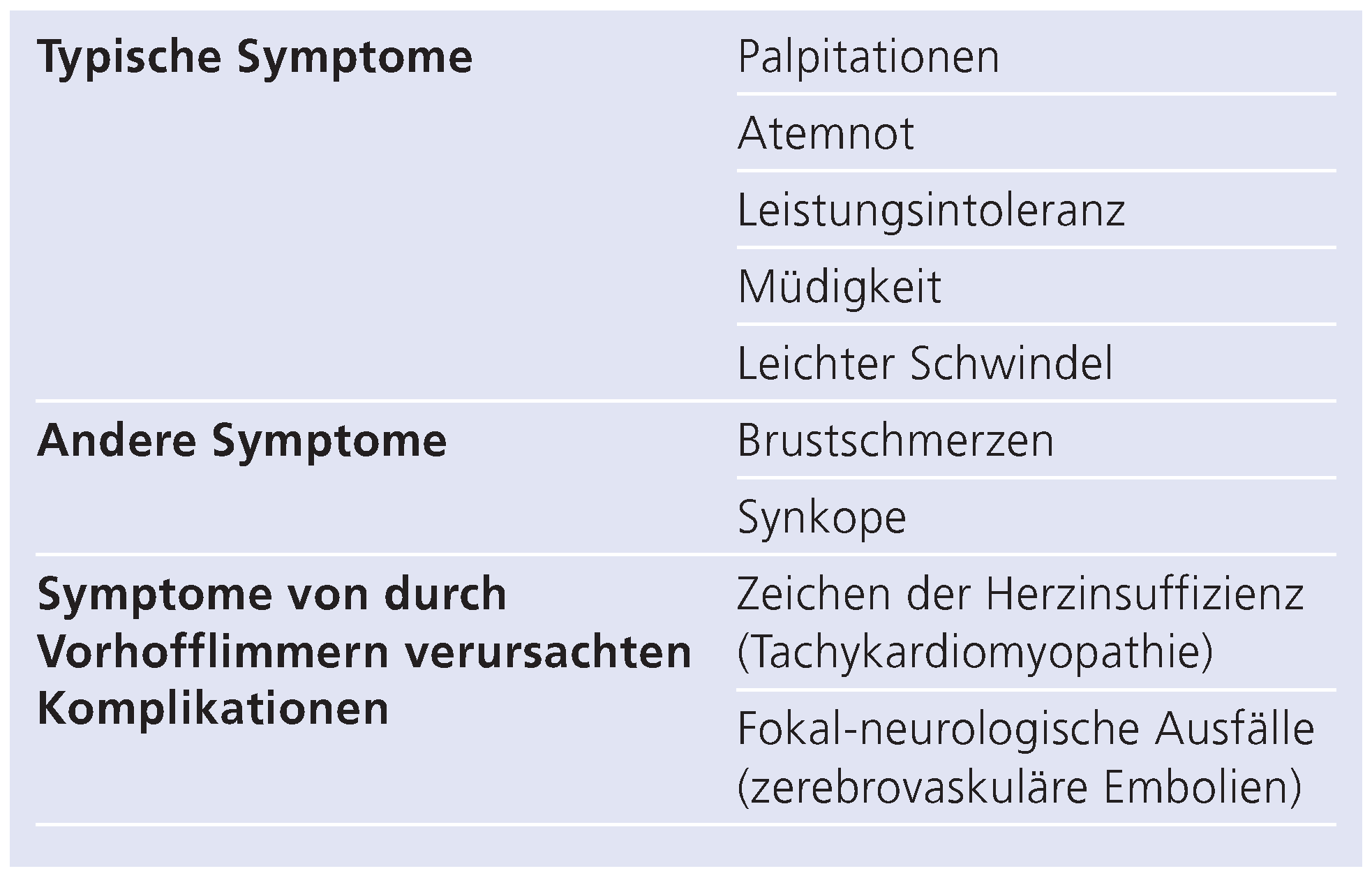
1. Bedeutung des Vorhofflimmerns
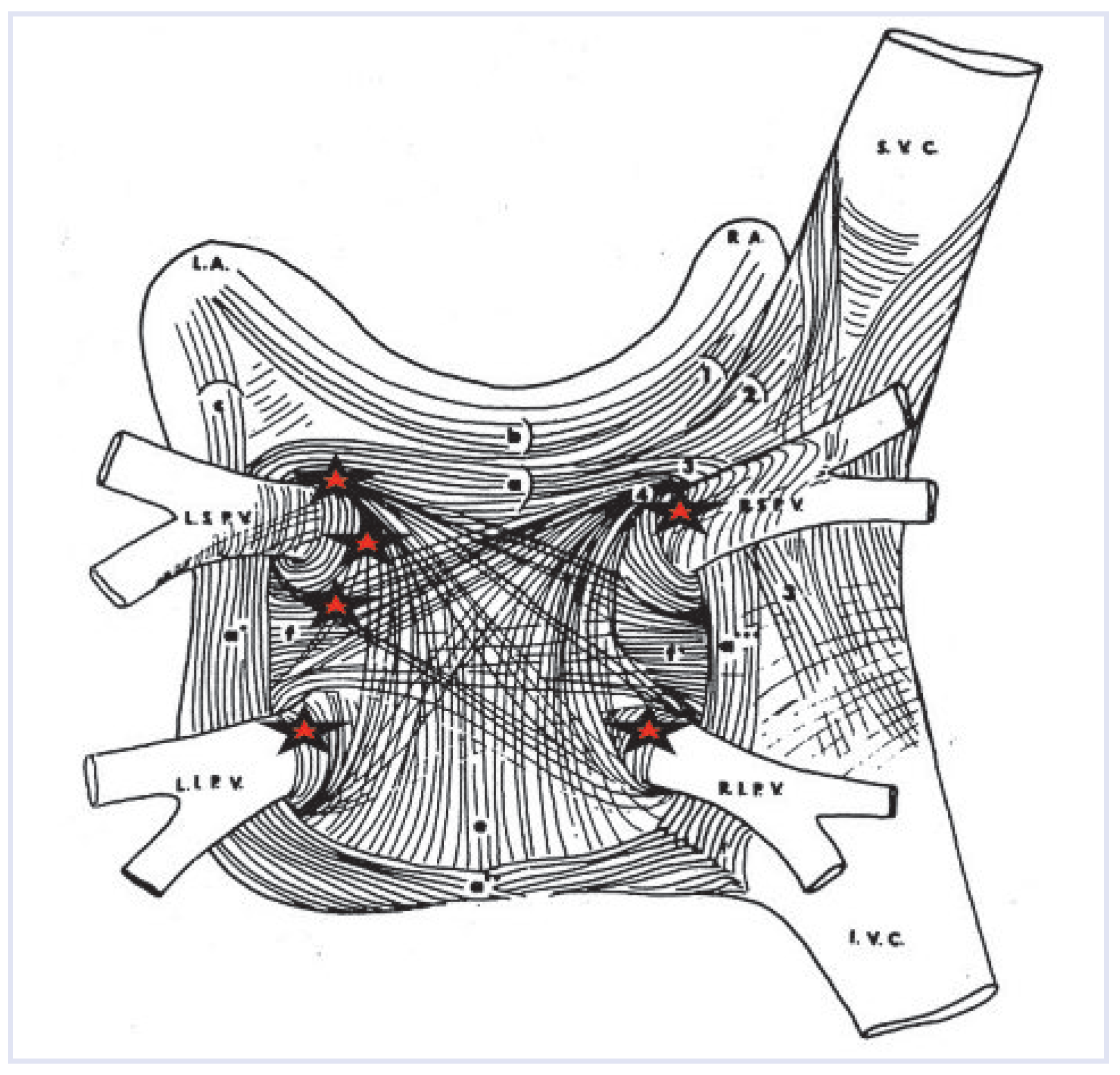
2. Pathophysiologie und Perkutane Kathetergestützte Ablation
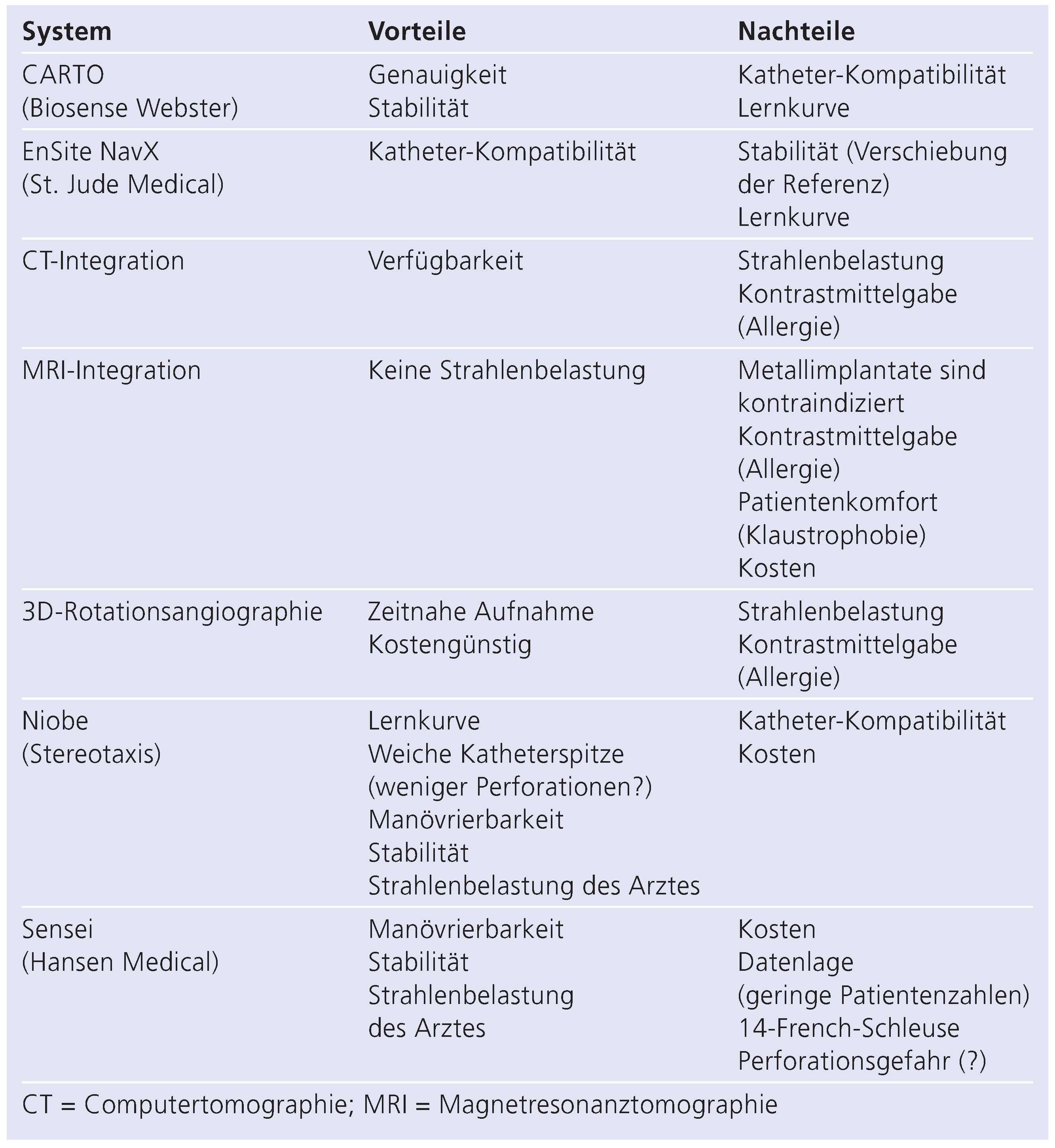
3. Mapping-Systeme—Die Landkarte Während der Untersuchung
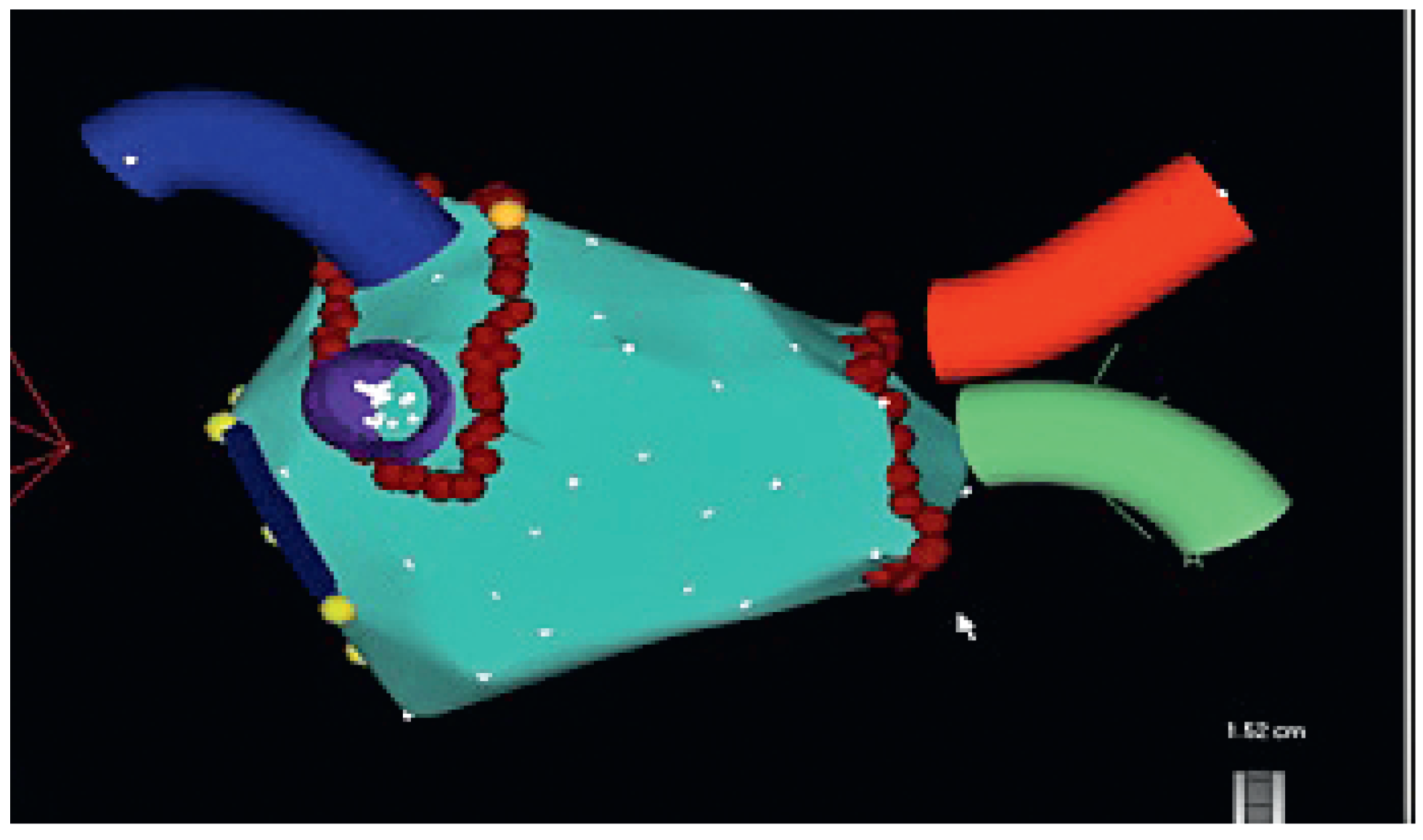
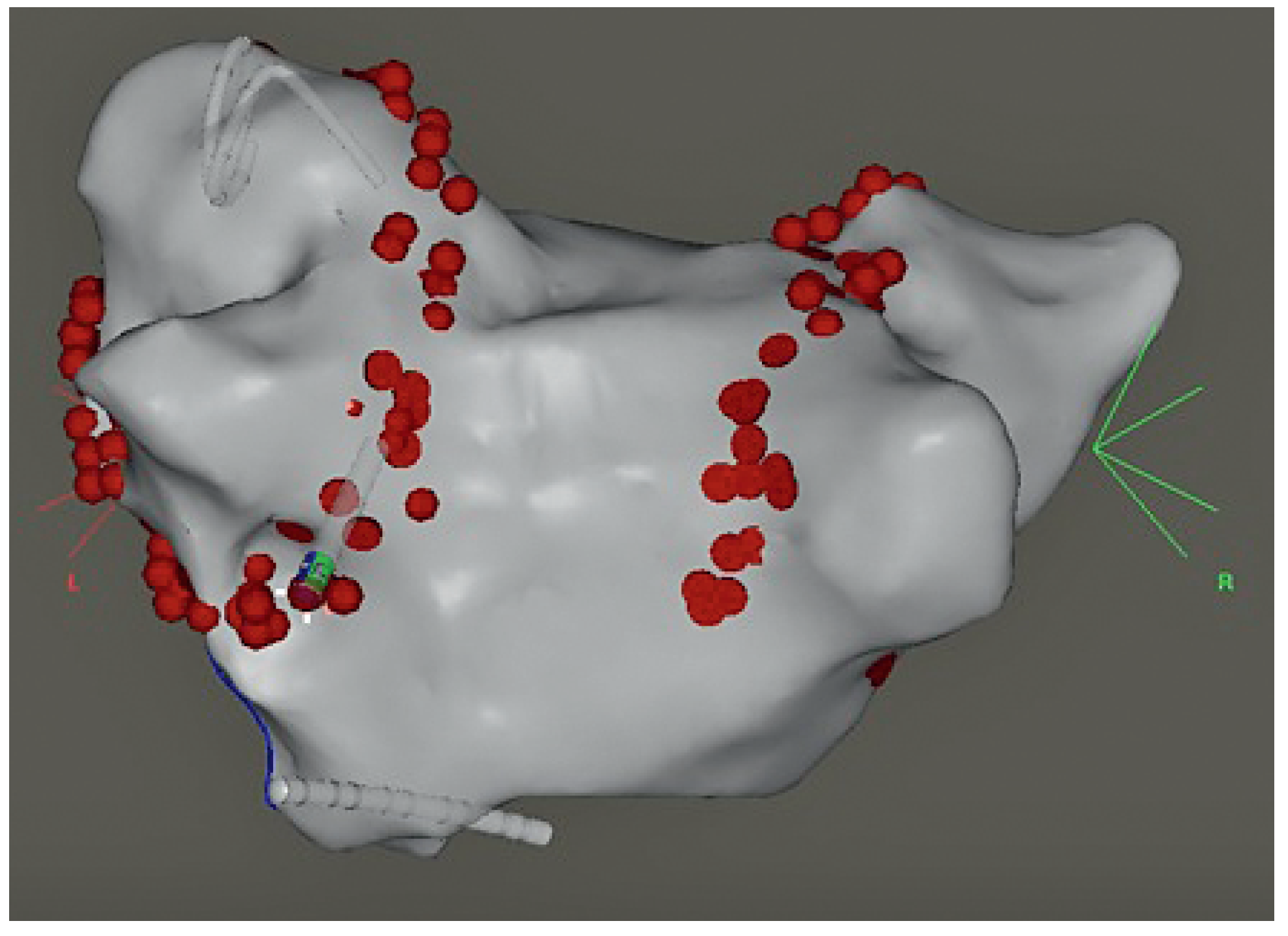
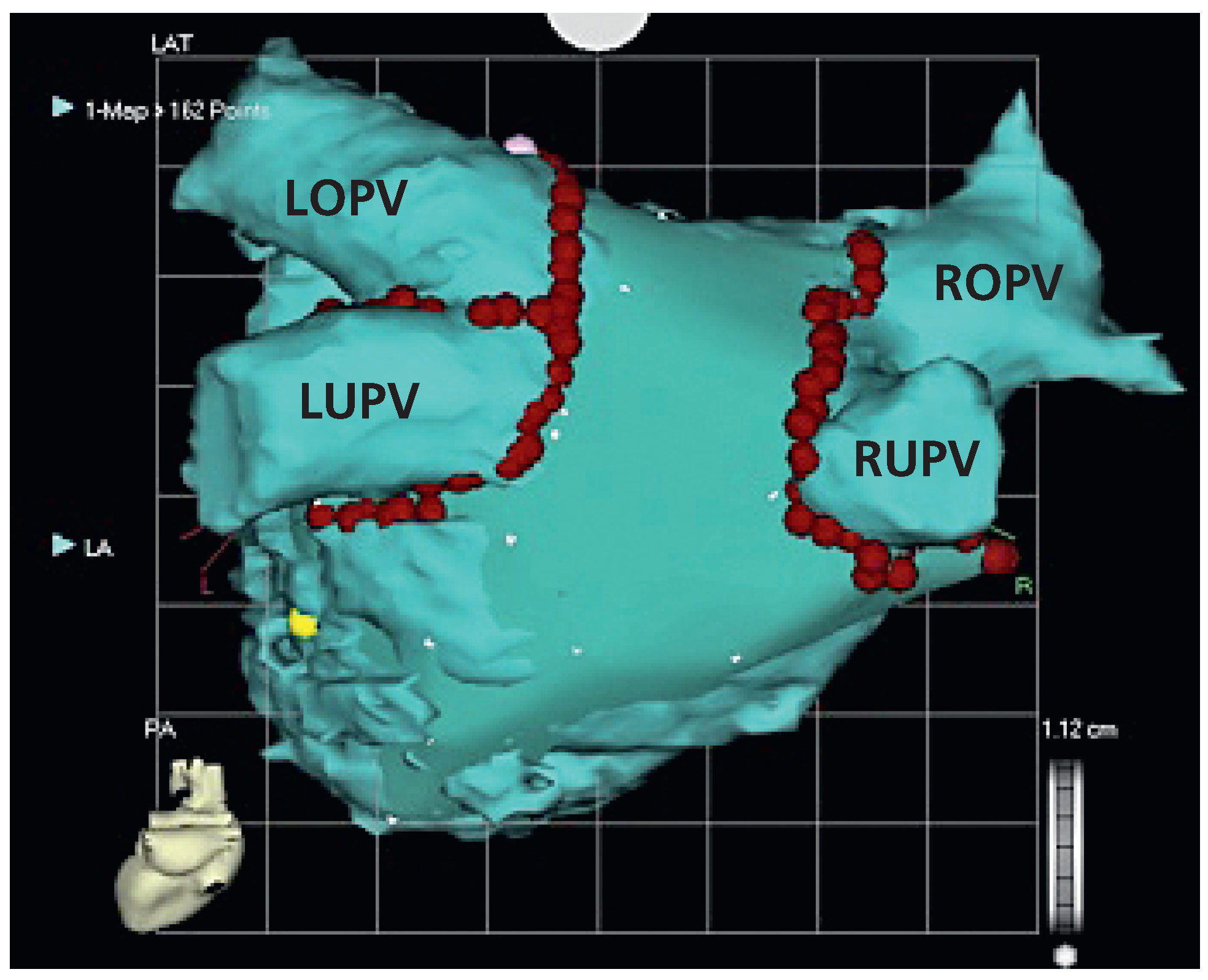
3.1. CARTO
3.2. EnSite NavX
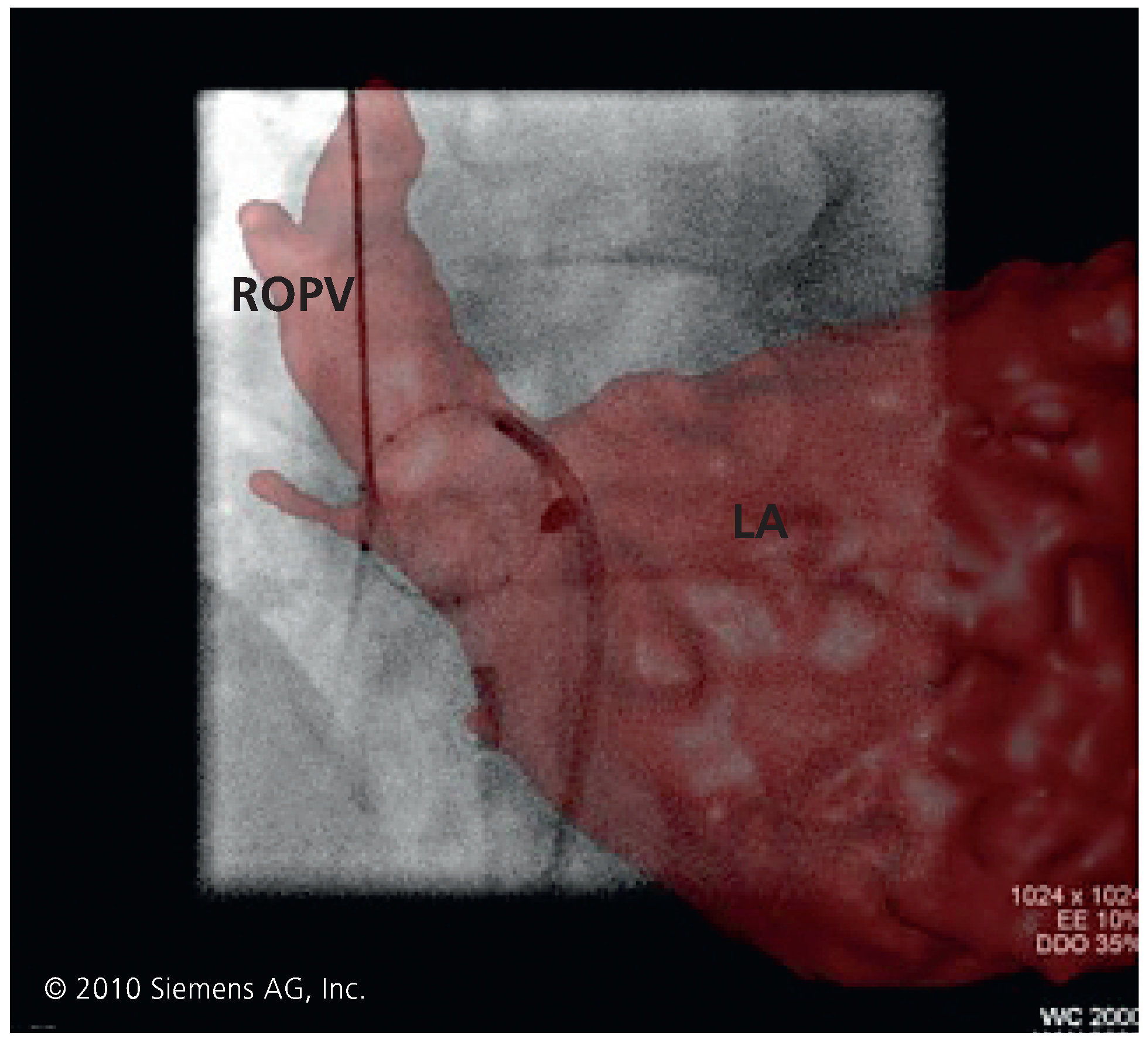
4. Bildintegration von Computertomographie und Magnetresonanztomographie
5. Dreidimensionale Rotationsangiographie
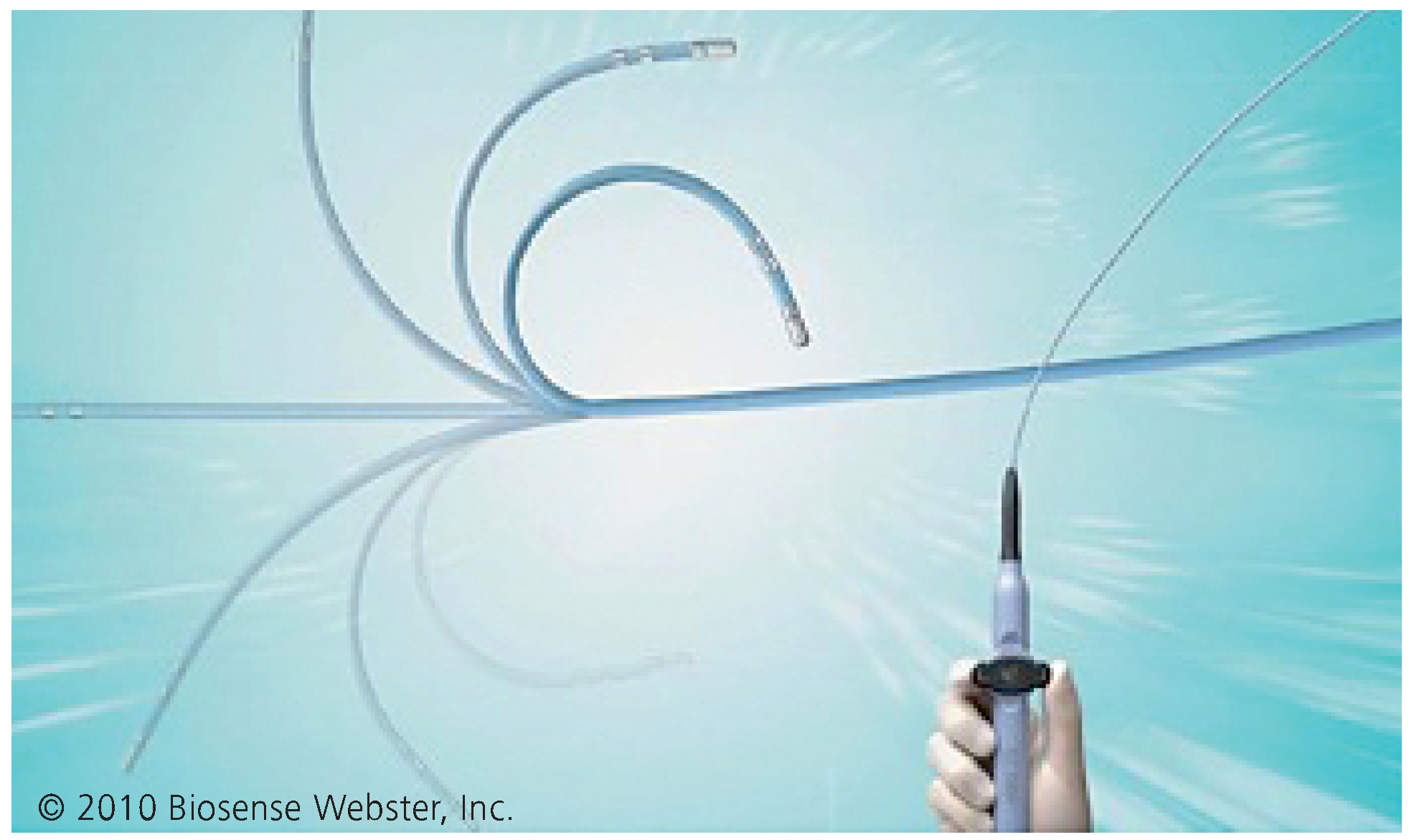
6. Moderne Systeme zur Besseren Steuerung der Katheter
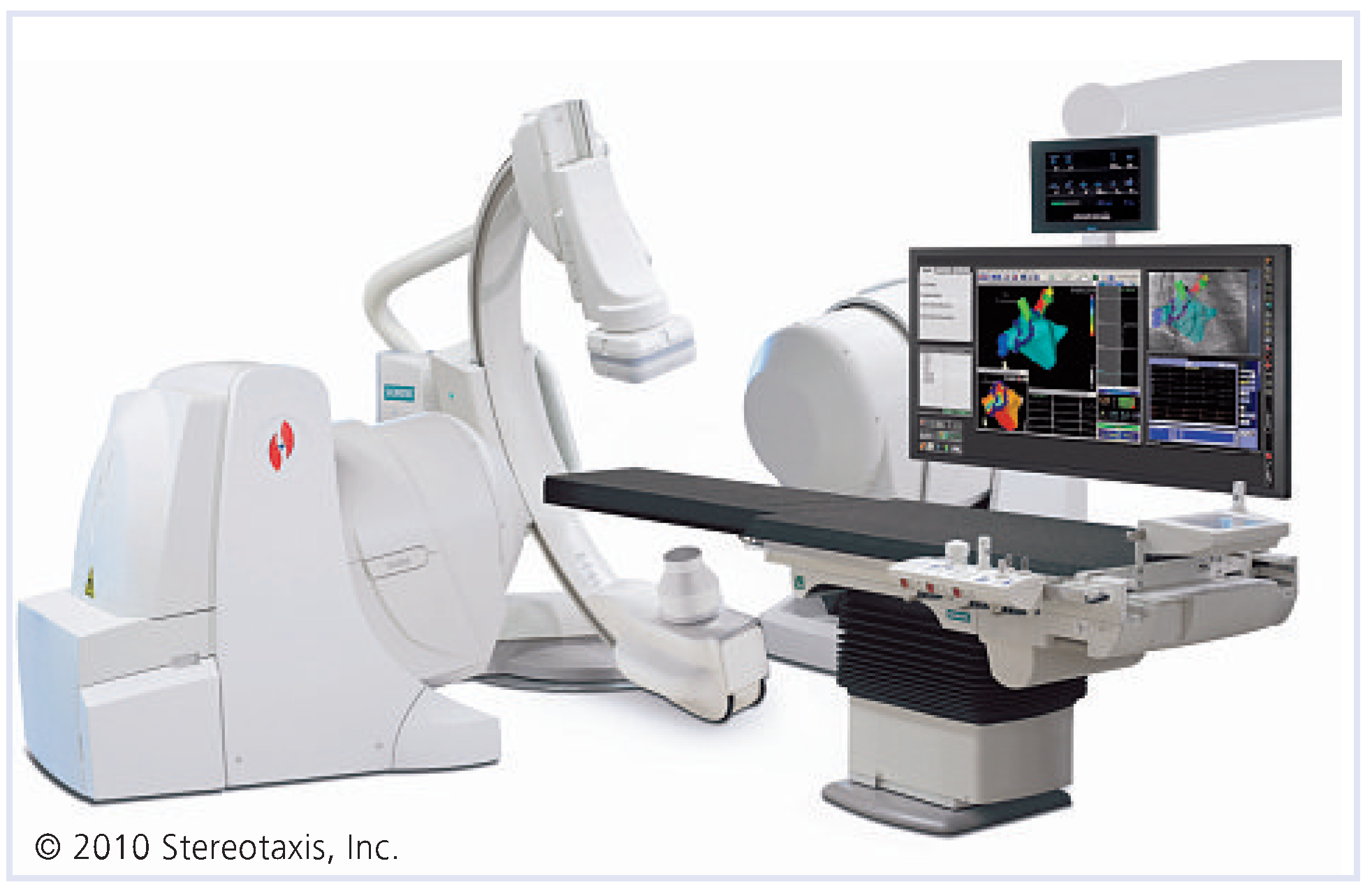
6.1. Niobe
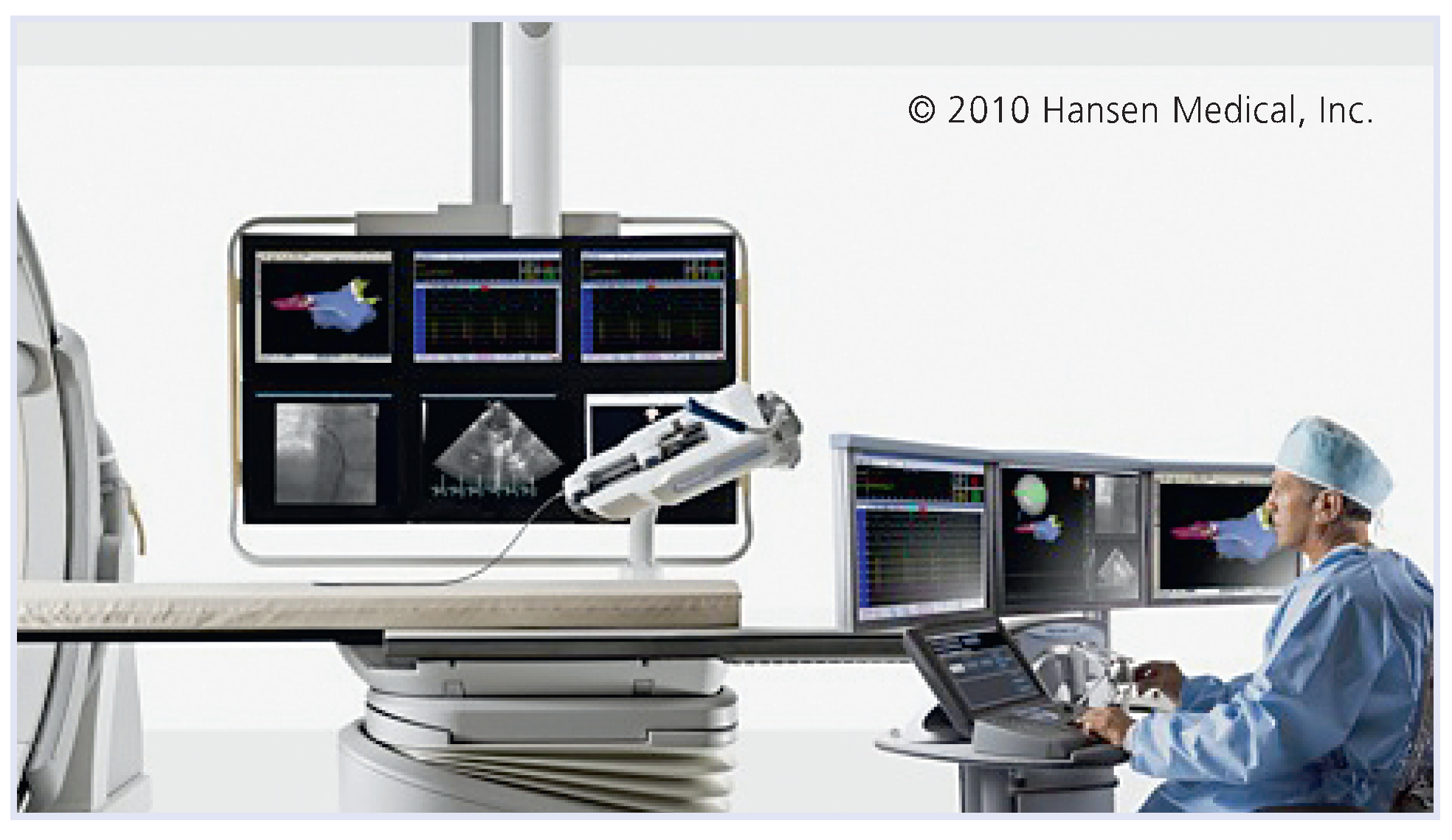
6.2. Sensei
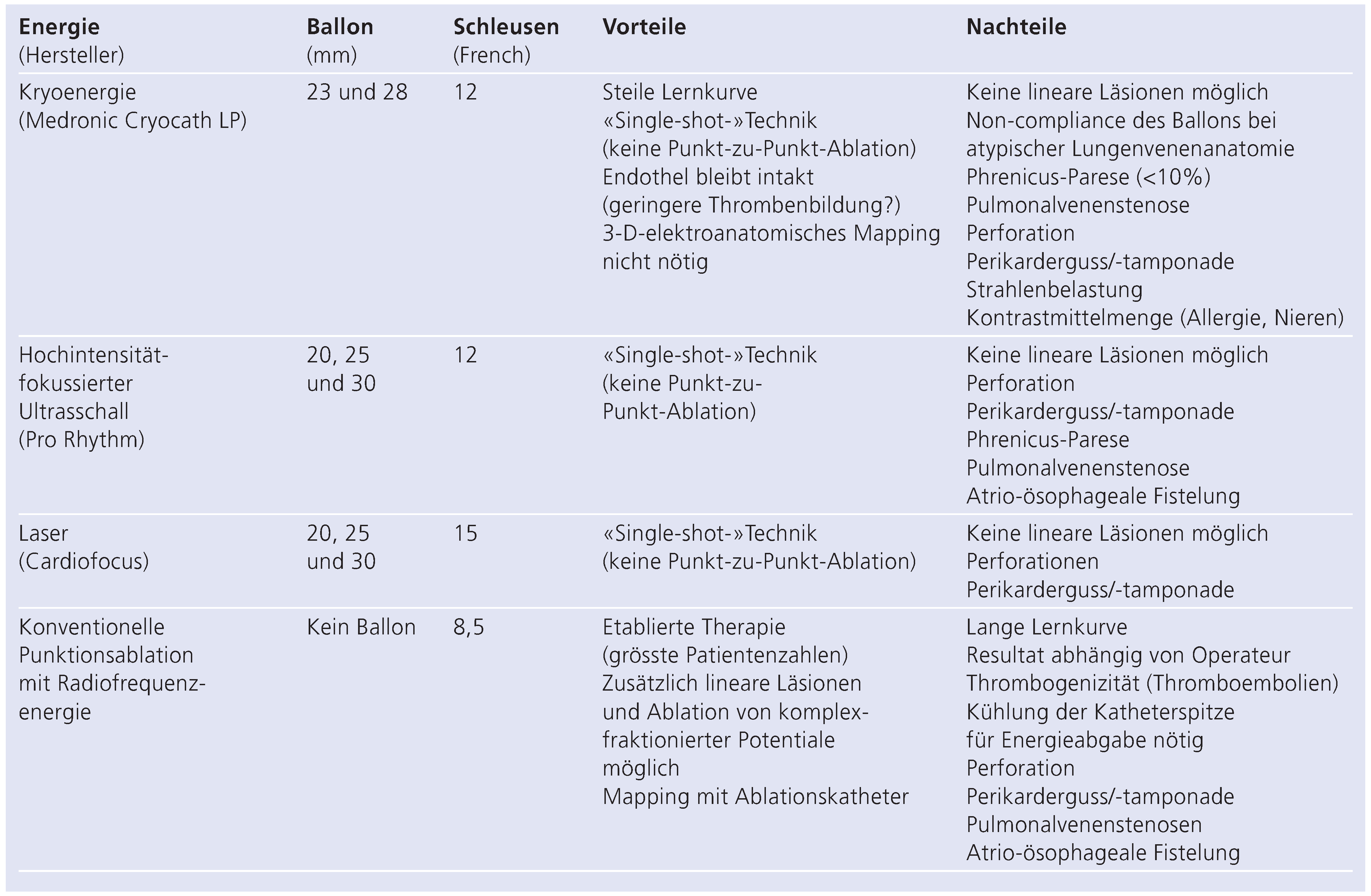
7. Neue Ablationsstrategien und Energieformen
7.1. Kryoenergie
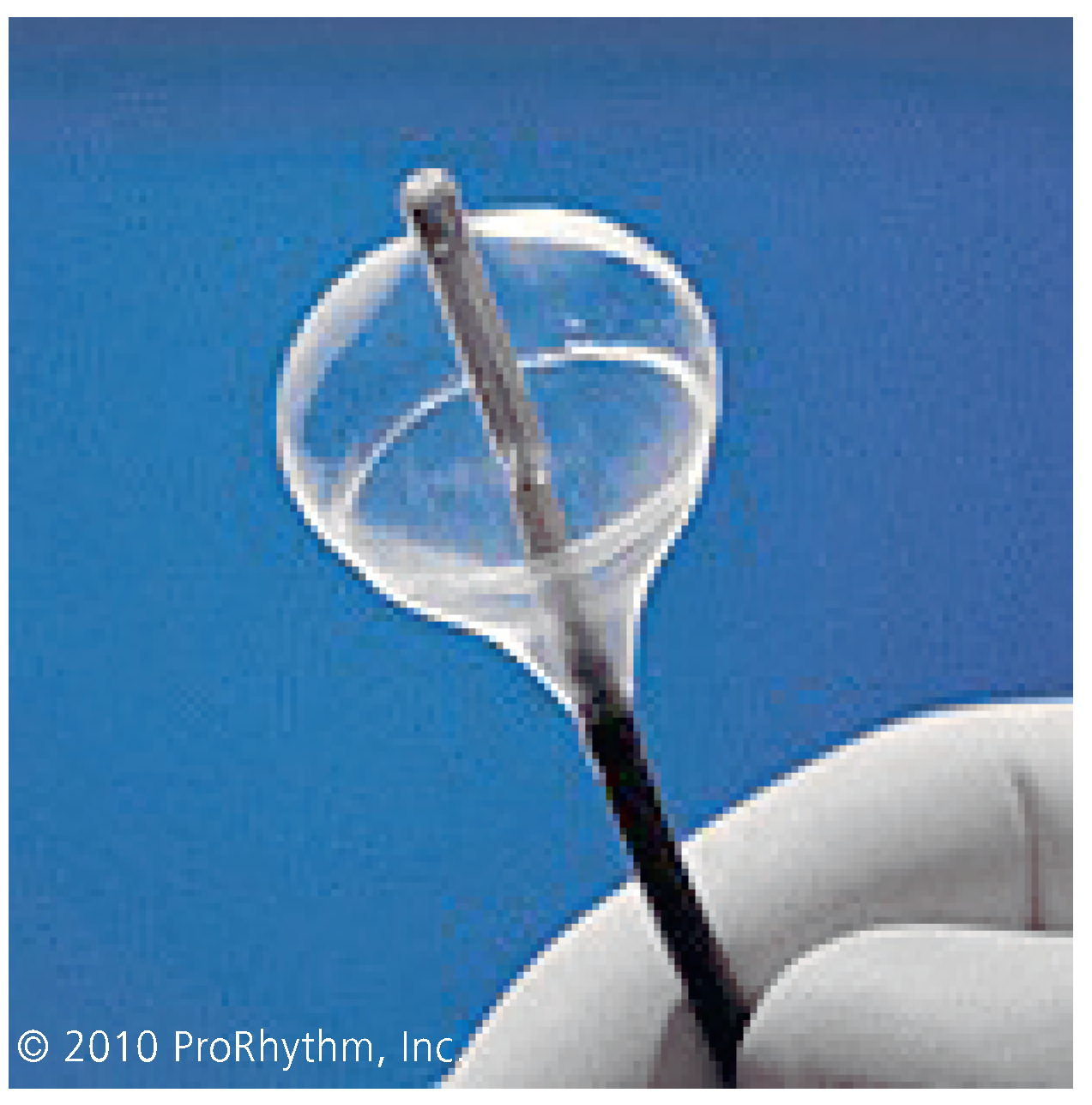
7.2. Hochintensität-Fokussierter Ultraschall (HIFU)
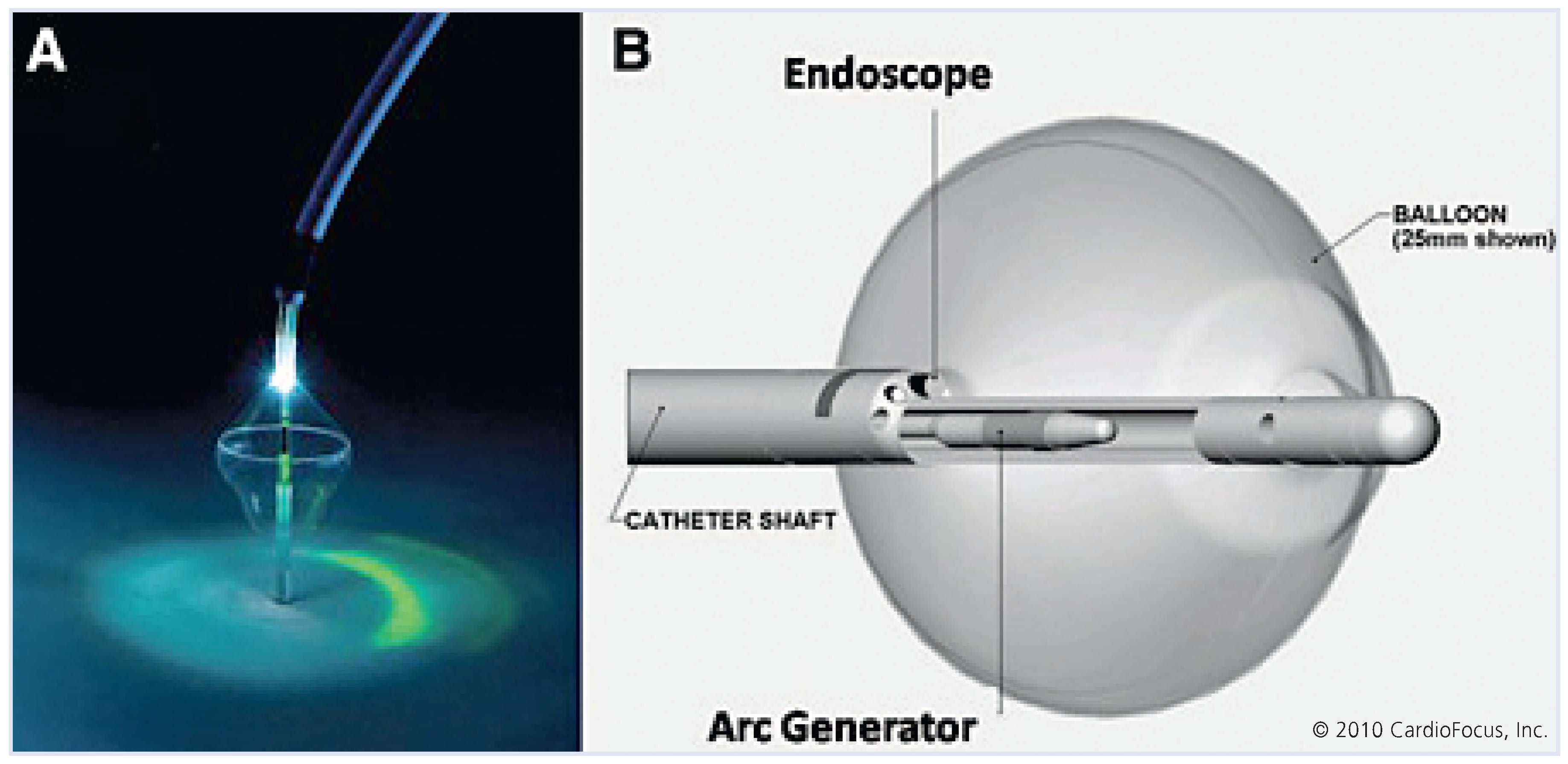
7.3. Laser-Energie
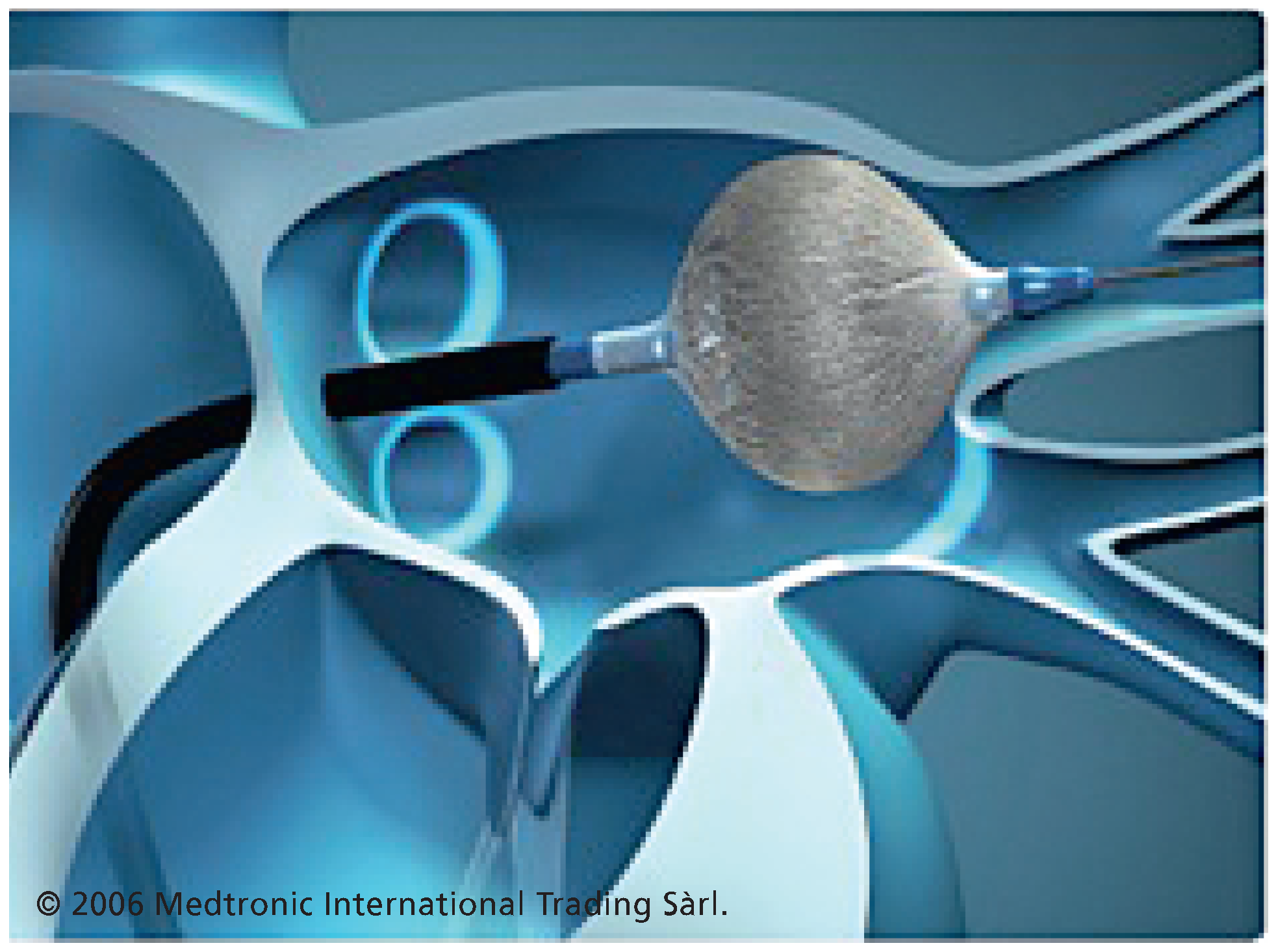
7.4. Neue Mehrpolige Radiofrequenz-Ablationskatheter
8. Zusammenfassung und Ausblick
Conflicts of Interest
References
- Fuster, V.; Rydén, L.E.; Cannom, D.S.; Crijns, H.J.; Curtis, A.B.; Ellenbogen, K.A.; et al. ACC/AHA/ESC 2006 Guidelines for the Management of Patients with Atrial Fibrillation: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients with Atrial Fibrillation): Developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Circulation 2006, 114, e257–e354. [Google Scholar] [PubMed]
- Feinberg, W.M.; Blackshear, J.L.; Laupacis, A.; Kronmal, R.; Hart, R.G. Prevalence, age distribution, and gender of patients with atrial fibrillation. Analysis and implications. Arch Intern Med 1995, 155, 469–473. [Google Scholar] [CrossRef]
- Go, A.S.; Hylek, E.M.; Phillips, K.A.; Chang, Y.; Henault, L.E.; Selby, J.V.; et al. Prevalence of diagnosed atrial fibrillation in adults: National implications for rhythm management and stroke prevention: The AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001, 285, 2370–2375. [Google Scholar] [CrossRef]
- Gollob, M.H.; Jones, D.L.; Krahn, A.D.; Danis, L.; Gong, X.Q.; Shao, Q.; et al. Somatic mutations in the connexin 40 gene (GJA5) in atrial fibrillation. N Engl J Med 2006, 354, 2677–2688. [Google Scholar]
- Stewart, S.; Hart, C.L.; Hole, D.J.; McMurray, J.J. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/Paisley study. Am J Med 2002, 113, 359–364. [Google Scholar] [PubMed]
- Wattigney, W.A.; Mensah, G.A.; Croft, J.B. Increasing trends in hospitalization for atrial fibrillation in the United States, 1985 through 1999: Implications for primary prevention. Circulation 2003, 108, 711–716. [Google Scholar] [CrossRef] [PubMed]
- Wolf, P.A.; Abbott, R.D.; Kannel, W.B. Atrial fibrillation as an independent risk factor for stroke: The Framingham Study. Stroke 1991, 22, 983–988. [Google Scholar] [CrossRef]
- Haissaguerre, M.; Jais, P.; Shah, D.C.; Takahashi, A.; Hocini, M.; Quiniou, G.; et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998, 339, 659–666. [Google Scholar] [CrossRef]
- Jaïs, P.; Haïssaguerre, M.; Shah, D.C.; Chouairi, S.; Gencel, L.; Hocini, M.; et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation 1997, 95, 572–576. [Google Scholar] [CrossRef]
- Wazni, O.M.; Marrouche, N.F.; Martin, D.O.; Verma, A.; Bhargava, M.; Saliba, W.; et al. Radiofrequency ablation vs. antiarrhythmic drugs as first-line treatment of symptomatic atrial fibrillation: A randomized trial. JAMA 2005, 293, 2634–2640. [Google Scholar]
- Oral, H.; Pappone, C.; Chugh, A.; Good, E.; Bogun, F.; Pelosi FJr et, a.l. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006, 354, 934–941. [Google Scholar] [CrossRef]
- Stabile, G.; Bertaglia, E.; Senatore, G.; De Simone, A.; Zoppo, F.; Donnici, G.; et al. Catheter ablation treatment in patients with drug-refractory atrial fibrillation: A prospective, multi-centre, randomized, controlled study (Catheter Ablation For The Cure Of Atrial Fibrillation Study). Eur Heart J 2006, 27, 216–221. [Google Scholar] [CrossRef]
- Pappone, C.; Augello, G.; Sala, S.; Gugliotta, F.; Vicedomini, G.; Gulletta, S.; et al. A randomized trial of circumferential pulmonary vein ablation versus antiarrhythmic drug therapy in paroxysmal atrial fibrillation: The APAF Study. J Am Coll Cardiol 2006, 48, 2340–2347. [Google Scholar] [CrossRef]
- Jaïs, P.; Cauchemez, B.; Macle, L.; Daoud, E.; Khairy, P.; Subbiah, R.; et al. Catheter ablation versus antiarrhythmic drugs for atrial fibrillation: The A4 study. Circulation 2008, 118, 2498–2505. [Google Scholar] [CrossRef]
- Kirchhof, P.; Auricchio, A.; Bax, J.; Crijns, H.; Camm, J.; Diener, H.C.; et al. Outcome parameters for trials in atrial fibrillation: Executive summary. Eur Heart J 2007, 28, 2803–2817. [Google Scholar] [CrossRef]
- Wijffels, M.C.; Kirchhof, C.J.; Dorland, R.; Power, J.; Allessie, M.A. Electrical remodeling due to atrial fibrillation in chronically instrumented conscious goats: Roles of neurohumoral changes, ischemia, atrial stretch, and high rate of electrical activation. Circulation 1997, 96, 3710–3720. [Google Scholar] [CrossRef]
- Morillo, C.A.; Klein, G.J.; Jones, D.L.; Guiraudon, C.M. Chronic rapid atrial pacing. Structural, functional, and electrophysiological characteristics of a new model of sustained atrial fibrillation. Circulation 1995, 91, 1588–1595. [Google Scholar] [CrossRef] [PubMed]
- Bertaglia, E.; Bella, P.D.; Tondo, C.; Proclemer, A.; Bottoni, N.; De Ponti, R.; et al. Image integration increases efficacy of paroxysmal atrial fibrillation catheter ablation: Results from the CartoMerge Italian Registry. Europace 2009, 11, 1004–1010. [Google Scholar] [CrossRef] [PubMed]
- Nathan, H.; Eliakim, M. The junction between the left atrium and the pulmonary veins. An anatomic study of human hearts. Circulation 1966, 34, 412–422. [Google Scholar] [CrossRef] [PubMed]
- Hsu, L.F.; Jaïs, P.; Sanders, P.; Garrigue, S.; Hocini, M.; Sacher, F.; et al. Catheter ablation for atrial fibrillation in congestive heart failure. N Engl J Med 2004, 351, 2373–2383. [Google Scholar] [CrossRef]
- Jaïs, P.; Hocini, M.; Hsu, L.F.; Sanders, P.; Scavee, C.; Weerasooriya, R.; et al. Technique and results of linear ablation at the mitral isthmus. Circulation 2004, 110, 2996–3002. [Google Scholar] [CrossRef]
- Ernst, S.; Ouyang, F.; Löber, F.; Antz, M.; Kuck, K.H. Catheter-induced linear lesions in the left atrium in patients with atrial fibrillation: An electroanatomic study. J Am Coll Cardiol 2003, 42, 1271–1282. [Google Scholar] [CrossRef]
- Orlov, M.V. How to perform and interpret rotational angiography in the electrophysiology laboratory. Heart Rhythm 2009, 6, 1830–1836. [Google Scholar] [CrossRef] [PubMed]
- Pappone, C.; Vicedomini, G.; Manguso, F.; Gugliotta, F.; Mazzone, P.; Gulletta, S.; et al. Robotic magnetic navigation for atrial fibrillation ablation. J Am Coll Cardiol 2006, 47, 1390–1400. [Google Scholar] [CrossRef] [PubMed]
- Ernst, S.; Ouyang, F.; Linder, C.; Hertting, K.; Stahl, F.; Chun, J.; et al. Initial experience with remote catheter ablation using a novel magnetic navigation system: Magnetic remote catheter ablation. Circulation 2004, 109, 1472–1475. [Google Scholar] [CrossRef]
- Reddy, V.Y.; Neuzil, P.; Malchano, Z.J.; Vijaykumar, R.; Cury, R.; Abbara, S.; et al. View-synchronized robotic image-guided therapy for atrial fibrillation ablation: Experimental validation and clinical feasibility. Circulation 2007, 115, 2705–2714. [Google Scholar] [CrossRef]
- Chun, K.R.; Schmidt, B.; Metzner, A.; Tilz, R.; Zerm, T.; Köster, I.; et al. The “single big cryoballoon” technique for acute pulmonary vein isolation in patients with paroxysmal atrial fibrillation: A prospective observational single centre study. Eur Heart J 2009, 30, 699–709. [Google Scholar] [CrossRef] [PubMed]
- Neumann, T.; Vogt, J.; Schumacher, B.; Dorszewski, A.; Kuniss, M.; Neuser, H.; et al. Circumferential pulmonary vein isolation with the cryoballoon technique. J Am Coll Cardiol 2008, 52, 273–278. [Google Scholar]
- Schmidt, B.; Chun, K.; Metzner, A.; Fuernkranz, A.; Ouyang, F.; Kuck, K.H. Pulmonary vein isolation with focused ultrasound: Results from the HIFU 12F study. Europace 2009, 11, 1281–1288. [Google Scholar] [CrossRef]
- Boersma, L.V.; Wijffels, M.C.; Oral, H.; Wever, E.F.; Morady, F. Pulmonary vein isolation by duty-cycled bipolar and unipolar radiofrequency energy with a multielectrode ablation catheter. Heart Rhythm 2008, 5, 1635–1642. [Google Scholar] [CrossRef]
- Scharf, C.; Boersma, L.; Davies, W.; Kanagaratnam, P.; Peters, N.S.; Paul, V.; et al. Ablation of persistent atrial fibrillation using multielectrode catheters and duty-cycled radiofrequency energy. J Am Coll Cardiol 2009, 54, 1450–1456. [Google Scholar] [CrossRef] [PubMed]
- Steinwender, C.; Hönig, S.; Leisch, F.; Hofmann, R. One-year follow-up after pulmonary vein isolation using a single mesh catheter in patients with paroxysmal atrial fibrillation. Heart Rhythm 2010, 7, 333–339. [Google Scholar] [CrossRef] [PubMed]

 |
 |
 |
© 2010 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Haegeli, L.M.; Duru, F.; Lüscher, T.F. Moderne Technologien in der Ablation des Vorhofflimmerns. Cardiovasc. Med. 2010, 13, 272. https://doi.org/10.4414/cvm.2010.01529
Haegeli LM, Duru F, Lüscher TF. Moderne Technologien in der Ablation des Vorhofflimmerns. Cardiovascular Medicine. 2010; 13(9):272. https://doi.org/10.4414/cvm.2010.01529
Chicago/Turabian StyleHaegeli, Laurent M., Firat Duru, and Thomas F. Lüscher. 2010. "Moderne Technologien in der Ablation des Vorhofflimmerns" Cardiovascular Medicine 13, no. 9: 272. https://doi.org/10.4414/cvm.2010.01529
APA StyleHaegeli, L. M., Duru, F., & Lüscher, T. F. (2010). Moderne Technologien in der Ablation des Vorhofflimmerns. Cardiovascular Medicine, 13(9), 272. https://doi.org/10.4414/cvm.2010.01529




