Fallbeschreibung
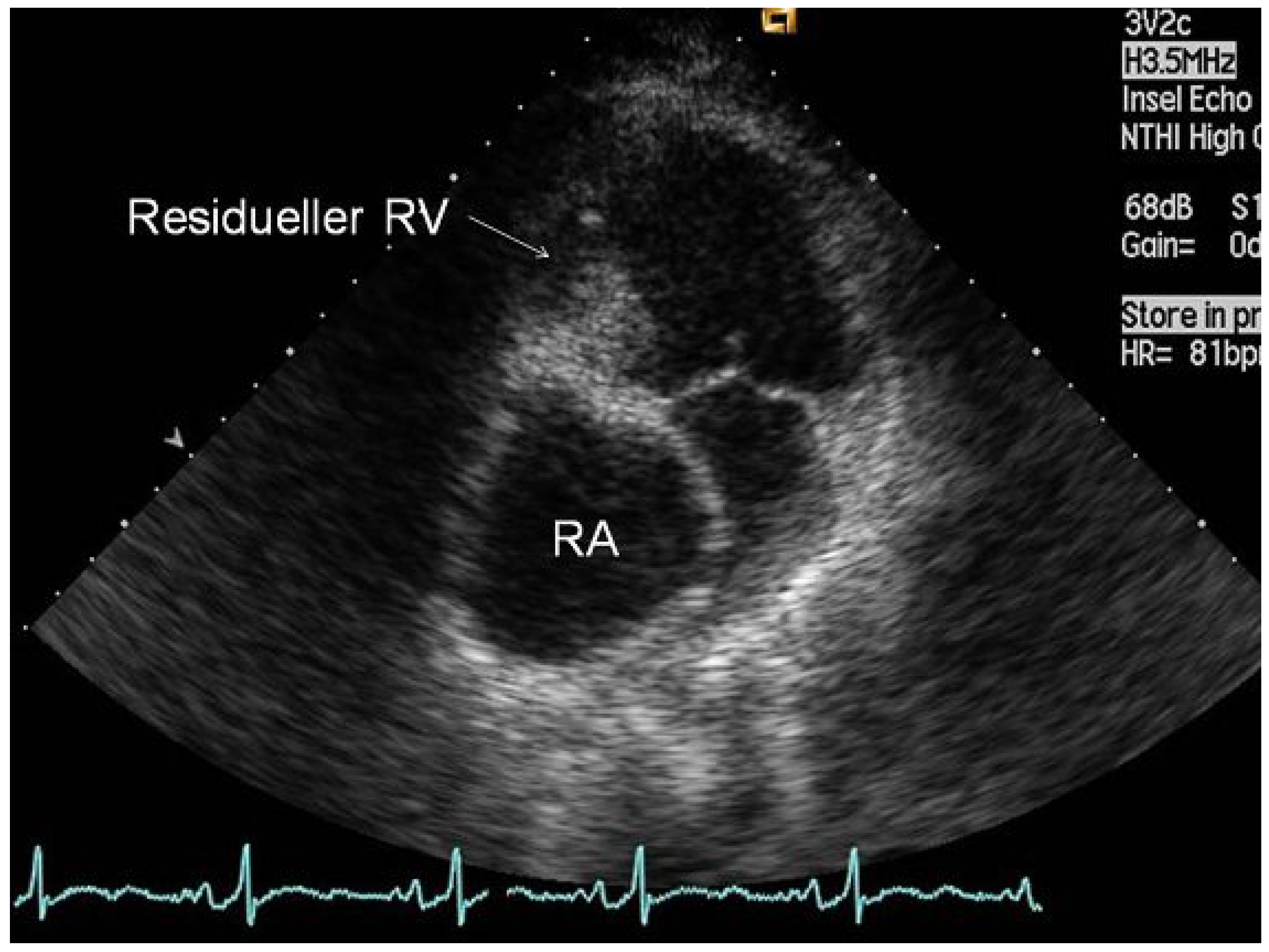
Die Patientin wurde 1984 mit einer Trikuspidalatresie und einem grossen Ventrikelseptumdefekt, einer Transposition der grossen Arterien und einer subvalvulären Pulmonalstenose geboren. In den ersten Lebensjahren bestand eine «balancierte» Physiologie. Die Pulmonalstenose verhinderte die Entwicklung einer pulmonalen Hypertonie. 1992 wurde bei ihr als erste Patientin am Inselspital eine Fontan-Zirkulation angelegt, in der das rechte Vorhofohr mit dem Truncus pulmonalis verbunden wurde (atriopulmonale Anastomose; Abb. 1B). Während der nachfolgenden Jugendzeit war sie körperlich gut belastbar und beschwerdefrei. In den letzten drei Jahren beklagte sie zunehmend rezidivierende, mehrmals täglich auftretende, symptomatische Tachykardien von mehreren Minuten Dauer, die sie im Alltag einschränkten. Als weiteres bestand eine progrediente Leistungsintoleranz, die sich in der Spiroergometrie mit einer Maximalbelastung von 90 Watt und VO2max von 21.3 mL/min/kg (58% des Solls) ausdrückte. Klinisch bestand eine leichte Hypoxämie mit einem Biox von 90%. Echokardiographisch zeigten sich eine normale Funktion des linken Ventrikels und der Klappen sowie ein eindrücklich dilatierter rechter Vorhof (Abb. 2). Durch die Vorhofsdilatation kam es zu einer retrokardialen Kompression der rechtsseitigen Lungenvenen (Abb. 3).
Abbildung 1.
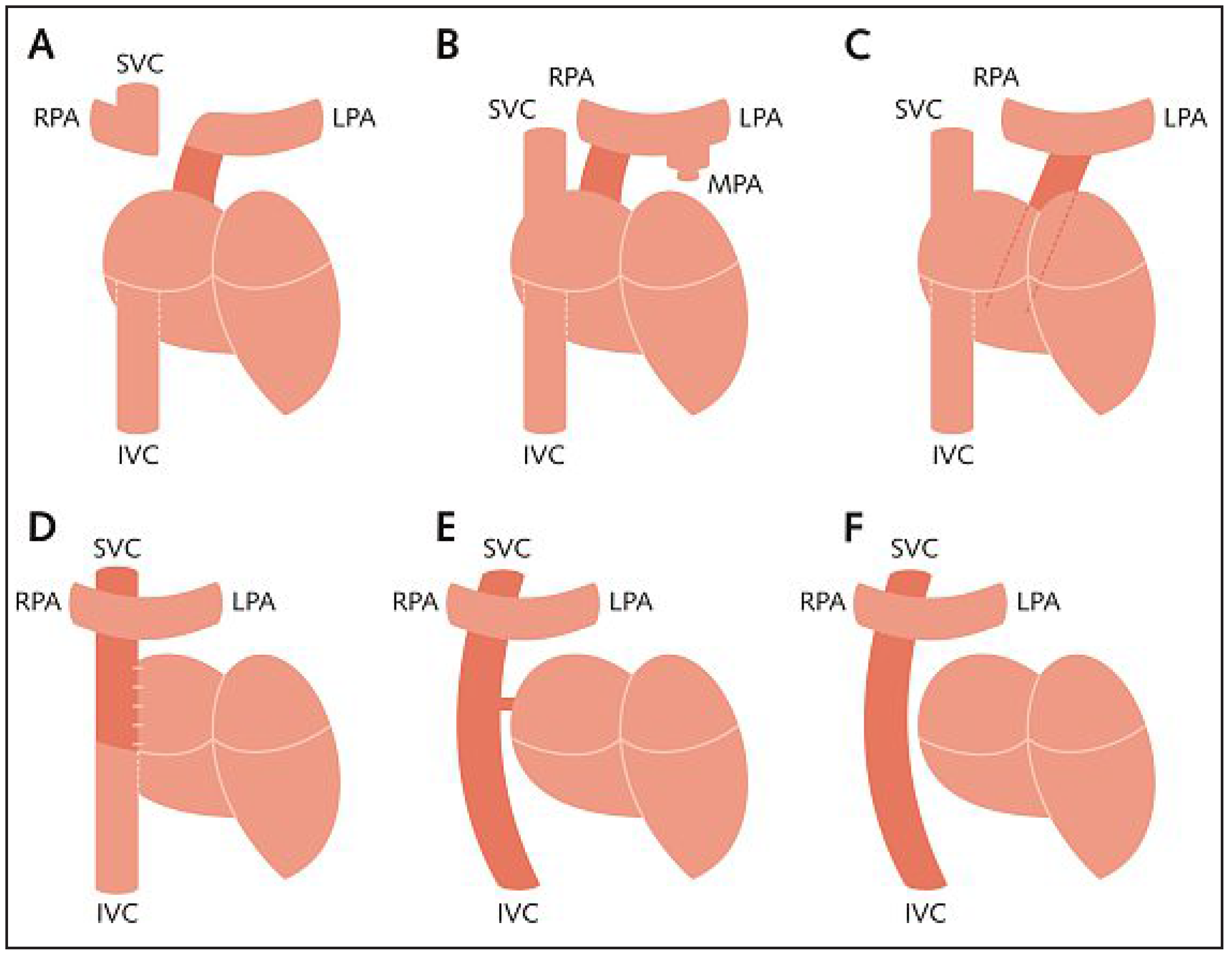
Schematische Darstellung der verschiedenen Typen von möglichen Fontan-Zirkulationen. A Originale Fontan-Operation mit oder ohne klappentragende Anastomosen des rechten Vorhofes mit der linken Pulmonalarterie sowie der Vena cava superior mit der rechten Pulmonalarterie, unter Ligatur der Pulmonalisbifurkation. B Atrio-pulmonale Anastomose nach Kreutzer mit Anastomose des rechten Vorhofohres mit der rechten Pulmonalarterie. C Atrioventrikuläre Anastomose nach Björk bei Trikuspidalatresie. D Intrakardialer lateraler Tunnel mit Anastomose der Vena cava inferior zur rechten Pulmonalarterie. E Extrakardiale totale cavo-pulmonale Anastomose mittels Conduit (TCPC) und Fenestrierung. F TCPC ohne Fenestrierung. SVC = Vena cava superior; IVC = Vena cava inferior; RPA = rechte Pulmonalarterie; LPA = linke Pulmonalarterie; MPA = Truncus pulmonalis.
Abbildung 1.
Schematische Darstellung der verschiedenen Typen von möglichen Fontan-Zirkulationen. A Originale Fontan-Operation mit oder ohne klappentragende Anastomosen des rechten Vorhofes mit der linken Pulmonalarterie sowie der Vena cava superior mit der rechten Pulmonalarterie, unter Ligatur der Pulmonalisbifurkation. B Atrio-pulmonale Anastomose nach Kreutzer mit Anastomose des rechten Vorhofohres mit der rechten Pulmonalarterie. C Atrioventrikuläre Anastomose nach Björk bei Trikuspidalatresie. D Intrakardialer lateraler Tunnel mit Anastomose der Vena cava inferior zur rechten Pulmonalarterie. E Extrakardiale totale cavo-pulmonale Anastomose mittels Conduit (TCPC) und Fenestrierung. F TCPC ohne Fenestrierung. SVC = Vena cava superior; IVC = Vena cava inferior; RPA = rechte Pulmonalarterie; LPA = linke Pulmonalarterie; MPA = Truncus pulmonalis.
Abbildung 2.
Präoperative transthorakale Echokardiographie in der apikalen «4-Kammer»-Ansicht mit Darstellung des massiv dilatierten rechten Vorhofes (RA) und Vorwölbung des atrialen Septums. Sichtbar sind auch die Gewebebrücke anstelle der Trikuspidalklappe sowie der residuelle «rechte Ventrikel» (RV).
Abbildung 2.
Präoperative transthorakale Echokardiographie in der apikalen «4-Kammer»-Ansicht mit Darstellung des massiv dilatierten rechten Vorhofes (RA) und Vorwölbung des atrialen Septums. Sichtbar sind auch die Gewebebrücke anstelle der Trikuspidalklappe sowie der residuelle «rechte Ventrikel» (RV).
Abbildung 3.
Präoperatives Kontrastmittel-CT mit Darstellung des stark dilatierten rechten Atriums (RA) und einer konsekutiven partiellen Kompression der rechten Pulmonalvenen.
Abbildung 3.
Präoperatives Kontrastmittel-CT mit Darstellung des stark dilatierten rechten Atriums (RA) und einer konsekutiven partiellen Kompression der rechten Pulmonalvenen.
Die invasive Abklärung ergab keine behebbaren lokalen Obstruktionen innerhalb der Fontan-Zirkulation, ebenso konnten aorto-pulmonale, pulmonale arterio-venöse und veno-venöse Shunts ausgeschlossen werden. Der mittlere rechtsatriale Druck betrug 12 mm Hg, der mittlere pulmonale Druck 11 mm Hg und der mittlere pulmonale Wedge-Druck 5 mm Hg. In der elektrophysiologischen Untersuchung konnten inzisionelle rechtsatriale Reentry-Tachykardien induziert werden, vor allem lateral zwischen Vena cava superior (VCS) und Vena cava inferior (VCI).
In einem interdisziplinären Kolloquium wurden die möglichen Behandlungsoptionen diskutiert. Aufgrund der im Alltag vermehrt eingeschränkten Leistungsfähigkeit und der symptomatischen inzisionellen supraventrikulären Arrhythmien fassten wir mit der Patientin den Entschluss, nicht nur die Arrhythmien anzugehen, sondern gleichzeitig die Fontan-Zirkulation chirurgisch zu verbessern und einen günstigeren Langzeitverlauf und eine bessere Lebensqualität der Patientin zu sichern.
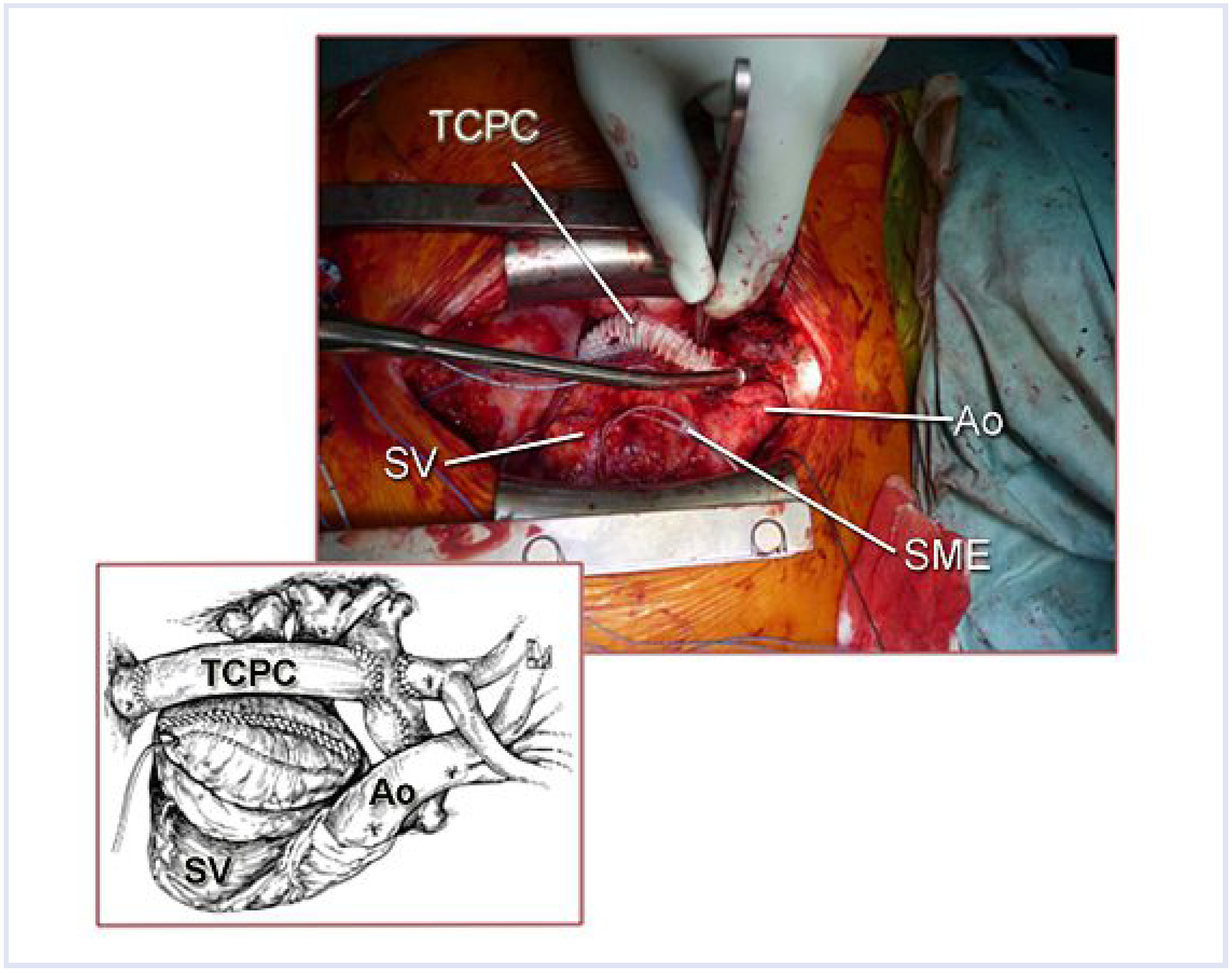
Nach Resternotomie und ausgedehnter Adhäsiolyse, insbesondere des massiv dilatierten rechten Vorhofes, wurde die Patientin mittels arteriell-aortaler und venöser-bicavaler Kannulation an die Herz-Lungen-Maschine angeschlossen. Das rechte Atrium wurde eröffnet und die Anastomose zur Pulmonalarterie identifiziert. Nach ausgedehnter Resektion der antero-lateralen Vorhofswand bis auf ca. ¼ der ursprünglichen Grösse wurde das intraatriale Septum reseziert. Dies ermöglichte eine ungestörte Drainage des Sinus coronarius in den linken Vorhof. Nach Durchführung einer rechtsatrialen Kryoablation wurde die VCI am Eintritt zum Atrium abgesetzt und der Vorhof verschlossen. Für die Herstellung der VCI-Pulmonalis-Kontinuität wurde eine 19-mm-ringverstärkte PTFE-Gefässprothese gewählt, welche End-zu-End mit der VCI und End-zu-Seit am inferioren Aspekt der zentralen Pulmonalarterie am Ort der vorherigen atriopulmonalen Verbindung anastomosiert wurde. Aufgrund der angestrebten Anastomose mit dem Truncus pulmonalis und der Umgehung des rechten Atriums liess sich eine leichte Bogenform des Goretex-Conduits nicht vermeiden. Die Vena cava superior wurde End-zu-Seit mit der rechten Pulmonalarterie anastomosiert. Abschliessend wurde ein epikardiales Zwei-Kammer-Schrittmachersystem mit Antitachykardie-Funktion implantiert (Abb. 4). Unmittelbar postoperativ wurde die Patientin mit Cordarone aufgesättigt und mit DDD-Modus mit einer Frequenz von 120/min stimuliert. Es wurde eine frühzeitige Extubation angestrebt.
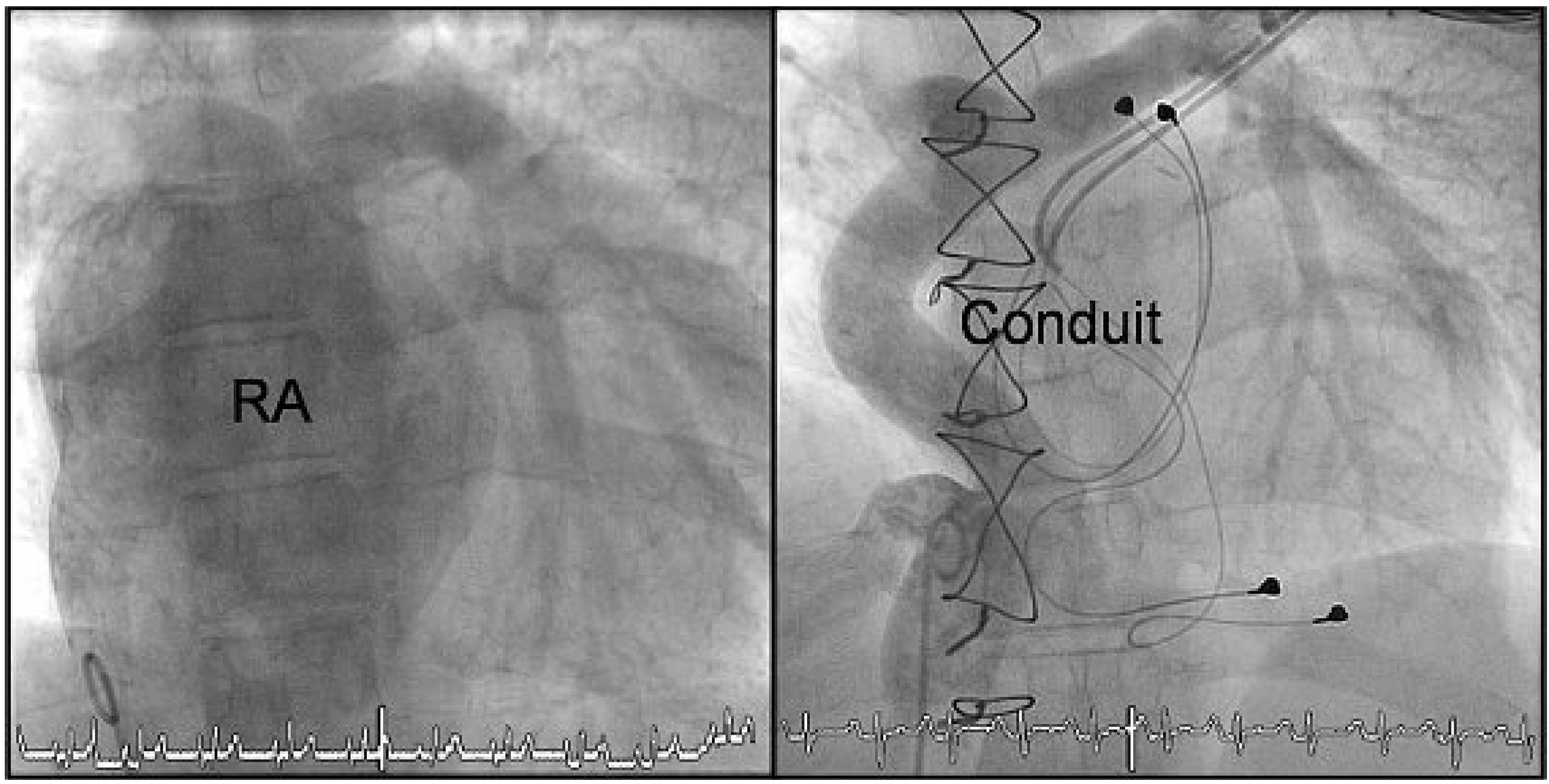
Eine Rechtsherzkatheteruntersuchung aufgrund prolongierter Diarrhoe eine Woche postoperativ zeigte eine gute funktionierende «neue» extrakardiale Fontan-Zirkulation (Abb. 5). In der Schrittmacherabfrage ergaben sich im weiteren Verlauf keine Hinweise für weitere Tachyarrhythmien. Bereits in der vierten postoperativen Woche leistete unsere Patientin in der Eintrittsuntersuchung für die ambulante kardiale Rehabilitation 10 METs (100% des Solls). Cordarone konnte in der Zwischenzeit abgesetzt werden. Die weiteren Schrittmacherkontrollen zeigten, dass der Grundrhythmus nun ein Sinusrhythmus war, die Patientin aber während der Ruhephasen atrial gepaced wurde (AAIR 70–145/min).
Abbildung 4.
Intraoperativer Situs nach «Fontan-Konversion»: Status nach Implantation eines 19-mm-PTFE-ringverstärkten extrakardialen Conduits (TCPC), Vorhofreduktionsplastie und Implantation von linksatrialen und systemventrikulären epikardialen Vorhofelektroden. TCPC = totale cavo-pulmonale Konnektion; Ao = Aorta; SME = epikardiale Schrittmacherelektroden; SV = Systemventrikel.
Abbildung 4.
Intraoperativer Situs nach «Fontan-Konversion»: Status nach Implantation eines 19-mm-PTFE-ringverstärkten extrakardialen Conduits (TCPC), Vorhofreduktionsplastie und Implantation von linksatrialen und systemventrikulären epikardialen Vorhofelektroden. TCPC = totale cavo-pulmonale Konnektion; Ao = Aorta; SME = epikardiale Schrittmacherelektroden; SV = Systemventrikel.
Abbildung 5.
Angiographie vor (links) und nach Fontan-Revision (rechts). Vor der Revisionsoperation wird das Blut von der Vena cava inferior und den Lebervenen über den riesigen RA in die pulmonale Zirkulation geleitet. Nach der Fontan-Revision zeigt sich der Konfluens der Vena cava inferior mit den Lebervenen in den extrakardialen Goretex-Conduit sowie dessen Anastomose zum Truncus pulmonalis unmittelbar proximal der Bifurkation. Durch die separate Mündung der Vena cava superior in die rechte Pulmonalarterie zeigt sich hier weniger Kontrastmittel (konkurrenzierender Fluss). Die epikardialen linksatrialen und linksventrikulären Elektroden des Schrittmachers sind ebenfalls erkennbar.
Abbildung 5.
Angiographie vor (links) und nach Fontan-Revision (rechts). Vor der Revisionsoperation wird das Blut von der Vena cava inferior und den Lebervenen über den riesigen RA in die pulmonale Zirkulation geleitet. Nach der Fontan-Revision zeigt sich der Konfluens der Vena cava inferior mit den Lebervenen in den extrakardialen Goretex-Conduit sowie dessen Anastomose zum Truncus pulmonalis unmittelbar proximal der Bifurkation. Durch die separate Mündung der Vena cava superior in die rechte Pulmonalarterie zeigt sich hier weniger Kontrastmittel (konkurrenzierender Fluss). Die epikardialen linksatrialen und linksventrikulären Elektroden des Schrittmachers sind ebenfalls erkennbar.
Diskussion
Die Fontan-Operation wurde ursprünglich von Fontan und Baudet im Jahre 1971 für Patienten mit Trikuspidalatresie eingeführt [
1]. Der «typische» Fontan-Patient weist eine Trikuspidalatresie auf und hat einen hypoplastischen rechten Ventrikel, der über einen Ventrikelseptumdefekt mit dem linken Ventrikel in Kommunikation steht. Die Hypoplasie des rechten Ventrikels verunmöglicht eine biventrikuläre Korrektur. Heutzutage wird eine Fontan-Zirkulation auch bei Patienten mit anderen komplexen Herzfehlern und effektiv singulärem Ventrikel, bei denen ebenfalls eine biventrikuläre Korrektur nicht möglich ist, angelegt. Wichtige Voraussetzungen für die Anlage einer Fontan-Zirkulation sind ein tiefer pulmonaler Widerstand, keine relevante systolische Dysfunktion des Ventrikels und keine bedeutende Insuffizienz der AV-Klappe(n) [
2].
Seit der ersten Publikation von Fontan und Baudet im Jahre 1971 haben sich die chirurgischen Möglichkeiten, eine Fontan-Zirkulation anzulegen, entscheidend weiterentwickelt (Abb. 1). Wurden bei den ersten Fontan-Patienten noch eine unidirektionale obere cavo-pulmonale Anastomose («klassische Glenn-Anastomose») sowie klappentragende Anastomosen zwischen der VCI und der atrio-pulmonalen Konnektion durchgeführt (Abb. 1A), setzte sich eine technisch einfachere und weniger komplikationsträchtige Variante nach Kreutzer (wie bei unserer Patientin) für die folgenden Jahre durch. Hierbei wurde lediglich der rechte Vorhof mit dem Truncus pulmonalis anastomosiert (Abb. 1B). Nach weiteren Modifikationsschritten wird heutzutage der rechte Vorhof umgangen und das Blut der VCI durch einen extrakardialen Conduit direkt in die Pulmonalarterie geleitet (Abb. 1E, 1F). Die «Fontan-Zirkulation» wird dabei stufenweise erreicht. Falls nötig wird beim Neugeborenen mit komplexem Herzfehler als Erstes eine pulmonale Hyperperfusion durch Bändelung der Pulmonalarterien oder eine pulmonale Hypoperfusion durch Anlage einer aorto-pulmonalen Verbindung (z.B. modifizierter Blalock-Taussig-Shunt) korrigiert. Als nächster Schritt wird im Alter von 3–6 Monaten zur Vorbereitung der Fontan-Zirkulation bidirektional eine Anastomose zwischen VCS und rechter Pulmonalarterie angelegt. Als letzter Schritt erfolgt im Alter zwischen 2 und 3 Jahren die Implantation eines extrakardialen Conduits zur Konnektion der VCI und der Pulmonalarterie mit der resultierenden kompletten Trennung des venösen und systemischen Kreislaufes.
Die vergangenen dreissig Jahre haben gezeigt, dass die Mehrheit der Fontan-Patienten in der Kinderund Jugendzeit beschwerdearm sind. Im späteren Leben sind die physiologischen Konsequenzen des Verzichts auf einen subpulmonalen Ventrikel unausweichlich. Der chronisch erhöhte systemvenöse Druck fordert Tribut, und insbesondere bei Patienten mit atriopulmonaler Anastomose führt die rechtsatriale Dilatation zu atrialen Tachyarrhythmien, ungünstigen Strömungsverhältnissen und Thrombusbildung und kann auch in einer Kompression der Lungenvenen enden. Bei bis zu 10% der Fälle können sich lymphatische Komplikationen als «Protein-loosing enteropathy» [
3] oder «plastische Bronchitis» manifestieren, welche mit einer Mortalitätsrate von bis zu 40% einhergehen. Intrapulmonale arterio-venöse oder veno-venöse Fisteln sind weitere mögliche Komplikationen [
4,
5] und treten v.a. bei Patienten mit klassischem Glenn-Shunt auf. Die supraventrikulären Tachykardien (häufig atriales Makro-Reentry) sprechen typischerweise schlecht auf eine medikamentöse Therapie an. Antitachykardie-Pacing und Ablation sind die am meisten erfolgversprechenden Therapieansätze. Hinzu kommt nicht selten eine systolische und diastolische Dysfunktion des Systemventrikels, bei der aufgrund der speziellen Hämodynamik eine traditionelle Herzinsuffizienztherapie keinen grossen klinischen Benefit zeigt [
6].
In dieser Situation liegt der Ausweg in sorgfältig ausgewählten Fällen in einem aggressiven Behandlungsplan, bei dem die Hämodynamik konsequent optimiert und Arrhythmien abladiert werden. Das Stenting von Stenosen innerhalb der Fontan-Zirkulation, der Verschluss von Fisteln oder die Umwandlung einer atriopulmonalen Fontan-Zirkulation in eine extrakardiale totale cavo-pulmonale Konnektion sind Möglichkeiten, die Hämodynamik zu optimieren, ohne auf einen Herzersatz zurückzugreifen. Die Mortalität einer Fontan-Konversion wird in der Literatur in grossen Serien mit 6–20% angegeben [
7]. Perioperative Komplikationen können sich als Blutungen aufgrund der ausgedehnten Adhäsionen, dialysepflichtiges Nierenversagen, kardiales Pumpversagen und Indikation für Herztransplantation, «Protein-loosing enteropathy», persistierende Pleuraergüsse und Mediastinitis manifestieren. In einer grossen Serie mit 111 Patienten aus Chicago, einem der erfahrensten Zentren für Fontan-Konversionen mit antiarrhythmischer Chirurgie, wurde das transplantationsfreie Überleben drei Jahre postoperativ mit 88% angegeben. Prädiktive Faktoren für Tod oder Herztransplantation sind mittelschwere bis schwere AV-Klappeninsuffizienz, präoperative «Protein-loosing enteropathy», lange Bypass-Zeit (>239 Minuten) und ein morphologisch rechter Systemventrikel. Atriale Tachykardierezidive traten bei 13.5% der Überlebenden auf [
7].
Unbestritten bleibt die Fontan-Zirkulation eine nicht perfekte Lösung eines komplexen Problems. Obwohl die in unserem Fall beschriebene Patientin mit ihren optimalen pulmonalen Druckverhältnissen, kompetenten Klappen und gut erhaltener Ventrikelfunktion eine Niedrig-Risiko-Patientin für eine Fontan-Zirkulation darstellte, benötigte sie eine chirurgische Korrektur für Spätkomplikationen der altmodischen Fontan-Variante. Diese Patienten bedürfen obligat lebenslange engmaschige kardiologische Verlaufskontrollen in Zentren mit speziell ausgebildeten Kardiologen für angeborene Herzfehler, in enger Zusammenarbeit mit in diesem Gebiet erfahrenen Herzchirurgen, Elektrophysiologen, interventionellen Kardiologen und Herztransplantationsteam.