New Sulphated Flavonoids and Larvicidal Activity of Helicteres velutina K. Schum (Sterculiaceae)
Abstract
1. Introduction
2. Results
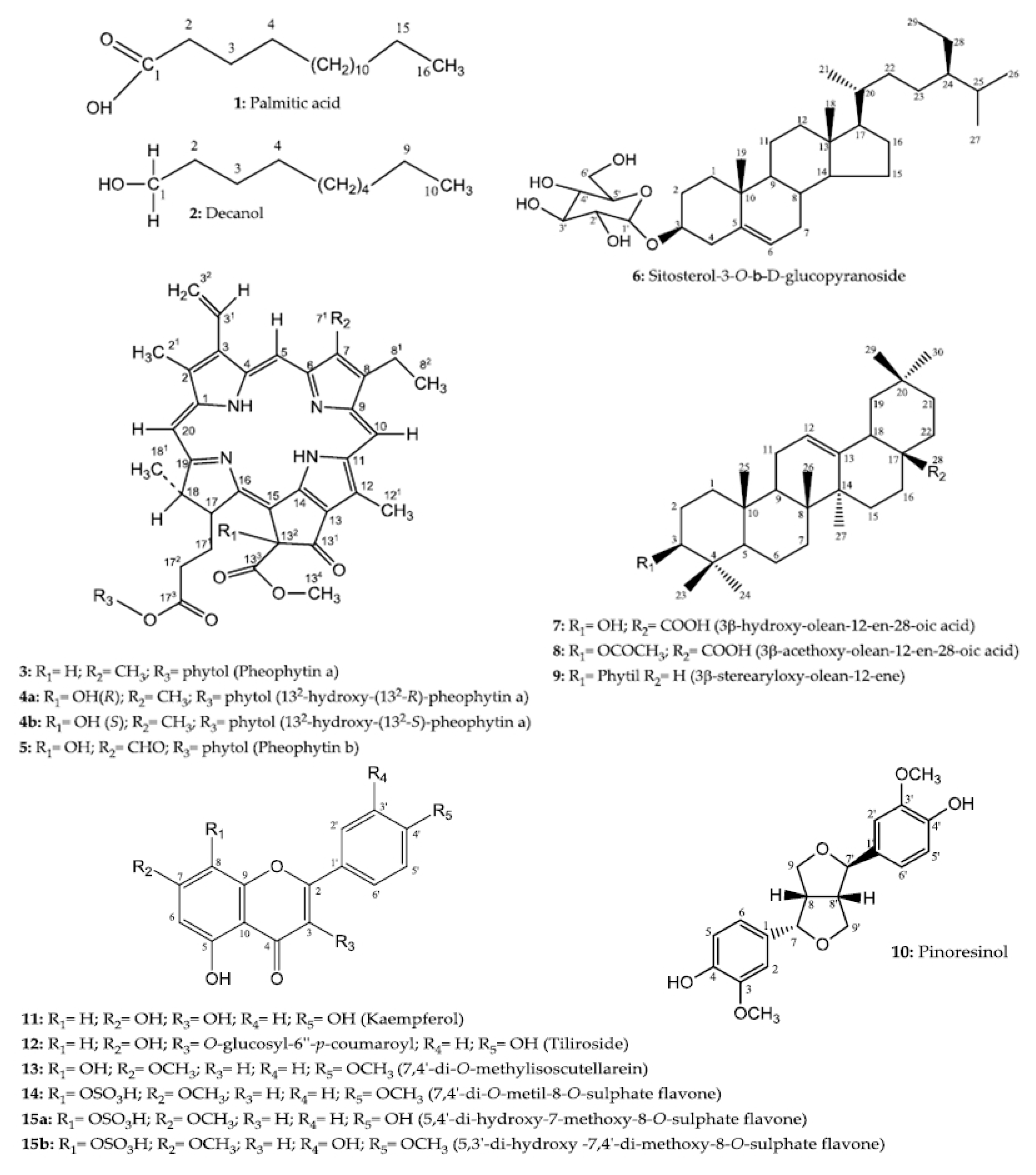
2.1. Identification of Compounds
Spectral Data
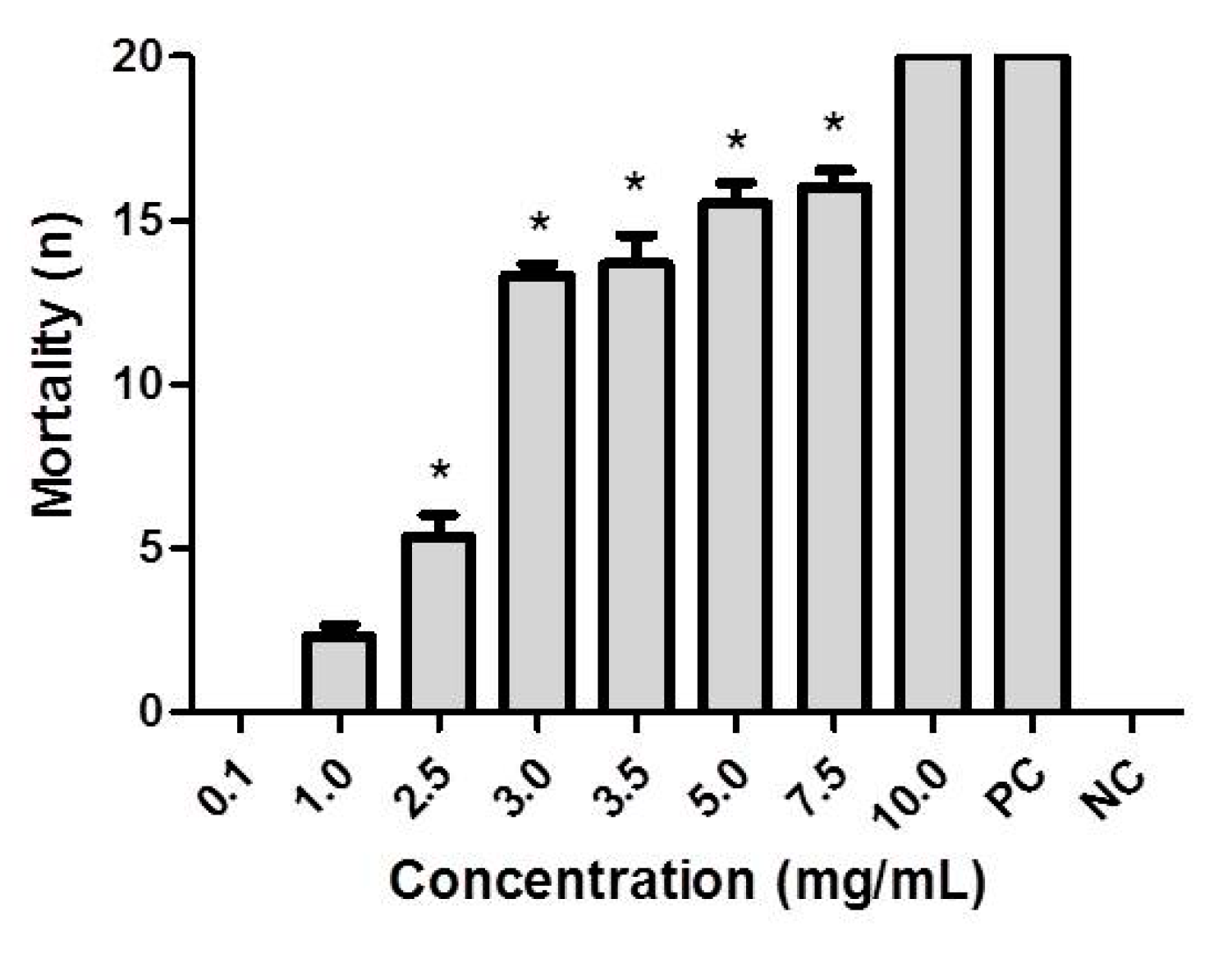
2.2. Biological Assay
3. Discussion
4. Materials and Methods
4.1. General
4.2. Collection, Extraction, and Compound Isolation
4.3. Biological Assay
5. Conclusions
Supplementary Materials
Author Contributions
Funding
Acknowledgments
Conflicts of Interest
References
- Cruz, F.R.; Esteves, G.L. Melastomataceae, Polygonaceae, Sapindaceae e Sterculiaceae. In Flora Fanerogâmica do Estado de São Paulo Online; Martins, S.E., Wanderley, M.G.L., Shepherd, G.J., Giulietti, A.M., Melhem, T.S., Eds.; Instituto de Botânica: São Paulo, Brasil, 2009; Volume 6, pp. 257–284. ISBN 978-85-7523-057-2. [Google Scholar]
- Muqarrabun, L.M.R.A.; Ahmat, N. Medicinal uses, phytochemistry and pharmacology of Family Sterculiaceae: A review. Eur. J. Med. Chem. 2015, 92, 514–530. [Google Scholar] [CrossRef] [PubMed]
- The Angiosperm Phylogeny Group (APG). An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Bot. J. Linn. Soc. 2016, 181, 1–20. [Google Scholar] [CrossRef]
- Cruz, F.R. Sterculiaceae Vent. no Estado de São Paulo. Master’s Thesis, Instituto de Botânica da Secretária de Estado do Meio Ambiente, São Paulo, Brasil, 2007. [Google Scholar]
- Chen, W.; Tang, W.; Lou, L.; Zhao, W. Pregnane, coumarin and lupine derivatives and cytotoxic constituents from Helicteres angustifolia. Phytochemistry 2006, 67, 1041–1047. [Google Scholar] [CrossRef] [PubMed]
- Chen-Zong, T.; Lee, S.W.; Chen-Chiu, M. Cucurbitacin B 2-Sulfate and Cucurbitacin Glucosides from the Root Bark of Helicteres angustifolia. Chem. Pharm. Bull. 2006, 54, 1605–1607. [Google Scholar] [CrossRef][Green Version]
- Wang, G.C.; Li, T.; Wei, Y.R.; Zhang, Y.B.; Li, Y.L.; Sze, S.C.W.; Ye, W.C. Two pregnane derivates and a quinolone alkaloid from Helicteres angustifolia. Fitoterapia 2012, 83, 1643–1647. [Google Scholar] [CrossRef] [PubMed]
- Kumar, N.; Singh, A.K. Plant profile, phytochemistry and pharmacology of Avartani (Helicteres isora Linn.): A review. Asian Pac. J. Trop. Biomed. 2014, 4, 22–26. [Google Scholar] [CrossRef] [PubMed]
- Kamiya, K.; Saiki, Y.; Hama, T.; Fujimoto, Y.; Endang, H.; Umar, M.; Satake, T. Flavonoid glucuronides from Helicteres isora. Phytochemistry 2001, 57, 297–301. [Google Scholar] [CrossRef]
- Huang, Q.; Huang, R.; Wei, L.; Chen, Y.; Lv, S.; Liang, C.; Zhang, X.; Yin, F.; Li, H.; Zhuo, L.; et al. Antiviral activity of methyl helicterate isolated from Helicteres angustifolia (Sterculiaceae) against hepatitis B virus. Antivir. Res. 2013, 100, 373–381. [Google Scholar] [CrossRef] [PubMed]
- Santos, E.A.; Carvalho, C.M.; Costa, A.L.S.; Conceição, A.S.; Moura, F.B.P.; Santana, A.E.G. Bioactivity evaluation of plants extracts used in indigenous medicine against the snail, Biomphalaria glabrata, and the larvae of Aedes aegypti. Evid.-Based Complement. Altern. Med. 2012, 1, 1–9. [Google Scholar] [CrossRef]
- Brito-Filho, S.G.; Maciel, J.K.S.; Teles, Y.C.F.; Fernandes, M.M.M.S.; Chaves, O.S.; Ferreira, M.D.L.; Fernandes, P.D.; Felix, L.P.; Cirino, I.C.S.; Siqueira-Júnior, J.P.; et al. Phytochemical study of Pilosocereus pachycladus and antibiotic-resistance modifying activity of syringaldehyde. Braz. J. Pharmacogn. 2017, 27, 453–458. [Google Scholar] [CrossRef]
- Gomes, R.A.; Teles, Y.C.F.; Pereira, F.O.; Rodrigues, L.A.S.; Lima, E.O.; Agra, M.F.; Souza, M.F.V. Phytoconstituents from Sidastrum micranthum (A. St.-Hil.) Fryxell (Malvaceae) and antimicrobial activity of pheophytin a. Braz. J. Pharm. Sci. 2015, 4, 861–867. [Google Scholar] [CrossRef]
- Chaves, O.S.; Gomes, R.A.; Tomaz, A.C.A.; Fernandes, M.G.; das Graças Mendes Junior, L.; de Fátima Agra, M.; Braga, V.A.; Souza, M.F.V. Secondary Metabolites from Sida rhombifolia L. (Malvaceae) and the Vasorelaxant Activity of Cryptolepinone. Molecules 2013, 18, 2769–2777. [Google Scholar] [CrossRef] [PubMed]
- Hossain, R.; Sultana, R.; Cloudhary, M.I.; Zaman, S. Xanthone from the fruits of Terminalia arjuna. J. Sci. Res. 2016, 2, 1–7. [Google Scholar] [CrossRef]
- Seebacher, W.; Simic, N.; Weis, R.; Saf, R.; Kunert, O. Complete assignments of 1H and 13C resonances of oleanolic acid, 18α-oleanolic acid, ursolic acid and their 11-oxo derivates. Magn. Reson. Chem. 2003, 41, 636–638. [Google Scholar] [CrossRef]
- Costa, V.C.O. Contribuição ao Conhecimento Químico de Espécies de Hyptis com Ocorrência no Semiárido Paraibano: Hyptis macrostachys Benth. E Hyptis umbrosa Salzm. Ph.D. Thesis, Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos, Universidade Federal da Paraíba, João Pessoa, Brasil, 2013. [Google Scholar]
- Vieira-Filho, S.A.; Duarte, L.P.; Silva, G.D.F.; Howarth, O.W.; Lula, I.S. 3-(Stearyloxy)olean-12-ene from Austroplenckia populnea: Structure Elucidation by 2D-NMR and Quantitative 13C-NMR Spectroscopy. Helv. Chim. Acta 2003, 86, 3445–3449. [Google Scholar] [CrossRef]
- Yi, B.; Hu, L.; Mei, W.; Zhou, K.; Wang, H.; Luo, Y.; Wei, X.; Dai, H. Antioxidant Phenolic Compounds of Cassava (Manihot esculenta) from Hainan. Molecules 2010, 16, 10157–10167. [Google Scholar] [CrossRef] [PubMed]
- Barreto, M.B.; Gomes, C.L.; Freitas, J.V.B.; Pinto, F.C.L.; Silveira, E.R.; Gramosa, N.V. Flavonoides e terpenoides de Croton muscicarpa (Euphorbiaceae). Quím. Nova 2013, 6, 675–679. [Google Scholar] [CrossRef]
- Teles, Y.C.F.; Horta, C.C.R.; Agra, M.F.; Siheri, W.; Boyd, M.; Igoli, J.O.; Gray, A.I.; Souza, M.F.V. New Sulphated Flavonoids from Wissadula periplocifolia (L.) C. Presl (Malvaceae). Molecules 2015, 20, 20161–20172. [Google Scholar] [CrossRef] [PubMed]
- Pavia, D.L.; Lampman, G.M.; Kriz, G.S.; Vyvyan, J.R. Introdução à Espectroscopia, 4th ed.; Cengage Learning: São Paulo, Brazil, 2010; pp. 169–342. ISBN 978-85-221-0708-7. [Google Scholar]
- Buchholz, H.; Wirth, C.; Carola, C.; Alves Fontes, R. Flavonoid Derivative. U.S. Patent 20,070,134,172A1, 14 July 2007. [Google Scholar]
- Teles, Y.C.F.; Souza, M.S.R.; Souza, M.F.V. Sulphated Flavonoids: Biosynthesis, Structures, and Biological Activities. Molecules 2018, 23, 480–491. [Google Scholar] [CrossRef] [PubMed]
- Cabral, S.S. Atividade Larvicida do Extrato Bruto de Swinglea glutinosa Evidenciada Pelas Alterações Morfohistológicas em Larvas de Aedes aegypti (Diptera, Culicidae). Master’s Thesis, Pós graduação em Biologia da Relação Parasito-Hospedeiro, Universidade Federal de Goiás, Goiânia, Brasil, 2015. [Google Scholar]
- Abed, R.A.; Cavasin, G.M.; Silva, H.H.G.; Silva, I.G. Alterações Morfohistológicas em Larvas de Aedes aegypti (Linnaeus, 1762) (Diptera, Culicidae) causadas pela atividade larvicida do óleo-resina da planta medicinal Copaifera reticulata Ducke (Leguminosae). Rev. Patol. Trop. 2007, 36, 75–86. [Google Scholar] [CrossRef]
- Santos, D.B. Atividade Larvicida da Copaifera langsdorffii (Leguminosae), Evidenciada Pelas Alterações Morfohistológicas em Aedes aegypti (Diptera, Culicidae). Master’s Thesis, Pós-Graduação em Biologia da Relação Parasito-Hospedeiro, Universidade Federal de Goiás, Goiânia, Brasil, 2015. [Google Scholar]
- Darmali, L.; Silva, C.B.; Campos, F.M.M.; Bursi, L.M.; Nascimento, K.F.; Jesus, C.; Dias, J.F.G.; Dallarmi, M.M.; Gomes, O.M.; Zanin, S.M.W. Larvicidal activity of Dalbergia brasiliensis (Fabaceae-Papilioideae) on Aedes aegypti. Afr. J. Phram. Pharmacol. 2015, 9, 881–885. [Google Scholar] [CrossRef]
- Silva, S.L.C.; Gualberto, S.A.; Carvalho, K.S.; Fries, D.D. Avaliação da atividade larvicida de extratos obtidos do caule de Croton linearifolius Mull. Arg. (Euphorbiaceae) sobre larvas de Aedes aegypti (Linnaeus, 1762) (Diptera: Culicidae). Biotemas 2014, 27, 79–85. [Google Scholar] [CrossRef]
- Carvalho, G.H.F. Atividade Inseticida do Extrato Bruto Etanólico de Persea americana (Lauraceae) Sobre Larvas e Pupas de Aedes aegypti (Diptera, Culicideae). Master’s Thesis, Pós-Graduação em Biologia da Relação Parasito-Hospedeiro, Universidade Federal de Góias, Goiânia, Brasil, 2011. [Google Scholar]
- Oliveira, G.P.; Silva, S.L.C.; Gualberto, S.A.; Cruz, R.C.D.; Carvalho, K.S. Atividade larvicida do extrato etanólico da raiz de Croton linearifolius sobre Aedes aegypti. Encicl. Biosf. Centro Cient. Conhecer 2014, 10, 442–448. [Google Scholar]
- Amaro, N.B. Avaliação do Potencial de Extratos Vegetais de Trichilia pallida (Swartz, 1788) (Sapindales: Meliaceae) e Sesamum indicum (L. Linnaeus, 1753) (Lamiales: Pedaliaceae) na Prospecção de Acaricidas Botânicos Para Controle de Rhipicephalus Sanguineus (Latreille, 1806) (Acari: Ixodidae). Master’s Thesis, Pós graduação em Medicina Tropical, Universidade Federal de Goiás, Goiânia, Brasil, 2007. [Google Scholar]
- Fernandes, R.S. Espacialização da Dengue e os Efeitos dos Extratos de Anonáceas no Controle do Vetor Aedes aegypti (Linnaeus, 1762) (Diptera: Culicidae) em Tangará da Serra, Mato Grosso. Master’s Thesis, Pós-graduação em Ciências ambientais, Universidade do Estado de Mato Grosso, Cáceres, Brasil, 2012. [Google Scholar]
- Monteiro, L.C.C.F.; Araújo, E.I.M.; Oliveira, A.M.S.; Alves, L.A.; Bertini, L.M. Atividade antioxidante, teor de fenóis e atividade larvicida ao Aedes aegypti de Vitex gardneriana Schauer. Blucher Chem. Proc. 2015, 3, 1–8. [Google Scholar] [CrossRef][Green Version]
- Santana, H.T. Estudo Fitoquímico de Piper alatabaccum Trel & Yunck, 1950 e Avaliação da Atividade Larvicida Sobre Aedes aegypti Linnaus, 1762 (Diptera: Culicidae) em Condições de Campo Simulado. Master’s Thesis, Pós-graduação em Biologia experimental, Universidade Federal de Rondônia, Porto Velho, Brasil, 2012. [Google Scholar]
- Nour, A.H.; Sandanasamy, J.D.; Nour, A.H. Larvicidal activity of extracts from diferente parts of Neem (Azadirachta indica) against Aedes aegypti mosquitoes’ larvae. Sci. Res. Essays 2012, 7, 2810–2815. [Google Scholar] [CrossRef]
- Coelho, A.A.M.; De Paula, J.E.; Espíndola, L.S. Atividade larvicida de Extratos Vegetais sobre Aedes aegypti (L.) (Diptera: Culicidae), em condições de laboratório. BioAssay 2009, 4, 1–6. [Google Scholar] [CrossRef]
- Varjão, R.R.; Jardim, J.G.; Conceição, A.S. Rubiaceae Juss. De catinga na APA Serra Branca/Raso da Catarina, Bahia, Brasil. Biota Neotrop. 2013, 13, 105–123. [Google Scholar] [CrossRef]
Sample Availability: Samples of all isolated compounds are available from the authors. |
| C | 14 | 15a | 15b | ||||||
|---|---|---|---|---|---|---|---|---|---|
| δH | δc | HMBC | δH | δC | HMBC | δH | δc | HMBC | |
| 2 | - | 164.3 | - | - | 164.8 | - | - | 164.7 | - |
| 3 | 6.74 (s, 1H) | 101.8 | C-2 | 6.74 (s, 1H) | 101.8 | C-2, C-1′ | 6.69 (s, 1H) | 102.7 | - |
| 4 | - | 182.6 | - | - | 182.6 | - | - | 182.6 | - |
| 5 | - | - | - | - | - | - | - | - | - |
| 6 | 6.48 (s, 1H) | 95.8 | - | 6.48 (s, 1H) | 95.8 | - | 6.48 (s, 1H) | 95.8 | |
| 7 | - | 159.1 | - | 159.1 | - | 159.1 | - | ||
| 8 | - | 123.1 | - | - | 123.2 | - | - | 123.2 | - |
| 9 | - | 148.8 | - | - | 148.8 | - | - | 148.8 | - |
| 10 | - | 104.7 | - | - | 104.7 | - | - | 104.7 | - |
| 1′ | - | 123.6 | - | - | 121.6 | - | - | 123.6 | - |
| 2′ | 8.26 (d, J = 1.75 e 9.0 Hz, 2H) | 129.3 | C-2, C-4′, C-6′ | 8.13 (d, J = 8.9 Hz, 2H) | 129.3 | C-2, C-4′, C-6′ | 7.56 (d, J = 2.2 Hz 1H) | 113.8 | C-3′, C-4′, C-6′ |
| 3′ | 7.09 (d, J = 9.0 Hz, 2H) | 116.2 | C-4′, C-1′ | 6.86 (d, J = 8.8 Hz, 2H) | 116.0 | C-4′, C-1′, C-5′ | - | 146.8 | - |
| 4′ | - | 162.7 | - | - | 162.3 | - | - | 151.6 | - |
| 5′ | 7.09 (d, J = 9.0 Hz, 2H) | 116.2 | C-4′, C-1′ | 6.86 (d, J = 8.8 Hz, 2H) | 116.0 | C-4′, C-1′ | 7.07 (d, J = 8.5 Hz, 1H) | 111.8 | C-1′ |
| 6′ | 8.26 (d, J = 1.75 e 9.0 Hz, 2H) | 129.3 | C-2, C-4′ | 8.13 (d, J = 8.9 Hz, 2H) | 129.3 | C-2, C-4′ | 7.83 (dd, J = 2.2 e 8.5 Hz, 1H) | 119.8 | C-2′, C-4′ |
| OCH3-4′ | 3.84 (s, 3H) | 56.4 | - | - | - | - | 3.85 (s, 3H) | 55.7 | - |
| OCH3-7 | 3.82 (s, 3H) | 56.4 | - | 3.82 (s, 3H) | 56.4 | - | 3.82 (s, 3H) | 56.4 | |
| OH-5 | 12.91 (s, 1H) | - | - | 12.91 (s, 1H) | - | - | 12.91 (s, 1H) | - | - |
| Concentration (mg/mL) | Mean Mortality (n) | Standard Deviation (Triplicate) |
|---|---|---|
| 0.1 (a) * | 0 | 0 |
| 1.0 (a) | 2.3 (11.6%) | 0.57 |
| 2.5 | 5.3 (26.6) | 1.15 |
| 3.0 (b) (c) | 13.3 (66.6%) | 0.57 |
| 3.5 (b) (d) (e) | 13.6 (68.3%) | 1.52 |
| 5.0 (c) (d) (f) | 15.5 (77.5%) | 1.29 |
| 7.5 (e) (f) | 16.0 (80.0%) | 1.26 |
| 10.0 | 20 (100%) | 0 |
| Negative Control | 0 | 0 |
| Positive Control | 20 (100%) | 0 |
| Used Part | LC10 | LC50 | LC90 |
|---|---|---|---|
| Stem * | 60.406 mg/mL | 138.896 mg/mL | 319.372 mg/mL |
| Roots * | 73.029 mg/mL | 171.683 mg/mL | 403.607 mg/mL |
| Aerial parts | 0.965 mg/mL | 2.983 mg/mL | 9.691 mg/mL |
| Time (min) | A% | B% |
|---|---|---|
| 0 | 75 | 25 |
| 15 | 25 | 75 |
© 2018 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/).
Share and Cite
Fernandes, D.A.; Souza, M.S.R.; Teles, Y.C.F.; Oliveira, L.H.G.; Lima, J.B.; Conceição, A.S.; Nunes, F.C.; Silva, T.M.S.; Souza, M.d.F.V.d. New Sulphated Flavonoids and Larvicidal Activity of Helicteres velutina K. Schum (Sterculiaceae). Molecules 2018, 23, 2784. https://doi.org/10.3390/molecules23112784
Fernandes DA, Souza MSR, Teles YCF, Oliveira LHG, Lima JB, Conceição AS, Nunes FC, Silva TMS, Souza MdFVd. New Sulphated Flavonoids and Larvicidal Activity of Helicteres velutina K. Schum (Sterculiaceae). Molecules. 2018; 23(11):2784. https://doi.org/10.3390/molecules23112784
Chicago/Turabian StyleFernandes, Diégina A., Maria S. R. Souza, Yanna C. F. Teles, Louise H. G. Oliveira, Jéssica B. Lima, Adilva S. Conceição, Fabíola C. Nunes, Tania M. S. Silva, and Maria de Fátima Vanderlei de Souza. 2018. "New Sulphated Flavonoids and Larvicidal Activity of Helicteres velutina K. Schum (Sterculiaceae)" Molecules 23, no. 11: 2784. https://doi.org/10.3390/molecules23112784
APA StyleFernandes, D. A., Souza, M. S. R., Teles, Y. C. F., Oliveira, L. H. G., Lima, J. B., Conceição, A. S., Nunes, F. C., Silva, T. M. S., & Souza, M. d. F. V. d. (2018). New Sulphated Flavonoids and Larvicidal Activity of Helicteres velutina K. Schum (Sterculiaceae). Molecules, 23(11), 2784. https://doi.org/10.3390/molecules23112784






