Intestinal Microbiota of Commercial Laying Hens in a Cage-Free System Fed with Probiotics
Simple Summary
Abstract
1. Introduction
2. Materials and Methods
2.1. Housing of the Hens
2.2. Diet
2.3. Intestinal Microbiota Analysis
2.4. Statistical Analysis
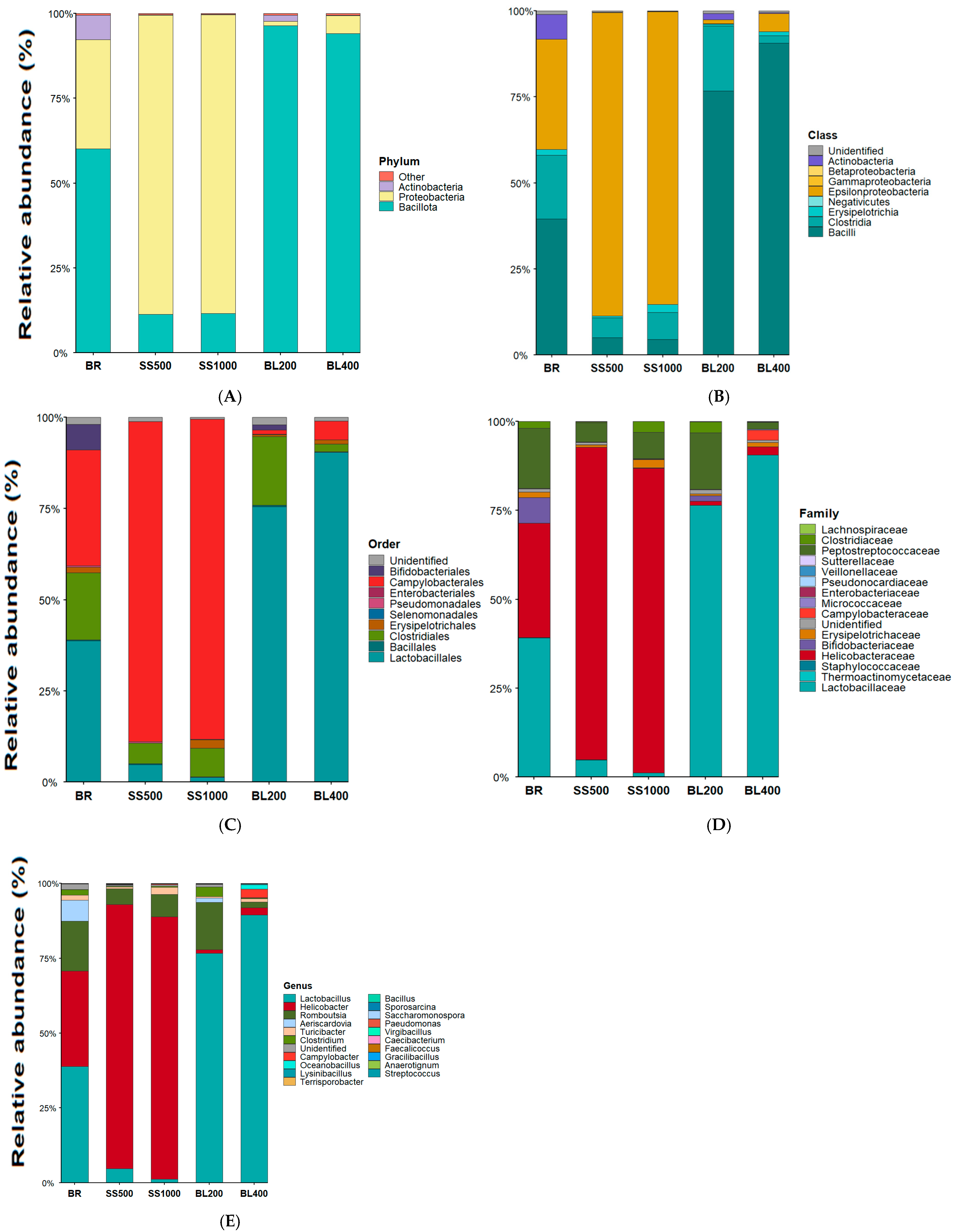
3. Results
Intestinal Microbiota at the Phylum Level
4. Discussion
5. Conclusions
Author Contributions
Funding
Institutional Review Board Statement
Informed Consent Statement
Data Availability Statement
Acknowledgments
Conflicts of Interest
References
- de Paula, P.D.; Moreira, J.; Almeida, A.A.; Valentim, J.K. Sistema cage-free na avicultura brasileira: Produtividade e tendências da indústria. Veterinária Zootec. 2025, 32, 1–14. [Google Scholar] [CrossRef]
- Costa, F.A.; Volpi, M.G.; Patil, M.E.F.; Cassim, L.F.; Hoffmann, N.C.; Santos, B.S.B.; Carvalhais, J.F. Discernimento dos consumidores de produtos de origem animal sobre segurança dos alimentos. Rev. DELOS 2025, 18, e5658. [Google Scholar] [CrossRef]
- Costa, E.B.; Simon, M.T.; Vinagre, D.O.V.B.; Recla, G.M. A influência do consumidor nos processos de produção agropecuária: O futuro é sustentável. INCAPER Rev. 2025, 15, 6–16. [Google Scholar] [CrossRef]
- Romano, G.G.; Demattê Filho, L.C.; Nascimento Amorim, M.; Santos Harada, É.; Ricci, G.D.; Narbot, M.Â.C.; Silva-Miranda, K.O. Animal welfare in free-range systems: Integrating environmental, behavioral, and physiological aspects in Lohmann Brown egg-laying hens. Res. Soc. Dev. 2025, 14, e11914348502. [Google Scholar] [CrossRef]
- Meireles, W.A.; dos Santos, J.S.; Neres, C.P.; Barros, K.G.; Ferreira, S.A.; de Pinho, E.B.; Gonçalves, A.C.S. A influência do bem-estar animal na eficiência produtiva e no mercado avícola: Uma análise baseada nos princípios das cinco liberdades. Rev. Multidiscip. Nordeste Min. 2025, 8, 1–10. [Google Scholar] [CrossRef]
- Pinho, E.B.; Silva Brito, E.C.; Santos, J.S.; Barros, K.G.; Santos Gonçalves, R.; Meireles, W.A.; Gonçalves, A.C.S. Impacto da alimentação no controle de doenças em galinhas poedeiras: Estratégias nutricionais para a saúde e produtividade. Rev. Multidiscip. Nordeste Min. 2025, 8, 1–11. [Google Scholar] [CrossRef]
- da Silva Teixeira, H.; de Sena Gandra, É.R.; Gandra, J.R.; de Souza Quevedo, P.; Oliveira, G.G.; de Sousa Matos, K.; Eufrasio, E.M.N.; de Oliveira Grieser, D. Uso de probióticos em dietas de codornas japonesas: Uma revisão. Braz. J. Anim. Environ. Res. 2025, 8, e79273. [Google Scholar] [CrossRef]
- Martos, K.G.; Souza Lima, M.; Sousa, A.M.L.; Brito, J.C. Aspectos econômicos do bem-estar animal: Um estudo de boas práticas na pecuária brasileira. Rev. JRG Estud. Acadêmicos 2025, 8, e081860. [Google Scholar] [CrossRef]
- Silva, R.A.; Sanseverino, E.C.; dos Santos Ceretta, G.; Matte, A.; Abramovay, R. The viability of poultry and swine production should not (and cannot) depend on antibiotics. REDES Rev. Desenvolv. Reg. 2025, 30, e20037. [Google Scholar] [CrossRef]
- Ornaghi, M.G.; Tellini, C.; Berto, R.; Castilho, R.A.; do Prado, I.N. A gut-release blend of bioactive compounds in synergistic combination with organic acids on the performance of broilers challenged with Clostridium perfringens. Pubvet 2025, 19, e1707. [Google Scholar] [CrossRef]
- Meira, C.C.; Freitas, E. Utilização de produtos alternativos em substituição aos antibióticos promotores de crescimento na nutrição de frangos de corte. Arq. Bras. Med. Veterinária FAG 2022, 5, 60–76. [Google Scholar]
- Ribeiro, A.G.; Rabello, C.B.V.; Santos, M.J.B.; Santos Nascimento, J.C.; Silva, D.A.; de Holanda Oliveira, H.S.; Miranda, V.M.D.M.C. Hábitats da microbiota residente e aditivos equilibradores intestinais para aves de produção: Revisão. Res. Soc. Dev. 2021, 10, e242101018800. [Google Scholar] [CrossRef]
- Feltrin, P.D.F.; Roll, A.A.P.; Mühlen, C.V.; Gatti, N.L.S.; Leite, F.P.L.; Corcini, C.D.; Roll, V.F.B. An assessment of Bacillus thuringiensis var. israelensis effects on hematology, intestinal morphology, and testicular growth in chickens. Rev. Bras. Saúde Produção Anim. 2025, 26, 20240022. [Google Scholar] [CrossRef]
- Cruz, L.C.F.; Costa, T.F.; Sampaio, S.A.; da Silva, N.G.D.; de Abreu, J.M.; Borges, K.F.; Minafra, C.S. Intestinal microbiome of birds and its importance. Res. Soc. Dev. 2022, 11, e22411225583. [Google Scholar] [CrossRef]
- Ducatelle, R.; Goossens, E.; Eeckhaut, V.; Van Immerseel, F. Poultry gut health and beyond. Anim. Nutr. 2023, 13, 240–248. [Google Scholar] [CrossRef]
- Mellor, D.J.; Beausoleil, N.J.; Littlewood, K.E.; Mclean, A.N.; Mcgreevy, P.D.; Jones, B.; Wilkins, C. The 2020 five domains model: Including human–animal interactions in assessments of animal welfare. Animals 2020, 10, 1870. [Google Scholar] [CrossRef] [PubMed]
- Carvalho, C.L.; Andretta, I.; Camargo, N.D.O.T.; Melchior, R.; Cardoso, S. Bem-estar animal em galinhas poedeiras. In Suinocultura e Avicultura: Básico a Zootecnia de Precisão; Editora Científica Digital: Guarujá, Brasil, 2021; Volume 1, pp. 68–88. [Google Scholar] [CrossRef]
- Rostagno, H.S.; Albino, L.T.; Hannas, M.I.; Donzele, J.L.; Sakomura, N.K.; Perazzo, F.G.; Brito, C.O. Tabelas Brasileiras Para Aves e Suínos: Composição de Alimentos e Exigências Nutricionais, 4th ed.; Departamento de Zootecnia, Universidade Federal de Viçosa: Viçosa, Brasil, 2017; p. 488. [Google Scholar]
- Christoff, A.P.; Sereia, A.F.R.; Boberg, D.R.; Moraes, R.L.; Oliveira, L.F. Bacterial identification through accurate library preparation and high-throughput sequencing. Neoprospecta Microbiome Technol. 2017, 25, 1–5. [Google Scholar]
- Pirgozliev, V.; Mansbridge, S.C.; Rose, S.P.; Lillehoj, H.S.; Bravo, D. Immune modulation, growth performance, and nutrient retention in broiler chickens fed a blend of phytogenic feed additives. Poult. Sci. 2019, 98, 3443–3449. [Google Scholar] [CrossRef] [PubMed]
- Ferreira, D.F. Sisvar: A computer statistical analysis system. Ciência Agrotecnol. 2011, 35, 1039–1042. [Google Scholar] [CrossRef]
- Mendiburu, F. Agricolae: Statistical Procedures for Agricultural Research, version 1.3.5; R-Project; Universidade Nacional Agrária: La Molina, Peru, 2021. [Google Scholar]
- Schoeler, M.; Caesar, R. Dietary lipids, gut microbiota, and lipid metabolism. Rev. Endocr. Metab. Disord. 2019, 20, 461–472. [Google Scholar] [CrossRef]
- Macari, M.; Lunedo, R.; Pedroso, A. Microbiota intestinal de aves. In Produção de Frangos de Corte, 2nd ed.; Facta, Campinas: Campinas, Brazil, 2014; pp. 1–22. [Google Scholar]
- He, Y.; Liu, X.; Dong, Y.; Lei, J.; Ito, K.; Zhang, B. Enterococcus faecium PNC01 isolated from the intestinal mucosa of chicken as an alternative for antibiotics to reduce feed conversion rate in broiler chickens. Microb. Cell Factories 2021, 20, 122. [Google Scholar] [CrossRef]
- Rama, E.N.; Bailey, M.; Kumar, S.; Leone, C.; den Bakker, H.C.; Thippareddi, H.; Singh, M. Characterizing the gut microbiome of broilers raised under conventional and no antibiotics ever practices. Poult. Sci. 2023, 102, 102832. [Google Scholar] [CrossRef]
- de Carvalho Maquiné, L.; Rufino, J.P.F.; Neto, P.D.Q.C.; Pereira, J.O. Probióticos como aditivos melhoradores de desempenho produtivo e econômico de aves em produção: Uma revisão. Obs. Econ. Latinoam. 2024, 22, e4249. [Google Scholar] [CrossRef]
- Chapman, M.A.; Grahn, M.F.; Boyle, M.A.; Hutton, M.; Rogers, J.; Williams, N.S. Butyrate oxidation is impaired in the colonic mucosa of sufferers of quiescent ulcerative colitis. Gut 1994, 35, 73–76. [Google Scholar] [CrossRef] [PubMed]
- Wesguerber, T.; Pinto, A.C.P.; Santos, A.C.M.; Saint Pierre, L.D.S.; Rocha, L.S.; de Faria, R.D.R.; Galeb, L.D.A.G. A influência do uso de antimicrobianos na produção animal e o impacto nos produtos derivados destinados à alimentação humana e animal. Braz. J. Anim. Environ. Res. 2024, 7, e71369. [Google Scholar] [CrossRef]
- Bahaddad, S.A.; Almalki, M.H.; Alghamdi, O.A.; Sohrab, S.S.; Yasir, M.; Azhar, E.I.; Chouayekh, H. Espécies de Bacillus como alternativas de antibióticos microbianos de alimentação direta para produção monogástrica. Probióticos Proteínas Antimicrob. 2023, 15, 1–16. [Google Scholar] [CrossRef] [PubMed]
- Nunes, R.V.; Scherer, C.; Silva, W.T.M.; Pozza, P.C.; Vieites, F.T. Avaliação de probioticos na alimentação de poedeiras comercias no segundo ciclo de postura. Arq. Bras. Med. Veterinária Zootécnico 2013, 5, 248–254. [Google Scholar] [CrossRef]
- Yadav, A.S.; Kolluri, G.; Gopi, M.; Karthik, K.; Singh, Y. Exploring alternatives to antibiotics as health promoting agents in poultry—A review. J. Exp. Biol. Agric. Sci. 2016, 4, 368–383. [Google Scholar] [CrossRef]
- Alexandrino, S.L.D.S.A.; Costa, T.F.; da Silva, N.G.D.; de Abreu, J.M.; da Silva, N.F.; Sampaio, S.A.; Minafra, C.S. Microbiota intestinal e os fatores que influenciam na avicultura. Res. Soc. Dev. 2020, 9, e87963098. [Google Scholar] [CrossRef]
- Conceição, J.D.S.; Carvalho, A.S.; Santos, L.C.; Pereira, E.; Melo, M.; Barreto, N.S.E. Bacillus spna nutrição de aves de corte e suínos: Uma revisão. Ciência Anim. Bras. 2025, 26, 80036E. [Google Scholar] [CrossRef]
- Kursa, O.; Tomczyk, G.; Sawicka-durkalec, A.; Giza, A.; SłomianySzwarc, M. Bacterial communities of the upper respiratory tract of turkeys. Sci. Rep. 2021, 11, 2544. [Google Scholar] [CrossRef]
- Salminen, S.; von Wright, A.; Morelli, L.; Marteau, P.; Brassart, D.; de Vos, W.M.; Fondén, R.; Saxelin, M.; Collins, K. Demonstration of safety of probiotics—A review. Int. J. Food Microbiol. 1998, 44, 93–106. [Google Scholar] [CrossRef] [PubMed]
- Huyghebaert, G.; Ducatelle, R.; Van Immerseel, F. An update on alternatives to antimicrobial growth promoters for broilers. Vet. J. 2011, 187, 182–188. [Google Scholar] [CrossRef]
- Dierikx, T.H.; Visser, D.H.; Benninga, M.A.; Van Kaam, A.H.L.C.; De Boer, N.K.H.; De Vries, R.; De Meij, T.G.J. A influência dos antibióticos pré-natais e intraparto na colonização da microbiota intestinal em lactentes: Uma revisão sistemática. J. Infecção 2020, 81, 190–204. [Google Scholar] [CrossRef]
- Lau, E.; Marques, C.; Pestana, D.; Santoalha, M.; Carvalho, D.; Freitas, P.; Calhau, C. The role of I-FABP as a biomarker of intestinal barrier dysfunction driven by gut microbiota changes in obesity. Nutr. Metab. 2016, 13, 31. [Google Scholar] [CrossRef] [PubMed]
- Panda, S.; El Khader, I.; Casellas, F.; Lopez Vivancos, J.; Garcia Cors, M.; Santiago, A.; Manichanh, C. Short-term effect of antibiotics on human gut microbiota. PLoS ONE 2014, 9, e95476. [Google Scholar] [CrossRef] [PubMed]
- Yazigi, A.; Gaborit, B.; Nogueira, J.P.; Butiler, M.E.; Andreelli, F. Rôle de la flore intestinale dans l’insulinorésistance et l’obésité. La Presse Médicale 2008, 37, 1427–1430. [Google Scholar] [CrossRef]
- Ferreira, C.C.; Zanin, T.B.N.; Comin, A.; Araujo, D.N.; Boiago, M.M.; Bajay, M.M.; Santos, A.d.S.; Stefani, L.d.C.M. Análise metagenômica da microbiota intestinal de poedeiras sob estresse calórico tratadas com melhoradores de desempenho. Obs. Econ. Latinoam. 2024, 22, e06213. [Google Scholar] [CrossRef]
- Chen, L.; Bai, X.; Wang, T.; Liu, J.; Miao, X.; Zeng, B.; Li, D. Analysis of the intestinal microbial diversity of different native chickens and screening of chicken-derived probiotics. Animals 2023, 13, 3672. [Google Scholar] [CrossRef]
- Crhanova, M.; Karasova, D.; Juricova, H.; Matiasovicova, J.; Jahodarova, E.; Kubasova, T.; Rychlik, I. Systematic culturomics shows that half of chicken caecal microbiota members can be grown in vitro except for two lineages of Clostridiales and a single lineage of Bacteroidetes. Microorganisms 2019, 7, 496. [Google Scholar] [CrossRef]
- Butel, M.J. Os probióticos e seu lugar na medicina humana. J. Des Anti-Infect. 2014, 16, 33–43. [Google Scholar] [CrossRef]
- Gibson, G.R.; Hutkins, R.; Sanders, M.E.; Prescott, S.L.; Reimer, R.A.; Salminen, S.J.; Reid, G. Documento de consenso de especialistas: Declaração de consenso da Associação Científica Internacional para Probióticos e Prebióticos (ISAPP) sobre a definição e o escopo dos prebióticos. Nat. Rev. Gastroenterol. Hepatol. 2017, 14, 491–502. [Google Scholar] [CrossRef]
- Nabhan, G.C.H.; Vefago, A.L.; Benites, M.L.; Capel, L.M.M. Efeitos dos diferentes padrões alimentares sobre a microbiota intestinal. Braz. J. Health Rev. 2025, 8, e78884. [Google Scholar] [CrossRef]
- Ichikawa, H.; Shineha, R.; Satomi, S.; Sakata, T. Gastric or rectal instillation of short-chain fatty acids stimulates epithelial cell proliferation of small and large intestine in rats. Dig. Dis. Sci. 2002, 47, 1141–1146. [Google Scholar] [CrossRef]
- Tu, M.J.; Yu, A.M. Recent Advances in Novel Recombinant RNAs for Studying Post-transcriptional Gene Regulation in Drug Metabolism and Disposition. Curr. Drug Metab. 2023, 24, 175–189. [Google Scholar] [CrossRef]
- Reis, F. Disbiose da microbiota intestinal e doenças cardiovasculares—A galinha e o ovo. Rev. Port. Cardiol. 2023, 42, 553–555. [Google Scholar] [CrossRef] [PubMed]
- Shehata, A.M.; Paswan, V.K.; Attia, Y.A.; Abougabal, M.S.; Khamis, T.; Alqosaibi, A.I.; Abdel-Moneim, A.M.E. A inoculação in ovo de Bacillus subtilis e rafinose afeta o desempenho do crescimento, a microbiota cecal, os ácidos graxos voláteis, a morfologia ileal e a expressão gênica e a sustentabilidade de frangos de corte (Gallus gallus). Front. Nutr. 2022, 9, 903847. [Google Scholar] [CrossRef]
- Aydin, Ö.D.; Yildiz, G.; Merhan, O. Efeitos da suplementação com probiótico (Lactobacillus farciminis) em rações de codornas (Coturnix coturnix japonica) no desempenho de crescimento, capacidade antioxidante do sangue e concentrações de alguns ácidos graxos de cadeia curta no ceco. Kafkas Üniversitesi Vet. Fakültesi Derg. 2021, 27, 15–20. [Google Scholar] [CrossRef]
- Mátis, G.; Kulcsár, A.; Turowski, V.; Fébel, H.; Neogrády, Z.; Huber, K. Efeitos da aplicação oral de butirato na sinalização da insulina em vários tecidos de galinhas. Endocrinol. Animais Domésticos 2015, 50, 26–31. [Google Scholar] [CrossRef]
- Popov, I.V.; Algburi, A.; Prazdnova, E.V.; Mazanko, M.S.; Elisashvili, V.; Bren, A.B.; Chikindas, M.L. Uma revisão dos efeitos e produção de probióticos formadores de esporos para aves. Animals 2021, 11, 1941. [Google Scholar] [CrossRef]
- Han, G.G.; Kim, E.B.; Lee, J.; Lee, J.Y.; Jin, G.; Park, J.; Kong, C. Relationship between the microbiota in different sections of the gastrointestinal tract, and the body weight of broiler chickens. Springerplus 2016, 5, 911. [Google Scholar] [CrossRef]
- Díaz-López, E.A.; Ángel-Isaza, J.; Ángel, D. Probióticos en la avicultura: Una revisión. Rev. Med. Vet. 2017, 35, 175–189. [Google Scholar] [CrossRef]
- Xiao, Y.; Xiang, Y.; Zhou, W.; Chen, J.; Li, K.; Yang, H. Microbial community mapping in intestinal tract of broiler chicken. Poult. Sci. 2017, 96, 1387–1393. [Google Scholar] [CrossRef]
- Nene, M.; Kunene, N.W.; Pierneef, R.; Hadebe, K. Perfil da diversidade da microbiota fecal de galinhas caipiras usando dados de sequenciamento do gene 16S rRNA e metagenômico para revelar padrões de assinaturas do microbioma intestinal. Front. Microbiol. 2025, 15, 1487595. [Google Scholar] [CrossRef]
- Du, X.; Xiang, Y.; Lou, F.; Tu, P.; Zhang, X.; Hu, X.; Lyu, W.; Xiao, Y. Microbial Community and Short-Chain Fatty Acid Mapping in the Intestinal Tract of Quail. Animals 2020, 10, 1006. [Google Scholar] [CrossRef] [PubMed]
- Parker, A.; Lawson, M.A.; Vaux, L.; Pin, C. Host-microbe interaction in the gastrointestinal tract. Environ. Microbiol. 2018, 20, 2337–2353. [Google Scholar] [CrossRef]
- Névoa, M.L.; Caramori-Júnior, J.G.; Vieites, F.M.; Nunes, V.R.; Vargas Junior, J.G.; Kamimura, R. Antimicrobianos e prebióticos nas dietas de animais não ruminantes. Sci. Agrar. 2013, 12, 85–95. [Google Scholar] [CrossRef]
- Peng, W.; Huang, J.; Yang, J.; Zhang, Z.; Yu, R.; Fayyaz, S.; Zhang, S.; Qin, Y.H. Integrated 16S rRNA sequencing, metagenomics, and metabolomics to characterize gut microbial composition, function, and fecal metabolic phenotype in non-obese type 2 diabetic. Front. Microbiol. 2020, 10, 3141. [Google Scholar] [CrossRef]
- Yang, Q.; Liang, Q.; Balakrishnan, B.; Belobrajdic, D.P.; Feng, Q.J.; Zhang, W. Role of dietary nutrients in the modulation of gut microbiota: A narrative review. Nutrients 2020, 12, 381. [Google Scholar] [CrossRef]
- LeBlanc, J.G.; Chain, F.; Martín, R.; Bermúdez-Humarán, L.G.; Courau, S.; Langella, P. Beneficial effects on host energy metabolism of short-chain fatty acids and vitamins produced by commensal and probiotic bacteria. Microb. Cell Factories 2017, 16, 79. [Google Scholar] [CrossRef]
- Topping, D.L. Ácidos graxos de cadeia curta produzidos por bactérias intestinais. Asia Pac. J. Clin. Nutr. 1996, 5, 15–19. [Google Scholar] [PubMed]
- den Besten, G.; Lange, K.; Havinga, R.; van Dijk, T.H.; Gerding, A.; van Eunen, K.; Müller, M.; Groen, A.K.; Hooiveld, G.J.; Bakker, B.M. Gut-derived short-chain fatty acids are vividly assimilated into host carbohydrates and lipids. American Journal of Physiology. Gastrointest. Liver Physiol. 2013, 305, G900–G910. [Google Scholar] [CrossRef]
- Khan, S.; Moore, R.J.; Stanley, D.; Chousalkar, K.K. A microbiota intestinal de galinhas poedeiras e sua manipulação com prebióticos e probióticos para melhorar a saúde intestinal e a segurança alimentar. Microbiol. Apl. Ambient. 2020, 86, e00600-20. [Google Scholar] [CrossRef]
- Attia, Y.A.; Al-Harthi, M.A.; El-Shafey, A.S.; Rehab, Y.A.; Kim, W.K. Aumentando a tolerância de frangos de corte ao estresse térmico por meio da suplementação com vitamina E, vitamina C e/ou probióticos. Ann. Anim. Sci. 2017, 17, 1155. [Google Scholar] [CrossRef]
- Rychlik, I. Composition, and function of chicken gut microbiota. Animals 2020, 10, 103. [Google Scholar] [CrossRef]
- Liu, J.; Sun, J.; Wang, F.; Yu, X.; Ling, Z.; Li, H.; Xu, J. Neuroprotective effects of Clostridium butyricum against vascular dementia in mice via metabolic butyrate. BioMed Res. Int. 2015, 1, 412946. [Google Scholar] [CrossRef]
- Lynch, J.B.; Gonzalez, E.L.; Choy, K.; Faull, K.F.; Jewell, T.; Arellano, A.; Hsiao, E.Y. Cepas de Turicibacter da microbiota intestinal modificam diferencialmente os ácidos biliares e os lipídios do hospedeiro. Nat. Commun. 2023, 14, 3669. [Google Scholar] [CrossRef]
- Chateau, N.; Castellanos, I.; Deschamis, A.M. Distribuition of pathogen inhibition in the Lactobacillus isolation of a commercial probiotic consortium. J. Appl. Bacteriol. 1993, 74, 36–40. [Google Scholar] [CrossRef]
- de Oliveira Alves, S.; Reis, L.W.D.; Bragança, A.F.B. Nutrigenômica na Medicina Veterinária. In Práticas, Políticas e Inovação na Abordagem Multidisciplinar; Editora Epitaya: Rio de Janeiro, Brazil, 2023; ISBN 978-65-87809-70-0. [Google Scholar]
- Yadav, S.; and Jha, R. Strategies to modulate the intestinal microbiota and their effects on nutrient utilization, performance, and health of poultry. J. Anim. Sci. Biotechnol. 2019, 10, 2. [Google Scholar] [CrossRef] [PubMed]

| Ingredients | Basal Ration | Single Strain 1 (500 g/t) | Single Strain 1 (1000 g/t) | Blend 2 (200 g/t) | Blend 2 (400 g/t) |
|---|---|---|---|---|---|
| Corn 7.88% | 66.021 | 66.021 | 66.021 | 66.021 | 66.021 |
| Soybean meal 45% | 20.151 | 20.151 | 20.151 | 20.151 | 20.151 |
| soybean oil | 1.708 | 1.708 | 1.708 | 1.708 | 1.708 |
| Limestone | 9.992 | 9.992 | 9.992 | 9.992 | 9.992 |
| Dicalcium phosphate | 0.730 | 0.730 | 0.730 | 0.730 | 0.730 |
| Mineral premix | 0.500 | 0.500 | 0.500 | 0.500 | 0.500 |
| Common salt | 0.388 | 0.388 | 0.388 | 0.388 | 0.388 |
| L-lysine | 0.138 | 0.138 | 0.138 | 0.138 | 0.138 |
| DL-methionine | 0.274 | 0.274 | 0.274 | 0.274 | 0.274 |
| L-threonine | 0.084 | 0.084 | 0.084 | 0.084 | 0.084 |
| L-tryptophan | 0.018 | 0.018 | 0.018 | 0.018 | 0.018 |
| Total (kg) | 100.0 | 100.0 | 100.0 | 100.0 | 100.0 |
| Calculated value | |||||
| ME (Mcal/kg) | 2.850 | 2.850 | 2.850 | 2.850 | 2.850 |
| Crude protein (%) | 14.830 | 14.830 | 14.830 | 14.830 | 14.830 |
| Linoleic acid (%) | 1.514 | 1.514 | 1.514 | 1.514 | 1.514 |
| Total Lysine (%) | 0.747 | 0.747 | 0.747 | 0.747 | 0.747 |
| Total methionine (%) | 0.688 | 0.688 | 0.688 | 0.688 | 0.688 |
| Total threonine (%) | 0.576 | 0.576 | 0.576 | 0.576 | 0.576 |
| Total tryptophan (%) | 0.172 | 0.172 | 0.172 | 0.172 | 0.172 |
| Calcium (%) | 4.100 | 4.100 | 4.100 | 4.100 | 4.100 |
| Potassium (%) | 0.568 | 0.568 | 0.568 | 0.568 | 0.568 |
| Phosphorus (%) | 0.213 | 0.213 | 0.213 | 0.213 | 0.213 |
| Sodium (HCL) (%) | 0.175 | 0.175 | 0.175 | 0.175 | 0.175 |
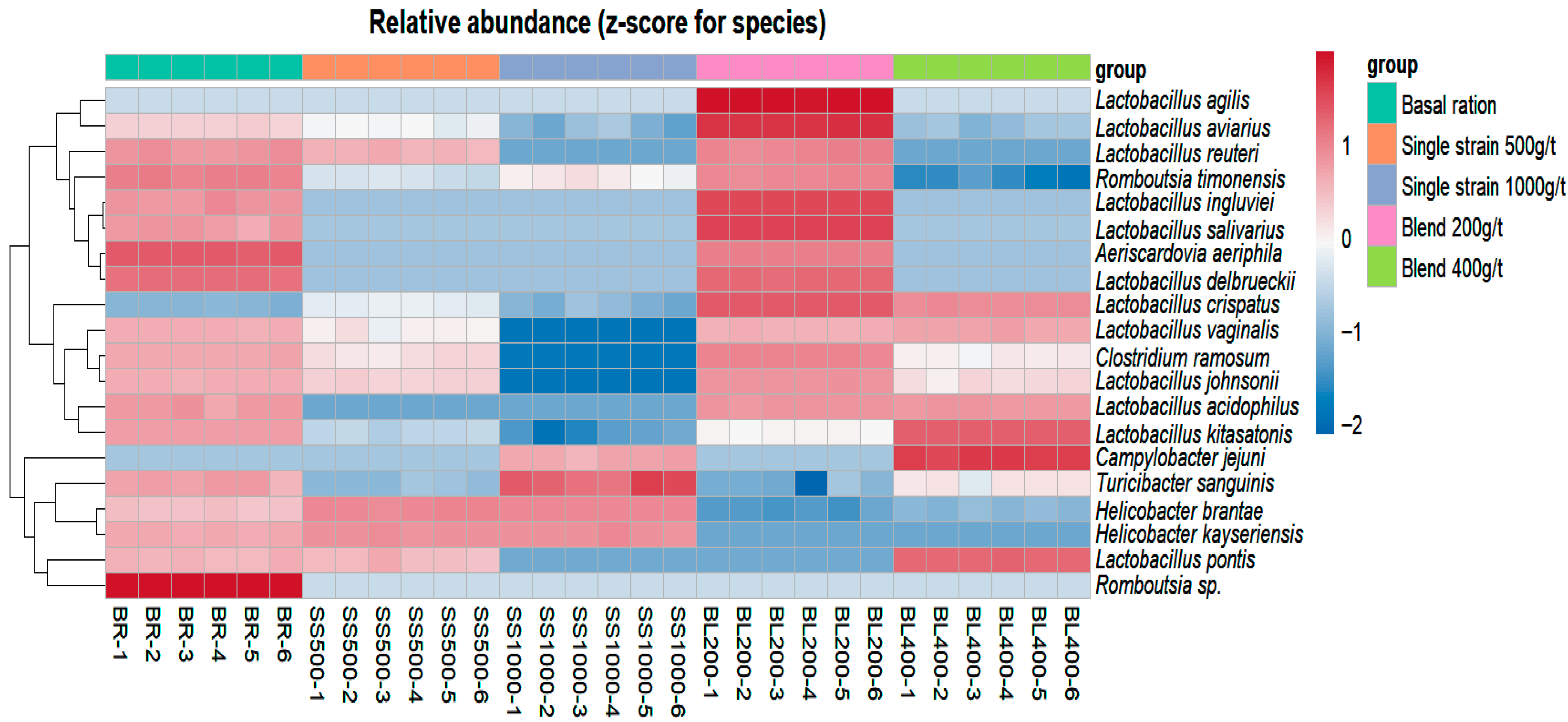
| Species | Basal Ration | Single Strain (500 g/t) | Single Strain (1000 g/t) | Blend (200 g/t) | Blend (400 g/t) | p Value | EMP 1 | CV 2 (%) |
|---|---|---|---|---|---|---|---|---|
| Aeriscardovia aeriphila | 7.140a | 0.000c | 0.000c | 1.445b | 0.000c | 0.000110 | 0.052 | 7.54 |
| Campylobacter jejuni | 0.000b | 0.000b | 0.053b | 0.000b | 2.795a | 0.000091 | 0.083 | 5.82 |
| Clostridium disporicum | 0.860b | 0.143c | 0.000d | 2.531a | 0.083c | 0.000029 | 0.026 | 9.05 |
| Helicobacter brantae | 31.60b | 86.038a | 85.500a | 1.163c | 2.423c | 0.000010 | 0.641 | 3.80 |
| Helicobacter kayseriensis | 0.801b | 2.41a | 2.47a | 0.000c | 0.000c | 0.000012 | 0.019 | 11.47 |
| Lactobacillus acidophilus | 0.590a | 0.000b | 0.000b | 0.660a | 0.626a | 0.000015 | 0.332 | 11.67 |
| Lactobacillus agilis | 0.000b | 0.000b | 0.000b | 0.730a | 0.000b | 0.000020 | 0.009 | 15.62 |
| Lactobacillus alvi | 1.050a | 0.225b | 0.041c | 1.051a | 0.280b | 0.000280 | 0.021 | 9.89 |
| Lactobacillus aviarius | 1.031c | 1.416b | 0.281d | 20.878a | 0.123d | 0.000222 | 0.115 | 5,94 |
| Lactobacillus crispatus | 0.352d | 1.668c | 0.358d | 36.466a | 15.595b | 0.000214 | 0.186 | 4.18 |
| Lactobacillus delbrueckii | 1.405b | 0.000c | 0.000c | 1.583a | 0.000c | 0.000690 | 0.029 | 12.23 |
| Lactobacillus ingluviei | 0.067b | 0.000c | 0.000c | 1.028a | 0.000c | 0.000901 | 0.005 | 6.16 |
| Lactobacillus johnsonii | 3.125b | 0.811c | 0.000d | 7.803a | 0.558c | 0.000009 | 0.104 | 10.44 |
| Lactobacillus kitasatonis | 14.15b | 0.393d | 0.043e | 1.656c | 67.585a | 0.000024 | 0.100 | 1.47 |
| Lactobacillus pontis | 0.181b | 0.146b | 0.000c | 0.000c | 3.571a | 0.000018 | 0.025 | 7.85 |
| Lactobacillus reuteri | 0.454b | 0.143c | 0.000d | 0.763a | 0.000d | 0.000015 | 0.029 | 6.73 |
| Lactobacillus salivarius | 0.101b | 0.000c | 0.000c | 3.091a | 0.000c | 0.000014 | 0.110 | 4.27 |
| Lactobacillus vaginalis | 0.910b | 0.106c | 0.000c | 0.841b | 1.218a | 0.000011 | 0.038 | 5.42 |
| Romboutsia sp. | 0.935a | 0.000b | 0.000b | 0.000b | 0.000b | 0.000010 | 0.111 | 4.96 |
| Romboutsia timonesis | 16.85a | 5.271d | 7.445c | 15.878b | 1.923e | 0.000010 | 0.174 | 4.51 |
| Turicibacter sanguinis | 1.625b | 0.625d | 2.393a | 0.531d | 1.108c | 0.000024 | 0.056 | 11.01 |
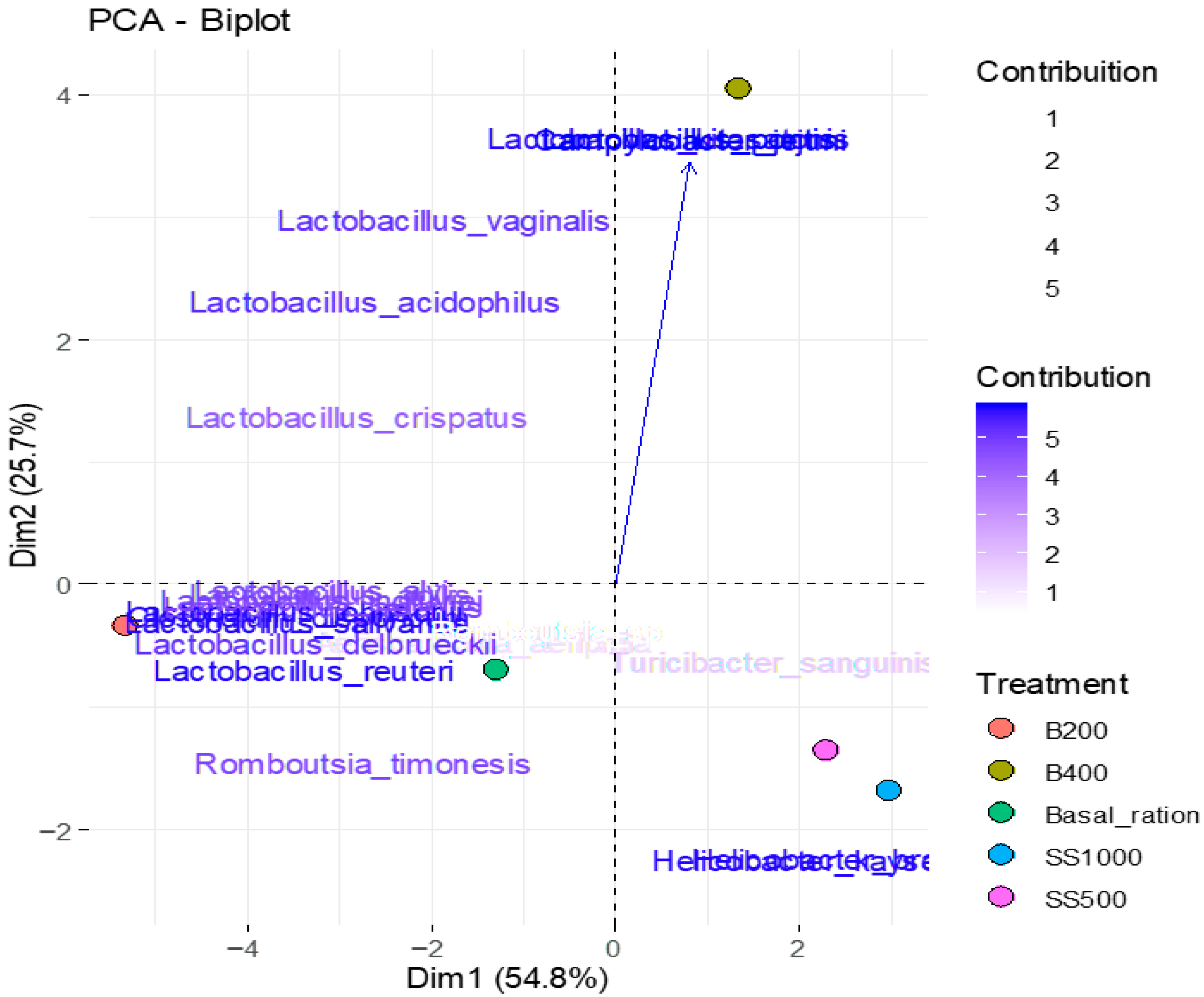
| Variables | Component 1 | Component 2 | Component 3 |
|---|---|---|---|
| Lactobacillus_alvi | −0.91 | −0.07 | 0.40 |
| Clostridium_disporicum | −0.98 | −0.13 | −0.16 |
| Lactobacillus_crispatus | −0.79 | 0.33 | −0.50 |
| Helicobacter_brantae | 0.71 | −0.69 | −0.10 |
| Lactobacillus_aviarius | −0.89 | −0.11 | −0.43 |
| Lactobacillus_johnsonii | −0.99 | −0.12 | −0.12 |
| Lactobacillus_kitasatonis | 0.16 | 0.97 | 0.15 |
| Romboutsia_timonesis | −0.78 | −0.47 | 0.41 |
| Lactobacillus_vaginalis | −0.52 | 0.78 | 0.34 |
| Campylobacter_jejuni | 0.23 | 0.97 | −0.04 |
| Lactobacillus_pontis | 0.23 | 0.97 | 0.00 |
| Lactobacillus_acidophilus | −0.74 | 0.60 | 0.31 |
| Turicibacter_sanguinis | 0.49 | −0.23 | 0.42 |
| Aeriscardovia_aeriphila | −0.40 | −0.19 | 0.89 |
| Lactobacillus_agilis | −0.88 | −0.08 | −0.46 |
| Lactobacillus_ingluviei | −0.90 | −0.09 | −0.40 |
| Lactobacillus_delbrueckii | −0.92 | −0.20 | 0.34 |
| Lactobacillus_salivarius | −0.98 | −0.14 | −0.12 |
| Lactobacillus_reuteri | −0.96 | −0.25 | 0.05 |
| Helicobacter_kayseriensis | 0.71 | −0.69 | −0.13 |
| Romboutsia_sp | −0.21 | −0.17 | 0.96 |
| Eigenvalue | 11.50 | 5.39 | 3.46 |
| % Variance | 54.78 | 25.68 | 16.49 |
| % Cumulative Variance | 54.78 | 80.46 | 96.95 |
Disclaimer/Publisher’s Note: The statements, opinions and data contained in all publications are solely those of the individual author(s) and contributor(s) and not of MDPI and/or the editor(s). MDPI and/or the editor(s) disclaim responsibility for any injury to people or property resulting from any ideas, methods, instructions or products referred to in the content. |
© 2025 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).
Share and Cite
Silva, W.J.d.; Sousa, J.S.; Bonifácio, N.P.; Carrijo, M.S.; Minafra, C.; Costa, H.C.G.d.; Santos, F.R.d.; Fernandes, C.C.; Costa, A.C.; Sobrane Filho, S.T.; et al. Intestinal Microbiota of Commercial Laying Hens in a Cage-Free System Fed with Probiotics. Animals 2025, 15, 3388. https://doi.org/10.3390/ani15233388
Silva WJd, Sousa JS, Bonifácio NP, Carrijo MS, Minafra C, Costa HCGd, Santos FRd, Fernandes CC, Costa AC, Sobrane Filho ST, et al. Intestinal Microbiota of Commercial Laying Hens in a Cage-Free System Fed with Probiotics. Animals. 2025; 15(23):3388. https://doi.org/10.3390/ani15233388
Chicago/Turabian StyleSilva, Weslane Justina da, Josilene Silva Sousa, Nadielli Pereira Bonifácio, Murilo Sousa Carrijo, Cíntia Minafra, Hindenburg Cruvinel Guimarães da Costa, Fabiana Ramos dos Santos, Cassia Cristina Fernandes, Adriano Carvalho Costa, Sérgio Turra Sobrane Filho, and et al. 2025. "Intestinal Microbiota of Commercial Laying Hens in a Cage-Free System Fed with Probiotics" Animals 15, no. 23: 3388. https://doi.org/10.3390/ani15233388
APA StyleSilva, W. J. d., Sousa, J. S., Bonifácio, N. P., Carrijo, M. S., Minafra, C., Costa, H. C. G. d., Santos, F. R. d., Fernandes, C. C., Costa, A. C., Sobrane Filho, S. T., Silva, F. G., & Minafra, C. S. (2025). Intestinal Microbiota of Commercial Laying Hens in a Cage-Free System Fed with Probiotics. Animals, 15(23), 3388. https://doi.org/10.3390/ani15233388






