Zusammenfassung
Die Pulsoxymetrie zur Bestimmung der Sauerstoffsättigung im Blut spielt in der medizinischen Diagnostik eine wichtige Rolle und ist integraler Bestandteil der Überwachung von invasiven und semiinvasiven Untersuchungen, so auch der transösophagealen Echokardiographie. Das Wissen des Untersuchers um das Prinzip, die Limiten, die Wertigkeit und die möglichen Ursachen von Veränderungen der Messwerte des Pulsoxymeters, ist entscheidend für die korrekte Interpretation der Befunde und damit für Diagnosestellung und Therapie des Patienten.
Tiefe Werte der Sauerstoffsättigung können unter anderem bedingt sein durch Hypoxämie oder technische Artefakte. Fehlinterpretationen können entstehen durch abnormes Hämoglobin oder Verschiebungen der Sauerstoffdissoziationskurve.
Eine zu Beginn der Untersuchung tiefe Sauerstoffsättigung ist am häufigsten durch technische Artefakte sowie Ventilationsstörungen bedingt; sind diese Ursachen ausgeschlossen, so muss an ein zyanotisches Herzvitium gedacht und dieses gesucht werden. Sinkt die Sauerstoffsättigung während der Untersuchung ab, so ist nach Ausschluss von Hypoventilation (zu tiefe Sedation, Lungenerkrankung) unter anderem auch an eine durch die Rachenanästhesie verursachte Methämoglobinbildung zu denken.
Schlüsselwörter: Pulsoxymetrie; transösophageale Echokardiographie; Shunt-Vitium; Methämoglobin
Einleitung
Das Pulsoxymeter ermöglicht die nicht invasive Messung der Sauerstoffsättigung im arteriellen Blut sowie die kontinuierliche Bestimmung der Herzfrequenz.
In der Überwachung und Beurteilung des Patienten vor, während, und nach einer transösophagealen Echokardiographie hat sich die Pulsoxymetrie etabliert. Sie ermöglicht die rasche Erkennung eines Abfalls der Sauerstoffsättigung und trägt somit entscheidend zur Sicherheit der Untersuchung und in vielen Fällen zur Differentialdiagnosestellung bei.
Abnorme oder vor allem abfallende Werte bedürfen der raschen Diagnose (Ursache!) und Therapie. Das Wissen um die Veränderung der mittels Pulsoxymetrie bestimmten Werte ist deshalb unverzichtbar. Auch die Limiten des Pulsoxymeters müssen bekannt sein, um Fehlinterpretationen zu vermeiden.
Der Vorliegende beschreibt das Prinzip der Messung und deren Veränderungen, vor allem in bezug auf eine transösophageale echokardiographische Untersuchung. Die differentialdiagnostischen Überlegungen gliedern sich in (1.) zu Beginn der Untersuchung abnorm tiefe Sauerstoffsättigungswerte und (2.) während dem Untersuch abfallenden Werte.
Es muss betont werden, dass die häufigsten Ursachen der tiefen Sauerstoffsättigung durch zu tiefe Sedation, pulmonale Erkrankungen und technische Artefakte bedingt sind. Der vorliegende Artikel geht auch auf die selteneren, weniger bekannten Ursachen ein.
Pulsoxymetrie
Die Pulsoxymetrie nützt den Umstand, dass oxygeniertes und deoxygeniertes Hämoglobin verschiedene Absorptionsspektren aufweisen und beruht auf dem Gesetz von Lambert (1728–1777) und Beer (1825–1863):
So werden vom Oxymeter meist Licht von zwei verschiedenen Wellenbereichen emittiert und deren Absorption im Photodetektor gemessen.
Die Plethysmographie nützt den pulsatilen Blutfluss, erhöht damit die Messgenauigkeit und errechnet die Herzfrequenz. Bei Sauerstoffsättigungen im Bereich von 75 bis 100% stimmt die Pulsoxymetrie relativ genau mit den mittels Blutgasanalyse gemessenen Werten überein [
1,
2].
Die Limiten der Pulsoxymetrie sind bei Sauerstoffsättigungen unter 75%, bei Methämoglobin-Bildungen [
3], bei KohlenmonoxidIntoxikationen [
4,
5], bei schwerster Anämie (Hb <5 g/dl), bei Verschiebung der Sauerstoffdissoziationskurve [
6] und bei Hämoglobinopathien.
Zyanose
Das klinische Bild der Zyanose kann in eine Hämoglobin- und eine Hämiglobinzyanose unterteilt werden. Die Hämoglobinzyanose wiederum ist entweder zentral oder peripher bedingt, die zentrale selbst kann sowohl kardiale als auch pulmonale Ursachen haben. Die Hämiglobinzyanose unterteilt sich in eine Methämoglobinämie und eine Sulfhämoglobinämie.
Hämoglobinzyanose
Damit eine Zyanose bei Hypoxämie in Erscheinung tritt, bedarf es einer Konzentration von über 5 g/dl deoxygeniertem Hämoglobin im Kapillarblut. Deshalb sind schwer anämische Patienten nicht zyanotisch.
Hämiglobinzyanose
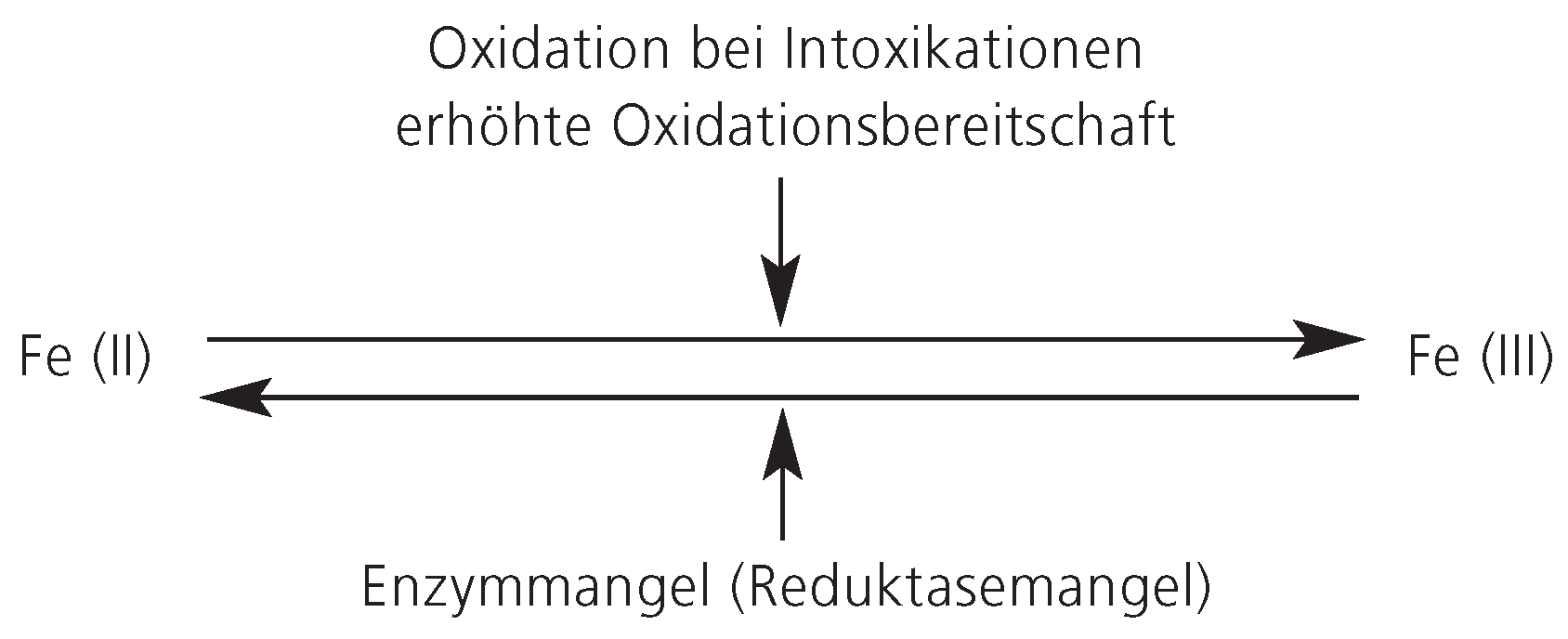
Bei der Hämiglobinzyanose ist insbesondere die Methämoglobinämie zu erwähnen. Hier liegt das sonst zweiwertige Eisen in oxidierter, dreiwertiger Form vor (siehe unten).
Differentialdiagnostische Überlegungen
Tiefe Sauerstoffsättigung vor der transösophagealen echokardiographischen Untersuchung
Zeigt das Pulsoxymeter vor Beginn der Untersuchung tiefe Werte an, so müssen im ersten Schritt Artefakte ausgeschlossen werden. Dazu gehören unter anderem eine ungenügende Fixation des Mess-Clip, Nagellack am Finger des Patienten, Hypoperfusion des Messfingers (kalte Finger) oder das Vorliegen einer schweren Anämie. Ein Ikterus stört die Messung meist nicht, schwarze Hautfarbe, kann aber muss nicht zu Messfehlern führen [
7,
8,
9]. Gegebenenfalls muss dann die Messung an einer anderen, wenig pigmentierten Körperstelle, beispielsweise dem Zungenbändchen (mit speziellem Mess-Clip) vorgenommen werden. Die gleichzeitige Blutdruckmessung mit einer Manschette am Oberarm der gleichen Extremität stört natürlich die Messung der Sauerstoffsättigung.
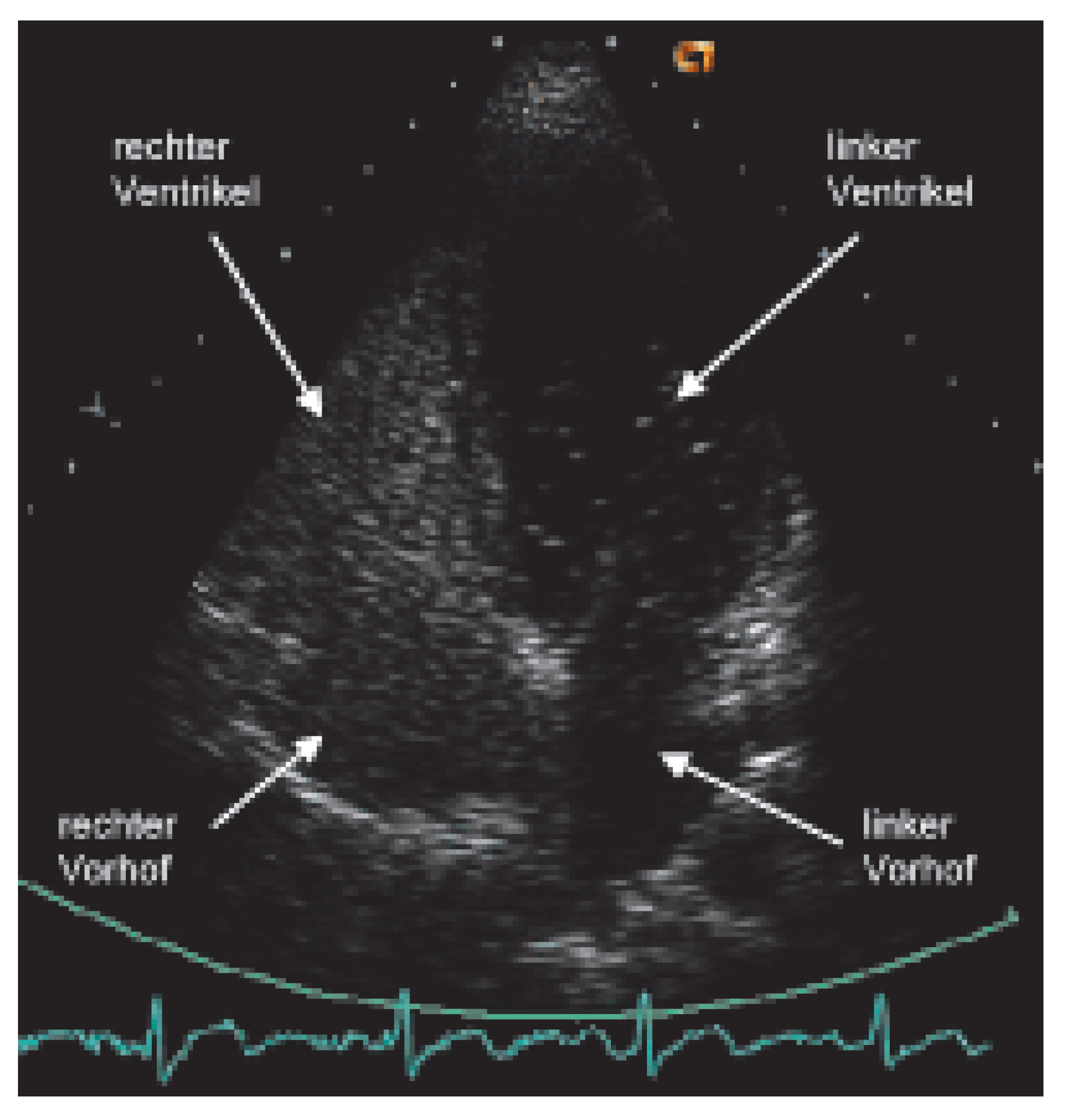
Sind die erwähnten Artefakte sowie pulmonale Erkrankungen ausgeschlossen, so muss an ein zyanotisches Herzvitium gedacht und ein Rechts-Links-Shunt gesucht werden. Ergibt sich aus der normalen transthorakalen Doppler-echokardiographischen Untersuchung noch keine Diagnose, so wird ein Echokontrastmittel (am besten aus Luft und physiologischer Kochsalzlösung hergestellte «Bubbles») von einer Vene der oberen Extremität injiziert (
Figure 1). Allenfalls kann der Rechts-Links-Shunt nur nach Provokation mittels eines korrekten Valsalva-Manövers nachgewiesen werden. Führt die Injektion von Bubbles auch nicht zur Diagnose, das heisst, findet kein Übertritt von Bubbles in die linken Herzhöhlen statt, so wird die Untersuchung mit Injektion von Bubbles von der unteren Extremität wiederholt. Treten die Bubbles nun nur im linken Vorhof auf, so kann die Diagnose einer in den linken Vorhof mündenden Vena cava inferior gestellt werden [
10]. Ist auch dieser Untersuch negativ, das heisst, ein RechtsLinks-Shunt ist ausgeschlossen, so muss in einem dritten Schritt ein abnormes Hämoglobin (z.B. CO-Hämoglobin bei CO-Intoxikation; Anteil des CO-Hämoglobins ist mit vielen Blutgas-Messgeräten bestimmbar) oder eine Hämoglobinopathie gesucht werden. Zu erwähnen ist hier z.B. das in der Schweiz vorkommende Hämoglobin Schlierbach [
11]. Fällt die Sauerstoffsättigung im Stehen gegenüber derer im Liegen ab, so ist an das seltene Platypnoe-Orthodeoxie-Syndrom zu denken [
12].
Abfall der Sauerstoffsättigung während der transösophagealen echokardiographischen Untersuchung
Tritt nach lokaler Rachenanästhesie während der TEE-Untersuchung ein Abfall der Sauerstoffsättigung auf, so muss in erster Linie an eine zu tiefe Sedation (falls der Patient sediert wurde) sowie an pulmonale Erkrankungen gedacht werden. Nach deren Ausschluss ist die, wenn auch selten auftretende, Methämoglobinämie in Betracht zu ziehen [
12]. Die Messung einer «Sauerstoffsättigung» trotz Gabe von Sauerstoff um 85% ist dabei charakteristisch.
Methämoglobin besitzt ein von oxyund deoxygeniertem Hämoglobin abweichendes Absorptionsspektrum, das Pulsoxymeter interpretiert dieses Spektrum als eine Sauerstoffsättigung um 85%, in Tat und Wahrheit kann aber die wirkliche Sauerstoffsättigung bereits viel tiefer liegen [
3]! Die rasche Erkennung einer Methämoglobinämie ist damit für den Patienten vital.
Methämoglobinämie
Wie erwähnt, liegt beim Methämoglobin das Eisen in oxidierter, dreiwertiger Form vor. Zwischen oxidiertem und reduziertem Hämoglobin besteht ein Gleichgewicht, das durch externe Faktoren beeinflusst werden kann. Vermehrtes Methämoglobin entsteht entweder durch verminderter Eisenreduktion (Reduktasemangel) oder vermehrte Eisenoxidation, letzteres bedingt einerseits durch Oxidation bei Intoxikationen oder durch erhöhter Oxidationsbereitschaft des Hämoglobins (
Figure 2). Als Enzymmangel sei der NADH-Methämoglobin-Reduktase-Mangel erwähnt. Eine erhöhte Oxidationsbereitschaft besteht bei der autosomal-dominant vererbten Hämoglobinopathie M, die sich als hämolytische Anämie oder Methämoglobinämie präsentieren kann [
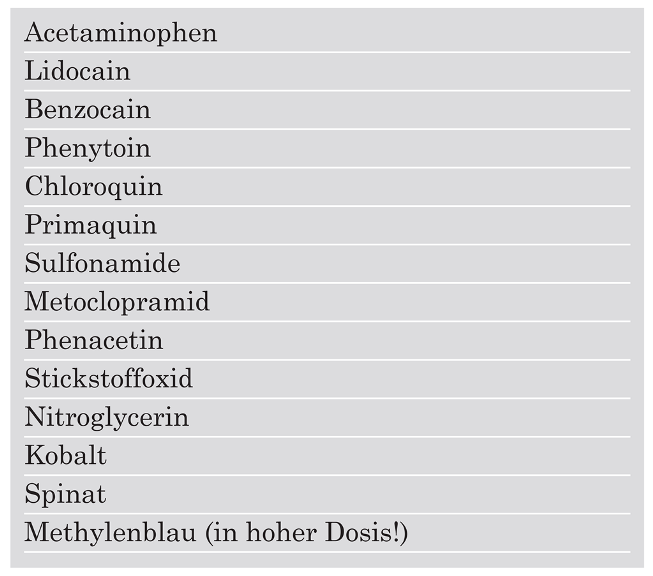
14]. Für eine toxische Methämoglobinbildung können eine ganze Reihe von Substanzen verantwortlich sein (
Table 1), unter anderem zählen dazu auch die Lokalanästhetika. Die Inzidenz der Benzocain-induzierten Methämoglobinämie nach Rachenanästhesie liegt in einer Serie von 4336 Patienten der Cleveland Clinic bei 0,115% [
15]. Prädisponierende Faktoren für die Entwicklung einer Methämoglobinämie sind unter anderem die erwähnten Substanzen der Tabelle 1, hohes Alter, Sepsis, Verletzungen der oropharyngealen Schleimhaut, Hypoxie und Malnutrition.
Von einer Methämoglobinämie wird gesprochen, wenn der Anteil des Methämoglobins über 1% des Gesamthämoglobins beträgt; Symptome treten ab einer Menge von 10% des Gesamthämoglobins. Mit steigendem Anteil des Methämoglobins kommt es zu Hautveränderungen, Tachykardie, Dyspnoe, Somnolenz, Koma und Tod (
Table 2).
Die Diagnose wird durch die Bestimmung des Methämoglobins in der Blutgasanalyse gestellt. Klinisch imponiert bei der Blutentnahme das charakteristische schokoladefarbene Blut.
Nach Gabe von Sauerstoff richtet sich die Therapie der akuten Methämoglobinämie nach der Klinik und der Ausprägung der Methämoglobinämie [
15]. Bei symptomatischen Patienten oder einem Methämoglobin-Anteil ab 30% ist die Gabe von Methylenblau indiziert (1 mg/kgKG in 1prozentiger Lösung i.v. über 5 Minuten; Wiederholung bis zu einer kumulativen Gesamtdosis von max. 5 mg/kgKG) [
16]. Vorsicht ist geboten bei einem Glukose6-Phosphat-Dehydrogenasemangel [
17]. Bei fehlendem Ansprechen und schwerer Methämoglobinämie kann, falls verfügbar, hyperbarer Sauerstoff verabreicht werden. Asymptomatische Patienten sollen überwacht und der Methämoglobin-Gehalt bis zum deutlichen Abfall stündlich bestimmt werden (Normalisierung meist innert 24–72 Stunden).
Schlussfolgerung (Figure 3)
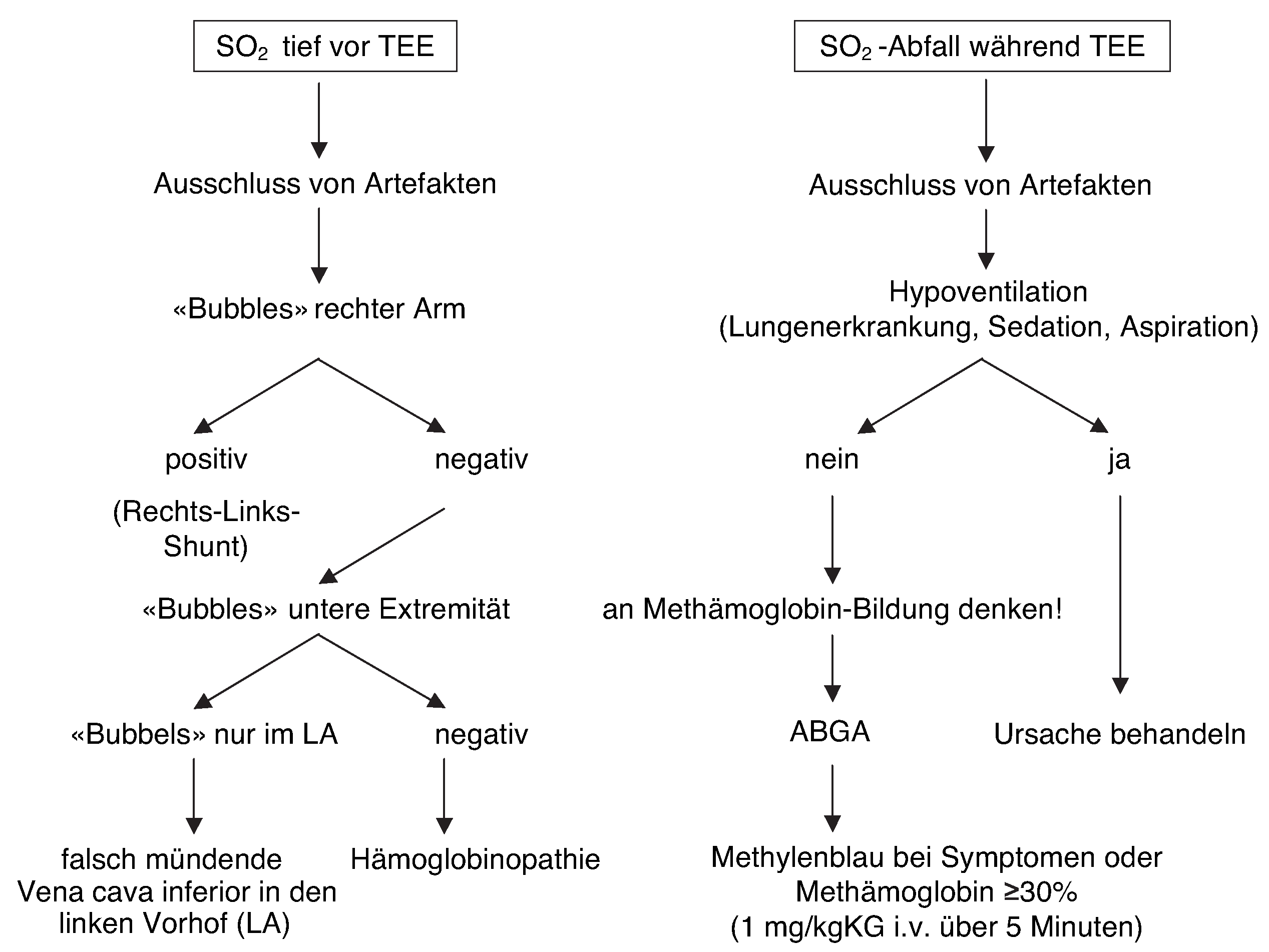
Bei mittels Pulsoxymeter gemessener tiefer Sauerstoffsättigung vor Beginn einer transösophagealen Echokardiographie muss nach Ausschluss von Artefakten und Hypoventilation ein Rechts-Links-Shunt gesucht werden. Findet sich kein Shunt, so ist eine Hämoglobinopathie möglich.
Bei Abfall der gemessenen Sauerstoffsättigung nach der Rachenanästhesie ist eine toxisch bedingte Methämoglobin-Bildung möglich. Typischerweise liegt die vom Pulsoxymeter gemessene Sättigung bei 85%, wobei die wahre Sauerstoffsättigung viel tiefer liegenkann. Bei symptomatischen Patienten oder einem Methämoglobin-Anteil ab 30% ist die Therapie der Wahl die unverzügliche Gabe von Methylenblau.
Figure 3.
Abklärungsbaum bei pathologischer SO2 vor und während TEE-Untersuchung
Figure 3.
Abklärungsbaum bei pathologischer SO2 vor und während TEE-Untersuchung