Approche de L’insuffisance Cardiaque Terminale dans la Perspective d’une Transplantation
Résumé
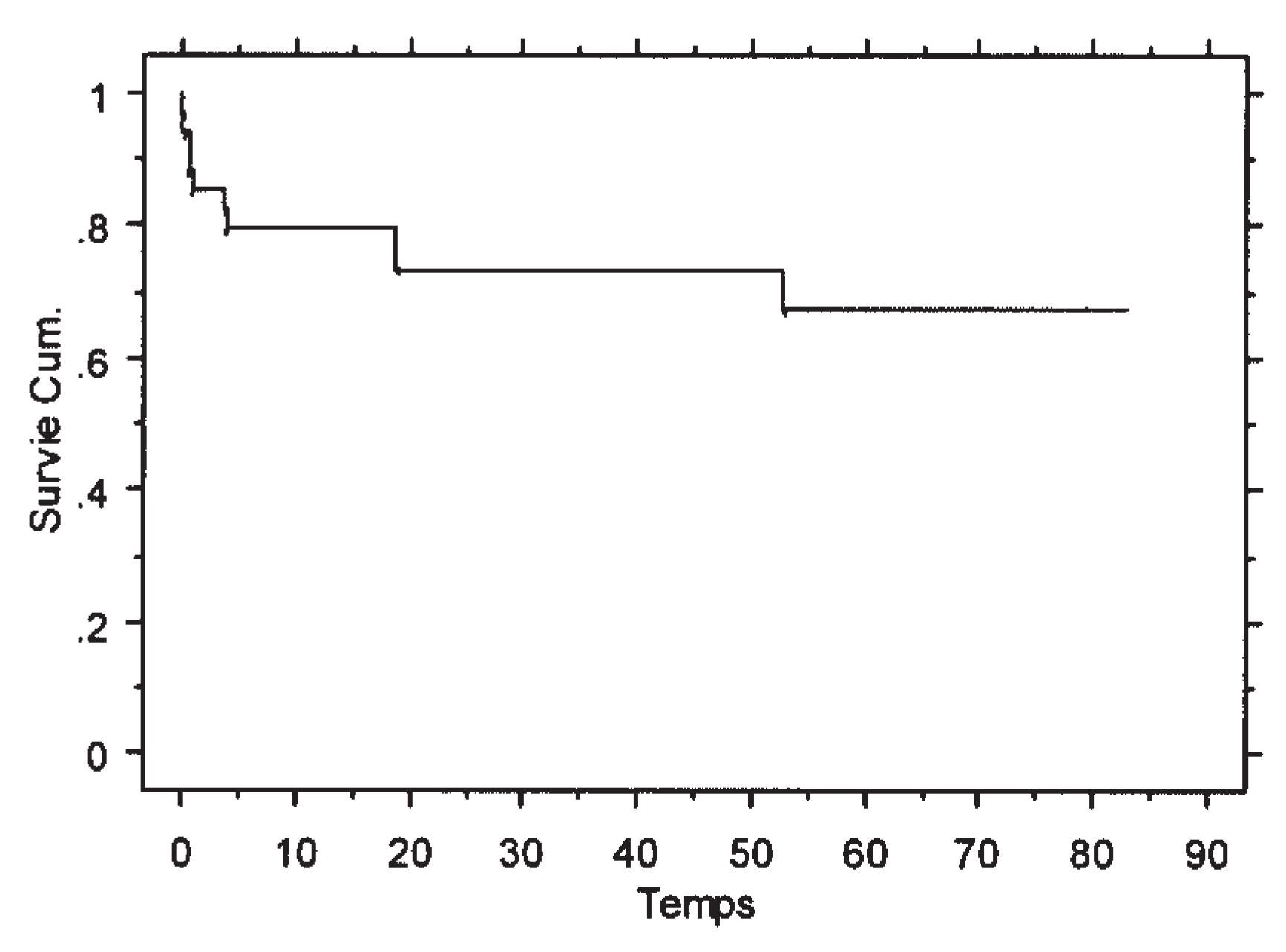
 |
Introduction
Complémentarité
Evolution constante
Stratégie générale de prise en charge de l’insuffisance cardiaque terminale (ICT)
- -
- une mise en liste de transplantation immédiate, avec mention d’urgence ou non
- -
- une surveillance hors liste. L’idée est de transplanter le plus tard possible, puisque la transplantation est associée à une morbidité et une mortalité initiales significatives (10–15% de mortalité à un an) et que les résultats à long terme sont imparfaits (de l’ordre de 50% de survie à 10 ans) [1].
- -
- un pont à la transplantation (bridge to transplant): pont électrique avec un défibrillateur implantable ou pont mécanique avec une assistance uni- ou bi-ventriculaire.
- -
- une alternative à la transplantation: l’utilisation d’une assistance ventriculaire comme thérapie définitive (destination therapy).
Les techniques à disposition
- -
- -
- -
- la spironolactone à 25 mg/j [14]
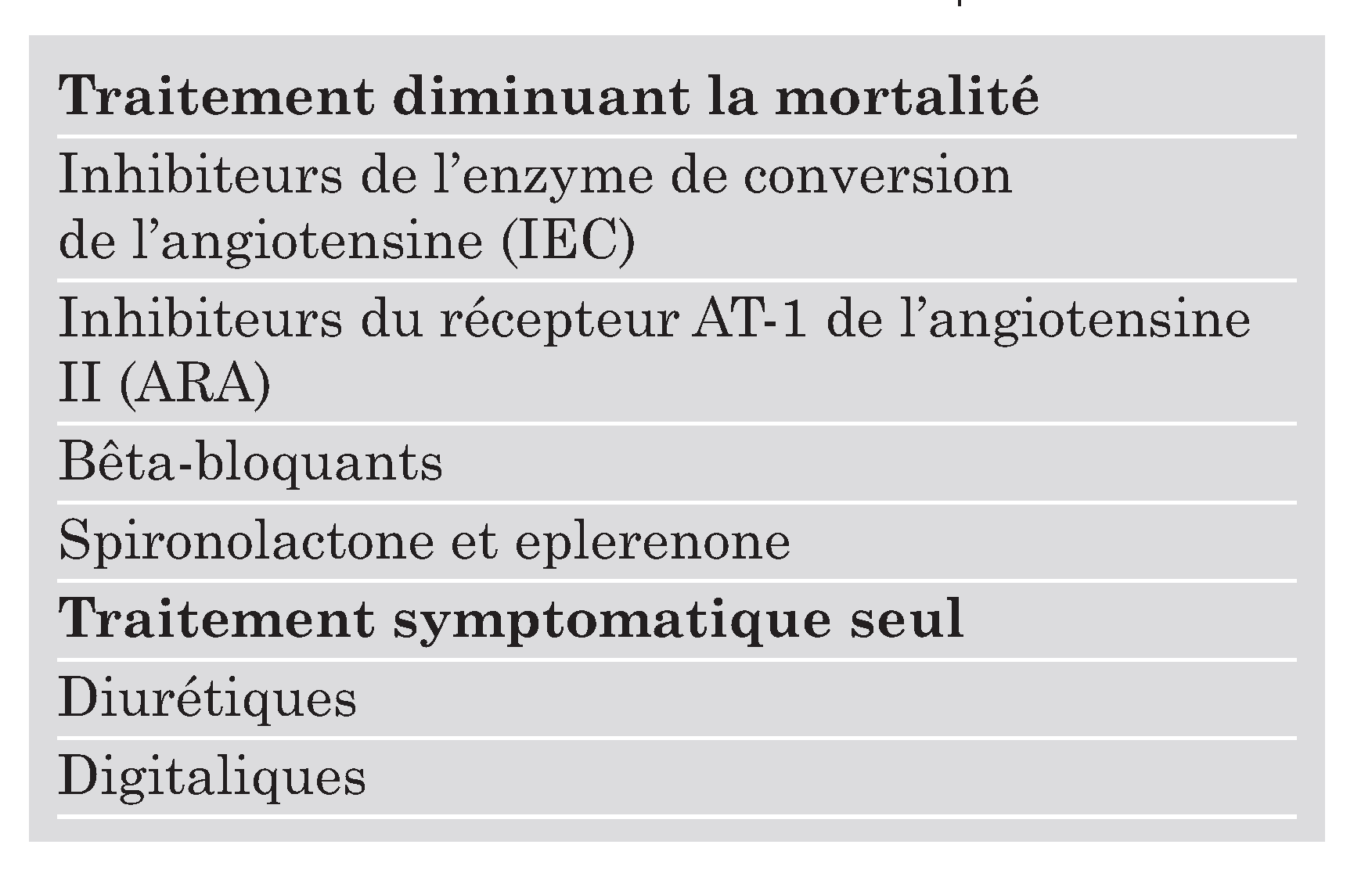 |
 |
Quelques paramètres de classification
 |
Conclusion et implications pour la pratique
References
- Hertz, M.I.; Taylor, D.O.; Trulock, E.P.; et al. The registry of the International Society for Heart and Lung Transplantation: Nineteenth Official Report – 2002. J Heart Lung Transplant 2002, 21, 950–970. [Google Scholar] [CrossRef]
- The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991, 325, 293–302. [Google Scholar] [CrossRef]
- Cohn, J.N.; Johnson, G.; Ziesche, S.; et al. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991, 325, 303–310. [Google Scholar] [CrossRef]
- CIBIS-II Investigators and Committees. The cardiac insufficiency bisoprolol study II (CIBIS-II): a randomized trial. Lancet 1999, 353, 9–13. [Google Scholar] [CrossRef]
- Hjalmarson, A.; Goldstein, S.; Fagerberg, B.; Wedel, H.; Waagstein, F.; Kjekshus, J.; et al. for the MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999, 353, 2001–2007. [Google Scholar]
- Packer, M.; Bristow, M.R.; Cohn, J.N.; Colucci, W.S.; Fowler, M.B.; Gilbert, E.M.; et al. for the U.S. Carvedilol Heart Failure Study Group. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med 1996, 334, 1349–1355. [Google Scholar] [CrossRef] [PubMed]
- The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987, 316, 1429–1435. [Google Scholar] [CrossRef] [PubMed]
- Mancini, D.M.; Eisen, H.; Kussmaul, W.; Mull, R.; Edmunds, L.H.; Wilson, J.R. Values of peak exercise oxygen consumption for optimal timing of cardiac transplantation in ambulatory patients with heart failure. Circulation 1991, 83, 778–786. [Google Scholar] [CrossRef]
- Aaronson, K.D.; Schwartz, J.S.; Chen, T.M.; Wong, K.L.; Goin, J.E.; Mancini, D.M. Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation. Circulation 1997, 95, 2660–2667. [Google Scholar] [CrossRef]
- Pfeffer, M.A.; Braunwald, E.; Moye, L.A.; Basta, L.; Brown EJJr Cuddy, T.E.; et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. N Engl J Med 1992, 327, 669–677. [Google Scholar] [CrossRef]
- Hjalmarson, A.; Goldstein, S.; Fagerberg, B.; Wedel, H.; Waagstein, F.; Kjekshus, J.; et al. for the MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999, 353, 2001–2007. [Google Scholar]
- CIBIS-II Investigators and Committees. The cardiac insufficiency bisoprolol study II (CIBIS-II): a randomized trial. Lancet 1999, 353, 9–13. [Google Scholar] [CrossRef]
- Packer, M.; Coats, A.J.; Fowler, M.B.; Katus, H.A.; Krum, H.; Mohasci, P.; et al. for the Carvedilol Prospective Randomized Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med 2001, 344, 1651–1658. [Google Scholar] [CrossRef] [PubMed]
- Pitt, B.; Zannad, F.; Remme, W.J.; Cody, R.; Castaigne, A.; Perez, A.; et al. for the Randomized Aldactone Evaluation Study Investigators. The effects of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med 2000, 341, 709–717. [Google Scholar] [CrossRef] [PubMed]
- Cohn, J.N.; Tognoni, G. A randomized trial of the angiotensinreceptor blocker valsartan in chronic heart failure. N Engl J Med 2001, 345, 1667–1675. [Google Scholar] [CrossRef] [PubMed]
- Granger, C.B.; McMurray, J.; Yusuf, S.; Held, P.; Michelson, E.L.; Olofsson, B.; et al. for the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left ventricular systolic function intolerant to angiotensin converting enzyme inhibitors: The CHARM-alternative trial. Lancet 2003, 362, 772–776. [Google Scholar] [CrossRef]
- The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997, 336, 525–533. [Google Scholar] [CrossRef]
- Grimm, W.; Alter, P.; Maisch, B. Arrhythmia risk stratification with regard to prophylactic implantable defibrillator therapy in patients with dilated cardiomyopathy Results of MACAS, DEFINITE and SCD-HeFT. Herz 2004, 29, 348–352. [Google Scholar] [CrossRef]
- McKelvie, R.S.; Yusuf, S.; Pericak, D.; Avezum, A.; Burns, R.J.; Probstfield, J.; et al. Comparison of candesartan, enalapril and their combination in congestive heart failure: randomized evaluation of strategies for left ventricular dysfunction (RESOLVD) pilot study. Circulation 1999, 100, 1056–1064. [Google Scholar] [CrossRef]
- Cohn, J.N.; Tognoni, G. A randomized trial of the angiotensinreceptor blocker valsartan in chronic heart failure. N Engl J Med 2001, 345, 1667–1675. [Google Scholar] [CrossRef]
- McMurray, J.J.; Ostergren, J.; Swedberg, K. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet 2003, 362, 767–771. [Google Scholar] [CrossRef]
- Pitt, B.; Remme, W.; Zannad, F.; Neaton, J.; Martinez, F.; Roniker, B.; Bittman, R.; et al. for the Eplerenone Post–Acute Myocardial Infarction Heart Failure Efficacy and Survival Study Investigators. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003, 348, 1309–1321. [Google Scholar] [CrossRef] [PubMed]
- Farwell, D.; Patel, N.R.; Hall, A.; Ralph, S.; Sulke, A.N. How many people with heart failure are appropriate for biventricular resynchronization? Eur Heart J 2000, 21, 1246–1250. [Google Scholar] [CrossRef] [PubMed]
- Grines, C.L.; Bashore, T.M.; Boudoulas, H.; Olson, S.; Shafer, P.; Wooley, C.F. Functional abnormalities in isolated left bundle branch block. The effect of interventricular asynchrony. Circulation 1989, 79, 845–853. [Google Scholar] [CrossRef] [PubMed]
- Cazeau, S.; Leclercq, C.; Lavergne, T.; et al. Effects of multisite biventricular pacing in patients with heart failure and interventricular conduction delay. N Engl J Med 2001, 344, 873–80. [Google Scholar] [CrossRef]
- Abraham, W.T.; Fisher, W.G.; Smith, A.L.; Delurgio, D.B.; Leon, A.R.; Loh, E.; et al. MIRACLE Study Group. Multicenter InSync Randomized Clinical Evaluation. Cardiac resynchronization in chronic heart failure. N Engl J Med 2002, 346, 1845–1853. [Google Scholar] [CrossRef]
- Cleland, J.G.; Daubert, J.C.; Erdmann, E.; Freemantle, N.; Gras, D.; Kappenberger, L.; et al. on behalf of the CARE-HF study Steering Committee and Invetigators. The CARE-HF study (CArdiac REsynchronisation in Heart Failure study): rationale, design and end-points. Eur J Heart Fail 2001, 3, 481–489.
- Bristow, M.R.; Saxon, L.A.; Boehmer, J.; Krueger, S.; Kass, D.A.; De Marco, T.; et al. for the Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac-resynchronisation therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004, 350, 2140–2150. [Google Scholar] [CrossRef]
- The antiarrhythmics versus implantable defibrillators (AVID) investigators. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med 1997, 337, 1576–1583. [Google Scholar] [CrossRef]
- Moss, A.J.; Zareba, W.; Hall, W.J.; Klein, H.; Wilber, D.J.; Cannom, D.S.; et al. for the Multicenter Automatic Defibrillator Implantation Trial II Investigators. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002, 346, 877–883. [Google Scholar] [CrossRef]
- Greenberg, H.; Case, R.B.; Moss, A.J.; et al. Analysis of mortality events in the Multicenter Automatic Defibrillator Implantation Trial (MADIT-II). J Am Coll Cardiol 2004, 43, 1459–1465. [Google Scholar] [CrossRef] [PubMed]
- Strickberger, S.A.; Hummel, J.D.; Bartlett, T.G.; et al. Amiodarone versus implantable cardioverter-defibrillator:randomized trial in patients with non-ischemic dilated cardiomyopathy and asymptomatic non-sustained ventricular tachycardia-AMIOVIRT. J Am Coll Cardiol 2003, 41, 1707–1712. [Google Scholar] [CrossRef] [PubMed]
- Fonarow, G.C.; Feliciano, Z.; Boyle, N.G.; et al. Improved survival in patients with nonischemic advanced heart failure and syncope treated with an implantable cardioverter-defibrillator. Am J Cardiol 2000, 85, 981–985. [Google Scholar] [CrossRef] [PubMed]
- Kadish, A.; Dyer, A.; Daubert, J.P.; Quigg, R.; Estes, N.A.M.; Anderson, K.P.; et al. for the Defibrillators in Non-Ischemic Cardiomyopathy Treatment Evaluation (DEFINITE) Investigators. Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med 2004, 350, 2151–2158. [Google Scholar] [CrossRef]
- Klein, H.; Auricchio, A.; Reek, S.; Geller, C. New primary prevention trials of sudden cardiac death in patients with left ventricular dysfunction: SCD-HeFT and MADIT-II. Am J Cardiol 1999, 83, 91–97D. [Google Scholar] [CrossRef]
- Grimm, W.; Alter, P.; Maisch, B. Arrhythmia risk stratification with regard to prophylactic implantable defibrillator therapy in patients with dilated cardiomyopathy Results of MACAS, DEFINITE and SCD-HeFT. Herz 2004, 29, 348–352. [Google Scholar] [CrossRef]
- Wilkoff, B.L.; Cook, J.R.; Epstein, A.E.; et al. Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA 2002, 288, 3115–3123. [Google Scholar]
- Sweeney, M.O.; Hellkamp, A.S.; Ellenbogen, K.A.; et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation 2003, 107, 2932–2937. [Google Scholar] [CrossRef]
- Frazier, O.H.; Rose, E.A.; Oz, M.C.; Dembitsky, W.; McCarthy, P.; Radovancevic, B.; et al. Multicenter clinical evaluation of the HeartMate vented electric left ventricular assist system in patients awaiting heart transplantation. J Thorac Cardiovasc Surg 2001, 122, 1186–1195. [Google Scholar] [CrossRef]
- Levin, H.R.; Oz, M.C.; Chen, J.M.; Packer, M.; Rose, E.A.; Burkhoff, D. Reversal of chronic ventricular dilation in patients with end stage cardiomyopathy by prolonged mechanical offloading. Circulation 1995, 91, 2717–2720. [Google Scholar] [CrossRef]
- Frazier, O.H.; Benedict, C.R.; Radovancevic, B.; Bick, R.J.; Capek, P.; Springer, W.E.; et al. Improved left ventricular function after chronic left ventricular unloading. Ann Thorac Surg 1996, 62, 675–682. [Google Scholar] [CrossRef]
- Rose, E.A.; Gelijns, A.C.; Moskowitz, A.J.; et al. Long-term use of a left ventricular assist device for end-stage heart failure. N Engl J Med 2001, 345, 1435–1443. [Google Scholar] [CrossRef]
- Sin, D.D.; Fitzgerald, F.; Parker, J.D.; et al. Risk factors for central and obstructive sleep apnea in 450 men and women with congestive heart failure. Am J Respir Crit Care Med 1999, 160, 1101–1106. [Google Scholar] [CrossRef] [PubMed]
- Bradley, T.D.; Floras, J.S. Sleep Apnea and Heart Failure: Part II: Central sleep apnea. Circulation 2003, 107, 1822–1826. [Google Scholar] [CrossRef] [PubMed]
- Lanfranchi, P.A.; Braghiroli, A.; Bosimini, E.; et al. Prognostic value of nocturnal Cheyne-Stokes respiration in chronic heart failure. Circulation 1999, 99, 1435–1440. [Google Scholar] [CrossRef] [PubMed]
- Sin, D.D.; Logan, A.G.; Fitzgerald, F.S.; et al. Effects of continuous positive airway pressure on cardiovascular outcomes in heart failure patients with and without Cheyne-Stokes respiration. Circulation 2000, 102, 61–66. [Google Scholar] [CrossRef]
- Bradley, T.D.; Floras, J.S. Sleep Apnea and Heart Failure: Part I: Obstructive sleep apnea. Circulation 2003, 107, 1671–1678. [Google Scholar] [CrossRef]
- Kaneko, Y.; Floras, J.S.; Kengo, D.P.; et al. Cardiovascular effects of continuous positive airway pressure in patients with heart failure and obstructive sleep apnea. N Engl J Med 2003, 348, 1233–1241. [Google Scholar] [CrossRef]
- Thohan, V. Prognostic implications of echocardiography in advanced heart failure. Curr Opin Cardiol 2004, 19, 238–249. [Google Scholar] [CrossRef]
- De Groote, P.; Millaire, A.; Foucher-Hossein, C.; et al. Right ventricular ejection fraction is an independent predictor of survival in patients with moderate heart failure. J Am Coll Cardiol 1998, 32, 948–954. [Google Scholar] [CrossRef]
- Ghio, S.; Gavazzi, A.; Campana, C.; et al. Independent and additive prognostic value of right ventricular systolic function and pulmonary artery pressure in patients with chronic heart failure. J Am Coll Cardiol 2001, 37, 183–188. [Google Scholar] [CrossRef]
- Xie, G.Y.; Berk, M.R.; Smith, M.D.; et al. Prognostic value of Doppler transmitral flow patterns in patients with congestive heart failure. J Am Coll Cardiol 1994, 24, 132–139. [Google Scholar] [CrossRef]
- Temporelli, P.L.; Corra, U.; Imparato, A.; et al. Reversible restrictive left ventricular diastolic filling with optimized oral therapy predicts a more favorable prognosis in patients with chronic heart failure. J Am Coll Cardiol 1998, 31, 1591–1597. [Google Scholar] [CrossRef]
- Hansen, A.; Haass, M.; Zugck, C.; et al. Prognostic value of Doppler echocardiographic mitral inflow patterns: implications for risk stratification in patients with chronic congestive heart failure. J Am Coll Cardiol 2001, 37, 1049–1055. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Lee, T.H.; Hamilton, M.A.; Stevenson, L.W.; et al. Impact of left ventricular cavity size on survival in advanced heart failure. Am J Cardiol 1993, 72, 672–676. [Google Scholar] [CrossRef] [PubMed]
- Peterson, L.R.; Schechtman, K.B.; Ewald, G.A.; Geltman, E.M.; de las Fuentes, L.; Meyer, T.; et al. Timing of cardiac transplantation in patients with heart failure receiving b-adrenergic blockers. J Heart Lung Transplant 2003, 22, 1141–1148. [Google Scholar] [CrossRef] [PubMed]
- Bittner, V.; Weiner, D.H.; Yusuf, S.; et al. Predicton of mortaliy and morbidity with a 6-minute walk test in patients with left ventricular dysfunction. JAMA 1986, 270, 1702–1707. [Google Scholar] [CrossRef]
- Shah, M.R.; Hasselblad, V.; Gheorghiade, M. Prognostic usefulness of the six-minute walk test in patients with advanced congestive heart failure secondary to ischemic or nonischemic cardiomyopathy. Am J Cardiol 2001, 88, 987–993. [Google Scholar] [CrossRef]
- Maisel, A.S.; Krishnaswamy, P.; Nowak, R.M.; et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med 2002, 347, 161–167. [Google Scholar] [CrossRef]
- Maeda, K.; Tsutamoto, T.; Wada, A.; et al. High levels of plasma brain natriuretic peptide and interleukin-6 after optimized treatment for heart failure are independent risk factors for morbidity and mortality in patients with congestive heart failure. J Am Coll Cardiol 2000, 36, 1587–1593. [Google Scholar] [CrossRef]
- Richards AM, Doughty R, Nicholls MG, et al, for the Australian-New Zealand Heart Failure Group Neurohumoral prediction of benefit from carvedilol in ischemic left ventricular dysfunction. Circulation 1999, 99, 786–792. [Google Scholar] [CrossRef][Green Version]
- Koglin, J.; Pehlivanli, S.; Schwaiblmair, M.; et al. Role of brain natriuretic peptide in risk stratification of patients with congestive heart failure. J Am Coll Cardiol 2001, 38, 1934–1941. [Google Scholar] [CrossRef]
© 2005 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Schnetzler, B.; Reverdin, S.; Sunthorn, H.; Kalangos, A.; Sigwart, U. Approche de L’insuffisance Cardiaque Terminale dans la Perspective d’une Transplantation. Cardiovasc. Med. 2005, 8, 228. https://doi.org/10.4414/cvm.2005.01112
Schnetzler B, Reverdin S, Sunthorn H, Kalangos A, Sigwart U. Approche de L’insuffisance Cardiaque Terminale dans la Perspective d’une Transplantation. Cardiovascular Medicine. 2005; 8(6):228. https://doi.org/10.4414/cvm.2005.01112
Chicago/Turabian StyleSchnetzler, Bruno, Stéphane Reverdin, Henri Sunthorn, Afksendiyos Kalangos, and Ulrich Sigwart. 2005. "Approche de L’insuffisance Cardiaque Terminale dans la Perspective d’une Transplantation" Cardiovascular Medicine 8, no. 6: 228. https://doi.org/10.4414/cvm.2005.01112
APA StyleSchnetzler, B., Reverdin, S., Sunthorn, H., Kalangos, A., & Sigwart, U. (2005). Approche de L’insuffisance Cardiaque Terminale dans la Perspective d’une Transplantation. Cardiovascular Medicine, 8(6), 228. https://doi.org/10.4414/cvm.2005.01112




