Zusammenfassung
Aspirin ist der Hauptpfeiler der thrombozytenaggregationshemmenden Behandlung bei Patienten mit hohem Risiko für kardiovaskuläre atherothrombotische Ereignisse, und der vorteilhafte Effekt ist in mehrfachen klinischen Studien zweifelsfrei dokumentiert worden. Dennoch ist die Effektivität von Aspirin in Frage gestellt worden, nachdem das Konzept der «Aspirin-Resistenz» formuliert worden war. Dieses Phänomen, obschon ohne präzise Definition, weist auf die Tatsache hin, dass sich bei einigen Patienten die erwartete Thrombozyten-Hemmung nicht nachweisen lässt, wenn die Thrombozyten-Funktion mittels verschiedener Tests gemessen wird. In der vorliegenden Übersichtsarbeit werden die verschiedenen Methoden der Messung der Aspirin-Resistenz evaluiert.
Die vorliegende Evidenz bezüglich der Prävalenz und der klinischen Bedeutung des Phänomens wird diskutiert und die möglichen Mechanismen, welche der Aspirin-Resistenz zugrunde liegen, werden erläutert.
Key words: Aspirin; Thrombozytenhemmer; Aspirin-Resistenz; Azetylsalizylsäure; Thrombozyten-Aggregation
Einleitung
Bereits seit mehreren Jahrzehnten ist Aspirin weltweit das am meisten verschriebene antithrombotische Arzneimittel. Die Effektivität von Aspirin sowohl in der primären als auch in der sekundären Prävention der kardiovaskulären thrombotischen Erkrankung ist hervorragend dokumentiert [
1]. Dennoch erleiden Patienten atherothrombotische Ereignisse trotz scheinbar adäquater Behandlung. Studien aus dem Laboratorium haben gezeigt, dass Thrombozyten einen äusserst variablen Effekt auf die Aspirin-Behandlung haben, und ein beachtlicher Anteil aller Aspirin-behandelten Patienten präsentiert sogar eine normale Thrombozyten-Funktion. Aufgrund dieser Funde entstand das Konzept der «Aspirin-Resistenz», im englischen Sprachraum auch «Aspirin non-responsiveness» genannt. Obschon dieses Paradigma bedeutendes wissenschaftliches Interesse erweckte, verblieb die klinische Anwendbarkeit beschränkt.
Aus therapeutischer Sicht ist die wichtigste Frage diejenige, ob die Aspirin-Resistenz (AR) mit «Durchbrüchen» atherothrombotischer Ereignisse korreliert ist, oder diese sogar voraussagen kann. Das Ziel dieser Übersichtsarbeit ist es, die vorliegende Evidenz zu diskutieren, welche sich hauptsächlich mit folgenden Fragestellungen befasst: (1.) Der Definition der AR, (2.) den Methoden, welche geeignet sind, den Aspirin-Effekt zu messen, (3.) der Prävalenz der AR in verschiedenen Patientenpopulationen, (4.) der klinischen Bedeutung der AR, und schliesslich (5.) den möglichen Mechanismen, welche der AR zugrunde liegen.
Definition
AR ist ein Phänomen, welches auf keiner breit akzeptierten Definition beruht (
Table 1). Aus therapeutischer Sicht ist die relevanteste Definition diejenige, welche einer klinischen Fragestellung entspringt, nämlich dem Unvermögen von Aspirin, gegen ischämische Ereignisse zu beschützen.
Tatsächlich erfährt trotz langfristiger Aspirin-Behandlung durchschnittlich einer von acht Patienten ein ischämisches Ereignis. Die Frage, die sich stellt, ist, ob diese Ereignisse ganz oder teilweise das Resultat eines fehlenden oder verminderten Effekts von Aspirin ist. Deshalb sollte die Definition der AR auf reproduzierbaren biochemischen und/ oder funktionellen In-vitro-Tests beruhen, und diese sollten mit der Vorbeugung klinischer ischämischer Ereignisse relatiert und verwendbar gemacht werden. Aspirin wirkt durch die irreversible Azetylierung der Serin-529-Aminosäure beim aktiven Komplex des Cyclooxygenase-1(COX-1)-Enzyms. Dadurch wird verhindert, dass COX-1 die Umwandlung von Arachidonsäure zu Thromboxan-A2 (TXA2), Prostazyklin und anderen Prostaglandinen katalysiert. TXA2 ist ein potenter Thrombozyten-Agonist, welcher die Aggregation von Blutplättchen induziert. Die Laboratoriums-Definition der AR kann nun auf verschiedene Art angegriffen werden. Wong et al. haben vorgeschlagen, den Begriff der AR einzuteilen in «Versagen des pharmakologischen Effekts von Aspirin» und «Versagen des Aspirins, die Thrombozytenaggregation zu verhindern» [
2]. «Pharmakologische AR» wurde demnach definiert als persistierende TXA2-Produktion trotz Aspirin-Behandlung, und der entsprechende Parameter ist die Messung von TXA2-Metaboliten im Serum und/oder Urin. «Funktionelle AR» hingegen ist das Unvermögen des Aspirins, die Thrombozytenaktivierung und/ oder -aggregation zu verhindern (
Table 1). Es ist logisch anzunehmen, dass das Vorliegen der pharmakologischen AR assoziiert ist mit dem persistierenden Vermögen der Thrombozyten zu aggregieren, und vice versa. Indessen können Thrombozyten durch TXA2-unabhängige Mechanismen aktiviert werden und deshalb ist die funktionelle AR möglich, selbst wenn die pharmakologische AR nicht nachweisbar ist. Weber et al. identifizierten 3 Typen der AR [
3]: In der AR Typ 1 ist das perorale Aspirin ineffektiv, während die
In-
vitro-Gabe von Aspirin in der erwarteten Inhibition sowohl der TXA2-Synthese als auch der Thrombozytenaggregation resultiert («reversible AR»). Patienten mit der AR Typ 2 antworten weder auf erhöhte perorale Aspirin-Dosen noch auf die In-vitro-Gabe von Aspirin («irreversible» AR). In der AR Typ 3 ist schliesslich die Thrombozytenaggregation induzierbar trotz kompletter Inhibition der TXA2-Formation («Pseudo»-AR;
Table 1).
Es wird deutlich, dass die kardiovaskuläre Gemeinschaft gut beraten wäre, einen international akzeptierten Konsensus zu erarbeiten, welcher die AR zweifelsfrei definiert. Unserer eigenen Ansicht nach sollte der Begriff «klinische AR» vermieden und—entsprechend dem Vorschlag von Patrono [
4]—durch die Umschreibung «Behandlungsversagen» ersetzt werden, da die Mechanismen der «atherothrombotischen Durchbrüche» aller Wahrscheinlichkeit nach mulifaktoriell sind. Die Definitionen, welche Wong et al. [
2] und Weber et al. [
3] vorgeschlagen haben, könnten mit Vorteil in einer gemeinsamen, allumfassenden Definition kombiniert werden (
Table 2). In der Tat finden wir die Klassifikation der AR in «irreversibel« oder «reversibel» wichtig, und zwar entweder spontan, nach Erhöhung der Dosis oder nach
In-
vitro-Zugabe von Aspirin. Diese Unterscheidung ist von grosser Bedeutung, da die Mechanismen, welche den beiden Zuständen zugrunde liegen wie auch die potentiellen Behandlungsmöglichkeiten, unterschiedlich sein könnten. Im weiteren wäre es möglich, die AR quasi semi-quantitativ in Aspirin «non-response» (kein messbarer Anti-Thrombozyten-Effekt) und «low-response» (verminderter Anti-Thrombozyten-Effekt) zu unterteilen. Diese Klassifikation sollte aufgrund von Messungen der Thrombozytenfunktion sowohl vor als auch unter Aspirin-Therapie vorgenommen werden.
Labormethoden zur Messung des Thrombozyten-hemmenden Effekts von Aspirin
Ein Konsensus hinsichtlich der besten Methode existiert nicht. Die gebräuchlichen In-vitro-Tests können in Methoden eingeteilt werden, welche die Fähigkeit von Aspirin, die TXA2-Synthese zu suprimieren, messen, und Tests, welche spezifisch verschiedene Phasen der Thrombozytenfunktion messen, wie beispielsweise Thrombozytenadhäsion, Thrombozytenaktivierung oder Thrombozytenaggregation. Der einzige erhältliche In-vivo-Test ist die Messung der Blutungszeit.
Optische Thrombozytenaggregation
Die optische Thrombozytenaggregation mittels Thrombozyten-reichem Plasma ist die traditionelle Methode der Messung des Anti-Aggregationseffekts von Aspirin. Diese Methode misst die Veränderungen der Lichttransmission durch die Plasmaprobe vor, während und nach induzierter Thrombozytenaggregation. Dieser Test ist eigentlich nicht physiologisch, da Thrombozyten einem sogenannten «lowshear stress» (niedrige Scher- oder Reibungskräfte) ausgesetzt sind, im Unterschied zu den «high-shear»-Bedingungen, welche in atherosklerotischen Arterien vorgefunden werden. Ausserdem werden die Thrombozyten nicht durch hämostatische Faktoren beeinflusst, welche beispielsweise von Erythrozyten oder Leukozyten in der Blutbahn ausgeschieden werden. Im weiteren kann die initiale Zentrifugierung eine Selektion von Thrombozyten mit sich führen, welche nicht repräsentativ ist für den gesammten Thrombozyten-Pool. Schliesslich ist die Durchfürung des Tests grossen subjektiven Variationen unterworfen: Einerseits werden wichtige Unterschiede hinsichtlich der Präparation des Thrombozytenreichen Plasmas in der Literatur rapportiert (Zentrifugierung und Standardisierung der Thrombozytenzählung), andererseits existieren beträchtliche Variationen hinsichtlich der Wahl des Agonisten. Dies ist besonders wichtig, da dokumentiert wurde, dass die Agonisten-Konzentration
per se die Prävalenz der AR beeinflussen kann [
5,
6]. Deshalb sollte bei allen Untersuchungen des Thrombozyten-inhibitorischen Effekts von Aspirin der Agonist und dessen Konzentration mit grösster Sorgfalt gewählt werden. Mehr spezifisch sollten Arachidonsäure, Kollagen, Epinephrin (Adrenalin) und niedrig-dosiertes Adenosin-Diphosphat (ADP) gewählt werden [
7,
8]. Schliesslich besteht weiterhin das Problem, dass eine etablierte Definition der AR bisher nicht zustande gekommen ist und tatsächlich sind in der Literatur verschiedene Definitionen gebraucht worden. Eine der Kontroversen in diesem Zusammenhang ist die Frage, ob die maximale, zeitunabhängige Aggregation als Ergebnis-Parameter gebraucht werden sollte oder diejenige Aggregation, welche nach einem fixierten Zeitintervall erreicht wird.
Zusammenfassend kann festgestellt werden, dass diese Unterschiede einen Vergleich der vorliegenden Daten äusserst schwierig macht.
Der Thrombozyten-FunktionsAnalyzer (PFA-100: Platelet Function Analyzer 100)
Das PFA-100-Instrument misst die primäre hämostatische Funktion in vitro [
9]. Im Gegensatz zur optischen Thrombozytenaggregation gebraucht die PFA-100-Methode Vollblut, und simuliert die «high-shear stress»-Bedingungen, welche in stenotischen Arterien vorkommen. Thrombozytenaggregation wird mittels zwei verschiedenen Testpatronen gemessen, die aus einer beschichteten Membran bestehen. Die erste Einheit ist mit 2 mg Kollagen und 10 mg Epinephrin (Adrenalin) beschichtet, die zweite mit 2 mg Kollagen und 50 μg ADP. Einzig die Kollagen-Epinephrin-Patrone kann zur Monitorisierung der Aspirin-Therapie gebraucht werden. Mittels einer Spritze wird mit Zitrat versetztes Vollblut unter hohen Scherkräften durch eine schmale Apertur in der Membran aspiriert. Das Zeitintervall, welches bis zur Okklusion der Apertur verstreicht, wird als «Verschlusszeit» («closure time») ausgedrückt und ist ein direkter Parameter der Thrombozytenfunktion. Auch auf diesem Gerät ist eine uniforme Definition der AR nicht etabliert worden und verschiedene Referenzwerte der Verschlusszeit im Bereich von 165–197 Sekunden sind als Cut-off der AR raportiert worden [
10,
11]. Wie
Table 3 zeigt, sind verschiedene Dosen des Aspirins erforscht worden. Kürzlich veröffentlichte Daten wiesen nach, dass die Resultate des PFA-100-Aspirindosis-abhängig sind. Dies mag die rapportierte Prävalenz der AR aus früheren Studien beeinflusst haben [
12]. Schliesslich ist bekannt, dass das Testresultat auch von der Konzentration des beigefügten Zitrats, welches die Koagulation der Blutprobe in der Spritze verhindert, beeinflusst werden kann [
13].
Der Ultegra-RPF-ASA-Test (Rapid Platelet Function Assay-ASA)
Der Ultegra-RPF («Rapid Platelet Function»)-Assay-ASA-Test ist vor allem innerhalb der Messung der Wirksamkeit der GP-IIb/IIIa-Antagonisten zum Einsatz gekommen. Einige Studien haben sich indessen auch der Messung des antithrombotischen Effekts von Aspirin gewidmet [
14,
15]. Die enstsprechenden Resultate werden in «Aspirin-Reaktionseinheiten» angegeben, wobei die beiliegende Firmeninformation den Wert von ≥550 als AR definiert.
Blutungszeit
Die Blutungszeit ist ein Test, welcher mit einer hohen Inter-Observator-Variabilität verbunden ist. Ausserdem hinterlässt er häufig Hautnarben. Aus diesen Gründen betrachten wir die Blutungszeit als obsolete Methode in Zusammenhang mit der wissenschaftlichen oder klinischen Erfassung der AR.
Thrombozytenaktivierung
Mittels der Fluss-Zytometrie ist es möglich, Marker zu messen, welche an der Oberfläche aktivierter Thrombozyten exprimiert werden. Im weiteren können Ausscheidungsprodukte von Thrombozyten sowie zirkulierende Thrombozytenaggregate erfasst werden. Nur wenige Studien haben indessen das Verhältnis zwischen dem Blutspiegel verschiedener Marker und dem Effekt von Aspirin-Behandlung untersucht [
16,
17] und keine dieser Studien hat sich spezifisch der Frage gewidmet, welche Blutwerte dieser verschiedenen Marker einen zufriedenstellenden Thrombozyten-hemmenden Effekt von Aspirin repräsentiert.
Thromboxan-A2 und seine Stoffwechselprodukte
Studien von gesunden Probanden und klinisch stabilen Patienten mit koronarer Herzkrankheit haben gezeigt, dass der Serumspiegel von TXB2, einem stabilen Stoffwechselprodukt von TXA2, signifikant (>95%) reduziert ist bei über 98% aller Personen, welche Aspirin einnehmen [
18,
19].
Dies kann dahingehend interpretiert werden, dass die pharmakologische AR bei Patienten mit stabiler kardiovaskulärer Erkrankung selten ist. Auf der anderen Seite wurde nachgewiesen, dass Patienten mit akutem Koronarsyndrom (AKS) eine unvollständige Inhibition der Thromboxan-Synthese haben [
20,
21]. Die TXA2-Synthese kann auch indirekt erfasst werden, nämlich durch die Messung der Urinkonzentration von 11-Dehydrothromboxan B2, einem anderen stabilen Stoffwechselprodukt von TXA2. Es ist wichtig zu betonen, dass verschienene Aspirin-Dosen sowohl die Serumals auch die Urinspiegel von TXA2-Syntheseprodukten beeinflussen können [
18]. Nur eine einzige Studie hat eine echte Definition der AR auf der Basis der TXA2-Syntheseprodukte vorgeschlagen [
22].
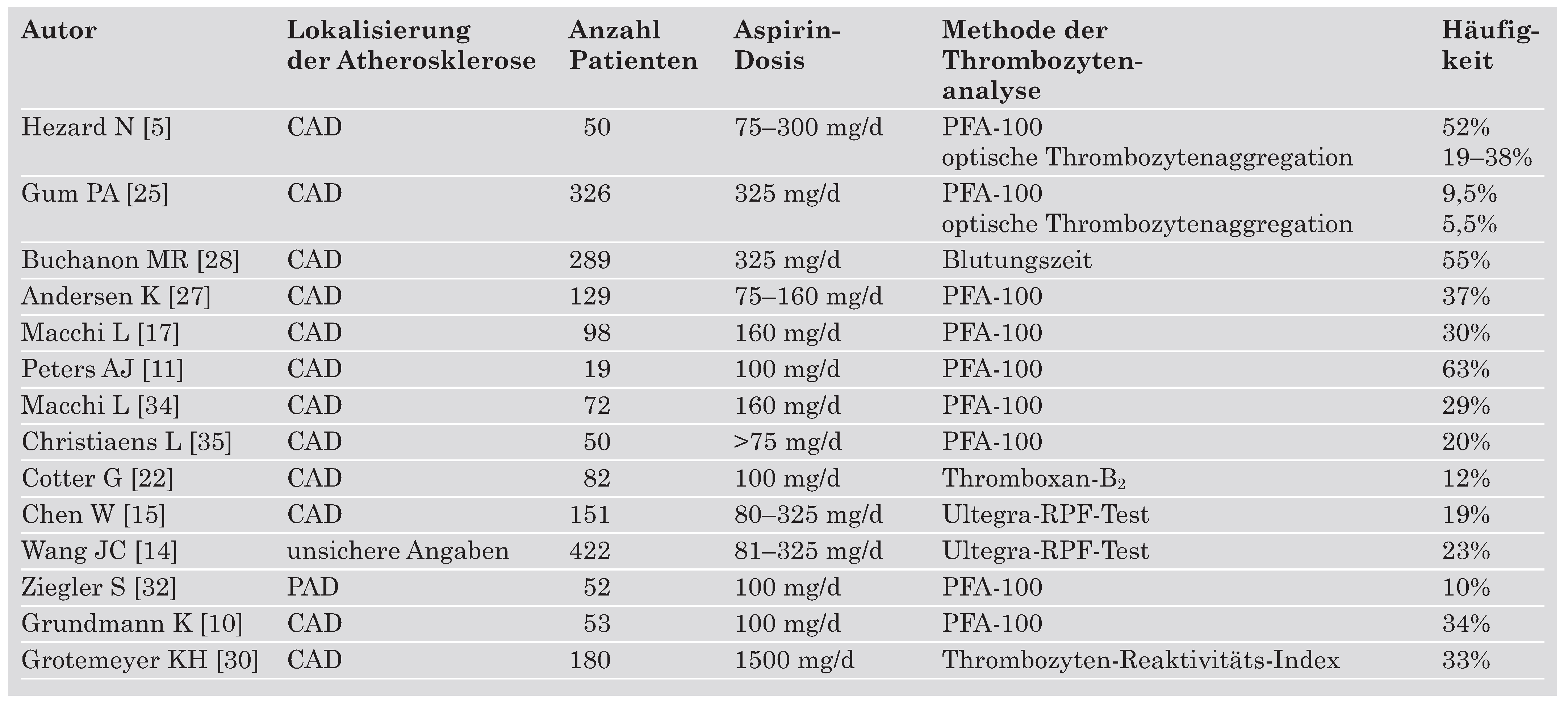
Die Prävalenz der Aspirin-Resistenz
AR wurde sowohl bei gesunden Probanden [
11,
23] als auch bei Patienten mit Atherosklerose nachgewiesen (
Table 3). Die rapportierten Häufigkeiten repräsentieren mit grosser Wahrscheinlichkeit eine Überschätzung der echten Prävalenz, da ein bedeutender Anteil der untersuchten Patienten eine AR aufgrund von fehlender Compliance haben könnte. Cotter und Mitarbeiter haben 73 Aspirin-behandelte Patienten mit durchgemachtem Myokardinfarkt (MI) untersucht [
22]. Aufgrund von TXB2-Messungen wurden die Patienten eingeteilt in supprimierte (n = 52)
versus erhaltene (n = 21) TXB2-Produktion. Die letztere Gruppe wurde kontaktiert und interviewt, und 12 Patienten bestätigten, dass sie die verschriebenen Aspirin-Tabletten nicht eingenommen hatten. Falls diese Resultate auf andere Populationen extrapoliert werden sollten, würde dies eine erhebliche Überschätzung der AR-Prävalenz bedeuten. Nur wenige Studien haben ausserdem untersucht, ob verschiedene Tests die Patienten gleichwertig in Aspirinresistente
versus Aspirin-sensitive einzuteilen vermögen. Gum et al. haben Patienten mit stabiler kardiovaskulärer Erkrankung mittels PFA-100 und optischer Thrombozytenaggregometrie undersucht [
24]. Es wurde eine schwache Übereinstimmung zwischen diesen beiden Methoden gefunden. Diese Resultate wurden durch Hezard et al. bestätigt, welche ebenfalls die PFA-100 mit der optischen Aggregometrie verglichen hatten [
5]. Malinin et al. haben die Effekte einer Aspirin-Einzeldosis bei Personen gemessen, welche ein hohes Risikoprofil hinsichtlich der Entwicklung einer koronaren Herzkrankheit hatten [
16]. Diese Forscher haben drei Methoden verglichen, nämlich die konventionelle Aggregometrie, die PFA-100- und die Ultegra-RPF-Methode. Der Vergleich resultierte in Korrelationen im Bereiche von 0,7337–0,8186. Es wurden indessen keine Informationen hinsichtlich der TestÜbereinstimmung präsentiert. Aufgrund dieses deutlichen Mangels von Übereinstimmungen zwischen verschiedenen Testmethoden scheinen möglicherweise unterschiedliche Typen von AR zu existieren.
Die klinische Relevanz der Aspirin-Resistenz
Die bekannte hohe Prävalenz der atherosklerotischen Erkrankung lässt vermuten, dass die AR ein klinisches Problem von ausgesprochener Tragweite sein könnte. Zum gegenwärtigen Zeitpunkt ist noch keine prospektive, umfassende, randomisierte Studie durchgeführt worden, welche zum Ziel hat, die klinische Implikation der AR zu erfassen. Immerhin ist die prognostische Wichtigkeit der AR wenigstens teilweise in einigen wenigen Studien angedeutet worden.
Patienten mit stabiler kardiovaskulärer Erkrankung
Gum et al. haben die Prävalenz der AR prospektiv in 326 stabilen Patienten, welche täglich 325 mg Aspirin einnahmen, erfasst [
25]. Blutproben wurden hinsichtlich einer möglichen AR mittels optischer Thrombozytenaggregation analysiert. Achtzehn Patienten (5,5%) hatten eine AR und nach einer 2jährigen Folgeperiode war die AR assoziiert mit einem erhöhten Risiko von Tod, Myokardinfarkt oder Apoplexie. Der Aussagewert der Studie ist indessen durch den geringen Umfang begrenzt: Nur insgesamt 4 klinische Endpunkte wurden bei den Patienten mit AR registriert.
Patienten mit durchgemachtem Myokardinfarkt (MI)
Eikelboom et al. haben untersucht, ob die AR, definiert als Unvermögen, die TXB2-Synthese zu supprimieren, das Risiko von kardiovaskulären Ereignissen erhöht [
26]. Die Autoren inkludierten 976 Patienten der HOPE-Studie in ihrer Analyse. Mittels eines sogenannten «nested case-control»-Design wurden 488 Aspirin-behandelte Patienten («cases») ausgewählt, die alle ein kardiovaskuläres Ereignis während der letzten 5 Jahre durchgemacht hatten. Diese wurden 488 Aspirin-behandelten Kontrollpatienten («controls») ohne derartige Ereignisse gegenübergestellt. Es zeigte sich, dass Patienten in der höchsten Quartile der TXB2-Exkretion ein 3,5mal höheres Risiko eines kardiovaskulären Todes (p = 0,001) und ein 2,5mal erhöhtes Myokardinfarkt-Risiko hatten verglichen mit denjenigen in der niedrigsten Quartile (p = 0,006). Es muss indessen erwähnt werden, dass ein derartiges «nested case-control»-Design schwerwiegende Unterschiede hinsichtlich sogenannter «confounding factors» mit sich bringen kann, beispielsweise bezüglich der Häufigkeit früherer Infarkte, Diabetes mellitus usw. Obschon die angewendeten statistischen Tests derartige Unterschiede in den Baseline-Charakteristika auszugleichen versuchen, kann diese Studie keine definitiven Schlussfolgerungen hinsichtlich der klinischen Bedeutung der AR zulassen. Darüber hinaus wurden die Patienten mit Aspirin-Dosen von 80–325 mg täglich behandelt, was problematisch ist, da verschiedene Aspirin-Dosen die Blut- und Urin-Marker der Thromboxane-Synthese unterschiedlich beeinflussen [
18].
Andersen et al. undersuchten 2002 Patienten aus der WARIS-II-Studie [
27]. Patienten wurden entweder zu Aspirin alleine, Aspirin und Warfarin oder Warfarin alleine randomisiert. Nach 4 Jahren wurde die Prävalenz der AR mittels der PFA-100-Methode gemessen. Bei Aspirin-behandelten Patienten wurden in 35% eine AR nachgewiesen, in 40% bei Patienten mit der Kombinationsbehandlung. Retrospektiv wurden für die vergangenen 4 Jahre die kardiovaskulären Ereignissraten ausgerechnet. Dabei wurde kein Einfluss der AR auf diese Rate gefunden. Diese Studie ist indessen eine post-hoc-Analyse, die nicht mit der notwendigen Anzahl Patienten ausgestattet war, um signifikante Unterschiede aufzufangen.
Patienten, die eine perkutane koronare Intervention (PCI) durchmachen
Chen et al. haben die Effekte der AR auf das Vorkommen der Myokardnekrose nach nichtnotfallmässiger PCI bei 151 Aspirin-behandelten Patienten untersucht [
15]. Die AR wurde hier mittels der Ultegra-RPF-ASA-Methode gemessen und entsprach 19% aller Patienten. Eine signifikant höherere Indizenz von erhöhten Werten kardialer Marker wurde bei Aspirin-resistenten Patienten verglichen mit Aspirin-sensitiven Patienten gefunden.
Patienten nach Bypass-Operation (CABG)
Buchanan et al. untersuchten 289 konsekutive Aspirin-behandelte Patienten, die sich einer nichtnotfallmässigen Bypass-Operation unterzogen [
28]. Der gemessene Parameter in dieser Studie war die Blutungszeit, welche erlaubte, die Patienten in Aspirin-sensitiv (45%) und Aspirin-resistent (55%) einzuteilen. Nach einer 2jährigen Folgeperiode fanden sich keine Unterschiede im Auftreten von thrombotischen Ereignissen zwischen den beiden Gruppen (6,9% vs. 9,5%; p = ns). Aufgrund dieses Resultats wurde nachträglich eine Berechnung der für die Studie notwendigen Anzahl Patienten durchgeführt, welche das Resultat signifikant hätte werden lassen: 1260 Patienten wäre eine angemessene Kohorte gewesen. Eine andere Studie von Yilmaz et al. untersuchte die Bedeutung der AR auf das Auftreten von späten Vena-saphena-Graft-Okklusionen mittels eines «case-control»-Designs [
29]. Die «case»-Gruppe bestand aus 14 Patienten nach durchgemachter Bypass-Operation, in welchen eine Kontroll-Koronarangiographie mindestens einen okkludierten Vena-saphena-Graft nachwies. Diese 14 Patienten wurden mit anderen 14 Bypass-operierten Patienten verglichen, bei welchen eine Angiographie normale Venengrafts ohne Wandunregelmässigkeiten zeigte. Die Thrombozytenfunktion wurde mittels des PFA-100-Tests gemessen und eine AR wurde bei 50% der Patienten mit okkludierten Grafts, hingegen nur bei 7,1% der Kontrollgruppe diagnostiziert (p = 0,033). Leider ist die Rekrutierungsmethode in dieser Studie nicht genau beschrieben worden. Es wird erwähnt, dass die Patienten mit okkludierten Grafts häufiger ein akutes Koronarsyndrom (AKS) durchmachten (11 von 14 Patienten), wogegen die Patienten der Kontrollgruppe häufiger unter stabiler Angina pectoris litten. Diese Unterschiede bei der klinischen Präsentation dürften die Resultate entscheidend beeinflusst haben, indem möglicherweise das AKS
per se die Thrombozytenfunktion kurzfristig beeinflussen kann, was wenigstens teilweise die hohe Prävalenz der AR in der AKS-Gruppe erklären könnte.
Patienten mit durchgemachter Apoplexie
Grotemeyer et al. untersuchten 180 ausgewählte Patienten nach durchgemachter Apoplexie [
30]. Die Prävalenz der AR war 30% und wurde mit dem «Thrombozyten-Reaktivitäts-Test» gemessen. Nach 2 Jahren zeigte sich, dass die AR mit einem erhöhten Risiko von MI, Apoplexie und vaskulärem Todesfall verbunden war, verglichen mit der Aspirin-sensitiven Gruppe (40% vs. 4,4%; p <0,0001). Indessen ist der «Thrombozyten-Reaktivitäts-Test» keine standardisierte Methode zur Erfassung der AR. In einer anderen Studie haben Grundmann et al. mittels eines «cross-sectional»-Designs 53 Aspirin-behandelte Patienten untersucht, welche eine zerebrovaskuläre Erkrankung durchgemacht hatten [
10]. Die symptomatischen Patienten (n = 35) hatten eine verifizierte Apoplexie innerhalb der letzten 3 Tage erlitten, während die asymptomatischen Patienten (n = 18) während mindestens 24 Monaten ohne zerebrovaskuläres Ereignis waren. Die AR wurde mittels der PFA-100-Methode gemessen. Keiner der asymtomatischen Patienten war Aspirin-resistent, wogegen 34% aller symptomatischen Patienten eine AR hatten. Indessen war in dieser Studie die Grösse der Patienten-Kohorte ungenügend und eine «cross-sectional»-Studie kann keine Kausalität beweisen.
Patienten mit peripherer arterieller Verschlusskrankheit (PAD)
Mueller et al. haben die mögliche Bedeutung der AR bei Patienten mit PAD beschrieben [
31]. Es wurden 100 Aspirin-behandelte Patienten mit geplanter elektiver perkutaner peripherer Angioplastie in die Untersuchung eingeschlossen und für 18 Monate verfolgt. Der Effekt der Aspirin-Behandlung wurde mittels der korrigierten Vollblut-Aggregometrie während 5 verschiedenen geplanten Zeitpunkten gemessen. Patienten mit AR hatten ein relatives Risiko der Reokklusion der Angioplastie, welches 87% höher war als die Aspirin-sensitiven Patienten. Indessen wurde eine grosse Variabilität des Aspirin-Effekts während den 5 Mess-Zeitpunkten demonstriert, und die Kohorten-Grösse wurde nicht aufgrund von statistischen Berechnungen gewählt. In einer anderen Studie haben Ziegler et al. den Effekt von Aspirin mittels regelmässigen, 3monatigen Kontrollen evaluiert und die Resultate mit der Restenose-Rate nach perkutaner peripherer Angioplastie bei Patienten mit PAD korreliert [
32]. Die Thrombozytenfunktion wurde mittels der PFA-100-Methode gemessen, von 52 Patienten hatten 5 eine AR. Keiner dieser 5 Patienten erlitt eine Reokklusion oder Restenose, wogegen 13 Aspirin-sensitive Patienten eine Restenose aufwiesen. Die Anzahl der Patienten mit AR war indessen niedrig in dieser Untersuchung, was den Wert der beschriebenen Beobachtungen schmälert.
Zusammenfassend kann festgehalten werden, dass die klinische Bedeutung der AR nicht ausgeschlossen werden kann. Es bedarf indessen grosser randomisierter Studien mit klinisch eindeutigen und klar definierten Endpunkten, um definitive Schlüsse ziehen zu können.
Potentielle Mechanismen der AR
Zum heutigen Zeitpunkt ist der Mechanismus, welcher der AR zugrunde liegt, nicht erfasst worden. Nur eine begrenzte Anzahl von Studien hat sich überhaupt mit diesem Thema befasst, und die möglichen Mechanismen scheinen multifaktoriell zu sein.
Fehlende Compliance
Die Compliance-Problematik ist eine offenbare Begrenzung vieler Studien, und aufgrund der Resultate von Cotter et al. ist die Non-Compliance sogar möglicherweise der Hauptgrund für die AR [
22]. Immerhin haben gewisse Studien spezielle Massnahmen getroffen, um einer mögliche Non-Compliance entgegenzuwirken. Grundmann et al. haben beispielsweise in ihrer (bereits referierten) Studie bei 53 Patienten mit einem Rezidiv einer ischämischen Apoplexie das Aspirin unter ärztlicher Supervision gegeben, und dennoch wurde eine AR bei 34% aller Patienten nachgewiesen [
10]. Es darf zweifelsfrei postuliert werden, dass zukünftige Studien eine gewissenhafte Kontrolle hinsichtlich Compliance benötigen. Bis heute haben sich die Compliance-Kontrollen auf 3 verschiedene Verfahren abgestützt: der Messung der optischen Thrombozytenaggregation mit Arachidonsäure als Agonist, der Messung von TXA2-Metaboliten und/oder der Pillen-Zählung. Aufgrund des bereits erwähnten Rapports von Cotter et al. sollte in der Zukunft auch ein dedikiertes Patient-Compliance-Interview empfohlen werden [
22]. Über alle diese Massnahmen hinaus ist die direkte Messung der Plasmakonzentration von Aspirin und Salizylsäure das allersicherste Verfahren. Mittels einer HPLC («high-performance liquid chromatography») kann bereits zehn Stunden nach Einnahme einer Einzeldosis von 80 mg Aspirin sowohl Aspirin und Salizylsäure im Plasma nachgewiesen werden [
33]. Es mag erstaunen, dass diese Methode in Studien zur AR so sparsam eingesetzt worden ist.
Inadäquate Aspirin-Dosis
Wenn man die grossen Effekt-Unterschiede berücksichtigt, welche Aspirin in verschiedenen Individuen bewirkt, ist es schwierig zu verstehen, dass eine «one size fits all»-Strategie für alle Patienten applizierbar ist. Manche Patienten könnten eine AR schlicht wegen der falschen Dosierung von Aspirin entwickeln. Einige Autoren haben dokumentiert, dass eine stufenweise Erhöhung von Aspirin eine AR revertieren kann [
34,
35]. Die Frage der optimalen Dosierung von Aspirin wird in der Tat seit Jahren diskutiert. Im allgemeinen erhofft man sich ein reduziertes Blutungsrisiko durch die Erniedrigung der Aspirin-Dosierung, wogegen eine kürzliche Metaanalyse dieses Argument nicht unterstützen konnte [
36].
Der Gebrauch von nichtsteroidalen antiinflammatorischen Medikamenten (NSAID)
Nichtselektive NSAID haben eine starke Bindungsaffinität zu einer speziellen Region im COX-1-Molekül und könnten Aspirin daran hindern, eine Azetylierung des Serin-529 vorzunehmen. Dies könnte erklären, weshalb eine kombinierte Therapie von NSAID und Aspirin bei manchen Patienten eine AR induzieren könnte. Die meisten Studien zum Thema AR haben jedoch diejenigen Patienten exkludiert, welche gleichzeitig NSAID eingenommen haben.
Alternative Stoffwechselwege der Thromboxane-Synthese
Das Cyclooxygenase(COX)-Enzym existiert in zwei Isoformen: COX-1 ist konstitutiv exprimiert in Thrombozyten, und unter normalen Bedingungen wird die TXA2-Synthese hauptsächlich in den Thrombozyten durchgeführt. Das COX-2-Isoenzym wird unter normalen Bedingungen hingegen praktisch kaum gemessen. Es kann aber durch Zytokine, Endotoxine, Wachstums- und Tumorpromotoren auch in anderen Geweben induziert werden, beispielsweise in atherosklerotischen Gefässen [
37]. Die induzierte Genese des COX-2-Enzyms kann zur Produktion von TXA2 oder der Synthese von Prostaglandin H2 führen, welches ebenfalls in der Produktion von TXA2 in Aspirin-behandelten Thrombozyten resultieren kann, trotz Inhibition des COX-1. Aus diesem Grund kann die AR in verschiedenen krankhaften Zuständen mit erhöhter COX-2-Expression vorkommen. Das Vorhandensein einer AR kann unter solchen Umständen reversibel oder irreversibel sein, abhängig von der Natur und Länge des krankhaften Zustandes, welcher die erhöhte COX-2-Expression mit sich geführt hat.
Erhöhter Thrombozytenumsatz
Es genügen 10–20% von nicht-«aspirinisierten» Thrombozyten im gesamten Thrombozyten-Pool des Organismus, um eine normale Thrombozytenfunktion und -aggregation zu gewährleisten. In Zuständen eines erhöhten Thrombozytenumsatzes («turnover»), beispielsweise während einer Bypass-Operation, kann indessen eine vorbeigehende AR eintreten. Rocca et al. zeigten, dass das COX-2-Enzym in neugebildeten Thrombozyten vorhanden ist [
38]. Dies bedeutet, dass in Zuständen erhöhten Umtausches die Anzahl der neugebildeten Thrombozyten gross genug ist, um ausreichende Mengen von TXA2 zu produzieren. Dieses Szenario würde jedoch eine kontinuierliche Normalisierung des Thrombozyten-Status mit sich führen, sobald sich ein gegebener Patient erholen würde, und ausserdem sollte dann die AR durch die Verringerung des Dosis-Intervals der Aspirin-Gabe beeinflussbar sein.
Andere Stoffwechselwege, welche die Thrombozytenaggregation stimulieren
Thrombozyten können auch durch Thrombin, ADP, Noradrenalin und Kollagen aktiviert werden. Eine Thrombozytenaktivierung durch diese Faktoren kann zu einer Thrombozytenaggregation führen und könnte gewisse Fälle von AR erklären [
17,
23]. Diese Situationen repräsentieren wahrscheinlich Zustände einer erhöhten Thrombozytenreaktivität. Es wurde beispielsweise gezeigt, dass der antiaggregatorische Effekt von Aspirin durch eine Erhöhung der Aktivität des sympathischen Nervensystems revertiert werden kann. Aspirin-behandelte Patienten können ihren Status von Aspirin-sensitiv zu Aspirin-resistent einzig durch die Durchführung eines Arbeits-EKG ändern, was den Mechanismus einer Katecholamin-induzierten Thrombozytenaggregation nahelegt [
35]. Tatsächlich wurde dieser Mechanismus in einer Studie an gesunden Probanden bestätigt, in welcher die Noradrenalin-induzierte Thrombozyten-Aggregation nur teilweise durch die Gabe von Aspirin verhindert werden konnte [
39]. Damit kann logischerweise postuliert werden, dass die erhöhte Sensitivität auf physischen und/oder mentalen Stress für eine AR verantwortlich gemacht werden kann, welche mit Situationen eines erhöhten Sympathikotonus einhergeht, beispielsweise einem akuten MI. Falls diese Hypothese korrekt ist, sollte der Zustand reversibel sein, und eine existierende Korrelation zwischen einer AR und dem Plasmaspiegel zirkulierender Katecholamine sollte nachweisbar sein. Dieses Konzept ist jedoch bisher noch nie untersucht worden. Schliesslich würde dieser Zugang—wenigstens aus theoretischer Sicht—die therapeutische Möglichkeit nahelegen, dass gewisse AR-Patienten von einer intensivierten Betablocker-Behandlung profitieren könnten.
Genetische Variable
Verschiedene genetische Polymorphismen sind vorgeschlagen worden, für das Auftreten gewisser Fälle von AR verantwortlich zu sein. Das Vorkommen eines genetischen Polymorphismus lokalisiert am COX-1-Enzym könnte die Thrombozytenfunktion beeinflussen und AR mit sich führen. Ein Polymorphismus, welcher die Gene verschiedener Glykoprotein-Rezeptor-Komplexe der Thrombozyten involviert, ist ebenfalls mit einer AR assoziiert worden [
12,
35].
Schlussfolgerung
Eine klare und universell akzeptierte Definition der AR muss erst in Stein gemeisselt werden, und die Mechanismen, die diesem Phänomen zugrunde liegen, sind bis zum heutigen Tage weiterhin grösstenteils unbekannt. Die Lektion, welche bislang gelernt werden muss, ist die Tatsache, dass ein relativ hoher Anteil der als Aspirin-resistent klassifizierten Patienten allein durch die Optimierung der Compliance und eine Erhöhung der Dosis einen genügenden antiaggregatorischen Effekt durch Aspirin erreichen kann. Tatsächlich ist die wirklich brennende Frage die, ob eine Konversion einer AR durch höhere Asprin-Dosen den klinischen Verlauf verbessern kann oder nur eine höhere Rate von Nebenwirkungen mit sich führt. Dazu kommt, dass bislang die klinische Bedeutung der AR als solche—sei sie reversibel oder irreversibel—überhaupt nicht eindeutig geklärt worden ist. Als erster Schritt muss advokiert werden, dass ein international akzeptierter Konsens entwickelt wird, welcher die Frage klärt, wie Thrombozytenfunktionstests quasi standardisiert durchgeführt und interpretiert werden sollten.
Es muss daran erinnert werden, dass akute atherothrombotische Ereignisse, inklusive AKS und ischämische Apoplexien, ernsthafte Erkrankungen sind, die eine schlechte Prognose haben. Sogar nur eine minimale Reduktion in der Häufigkeit dieser klinischen Ereignisse könnte sowohl gesundheitsökonomisch als auch hinsichtlich der Lebensqualität vieler Patienten eine grosse Rolle spielen. Es sollte deshalb nachdrücklich empfohlen werden, dass gross angelegte Untersuchungen geplant werden, welche die zugrunde liegenden pathophysiologischen Mechanismen der reduzierten Aspirin-Wirkung erforschen. Leider ist es realistisch anzunehmen, dass die Zugkraft für die Durchführung solcher Studien nicht von der pharmazeutischen Industrie herkommen wird, wenn es sich um ein Produkt handelt, welches seit beinahe einem Jahrhundert eines der Hauptprinzipien moderner medizinischer Therapie darstellt. Tatsächlich: Sollte der Mechanismus der AR erklärbar werden, könnten zielgerichtete klinische randomisierte Studien dazu führen, dass in Zukunft die Thrombozyten-hemmende Behandlung individualisiert wird.
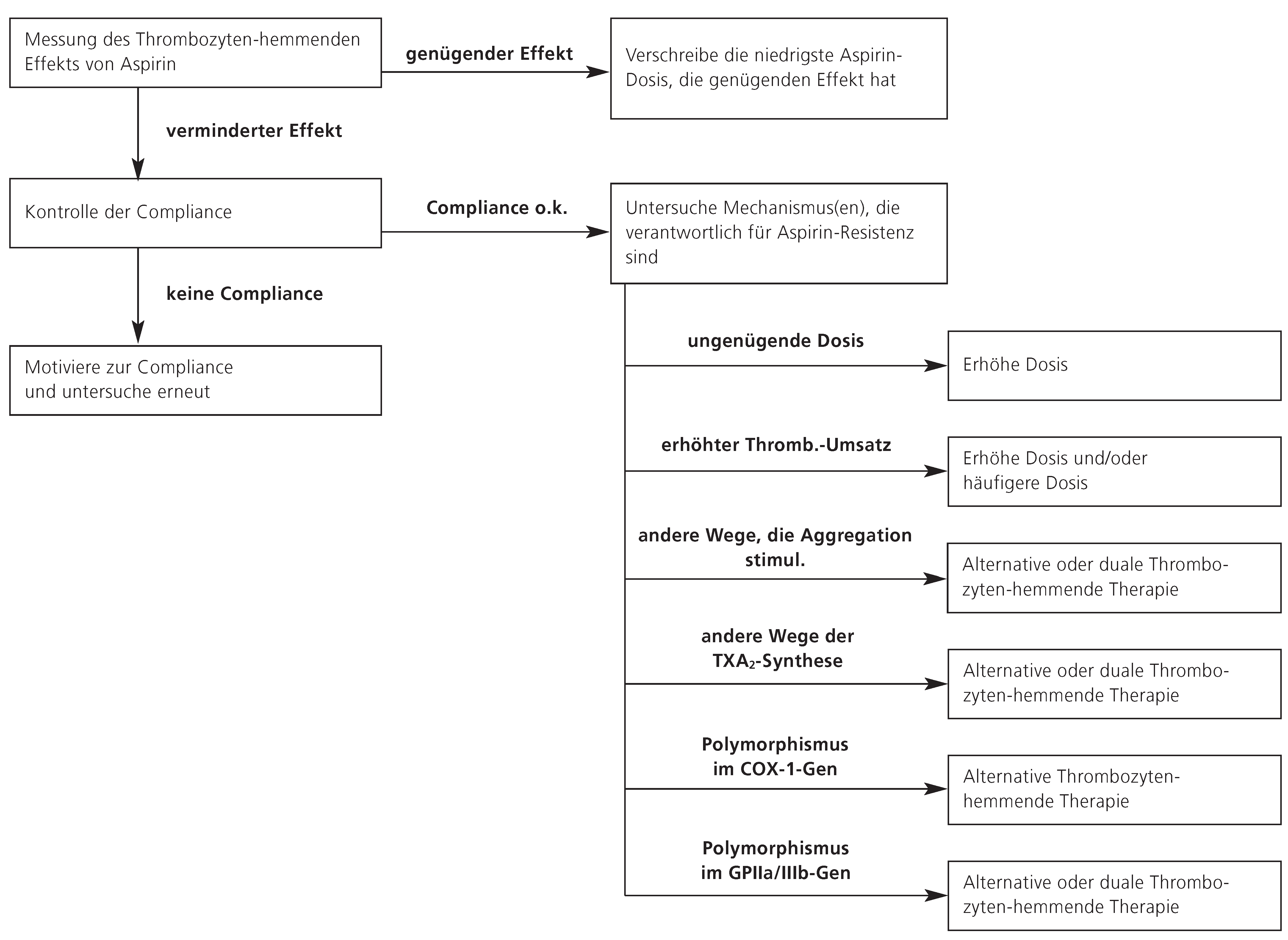
Figure 1 zeigt einen Vorschlag eines Algorithmus, wie massgeschneiderte Behandlungsstrategien bei Patienten mit AR aussehen könnten.
Zusammenfassend ist also die Erforschung der prognostischen Bedeutung der AR von grösster Wichtigkeit, wenn man bedenkt, wie viele Millionen Patienten täglich Aspirin einnehmen. Die Tatsache, dass die Rolle des Aspirins durch neue thrombozytenhemmende Arzneimittel herausgefordert wird, unterstreicht dieses Bedürfnis um so mehr.