Einleitung
Die neuen Richtlinien der Europäischen Gesellschaft für Kardiologie zur Diagnose und Therapie des akuten Koronarsyndroms ohne ST-Hebungen bestätigen vollumfänglich die Diagnose- und Therapiekonzepte der letzten Version der Guidelines aus 2011 [
1,
2], beinhalten aber auch sieben wichtige und klinisch relevante Neuerungen. Diese Neuerungen sollen hier kurz beschrieben werden:
präzisere Unterscheidung zwischen AMI und instabiler Angina pectorisDiagnose und Risikostratifizierung;
ESC-0/1-h-Algorithmus;
Dauer der Rhythmusüberwachung;
Beginn und Dauer der Blutplättchen-hemmenden Therapie;
Antikoagulation;
schnelle Revaskularisation;
konsequente und langfristige Einstellung der kardiovaskulären Risikofaktoren, insbesondere des LDL-Cholesterins.
Diagnose und Risikostratifizierung
Diagnose und Risikostratifizierung sind bei Patienten mit Verdacht auf akutes Koronarsyndrom eng verbunden. Bei der Mehrzahl der Patienten, die sich mit einer nicht-kardialen Ursache der Brustschmerzen vorstellen, ist diese Ursache eher harmlos (z.B. muskuloskeletale Brustschmerzen). Dagegen ist das Mortalitätsrisiko bei Patienten mit akutem Myokardinfarkt (AMI) substantiell.
Sowohl bei der Diagnose als auch bei der Risikostratifizierung sollten die drei klinischen Bausteine – die klinische Beurteilung mit genauer Anamnese und körperlicher Untersuchung inklusive Vitalparameter, das EKG und das kardiale Troponin – als quantitative Variablen interpretiert werden (
Abbildung 1).
Abbildung 1.
Initiale Evaluation von Patienten mit Verdacht auf ein akutes Koronarsyndrom.
Modifiziert nach Roffi et al. [
2], Nachdruck mit Genehmigung.
Abbildung 1.
Initiale Evaluation von Patienten mit Verdacht auf ein akutes Koronarsyndrom.
Modifiziert nach Roffi et al. [
2], Nachdruck mit Genehmigung.
Präzisere Unterscheidung zwischen AMI und instabiler Angina pectoris
Bereits seit der Richtlinie 2011 gilt die Empfehlung, zur Detektion und Quantifizierung der Herzmuskel-Zellschädigung hoch-sensitive kardiale Troponinassays zu verwenden. Diese ermöglichen die schnellere und präzisere Erkennung des AMI und auch erstmals eine präzise Unterscheidung zwischen AMI und instabiler Angina pectoris. Diese genauere Phänotypisierung des akuten Koronarsyndroms hat bedeutsame Unterschiede hinsichtlich Pathophysiologie, Risiko für bedeutsame Herzrhythmusstörungen sowie dem Nutzen der plättchenhemmenden Therapie sowie der frühen Koronarangiographie und Revaskularisation gezeigt (
Tabelle 1).
Die Diagnose des AMI basiert auf dessen universeller Definition: eine akute Herzmuskelzellschädigung mit einer Zunahme und/oder Abnahme des kardialen Troponins, wobei mindestens ein Wert die 99. Perzentile einer normalen Referenzpopulation (obere Referenzgrenze) überschreitet und mindestens ein weiteres Kriterium wie Symptome der Ischämie und/oder EKGVeränderungen vorliegt [
3].
Die höhere Genauigkeit und die höhere Sensitivität der
hoch-sensitiven kardialen Troponinassays ermöglicht
einen deutlich schnelleren «rule-out» oder eben «rulein
» des AMI. Entsprechend hat bereits die Richtlinie
2011 aufgezeigt, dass bei Verwendung eines hoch-sensitiven
kardialen Troponinassays das Zeitintervall bis
zur zweiten Blutentnahme im Rahmen des ESC-0/3-h-
Algorithmus von 6 Stunden auf 3 Stunden verkürzt
werden kann. Diese Empfehlung und der ESC-0/3-h-Algorithmus
wurden von der Richtlinie 2015 vollumfänglich
bestätigt. Der ESC-0/3-h-Algorithmus sollte in
der Zusammenschau mit der Anamnese und dem EKG
verwendet werden.
Tabelle 1.
Im Gegensatz zu Patienten mit instabiler Angina pectoris mit seriell normalen
kardialen Troponinwerten haben Patienten mit akutem Myokardinfarkt eine relevante
Herzmuskelzellschädigung, ein erhöhtes Risiko für gefährliche Herzrhythmusstörungen,
ein bedeutsam erhöhtes Risiko, zu versterben, sowie bedeutsamen langfristigen Nutzen
von intensiver plättchenhemmender Therapie und einer frühen Revaskularisation.
Tabelle 1.
Im Gegensatz zu Patienten mit instabiler Angina pectoris mit seriell normalen
kardialen Troponinwerten haben Patienten mit akutem Myokardinfarkt eine relevante
Herzmuskelzellschädigung, ein erhöhtes Risiko für gefährliche Herzrhythmusstörungen,
ein bedeutsam erhöhtes Risiko, zu versterben, sowie bedeutsamen langfristigen Nutzen
von intensiver plättchenhemmender Therapie und einer frühen Revaskularisation.
| | Instabile
Angina pectoris | Akuter
Myokardinfarkt |
|---|
| Akute Herzmuskelzellschädigung | – | +++ |
| Mortalität/ gefährliche Arrhythmie | –/+ | +++ |
| Nutzen von | | |
| – intensiver Plättchenhemmung | –/+ | +++ |
| – früher Revaskularisation | –/+ | +++ |
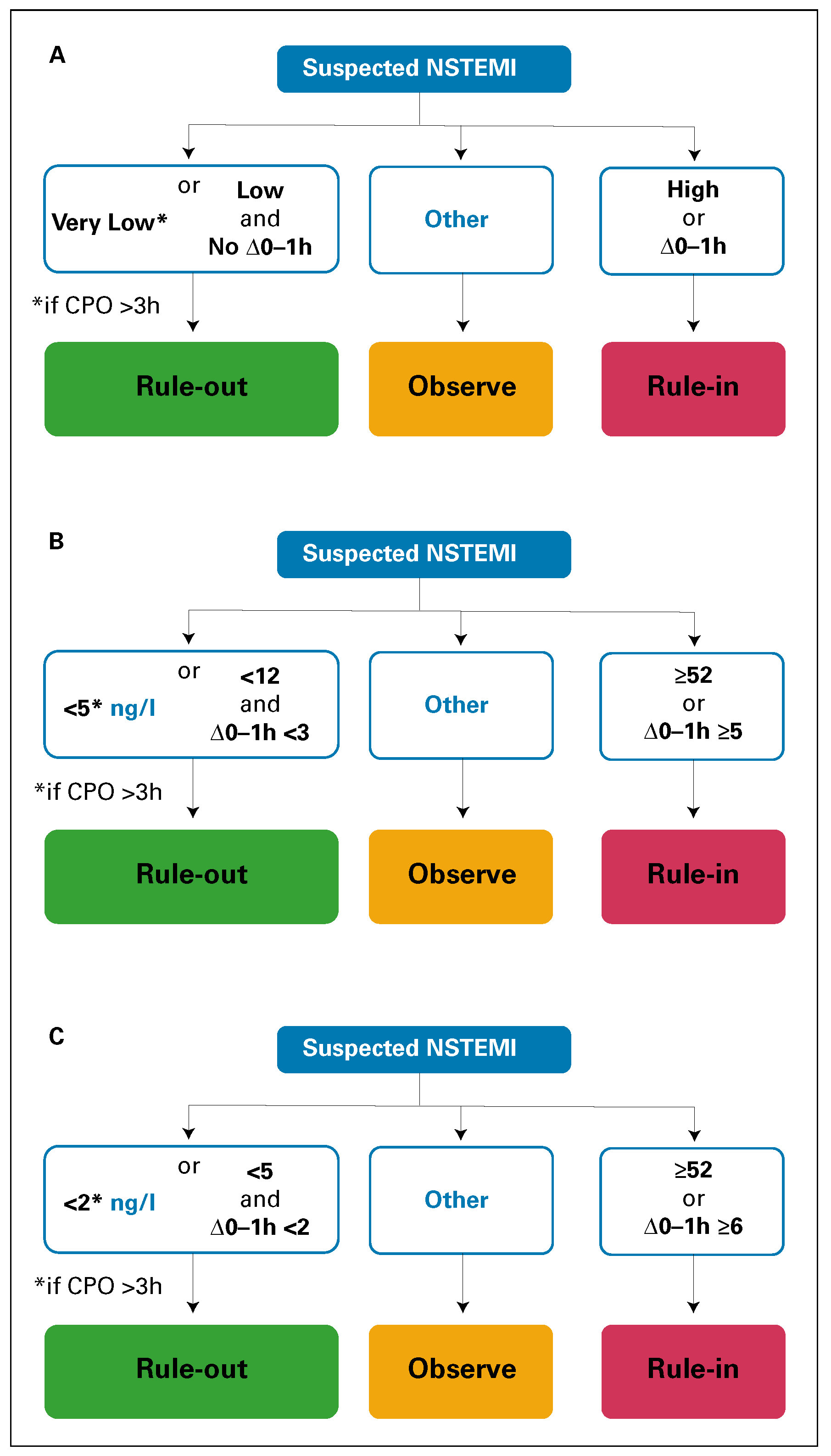
ESC-0/1-h-Algorithmus
Der ESC-0/1-h-Algorithmus ist eine Weiterentwicklung des ESC-0/3-h-Algorithmus und damit eine wichtige Innovation, um durch noch schnellere präzise Diagnose und Risikostratifizierung das Management von Patienten mit Verdacht auf akutes Koronarsyndrom weiter zu verbessern. Auch dieser Algorithmus sollte immer in der Zusammenschau mit der Anamnese und dem EKG verwendet werden. Dieser einfache und schnelle Triage-Algorithmus zum schnellstmöglichen «rule-out» oder eben «rule-in» des AMI verwendet die Blutkonzentrationen von hoch-sensitivem kardialem Troponin bei Eintritt und nach einer Stunde. Er wurde in grossen multizentrischen Diagnostikstudien unter Schweizer Führung erarbeitet und prospektiv validiert. Es gelten Assay-spezifische Cut-off-Werte für die beiden aktuell klinisch verfügbaren hoch-sensitiven kardialen Troponinassays (
Abbildung 2).
Je tiefer die Blutkonzentration des hoch-sensitiven kardialen Troponins ist, um so niedriger ist die Wahrscheinlichkeit, dass ein AMI vorliegt. Ist die Blutkonzentration bei Eintritt sehr niedrig (T <5 ng/L, I <2 ng/L) und sind seit dem Beginn des Brustschmerzes mindestens 3 Stunden vergangen, kann der AMI mit einem negativ-prädiktiven Wert von über 99% ausgeschlossen werden. Ist die Blutkonzentration bei Eintritt niedrig (T <12 ng/L, I <5 ng/L) und zeigt sich keine relevante Änderung innerhalb der ersten Stunde (delta T <3 ng/L, delta I <2 ng/L), so kann ebenfalls der AMI mit einem negativ-prädiktiven Wert von über 99% ausgeschlossen werden. Wenn andererseits die Blutkonzentration bei Eintritt deutlich erhöht ist (T/I ≥52 ng/L) oder sich innerhalb der ersten Stunde relevant ändert (delta T ≥5 ng/L, delta I ≥6 ng/L), ist der positiv-prädiktive Wert bei 70–80% und rechtfertigt in der Regel die Aufnahme auf einer monitorisierten Einheit (in der Regel CCU) und die schnelle Koronarangiogarphie.
Die schnelle Koronarangiographie bietet die Möglichkeit der schnellen Revaskularisation gemäss dem Konzept «time is muscle» bei jenen 70–80% der Patienten in der «rule-in» Gruppe, die tatsächlich einen AMI haben. Die Koronarangiographie ist aber auch bei der Mehrzahl den restlichen 20–30% in der «rule-in»-Gruppe nötig, und zwar aus rein diagnostischen Gründen, um z.B. eine Takostubo-Kardiomyopathie, eine Myokarditis oder eine Herzinsuffizienz sicher genug vom AMI unterscheiden zu können.
Der ESC-0/1-h-Algorithmus erlaubt eine schnelle Zuordnung zu «rule-out» oder «rule-in» bei gut 70% aller Patienten, die sich mit Verdacht auf ein akutes Koronarsyndrom auf der Notfallstation vorstellen. Bei den verbleibenden ca. 30% in der «observe zone» verbleibt die Notwendigkeit zur 3-Stunden-Blutentnahme, ebenso bei allen Patienten, bei denen die ersten beiden Troponinwerte nicht konklusiv sind und weiter Verdacht auf AMI besteht. Sowohl für die Änderungen der Blutkonzentration des hochsensitivem kardialen Troponins innerhalb der ersten Stunde als auch für die Änderungen innerhalb der ersten 3 Stunden gilt: je ausgeprägter die Änderungen, um so wahrscheinlicher liegt ein AMI vor.
Abbildung 2.
A. generelles Prinzip. B: hoch-sensitives
kardiales
Troponin T (Elecsys). C: hoch-sensitives kardiales
Troponin I (Architect). Modifiziert nach Roffi et al. [
2].
Abbildung 2.
A. generelles Prinzip. B: hoch-sensitives
kardiales
Troponin T (Elecsys). C: hoch-sensitives kardiales
Troponin I (Architect). Modifiziert nach Roffi et al. [
2].
Dauer der Rhythmusüberwachung
Unmittelbar nach Vorstellung auf der Notfallstation oder «Chest Pain Unit» muss der Patient an einen EKGMonitor zur Herzrhythmusüberwachung angeschlossen werden, um etwaige auftretende Herzrhythmusstörungen umgehend erkennen und behandeln zu können. Patienten, bei denen ein AMI diagnostiziert wird, müssen für 24–48 Stunden an der Herzrhythmusüberwachung bleiben, da sie ein relevant erhöhtes Risiko für lebensbedrohliche Herzrhythmusstörungen haben. Je höher das Risiko, desto länger die Überwachung. AMI-Patienten mit hohem Risiko wie bereits aufgetretenen Herzrhythmusstörungen, hämodynamischer Instabilität, linksventrikulärer Auswurffraktion <40%, fehlgeschlagener koronarer Reperfusion oder zusätzlichen kritischen koronaren Stenosen sollten 48 Stunden oder gegebenenfalls länger monitorisiert werden. AMI-Patienten mit niedrigem Risiko, d.h. keinem dieser Faktoren können nach 24 Stunden bzw. ggf. schon unmittelbar nach erfolgreicher perkutaner Revaskularisation auf eine Normalstation verlegt werden. Patienten mit instabiler Angina pectoris (d.h. mit zweimal normalem Werten des hoch-sensitiven kardialen Troponins) benötigen in der Regel keine kontinuierliche Herzrhythmusüberwachung, weil ihr Risiko für lebensbedrohliche Herzrhythmusstörungen sehr niedrig ist (Ausnahme: Verdacht auf einen koronaren Spasmus sowie bei Symptomrezidiv).
Beginn und Dauer der Blutplättchen-hemmenden Therapie
Analog zur Version 2011 empfiehlt auch die aktuelle Richtlinie, soweit keine Kontraindikationen wie übermässiges Blutungsrisiko oder Notwendigkeit für eine langfristige orale Antikoagulation vorliegen, eine doppelte Plättchenhemmung (DAPT) mit Aspirin und einem P2Y12-Inhibitor für 12 Monate. Diese Empfehlung gilt sowohl für Patienten, bei denen eine frühinvasive Strategie zur Anwendung kommt, als auch bei Patienten mit primär konservativer Therapie. Aufgrund bezüglich ihres primären Endpunktes positiver Zulassungsstudien ist prinzipiell die Gabe aller drei oralen P2Y12-Inhibitoren (Ticagrelor, Prasugrel, Clopidogrel) möglich. Beim akutem Koronarsyndrom ohne ST-Hebungen ist Ticagrelor der zu bevorzugende Partner für Aspirin, da in der entsprechenden Zulassungsstudie neben dem ischämischen Endpunkt auch die Gesamtmortalität signifikant reduziert werden konnte.
Eine Neuerung ist eine etwas konservativere Haltung bezüglich dem Beginn der DAPT, u.a. aufgrund der enttäuschenden Ergebnisse der einzigen randomisierten kontrollierten Studie, die den Wert einer «Vorbehandlung» mit einem P2Y12-Inhibitor (Prasugrel) adressiert hat [
4].
Aktuell wird empfohlen, Ticagrelor zu beginnen, sobald die Diagnose des akuten Koronarsyndroms klinisch sicher ist. Eine weitere Neuerung betrifft die Dauer der DAPT. Bei Patienten mit hohem Blutungsrisiko nach Implantation des Drug-Eluting Stents (DES) ist die Verabreichung von P2Y12-Inhibitoren für eine kürzere Dauer von 3 bis 6 Monaten empfohlen [
5,
6]. Ebenso gibt es v.a. aufgrund der PEGASUS-TIMI-54-Studie Hinweise, dass Patienten mit einem AMI, die ein niedriges Blutungsrisiko, aber eher hohes ischämisches Risiko haben (früher Rezidiv-AMI, Diabetiker, Bi-furkationsstenosen, lange Stentlänge), von einer Verlängerung der DAPT mit einer etwas erniedrigten Ticagrelor-Dosierung (60 mg 2×/d statt wie in den ersten 12 Monaten 90 mg 2×/d) profitieren [
5,
6].
Antikoagulation
Die Empfehlungen bezüglich Hemmung der plasmatischen Gerinnung sind weitgehend identisch zu den Richtlinien 2011.
Durch die Verkürzung der Dauer bis zur Revaskularisation in den letzten Jahren und durch die Verfügbarkeit potenterer Plättchenhemmer hat die Bedeutung der Antikoagulation, die ja in der Regel nur bis zur Revaskularisation durchgeführt wird, abgenommen. Es stehen mehrere intravenös und subkutan applizierte Antikoagulantien zur Verfügung (unfraktioniertes Heparin, niedermolekuläres Heparin, Fondaparinux, Bivalirudin) wobei gerade in Zeiten der intensiven DAPT Fondaparinux, u.a. aufgrund der deutlich niedrigeren Dosierung und damit niedrigeren Rate an schwerwiegenden Blutungen, für die meisten Patienten als die beste Option erscheint.
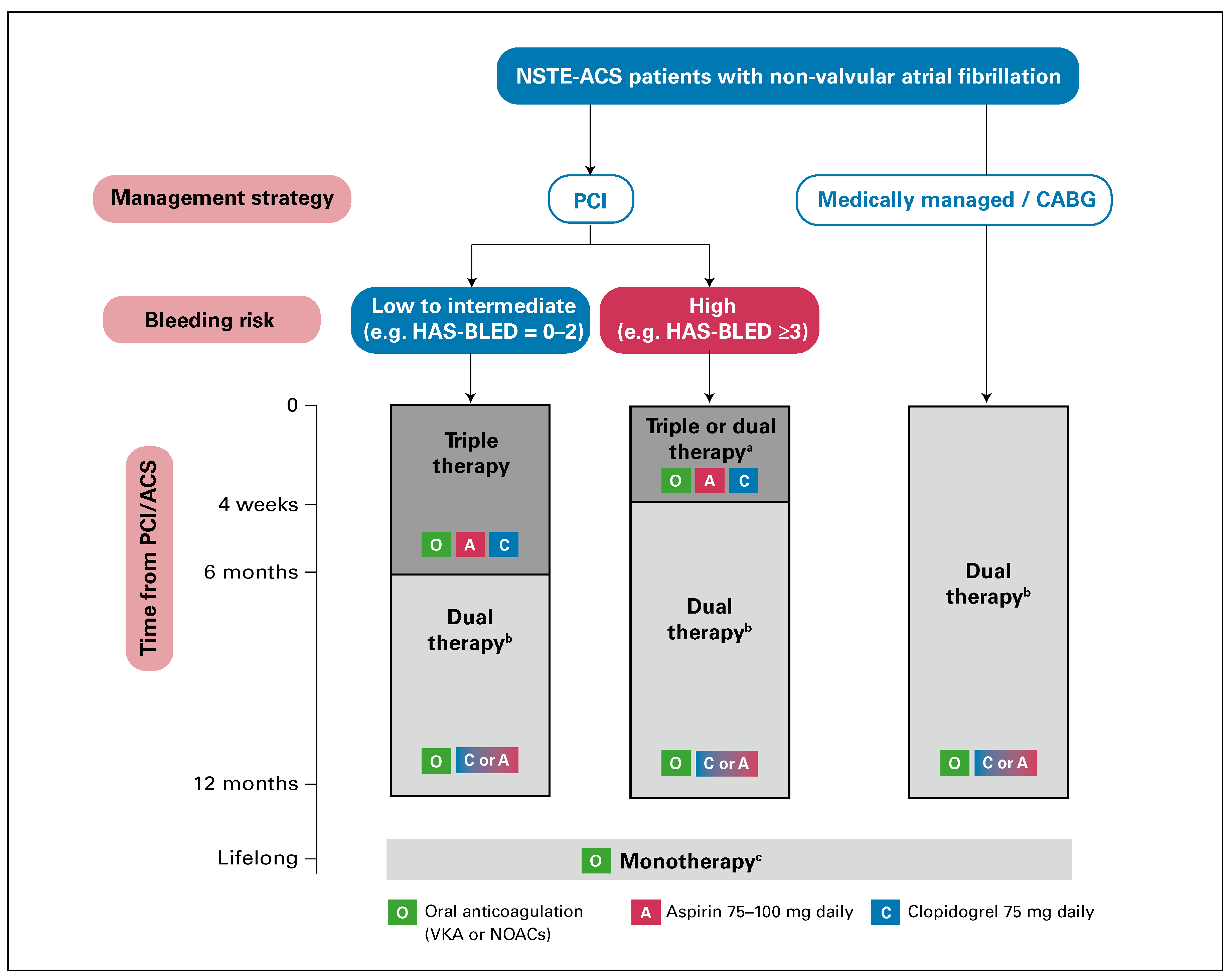
Eine wesentliche Neuerung stellt das Therapieschema für Patienten mit NSTE-ACS und Indikation zur langfristigen oralen Antikoagulation bei Vorhoffimmern dar (
Abbildung 3).
Abbildung 3.
Für rein konservativ behandelte Patienten und Patienten mit geplanter koronarer Bypassoperation ist die Kombination
aus einem plättchenhemmenden Medikament
(Aspirin oder Clopidogrel) und einem oralen Antikoagulans (einem Vitamin-
K-Antagonisten oder einem NOAC) für ein Jahr empfohlen. Für Patienten, die eine Stent-basierte PCI erhalten, ist
zumindest für eine gewisse Zeit eine Tripple-Therapie (d.h. Aspirin, Clopidogrel und VKA oder NOAC) indiziert. Die Dauer der
Tripple-Therapie richtet sich nach dem Blutungsrisiko: bei einem niedrigen bis mittleren Risiko einer Blutung für 6 Monate, bei
hohem Blutungsrisiko für einen Monat. Nach dem Ende der Tripple-Therapie folgt dann analog zu den konservativ behandelten
Patienten eine doppelte Therapie (d. h. Aspirin oder Clopidogrel und VKA oder NOAC) für den Rest der 12 Monate.
Nach einem Jahr reicht für die meisten Patienten eine alleinige orale Antikoagulation aus. Bei Patienten mit hohem ischämischem
Risiko (z.B. vorherige Stentthrombose trotz adäquater
DAPT, Hauptstamm-Stenting, Bifurkationsstenosen oder diffuse
Mehrgefässerkrankung) ist zusätzlich ein plättchenhemmendes Medikament (Aspirin oder Clopidogrel) auch nach dem ersten
Jahr sinnvoll. Nachdruck aus Roffi et al. [
2], mit Genehmigung.
Abbildung 3.
Für rein konservativ behandelte Patienten und Patienten mit geplanter koronarer Bypassoperation ist die Kombination
aus einem plättchenhemmenden Medikament
(Aspirin oder Clopidogrel) und einem oralen Antikoagulans (einem Vitamin-
K-Antagonisten oder einem NOAC) für ein Jahr empfohlen. Für Patienten, die eine Stent-basierte PCI erhalten, ist
zumindest für eine gewisse Zeit eine Tripple-Therapie (d.h. Aspirin, Clopidogrel und VKA oder NOAC) indiziert. Die Dauer der
Tripple-Therapie richtet sich nach dem Blutungsrisiko: bei einem niedrigen bis mittleren Risiko einer Blutung für 6 Monate, bei
hohem Blutungsrisiko für einen Monat. Nach dem Ende der Tripple-Therapie folgt dann analog zu den konservativ behandelten
Patienten eine doppelte Therapie (d. h. Aspirin oder Clopidogrel und VKA oder NOAC) für den Rest der 12 Monate.
Nach einem Jahr reicht für die meisten Patienten eine alleinige orale Antikoagulation aus. Bei Patienten mit hohem ischämischem
Risiko (z.B. vorherige Stentthrombose trotz adäquater
DAPT, Hauptstamm-Stenting, Bifurkationsstenosen oder diffuse
Mehrgefässerkrankung) ist zusätzlich ein plättchenhemmendes Medikament (Aspirin oder Clopidogrel) auch nach dem ersten
Jahr sinnvoll. Nachdruck aus Roffi et al. [
2], mit Genehmigung.
![Cardiovascmed 20 00081 g003 Cardiovascmed 20 00081 g003]()
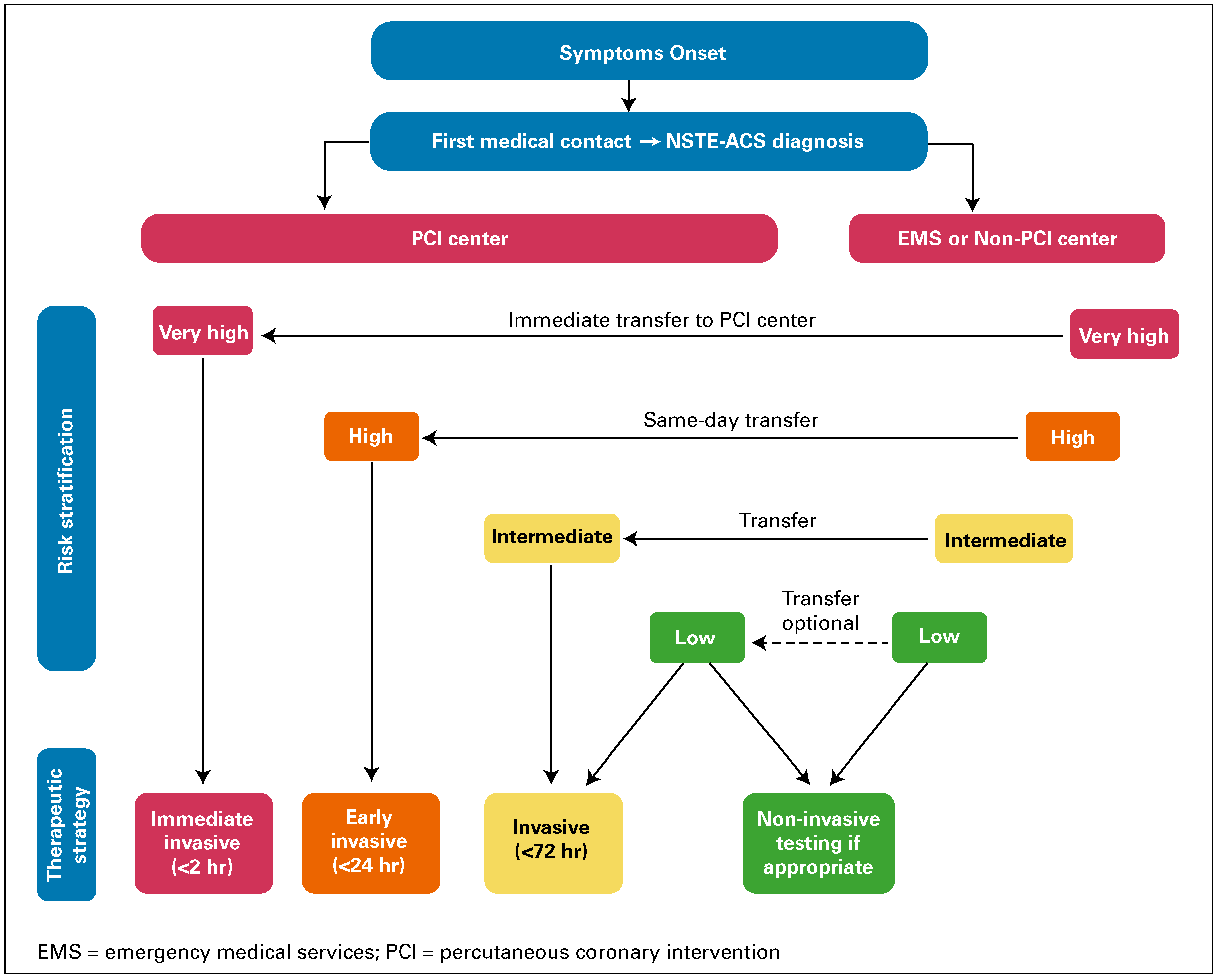
Schnelle Revaskularisation
Die Auswahl der NSTE-ACS-Behandlungsstrategie (invasiv oder konservativ) und der Zeitpunkt der Koronarangiographie basieren auf einer gemäss etablierten Kriterien durchgeführten Risikostratifizierung (
Tabelle 2).
Abbildung 4 zeigt die Zeitfenster für eine etwaige Verlegung in eine Klinik mit Herzkatheterlabor.
Gemäss den Daten der MATRIX-Studie wird primär der radiale Zugang empfohlen, wenn mit diesem im jeweiligen Zentrum genügend Erfahrung vorliegt [
7]. Als Stents sollten die neue Generation der drug-elutung stents (DES) verwendet werden [
8,
9].
Tabelle 2.
Risikokriterien, die für eine schnelle invasive Strategie sprechen [
2].
Tabelle 2.
Risikokriterien, die für eine schnelle invasive Strategie sprechen [
2].
| Sehr hohes Risiko | Hämodynamische Instabilität oder kardiogener Schock |
| | Wiederkehrende oder anhaltende therapierefraktäre Brustschmerzen |
| | Lebensbedrohliche Arrhythmien oder Herzstillstand |
| | Mechanische Komplikationen eines akuten Myokardinfarktes |
| | Akute Herzinsuffizienz |
| | Wiederkehrende dynamische ST- oder T-Veränderungen, insbesondere intermittierende ST-Hebungen |
| Hohes Risiko | Troponinanstieg (= NSTEMI) |
| | Dynamische ST- oder T-Wellenänderungen (symptomatisch oder stumm) |
| | GRACE-Score >140 |
| Intermediäres Risiko | Diabetes mellitus |
| | Niereninsuffizienz (eGFR <60 mL/min/1.73 m2) |
| | LVEF <40% oder kongestive Herzinsuffizienz |
| | Frühzeitige Angina pectoris |
| | Vorherige perkutane Revaskularisation |
| | Vorgängige Bypassoperation |
| | GRACE-Risiko-Score >109 und <140 |
| Niedriges Risiko | Keines der oben erwähnten Merkmale |
Abbildung 4.
Je höher das Mortalitätsrisiko, um so schneller sollte die Revaskularisation erfolgen. Nachdruck aus Roffi et al. [
2],
mit Genehmigung.
Abbildung 4.
Je höher das Mortalitätsrisiko, um so schneller sollte die Revaskularisation erfolgen. Nachdruck aus Roffi et al. [
2],
mit Genehmigung.
Konsequente und langfristige Einstellungen der kardiovaskulären Risikofaktoren, insbesondere des LDL-Cholesterins
Eine hochdosierte Statintherapie (z.B. mit 80 mg Atorvastatin) sollte unmittelbar nach der Diagnose eines NSTE-ACS begonnen werden. Neu wird bei allen Patienten mit unter einem hochdosierten Statin noch nicht optimal eingestelltem LDL-Cholesterin (LDL-Cholesterin ≥70 mg/dl; ≥1,8 mmol/L) die Ergänzung von Ezetemibe 10 mg empfohlen [
10].
Begleitmanuskripte mit Fragen und Antworten
Zum ersten Mal gibt es parallel zu einer ESC-Leitlinie auch Fall-basierte Begleitmanuskripte, um die konkrete klinische Implementierung der Richtlinie zu veranschaulichen. Jedes dieser Begleitmanuskripte enthält 40 interaktive Fallbeschreibungen [
11,
12,
13].
Schlussfolgerung
Die neuen 2015 NSTE-ACS-Richtlinien beinhalten mehrere klinisch relevante Neuerungen, deren konsequente Implementierung einen wichtigen Beitrag zur weiteren Verbesserung des Outcome dieser Patienten leisten kann.
Conflicts of Interest
Christian Mueller reports receiving research support from the Swiss National Science Foundation, the Swiss Heart Foundation, the KTI, the European Union, the Stiftung für kardiovaskuläre Forschung Basel; Abbott, Alere, Astra Zeneca, Beckman Coulter, Biomerieux, Brahms, Roche, Siemens, Singulex, Sphingotec, and the Department of Internal Medicine, University Hospital Basel, as well as speaker honoraria/ consulting honoraria from Abbott, Alere, Astra Zeneca, Biomerieux, Boehringer Ingelheim, BMS, Brahms, Cardiorentis, Novartis, Roche, Siemens, and Singulex.
Stephan Windecker works at an institution that has received research grants from Abbott, Biotronik, Boston Scientific, Edwards Lifesciences, Guerbet, Johnson & Johnson, The Medicines Company, Medtronic, Merck Sharp and Dohme, Novartis, Sorin, St. Jude, and Symetis.
Marco Roffi reports institutional research grants from Abbott Vascular, Biotronik, Terumo, Medtronic, and Boston Scientific and speaker fees from AstraZeneca.
References
- Hamm, C.W.; Bassand, J.P.; Agewall, S.; Bax, J.; Boersma, E.; Bueno, H.; et al. ESC Committee for Practice Guidelines. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2011, 32, 2999–3054. [Google Scholar] [PubMed]
- Roffi, M.; Patrono, C.; Collet, J.P.; Mueller, C.; Valgimigli, M.; Andreotti, F.; et al. Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016, 37, 267–315. [Google Scholar] [PubMed]
- Thygesen, K.; Alpert, J.S.; Jaffe, A.S.; Simoons, M.L.; Chaitman, B.R.; White, H.D.; et al. Writing Group on the Joint ESC/ACCF/AHA/WHF Task Force for the Universal Definition of Myocardial Infarction; ESC Committee for Practice Guidelines (CPG). Third universal definition of myocardial infarction. Eur Heart J. 2012, 33, 2551–2567. [Google Scholar] [CrossRef] [PubMed]
- Montalescot, G.; Bolognese, L.; Dudek, D.; Goldstein, P.; Hamm, C.; Tanguay, J.F.; et al. ACCOAST Investigators. Pretreatment with prasugrel in non-ST-segment elevation acute coronary syndromes. N Engl J Med. 2013, 369, 999–1010. [Google Scholar] [CrossRef] [PubMed]
- Navarese, E.P.; Andreotti, F.; Schulze, V.; Kołodziejczak, M.; Buffon, A.; Brouwer, M.; et al. Optimal duration of dual antiplatelet therapy aher percutaneous coronary intervention with drug eluting stents: meta-analysis of randomised controlled trials. BMJ. 2015, 350, h1618. [Google Scholar] [CrossRef] [PubMed]
- Udell, J.A.; Bonaca, M.P.; Collet, J.P.; Lincoff, A.M.; Kereiakes, D.J.; Costa, F.; et al. Long-term dual antiplatelet therapy for secondary prevention of cardiovascular events in the subgroup of patients with previous myocardial infarction: a collaborative meta-analysis of randomized trials. Eur Heart J. 2016, 37, 390–399. [Google Scholar] [CrossRef] [PubMed]
- Valgimigli, M.; Gagnor, A.; Calabró, P.; Frigoli, E.; Leonardi, S.; Zaro, T.; et al.; MATRIX Investigators Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial. Lancet. 2015, 385, 2465–2476. [Google Scholar] [CrossRef] [PubMed]
- Valgimigli, M.; Patialiakas, A.; Thury, A.; McFadden, E.; Colangelo, S.; Campo, G.; et al.; ZEUS Investigators Zotarolimus-eluting versus bare-metal stents in uncertain drug-eluting stent candidates. J Am Coll Cardiol. 2015, 65, 805–815. [Google Scholar] [CrossRef] [PubMed]
- Urban, P.; Meredith, I.T.; Abizaid, A.; Pocock, S.J.; Carrié, D.; Naber, C.; et al.; LEADERS FREE Investigators Polymer-free drug-coated coronary stents in patients at high bleeding risk. N Engl J Med. 2015, 373, 2038–2047. [Google Scholar] [CrossRef] [PubMed]
- Cannon, C.P.; Blazing, M.A.; Giugliano, R.P.; et al. Ezetimibe added to statin therapy aher acute coronary syndromes. N Engl J Med. 2015, 372, 2387–2397. [Google Scholar] [CrossRef] [PubMed]
- Mueller, C.; Patrono, C.; Valgimigli, M.; Collet, J.P.; Roffi, M. Questions and answers on diagnosis and risk assessment: a companion document of the 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2015, ehv409. [Google Scholar]
- Collet, J.P.; Roffi, M.; Mueller, C.; Valgimigli, M.; Patrono, C.; Baumgartner, H.; et al. Questions and answers on antithrombotic therapy: a companion document of the 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2015, ehv407. [Google Scholar]
- Valgimigli, M.; Patrono, C.; Collet, J.P.; Mueller, C.; Roffi, M. Questions and answers on coronary revascularization: a companion document of the 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2015, ehv408. [Google Scholar]
© 2017 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.