Update Hypertensive Herzkrankheit
Abstract
Einleitung
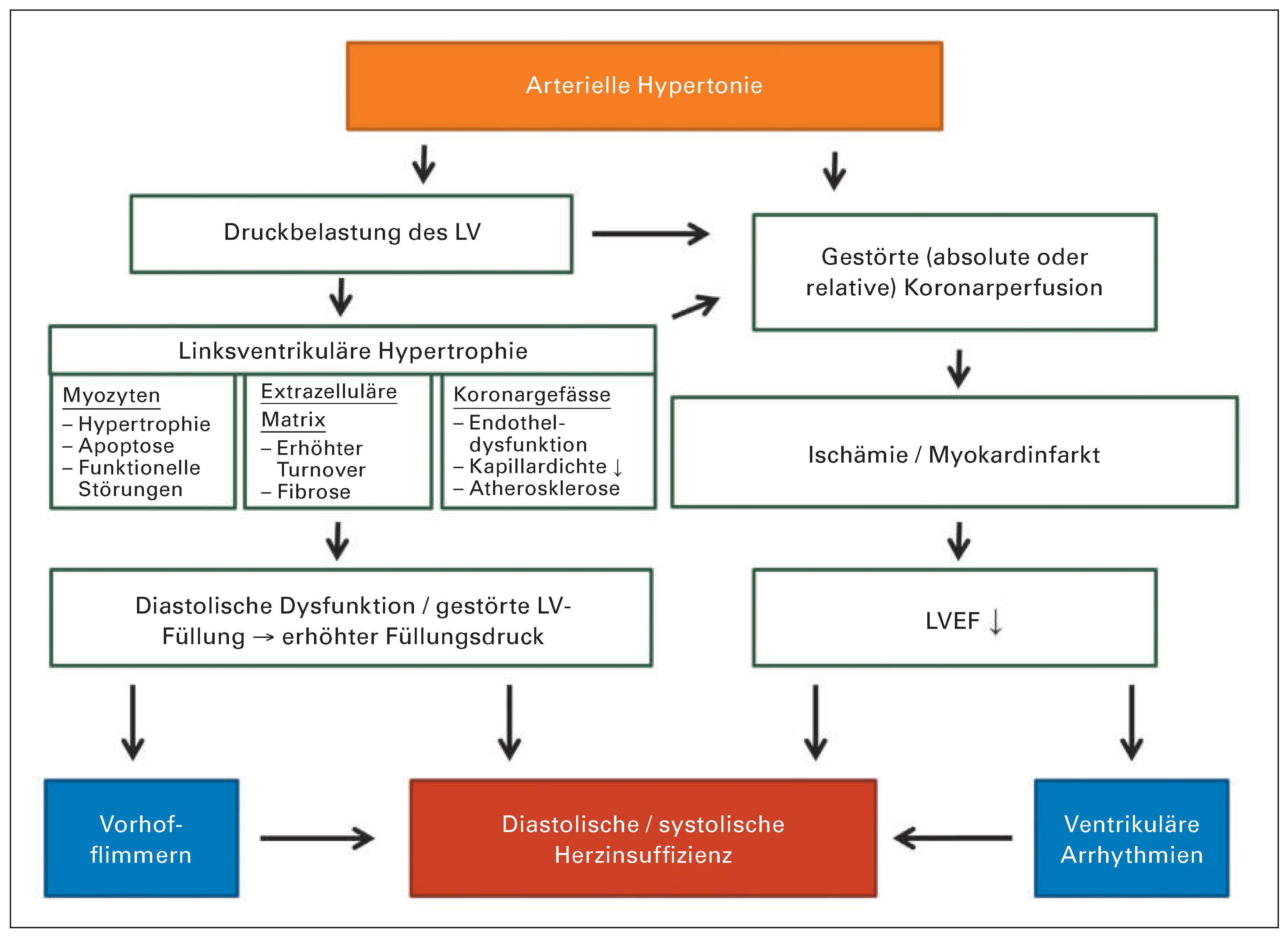
Entstehung der Hypertonie-assoziierten linksventrikulären Hypertrophie
Pathophysiologie: von der linksventrikulären Hypertrophie zur Herzinsuffizienz
| Index | Berechnung | Sensitivität | Spezifität |
|---|---|---|---|
| Cornell-Voltage-Duration-Produkt | S V3 + R aVL (+8 mm bei Frauen) × QRS-Dauer ≥2440 mm × ms | 20% | 91% |
| Sokolow-Index | R in Ableitung aVL >1,1 mV | 18% | 92% |
| Sokolow-Lyon-Index | S in V1 + R in V5 oder V6 >3,5 mV | 21% | 89% |
Linksventrikuläre Hypertrophie und koronare Durchblutung
Diagnostik
EKG

Echokardiographie
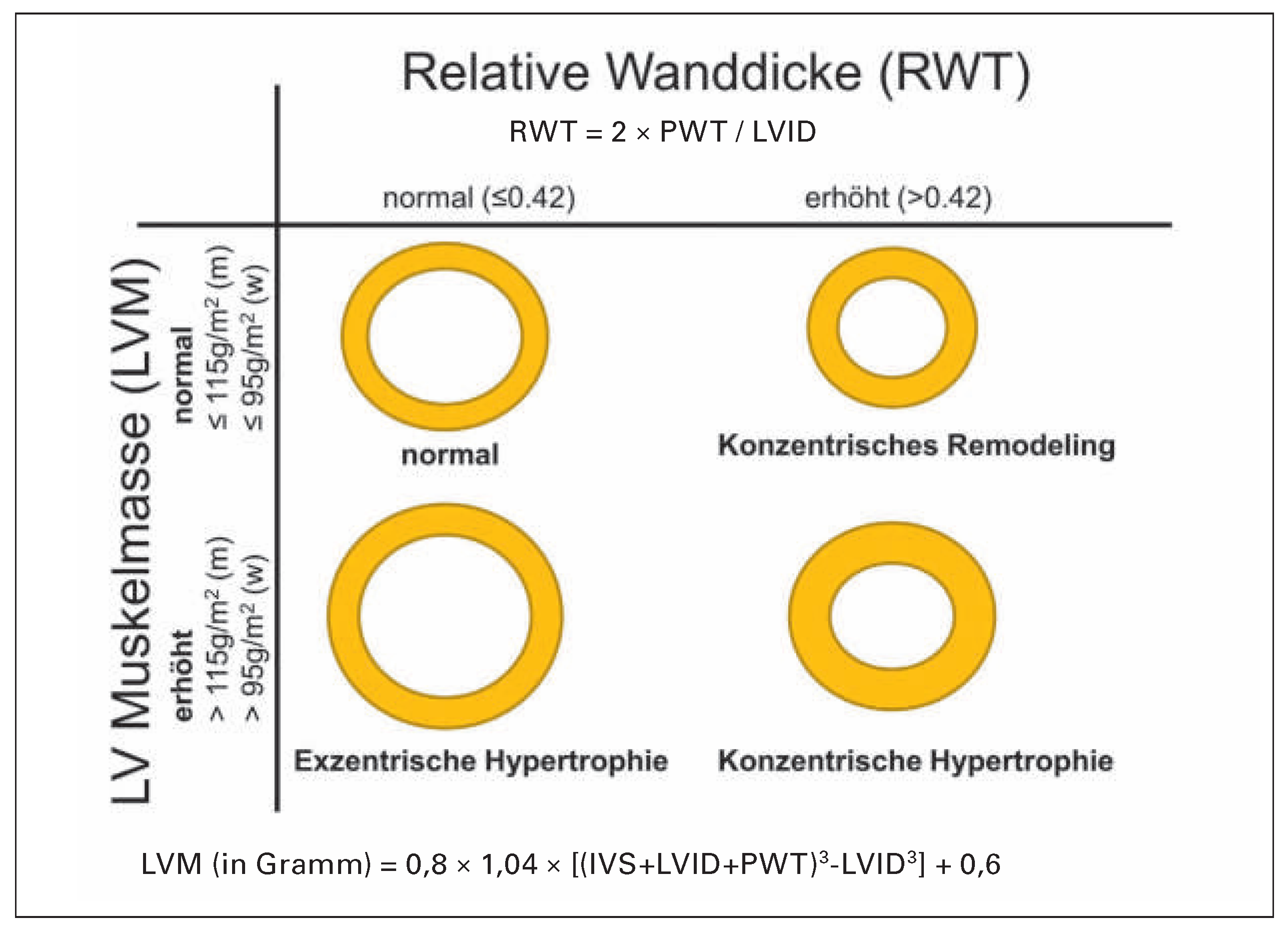
Bestimmung der Ventrikelgeometrie
Diastolische Dysfunktion

| Hypertensive Herzkrankheit |
| Aortenstenose |
| Athletenherz |
| Hypertrophe (obstruktive) Kardiomyopathie |
| Kardiale Amyloidose |
| Mitochondriale Myopathien (Friedreich-Ataxie, MELAS-Syndrom, Kearns-Sayre-Syndrom) |
| Mukopolysaccharidosen (Glykogenspeicherkrankheiten) |
| Anderson-Fabry-Erkrankung |
| Non-compaction-Kardiomyopathie |
| Hämochromatose |
Systolische Funktion und Differentialdiagnosen der linksventrikulären Hypertrophie
Therapieansätze
Schlussfolgerung
Conflicts of Interest
References
- Levy, D.; Garrison, R.J.; Savage, D.D.; Kannel, W.B.; Castelli, W.P. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study. N Engl J Med 1990, 322, 1561–1566. [Google Scholar] [CrossRef]
- Mancia, G.; Giannattasio, C. Diagnostic and therapeutic problems of isolated systolic hypertension. J Hypertens 2015, 33, 33–43. [Google Scholar] [CrossRef]
- Daniels, S.D.; Meyer, R.A.; Loggie, J.M. Determinants of cardiac involvement in children and adolescents with essential hypertension. Circulation 1990, 82, 1243–1248. [Google Scholar] [CrossRef]
- Schnall, P.L.; Pieper, C.; Schwartz, J.E.; Karasek, R.A.; Schlussel, Y.; Devereux, R.B.; Ganau, A.; Alderman, M.; Warren, K.; Pickering, T.G. The relationship between ‘job strain,’ workplace diastolic blood pressure, and left ventricular mass index. Results of a case-control study. JAMA 1990, 263, 1929–1935. [Google Scholar] [CrossRef]
- Lauer, M.S.; Anderson, K.M.; Levy, D. Separate and joint influences of obesity and mild hypertension on left ventricular mass and geometry: The Framingham Heart Study. J Am Coll Cardiol 1992, 19, 130–134. [Google Scholar] [CrossRef]
- Schmieder, R.E.; Messerli, F.H. Does obesity influence early target organ damage in hypertensive patients? Circulation 1993, 87, 1482–1488. [Google Scholar] [CrossRef]
- Drazner, M.H. The progression of hypertensive heart disease. Circulation 2011, 123, 327–334. [Google Scholar] [CrossRef]
- Hunter, J.J.; Chien, K.R. Signaling pathways for cardiac hypertrophy and failure. N Engl J Med 1999, 341, 1276–1283. [Google Scholar] [CrossRef] [PubMed]
- Schlaich, M.P.; Schobel, H.P.; Langenfeld, M.R.; Hilgers, K.; Schmieder, R.E. Inadequate suppression of angiotensin II modulates left ventricular structure in humans. Clin Nephrol 1998, 49, 153–159. [Google Scholar] [PubMed]
- Badenhorst, D.; Veliotes, D.; Maseko, M.; Tsotetsi, O.J.; Brooksbank, R.; Naidoo, A.; Woodiwiss, A.J.; Norton, G.R. Beta-adrenergic activation initiates chamber dilatation in concentric hypertrophy. Hypertension 2003, 41, 499–504. [Google Scholar] [CrossRef] [PubMed]
- Gonzalez, A.; Lopez, B.; Ravassa, S.; Beaumont, J.; Zudaire, A.; Gallego, I.; Brugnolaro, C.; Diez, J. Cardiotrophin-1 in hypertensive heart disease. Endocrine 2012, 42, 9–17. [Google Scholar] [CrossRef]
- Song, K.; Wang, S.; Huang, B.; Luciano, A.; Srivastava, R.; Mani, A. Plasma cardiotrophin-1 levels are associated with hypertensive heart disease: A meta-analysis. J Clin Hypertens (Greenwich) 2014, 16, 686–692. [Google Scholar] [CrossRef]
- de Simone, G.; Gottdiener, J.S.; Chinali, M.; Maurer, M.S. Left ventricular mass predicts heart failure not related to previous myocardial infarction: The Cardiovascular Health Study. Eur Heart J 2008, 29, 741–747. [Google Scholar] [CrossRef]
- Aurigemma, G.P.; Gaasch, W.H. Clinical practice. Diastolic heart failure. N Engl J Med 2004, 351, 1097–1105. [Google Scholar] [CrossRef] [PubMed]
- Kozakova, M.; Palombo, C.; Pratali, L.; Pittella, G.; Galetta, F.; L’Abbate, A. Mechanisms of coronary flow reserve impairment in human hypertension. An integrated approach by transthoracic and transesophageal echocardiography. Hypertension 1997, 29, 551–559. [Google Scholar] [CrossRef]
- Rizzoni, D.; Palombo, C.; Porteri, E.; Muiesan, M.L.; Kozakova, M.; La Canna, G.; Nardi, M.; Guelfi, D.; Salvetti, M.; Morizzo, C.; et al. Relationships between coronary flow vasodilator capacity and small artery remodelling in hypertensive patients. J Hypertens 2003, 21, 625–631. [Google Scholar] [CrossRef]
- Mancia, G.; Fagard, R.; Narkiewicz, K.; Redon, J.; Zanchetti, A.; Bohm, M.; Christiaens, T.; Cifkova, R.; De Backer, G.; Dominiczak, A.; et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2013, 31, 1281–1357. [Google Scholar] [CrossRef] [PubMed]
- Cuspidi, C.; Tadic, M.; Grassi, G. Diastolic dysfunction, blood pressure and obesity: New insights from a general population. J Hypertens 2014, 32, 2359–2361. [Google Scholar] [CrossRef]
- Maeder, M.T.; Ammann, P.; Rickli, H. The diagnosis of heart failure with normal ejection fraction—A demanding task! Swiss Med Wkly 2010, 140, 323, author reply 324. [Google Scholar] [CrossRef] [PubMed]
- Rimoldi, S.F.; Noll, G.; Allemann, Y. Hypertensive Herzkrankheit. Schweiz Med Forum 2009, 9, 516–519. [Google Scholar] [CrossRef]
- Kannel, W.B.; Gordon, T.; Offutt, D. Left ventricular hypertrophy by electrocardiogram. Prevalence, incidence, and mortality in the Framingham study. Ann Intern Med 1969, 71, 89–105. [Google Scholar] [CrossRef]
- Vakili, B.A.; Okin, P.M.; Devereux, R.B. Prognostic implications of left ventricular hypertrophy. Am Heart J 2001, 141, 334–341. [Google Scholar] [CrossRef]
- Bacharova, L.; Estes, H.; Bang, L.; Rowlandson, I.; Schillaci, G.; Verdecchia, P.; Macfarlane, P.W. The first statement of the Working Group on Electrocardiographic Diagnosis of Left Ventricular Hypertrophy. J Electrocardiol 2010, 43, 197–199. [Google Scholar] [CrossRef]
- Hancock, E.W.; Deal, B.J.; Mirvis, D.M.; Okin, P.; Kligfield, P.; Gettes, L.S.; Bailey, J.J.; Childers, R.; Gorgels, A.; Josephson, M.; et al. AHA/ACCF/HRS recommendations for the standardization and interpretation of the electrocardiogram: Part V: Electrocardiogram changes associated with cardiac chamber hypertrophy: A scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society. Endorsed by the International Society for Computerized Electrocardiology. J Am Coll Cardiol 2009, 53, 992–1002. [Google Scholar]
- Chin, D.; Battistoni, A.; Tocci, G.; Passerini, J.; Parati, G.; Volpe, M. Non-invasive diagnostic testing for coronary artery disease in the hypertensive patient: Potential advantages of a risk estimation-based algorithm. Am J Hypertens 2012, 25, 1226–1235. [Google Scholar] [CrossRef]
- Zuber, M.; Erne, P. Hypertensive Herzkrankheit—Zur Diagnoseist der Nachweis einer linksventrikulären Hypertrophie nicht nötig. Cardiovascular Medicine 2014, 17, 37–39. [Google Scholar]
- Rimoldi, S.F.; Noll, G.; Allemann, Y. Hypertensive Herzkrankheit. Schweiz Med Forum 2009, 9, 516–519. [Google Scholar] [CrossRef]
- Schillaci, G.; De Simone, G.; Reboldi, G.; Porcellati, C.; Devereux, R.B.; Verdecchia, P. Change in cardiovascular risk profile by echocardiography in low- or medium-risk hypertension. J Hypertens 2002, 20, 1519–1525. [Google Scholar] [CrossRef] [PubMed]
- Lang, R.M.; Bierig, M.; Devereux, R.B.; Flachskampf, F.A.; Foster, E.; Pellikka, P.A.; Picard, M.H.; Roman, M.J.; Seward, J.; Shanewise, J.; et al. Recommendations for chamber quantification. Eur J Echocardiogr 2006, 7, 79–108. [Google Scholar] [CrossRef]
- Cuspidi, C.; Meani, S.; Negri, F.; Giudici, V.; Valerio, C.; Sala, C.; Zanchetti, A.; Mancia, G. Indexation of left ventricular mass to body surface area and height to allometric power of 2.7: Is the difference limited to obese hypertensives? J Hum Hypertens 2009, 23, 728–734. [Google Scholar] [CrossRef]
- Chirinos, J.A.; Segers, P.; De Buyzere, M.L.; Kronmal, R.A.; Raja, M.W.; De Bacquer, D.; Claessens, T.; Gillebert, T.C.; John-Sutton, M.S.; Rietzschel, E.R. Left ventricular mass: Allometric scaling, normative values, effect of obesity, and prognostic performance. Hypertension 2010, 56, 91–98. [Google Scholar] [CrossRef]
- Verdecchia, P.; Schillaci, G.; Borgioni, C.; Ciucci, A.; Battistelli, M.; Bartoccini, C.; Santucci, A.; Santucci, C.; Reboldi, G.; Porcellati, C. Adverse prognostic significance of concentric remodeling of the left ventricle in hypertensive patients with normal left ventricular mass. J Am Coll Cardiol 1995, 25, 871–878. [Google Scholar] [CrossRef]
- Hensel, K.O.; Jenke, A.; Leischik, R. Speckle-tracking and tissue-Doppler stress echocardiography in arterial hypertension: A sensitive tool for detection of subclinical LV impairment. Biomed Res Int, 2014. 2014, 472562.
- Kato, T.S.; Noda, A.; Izawa, H.; Yamada, A.; Obata, K.; Nagata, K.; Iwase, M.; Murohara, T.; Yokota, M. Discrimination of nonobstructive hypertrophic cardiomyopathy from hypertensive left ventricular hypertrophy on the basis of strain rate imaging by tissue Doppler ultrasonography. Circulation 2004, 110, 3808–3814. [Google Scholar] [CrossRef]
- Verdecchia, P.; Staessen, J.A.; Angeli, F.; de Simone, G.; Achilli, A.; Ganau, A.; Mureddu, G.; Pede, S.; Maggioni, A.P.; Lucci, D.; et al. Usual versus tight control of systolic blood pressure in non-diabetic patients with hypertension (Cardio-Sis): An open-label randomised trial. Lancet 2009, 374, 525–533. [Google Scholar] [CrossRef] [PubMed]
- Levy, D.; Salomon, M.; D’Agostino, R.B.; Belanger, A.J.; Kannel, W.B. Prognostic implications of baseline electrocardiographic features and their serial changes in subjects with left ventricular hypertrophy. Circulation 1994, 90, 1786–1793. [Google Scholar] [CrossRef]
- Dahlof, B.; Devereux, R.B.; Kjeldsen, S.E.; Julius, S.; Beevers, G.; de Faire, U.; Fyhrquist, F.; Ibsen, H.; Kristiansson, K.; Lederballe-Pedersen, O.; et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): A randomised trial against atenolol. Lancet 2002, 359, 995–1003. [Google Scholar] [CrossRef]
- Fagard, R.H.; Celis, H.; Thijs, L.; Wouters, S. Regression of left ventricular mass by antihypertensive treatment: A meta-analysis of randomized comparative studies. Hypertension 2009, 54, 1084–1091. [Google Scholar] [CrossRef] [PubMed]
- Pitt, B.; Reichek, N.; Willenbrock, R.; Zannad, F.; Phillips, R.A.; Roniker, B.; Kleiman, J.; Krause, S.; Burns, D.; Williams, G.H. Effects of eplerenone, enalapril, and eplerenone/enalapril in patients with essential hypertension and left ventricular hypertrophy: The 4E-left ventricular hypertrophy study. Circulation 2003, 108, 1831–1838. [Google Scholar] [CrossRef]
- McMurray, J.J.; Adamopoulos, S.; Anker, S.D.; Auricchio, A.; Bohm, M.; Dickstein, K.; Falk, V.; Filippatos, G.; Fonseca, C.; Gomez-Sanchez, M.A.; et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012, 33, 1787–1847. [Google Scholar] [PubMed]
© 2015 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).
Share and Cite
Brennera, R.; Diethelmb, M.; Ricklia, H.; Maedera, M.T. Update Hypertensive Herzkrankheit. Cardiovasc. Med. 2015, 18, 312. https://doi.org/10.4414/cvm.2015.00361
Brennera R, Diethelmb M, Ricklia H, Maedera MT. Update Hypertensive Herzkrankheit. Cardiovascular Medicine. 2015; 18(11):312. https://doi.org/10.4414/cvm.2015.00361
Chicago/Turabian StyleBrennera, Roman, Markus Diethelmb, Hans Ricklia, and Micha T. Maedera. 2015. "Update Hypertensive Herzkrankheit" Cardiovascular Medicine 18, no. 11: 312. https://doi.org/10.4414/cvm.2015.00361
APA StyleBrennera, R., Diethelmb, M., Ricklia, H., & Maedera, M. T. (2015). Update Hypertensive Herzkrankheit. Cardiovascular Medicine, 18(11), 312. https://doi.org/10.4414/cvm.2015.00361




