Fallberichte
Wir berichten über zwei Patienten mit akutem Myokardinfarkt, bei denen unter notfallmässigem Einsatz einer Extrakorporalen Membranoxygenierung (ECMO) im Herzkatheterlabor eine Revaskularisierung vorgenommen wurde.
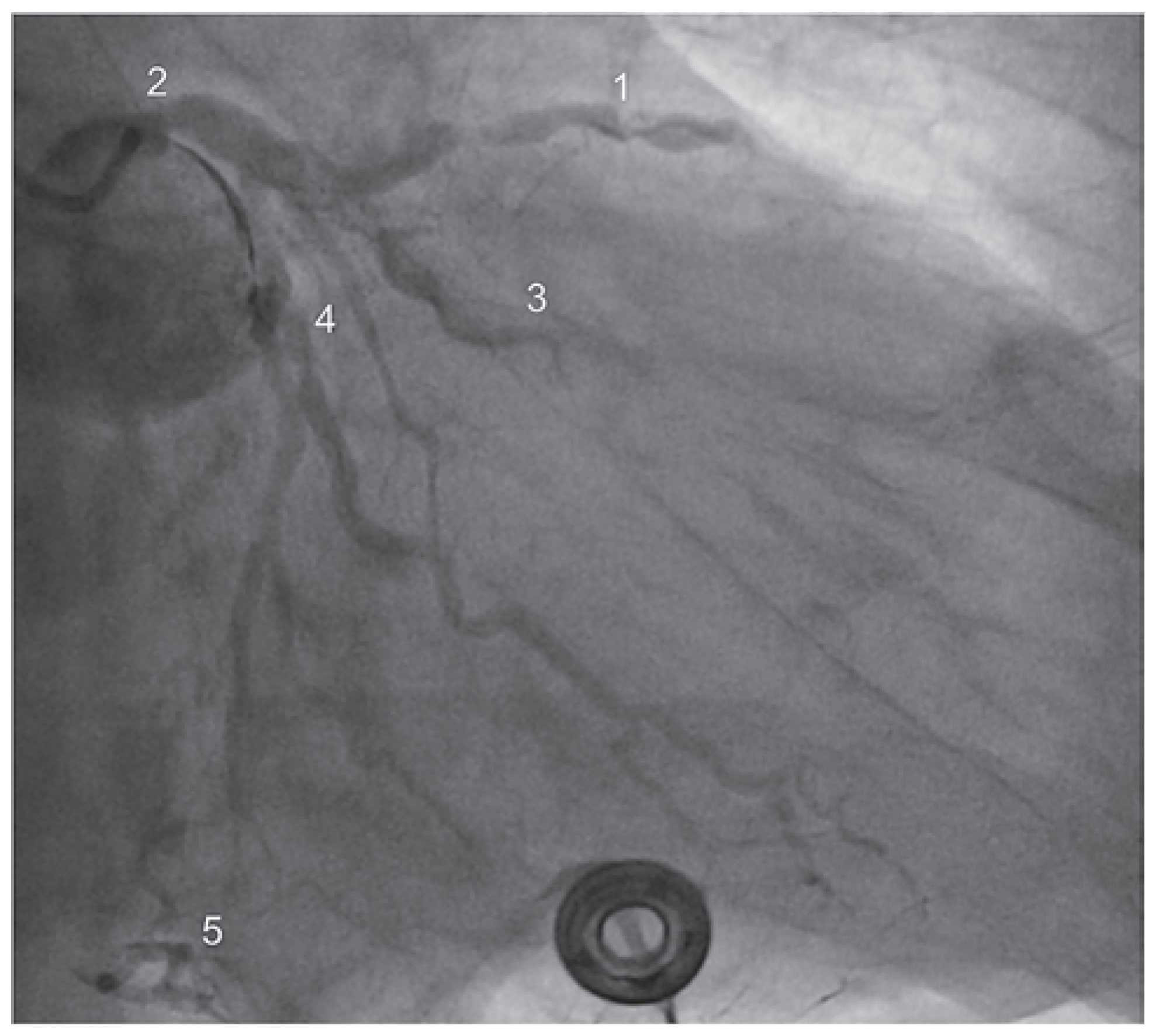
Die Zuweisung des 90-jährigen Patienten durch die Sanität erfolgte aufgrund eines akuten anterioren ST-Hebungsinfarktes mit typischer Symptomatik und zweifach über der Norm erhöhtem hoch-sensitivem Troponin T. Die Koronarangiographie zeigte als ursächliche Läsion einen Verschluss des mittleren Ramus interventricularis anterior (RIVA) (Abbildung 1). Insgesamt fand sich angiographisch eine schwerere koronare 3-Gefäss-Erkrankung: 70% Hauptstammstenose, mittlerer RIVA-Verschluss, subtotale Stenose des Ramus intermedius (RIM), 70% Stenose des 1. Marginalastes des Ramus circumflexus (RCX) und ein chronischer Verschluss der rechten Koronararterie (RCA). Ventrikulographisch zeigte sich eine schwer eingeschränkte linksventrikuläre systolische Funktion (Auswurffraktion [EF] = 25%) bei Akinesie der Vorderwand sowie Hypokinesie der übrigen definierten Segmente.
Der erste invasiv gemessene mittlere arterielle Blutdruck (MAP) betrug 76 mmHg; er sank im Verlauf von wenigen Minuten auf 50 mmHg, verbunden mit einem Abfall der zentralvenösen Sättigung (unter 8 l O2/min über Sauerstoffmaske) und einem Anstieg des Laktats auf 3.4 mmol/l.
Abbildung 1.
Koronarangiographie vor Intervention – Fall 1. 1 – RIVA, 2 – Hauptstamm, 3 – RIM, 4 – Marginalast 1/RCX. 5 – retrograde Darstellung der chronisch verschlossenen RCA.
Abbildung 1.
Koronarangiographie vor Intervention – Fall 1. 1 – RIVA, 2 – Hauptstamm, 3 – RIM, 4 – Marginalast 1/RCX. 5 – retrograde Darstellung der chronisch verschlossenen RCA.
Aufgrund der Koronaranatomie und des progredienten Herzkreislauf-Versagens bestand somit eine Hochrisiko-Konstellation für die indizierte perkutane Koronarintervention (PCI). Es erfolgte, bei insgesamt altersentprechend sehr gutem Allgemeinzustand des aktiven Patienten, der interdisziplinäre Entscheid zur Einlage einer veno-arteriellen ECMO.
Die ECMO-Einlage erfolgte unter sterilen Kautelen. Zusätzlich zur bereits durchgeführter Punktion der Arteria femoralis rechts erfolgte nach entsprechender Lokalanästhesie die Punktion der linken Arteria femoralis (antegrad und retrograd). Anschliessend erfolgte eine perkutane Einlage einer 28F-Schleuse in Seldinger-Technik in die linke A. femoralis nach proximal sowie einer 8F-Schleuse nach distal zur Sicherstellung der Perfusion des Beines. Im nächsten Schritt wurde eine venöse 28F-Kanüle in die rechte Vena femoralis perkutan eingelegt (Seldinger-Technik) und diese Kanüle unter Durchleuchtung auf Höhe der Vena cava inferior und dem Eingang des rechten Vorhofs platziert. Im Anschluss wurden die arterielle und venöse Kanüle luftfrei mit dem ECMO-System verbunden und die extrakorporale Zirkulation begonnen. Die Flussrate betrug schliesslich 3 l/min/m2, worunter sich rasch eine Verbesserung der Hämodynamik mit Erholung des MAP auf durchschnittlich 75 mmHg und Anstieg der zentralvenösen Sättigung sowie Reduktion des Laktats auf 1,6 mmol/l einstellte.
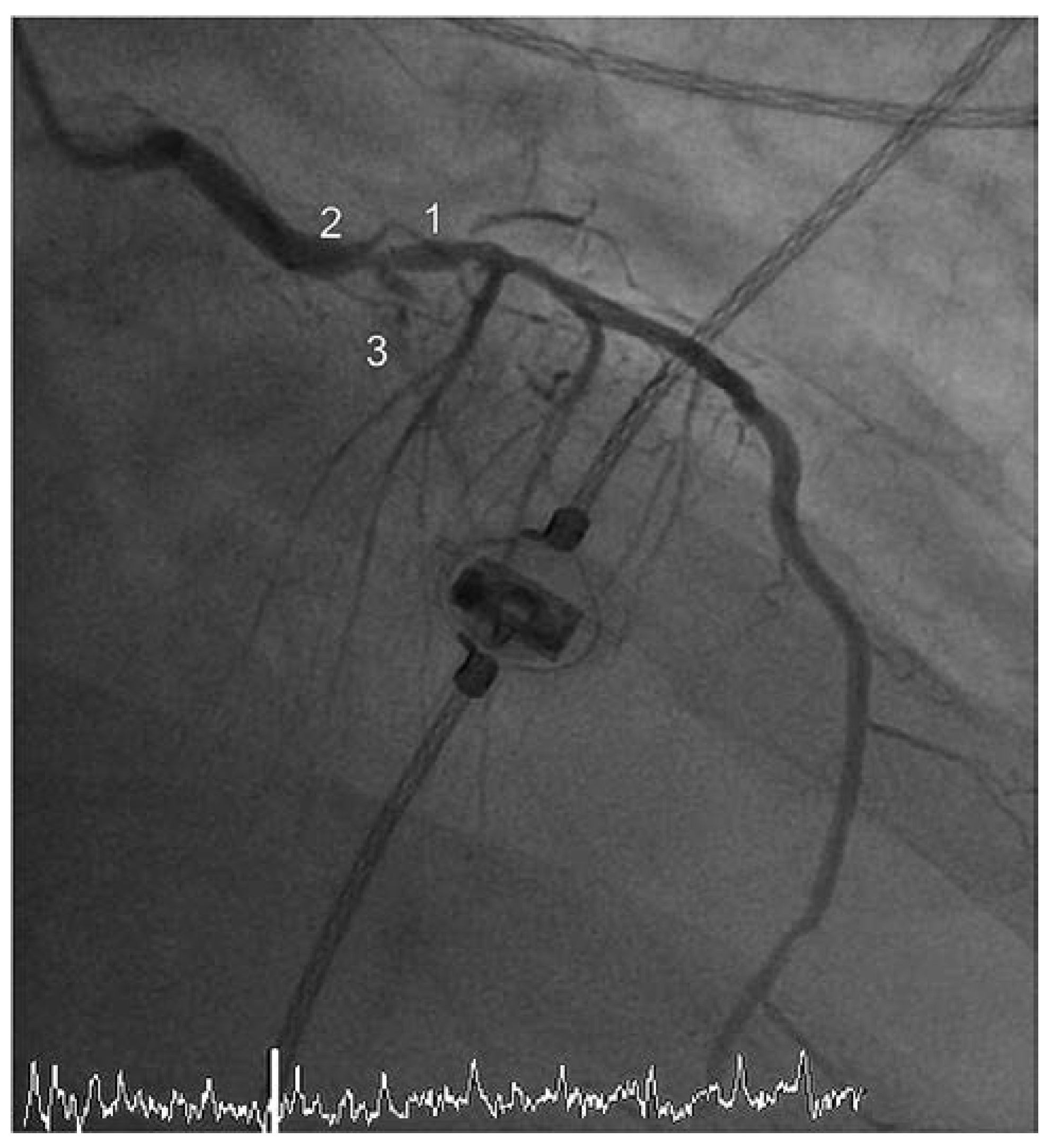
Unter diesem hämodynamischen Backup gelang die Durchführung der PCI mit Rekanalisation des RIVA mittels PTCA und 3-fach-Stent-Implantation (3× «drug eluting» Stents [DES]) sowie die Wiedereröffnung der subtotalen Stenose des Intermediärastes (PTCA/1× DES). Zudem konnte die hochgradige Hauptstammstenose mittels primärer Stentimplantation (1× DES) versorgt werden. Die Kontrollangiographie dokumentierte ein gutes postinterventionelles Ergebnis mit promptem Fluss bis in die Peripherie (Thrombolysis in myocardial Infarction-Klassifikation [TIMI] III) (Abbildung 2). Der Verschluss des arteriellen inguinalen Zugangs erfolgte mittels eines herkömmlichen perkutanen Verschluss-Systems (Angio-SealTM, St. Jude Medical, MN, USA).
Abbildung 2.
Koronarangiographie nach Intervention – Fall 1.
Abbildung 2.
Koronarangiographie nach Intervention – Fall 1.
Periinterventionell erfolgte die Gabe von kumulativ 8000 E Heparin, wodurch eine «activated clotting time» (ACT) von 280 s erreicht wurde. Zudem wurde zur dualen Thrombozytenaggregationshemmung die Therapie mit Aspirin und Ticagrelor eingeleitet.
Im Anschluss an die Herzkatheterintervention wurde der Patient auf die Intensivstation verlegt, wo unter intermittierender Katecholamingabe ein Weaning von der ECMO nach 3 Tagen erzielt werden konnte. Der arterielle und venöse Zugang der ECMO wurde jeweils mit einer vor ECMO-Anlage mittels perkutanem Verschluss-System eingelegten Naht (Perclose ProGlideTM, Abbott Vascular, USA) nach Entfernung der ECMO-Kanülen komplikationslos verschlossen.
Die Maximalkonzentration des hochsensitiven Troponin T wurde am Eintrittstag mit 15 gemessen. In den folgenden Tagen konnte der erwartete Enzymrückgang dokumentierte werden. Der Aufenthalt auf der Intensivstation komplizierte sich aufgrund einer Pneumonie, die jedoch durch eine empirische Antibiotikatherapie (Piperacillin/Tazobactam) adäquat therapiert werden konnte. Nach insgesamt 10 Tagen auf der Intensivstation und Cardiac Care Unit (CCU) konnte der Patient auf die Normalstation verlegt werden. Hier erfolgte bei echokardiographischem Nachweis einer weiterhin schwer eingeschränkten linksventrikulären systolischen Funktion (EF 20–25%) der vorsichtige Ausbau der bereits begonnen Herzinsuffizienztherapie nach den aktuellen Leitlinien [
1]. Nach insgesamt 20 Tagen Spitalaufenhalt konnte der Patient zur stationären kardialen Rehabilitation verlegt werden.
Die Zuweisung des 75-jährigen Patienten erfolgte durch ein Regionalspital mit dem Bild eines subakutem Nicht-ST-Hebungsinfarktes und beginnendem kardiogenem Schock (Killip Klasse III-VI). Die Labordiagnostik zeigte erhöhte Herzenzyme (hochsensitives Troponin 0,7). Die Koronarangiographie ergab eine schwere koronare 2-Gefäss-Erkrankung mit Hauptstammbeteiligung (90% Stenose des distalen Hauptstamms sowie Verschluss des proximalen RCX und 70% Stenose des proximalen RIVA) (Abbildung 3). Bei kleiner rechter Koronararterie liess sich zudem ein Linksversorgertyp identifizieren.
Abbildung 3.
Koronarangiographie vor Intervention – Fall 2. 1 – RIVA, 2 – Hauptstamm, 3 – RCX.
Abbildung 3.
Koronarangiographie vor Intervention – Fall 2. 1 – RIVA, 2 – Hauptstamm, 3 – RCX.
Der erste invasiv gemessene mittlere arterielle Blutdruck (MAP) betrug 107 mmHg bei einer Herzfrequenz von 110/min. Die periphere Sauerstoffsättigung unter 2 l/O2 über die Nasenbrille betrug 98%.
Aufgrund der Koronaranatomie bestand eine Hochrisiko-Konstellation für die indizierte perkutane Koronarintervention (PCI). Es erfolgte der interdisziplinäre Entscheid zur Einlage einer veno-arteriellen ECMO, die wie beim oben beschriebenen Patienten im-plantiert wurde. Nach komplikationsloser Einlage erfolgte die extrakorporale Zirkulation mit schliesslich 2 l/min, worunter sich eine stabile Hämodynamik zeigte. Unter dieser ECMO-Unterstützung gelang mittels PTCA und anschliessendem V-Stenting eine Revaskularisation der Hauptstammstenose sowie der proximalen RIVAund RCX-Stenosen (Abbildung 4). Bei stabiler postinterventioneller Hämodynamik erfolgte die Entfernung der ECMO noch in gleicher Sitzung.
Abbildung 4.
Koronarangiographie nach Intervention – Fall 2.
Abbildung 4.
Koronarangiographie nach Intervention – Fall 2.
Der arterielle Zugang wurde mit einer vor ECMO-Anlage mittels perkutanem Verschluss-System eingelegten Naht (Perclose ProGlideTM, Abbott Vascular, USA) nach Entfernung der ECMO-Kanüle komplikationslos verschlossen. Der venöse Schenkel wurde mittels vorgelegter U-Naht nach Entfernung der ECMO-Kanüle problemlos verschlossen.
Im Anschluss an die Herzkatheterintervention wurde der Patient für weitere 48 Stunden intensivmedizinisch überwacht. Die maximale Konzentration des hochsensitiven Troponins wurde am ersten post-interventionellen Tag dokumentiert (3,9). In den folgenden Tagen waren die Laborwerte der Herzenzyme rückläufig. Kompliziert wurde der weitere stationäre Aufenthalt durch eine protrahierte Volumenretention infolge der schwer eingeschränkten linksventrikulären systolischen Funktion (Echokardiograpie: EF 25–30%) mit Akinesie der anterioren, anteround inferolateralen Segmente. Unter Ausbau der Herzinsuffizienztherapie und forcierter der Diurese gelang eine adäquate Negativbilanzierung mit kardialer Rekompensation des Patienten. Nach insgesamt 3 Tagen Aufenthalt in unserem Universitären Herzzentrum konnte der Patient mit nur noch diskreten Zeichen der Volumenretention zur Weiterbetreuung in ein Regionalspital verlegt werden, wo er nach weiteren 6 Tagen kardiopulmonal kompensiert nach Hause entlassen wurde.
Technische Grundlagen der ECMO
Heutige ECMO-Systeme sind eine Modifikation der herkömmlich verwendeten Herz-Lungen-Maschinen, wie sie routinemässig bei herzchirurgischen Eingriffen zum Einsatz kommen. ECMO-Systeme können wie andere kardiopulmonale Unterstützungssysteme (z.B. Impella, TandemHeart) auch zur notfallmässigen Herz-Kreislauf-Unterstützung eingesetzt werden.
Die notfallmässige mechanische Kreislaufunterstütutzung mittels ECMO erfolgt mehrheitlich durch eine veno-arterielle Kanülierung. Hierzu erfolgt die Anlage eines kardiopulmonalen Bypasses über periphere Gefässe. Der thorakale Zugang mittels Sternotomie unter Einbeziehung zentraler Gefässe findet notfallmässig kaum Verwendung.
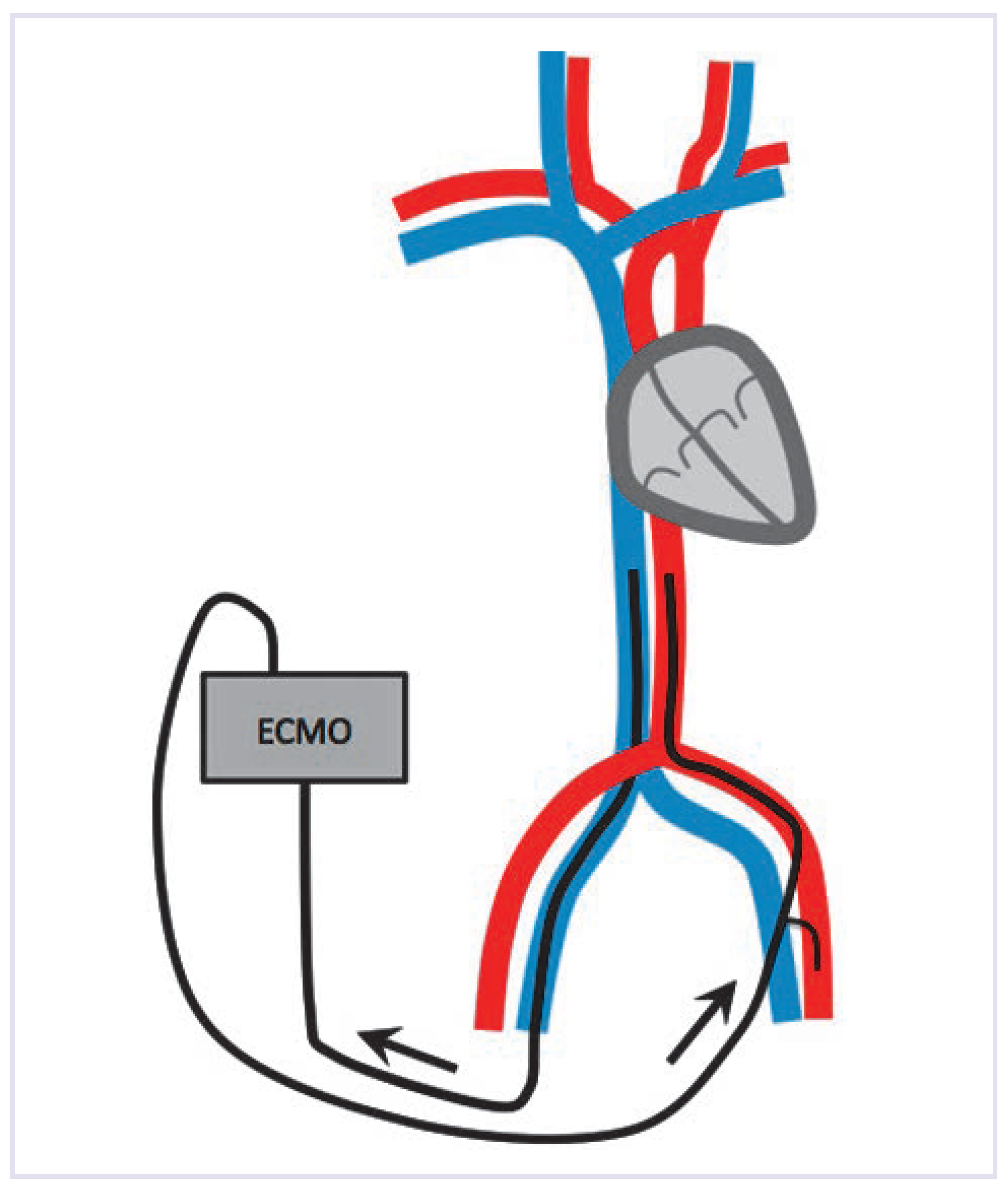
Der Anschluss des Patienten an das extrakorporale ECMO-System wird durch perkutane Einlage einer langen Drainagekanüle (inguinaler Zugang) in die Vena cava inferior bzw. den rechten Vorhof sowie durch eine rückführende Kanüle in die Arteria femoralis gewährleistet (Abbildung 5). Zur Aufrechterhaltung der Durchblutung des jeweiligen Beins mit liegender arterieller Kanüle erfolgt die Einlage eines zweiten nach distal gerichteten Katheters. Hierdurch wird eine kritische Ischämie der jeweiligen Extremität heutzutage weitgehend vermieden.
Abbildung 5.
Schematische Darstellung einer ECMO.
Abbildung 5.
Schematische Darstellung einer ECMO.
Hauptbestandteile des ECMO-Systems sind die Blutpumpe (Zentrifugalpumpe), der Oxygenator und der Wärmetauscher. Mittels Zentrifugalpumpe wird Blut über den venösen Schenkel (aus V. cava inferior / rechtem Vorhof) dem Körperkreislauf entzogen und dem kombinierten Oxygenator/Wärmetauscher der ECMO zugeführt. Hier wird zum einen das Blut erwärmt und oxygeniert und zum anderen CO2 eliminiert. Schliesslich wird dieses Blut über den arteriellen Schenkel (A. femoralis) dem arteriellen Körper-Kreislauf mit Systemdrücken wieder zugeführt. ECMO-Systeme können Blutflüsse bis 6,0 l/min gewährleisten.
Die Überwachung einer adäquaten Organperfusion wird durch Monitoring gängiger Parameter wie arterieller Blutdruck, Laktatkonzentration, zentralund gemischtvenöse Sauerstoffsättigung usw. sichergestellt. Zudem bedarf es einer therapeutischen Heparinisierung des Patienten, da der Blutkontakt mit Teilen des ECMO-Systems zu einer Aktivierung der Gerinnungskaskade führen kann.
Moderne ECMO-Systeme sind sehr kompakt (Abbildung 6), somit schnell transportabel und können ohne permanente Anwesenheit eines Kardiotechnikers auf einer Intensivstation betrieben werden.
Abbildung 6.
Bei den Interventionen verwendetes ECMO-System.
Abbildung 6.
Bei den Interventionen verwendetes ECMO-System.
Diskussion
Die ECMO kommt zur intensivmedinischen Betreuung bei Patienten mit Lungenund/oder Herz-KreislaufVersagen zum Einsatz, bei denen eine potentiell reversible Ursache dieses kardiopulmonalen Versagens vorliegt.
Häufigste Indikation ist die kurzfristige perioperative Kreislauf-Unterstützung im Rahmen herzchirugischer Eingriffe. Der Einsatz einer ECMO im Herzkatheterlabor findet insbesondere Anwendung zur Herz-Kreislauf-Unterstützung bei Patienten mit kardiogenem Schock oder – wie hier gezeigt – als «back up» bei Hochrisikoeingriffen. Diesbezüglich besteht eine Klasse IIb (Level C)-Empfehlung entsprechend der ESC-Richtlinien für ST-Hebungsinfarkt [
2].
Weiteren Einsatz findet die ECMO in der Kardiologie bei Patienten mit behandlungsresistentem kardiogenem Schock zur vorübergehenden Kreislaufunterstützung bis zur Erholung der kardialen Funktion (z.B. Myokarditis). Darüber hinaus wird die ECMO in akuten Situationen bei Patienten auf der Warteliste für eine Herztransplantation genutzt – hier meist als «bridge to bridge»-Option bis zur Einlage eines ventrikulären Unterstützungssystems oder seltener als «bridge to transplant»-Option bis zur Durchführung der Herztransplantation.
Die Studienlage hinsichtlich des Einflusses verschiedenster Faktoren auf das Outcome nach ECMOEinlage ist sehr heterogen. Einige Studien identifizieren hier ein hohes Lebensalter als wichtigen Problemfaktor [
3], wohingegen andere Studien zeigen, dass der Einsatz bei älteren Patienten ein ähnliches Outcome im Vergleich zu jüngeren Patienten-Kohorten aufweist [
4].
Aus unserer Sicht sollte bei hochbetagten Patienten die Indikation zur ECMO-Einlage unter Berücksichtigung der Komorbiditäten jeweils im Einzelfall interdisziplinär geprüft werden. Wie die vorliegenden Fälle zeigen, ist die ECMO in ausgewählten Fällen auch bei hochbetagten Patienten mit akutem Koronarsyndrom und komplexer Hochrisiko-Anatomie («last remaining vessel») eine erfolgsversprechende Therapieoption.