Vaskuläre Malformationen—Diagnostik und Behandlung
Abstract
Einleitung
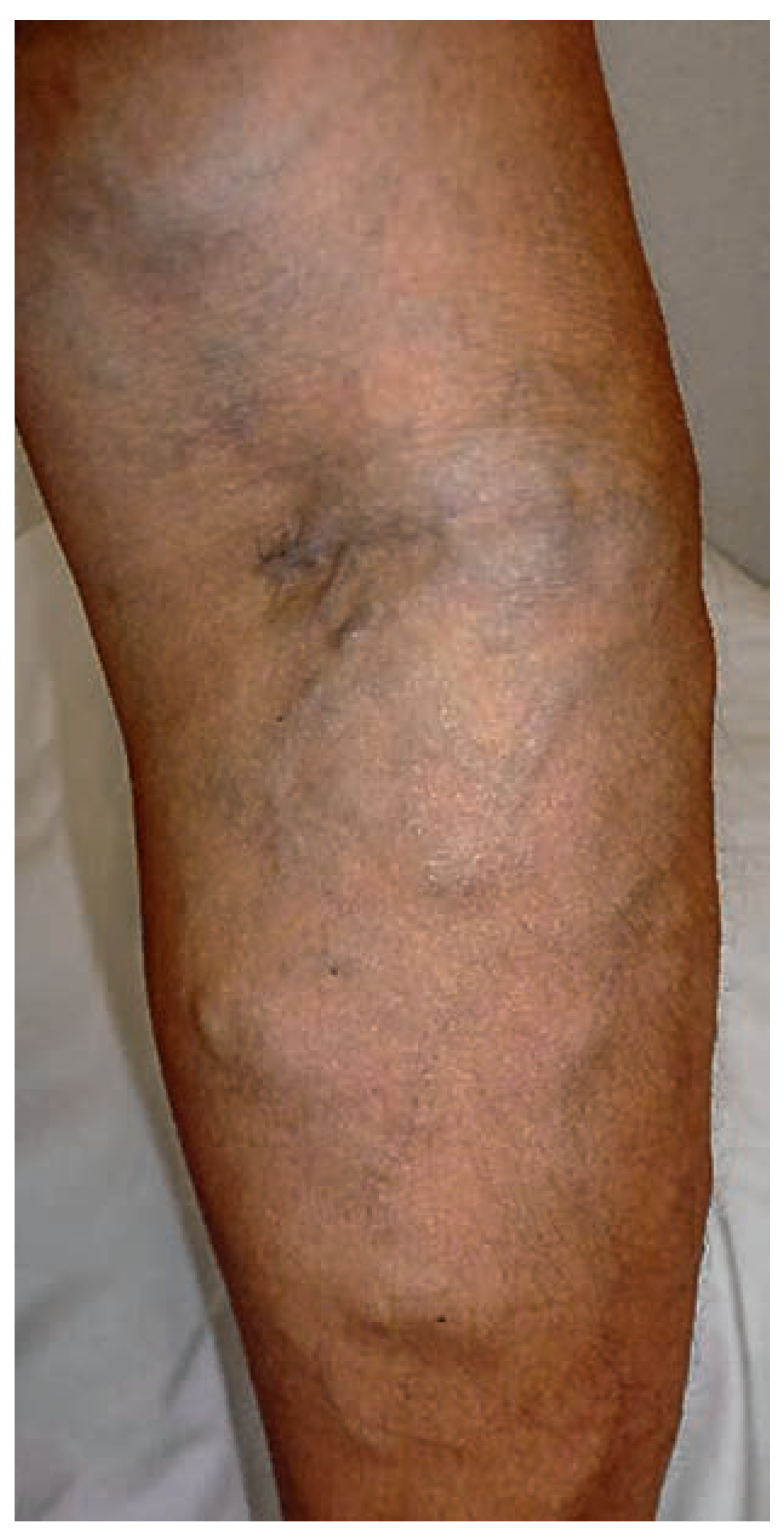
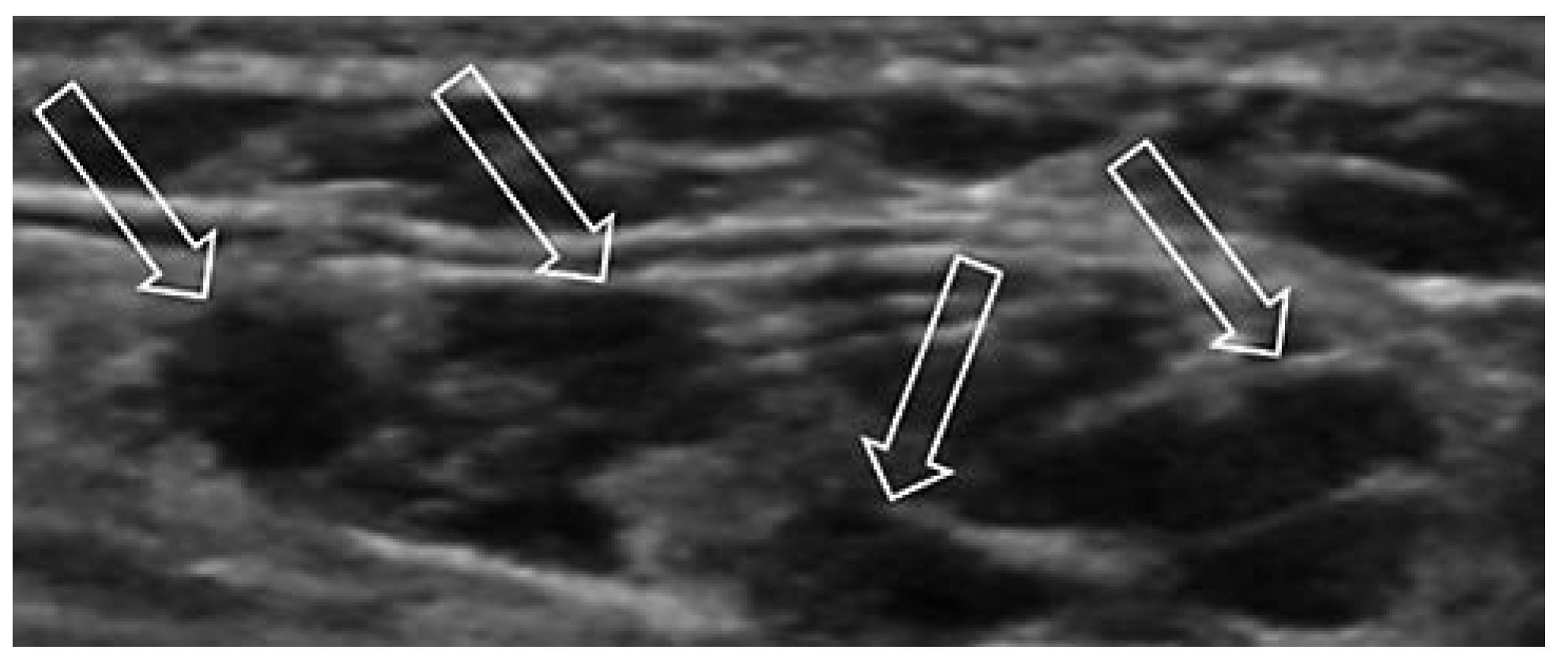
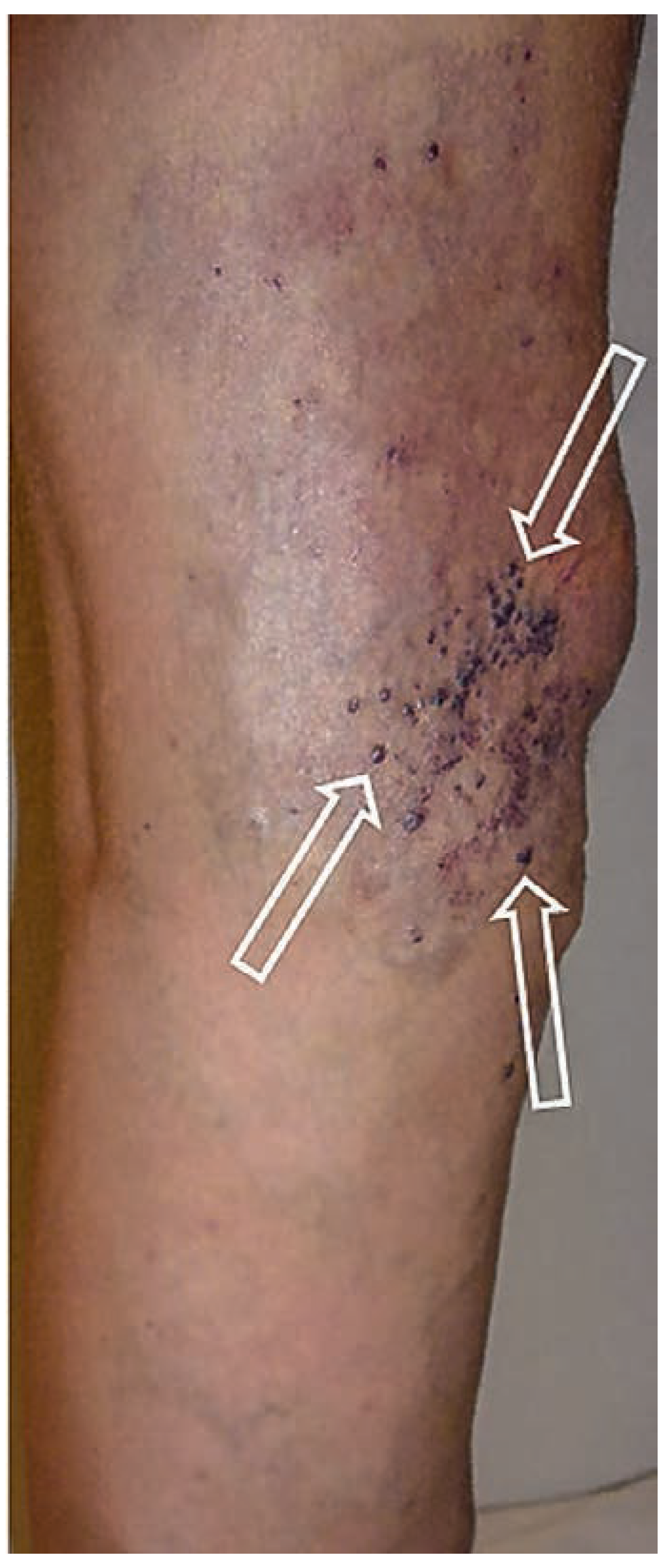
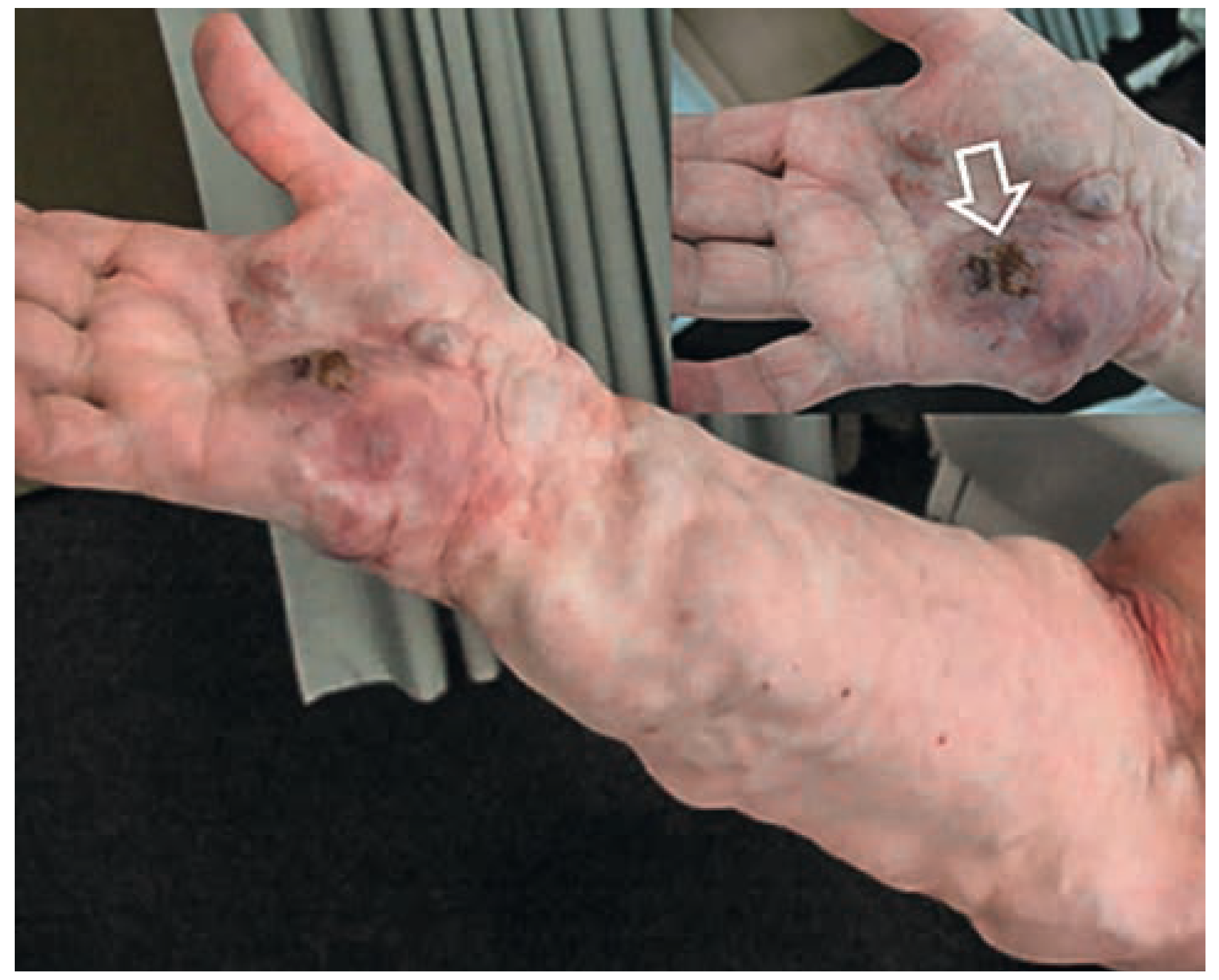
Venöse Malformationen
Kapillär-lymphatisch-venöse Malformation mit Überwuchs (Klippel-Trénaunay-Syndrom)
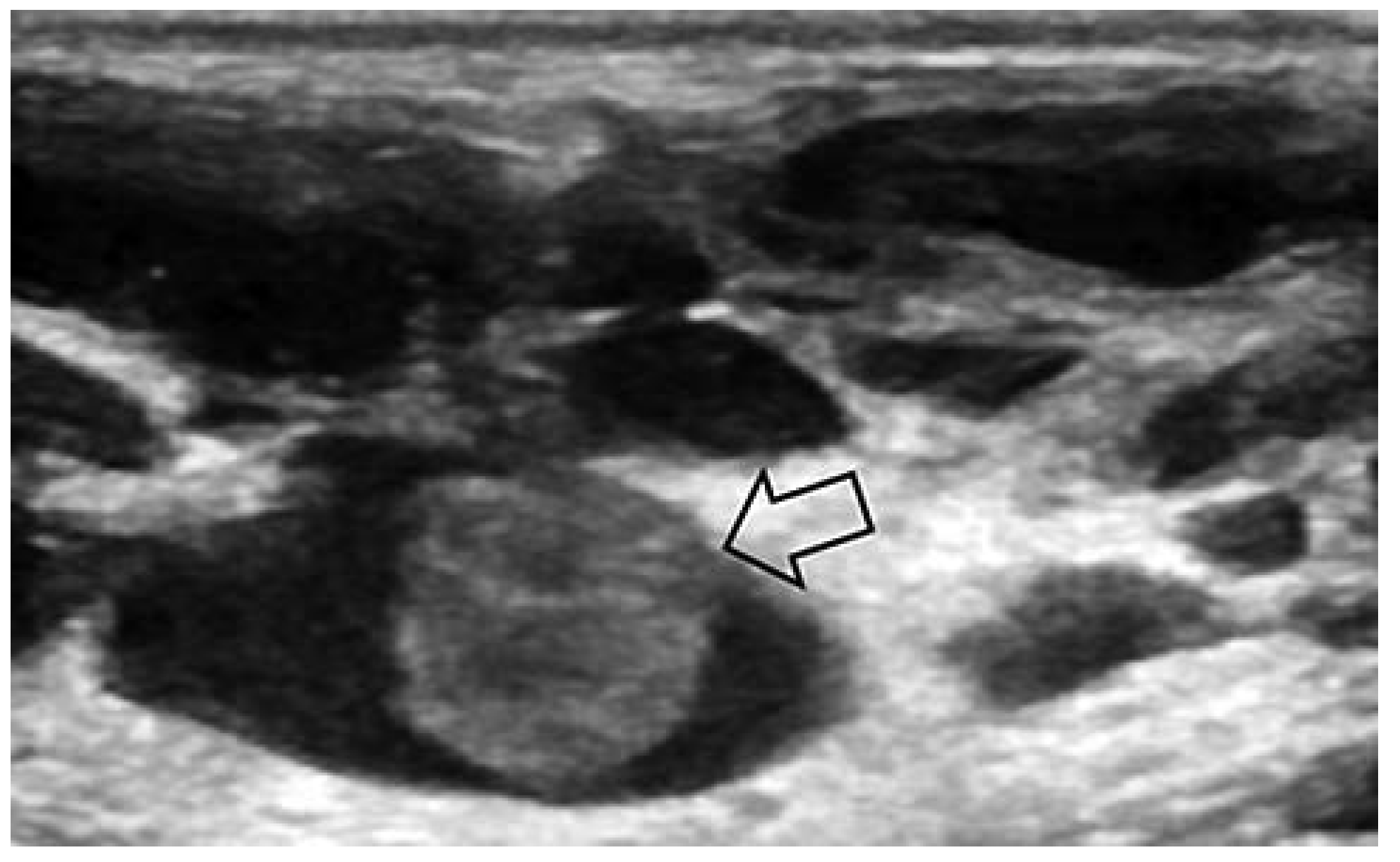
Lymphatische Malformation
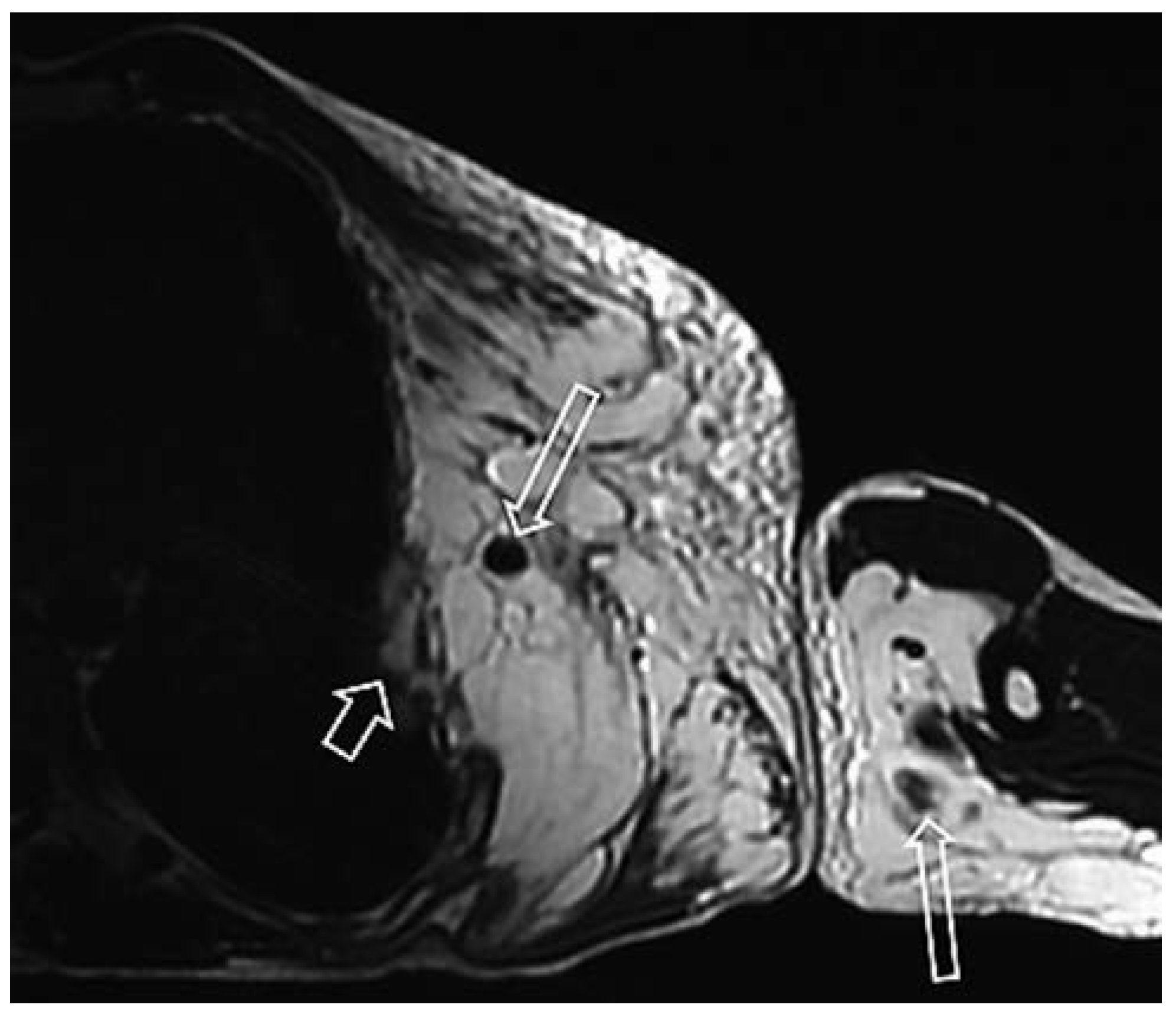
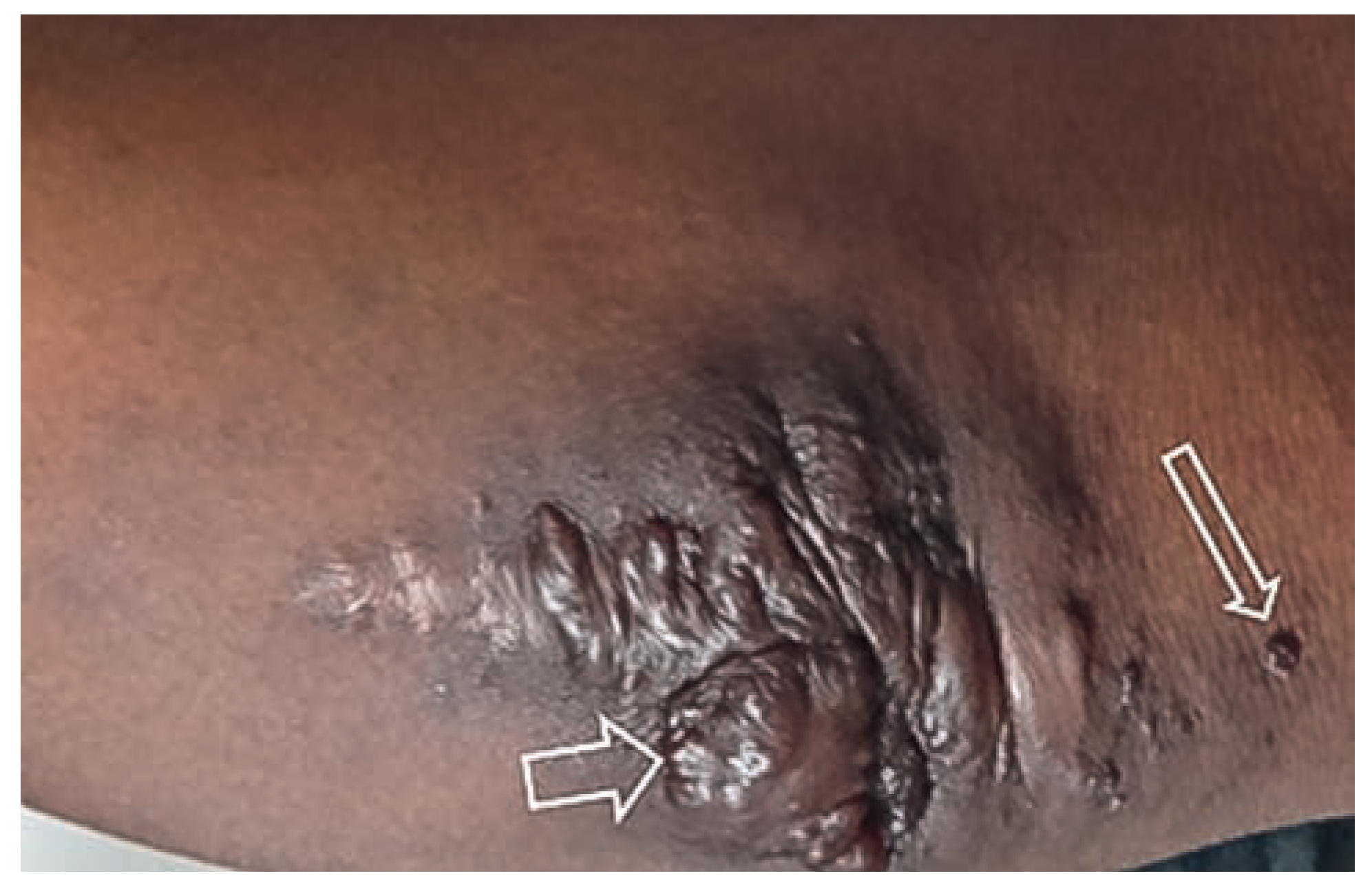
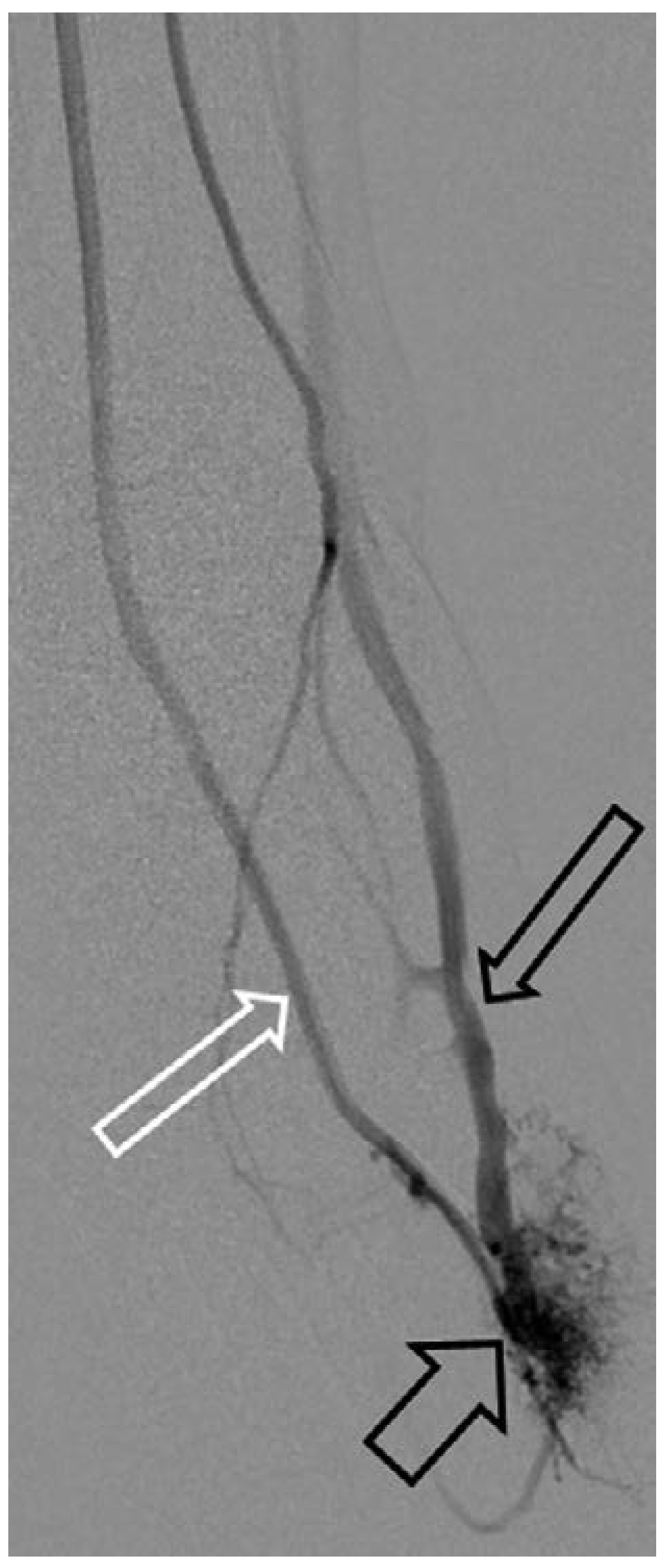
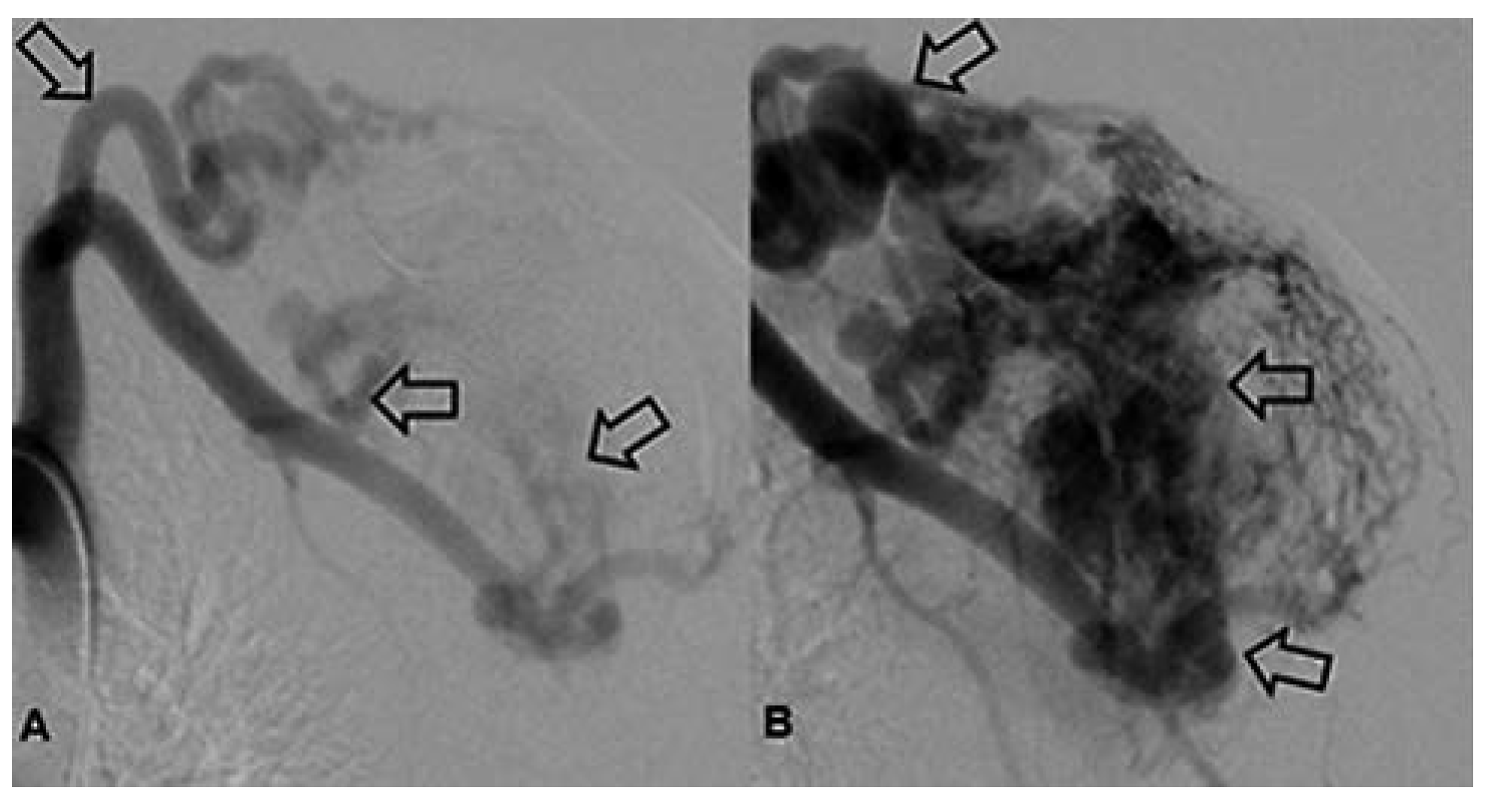
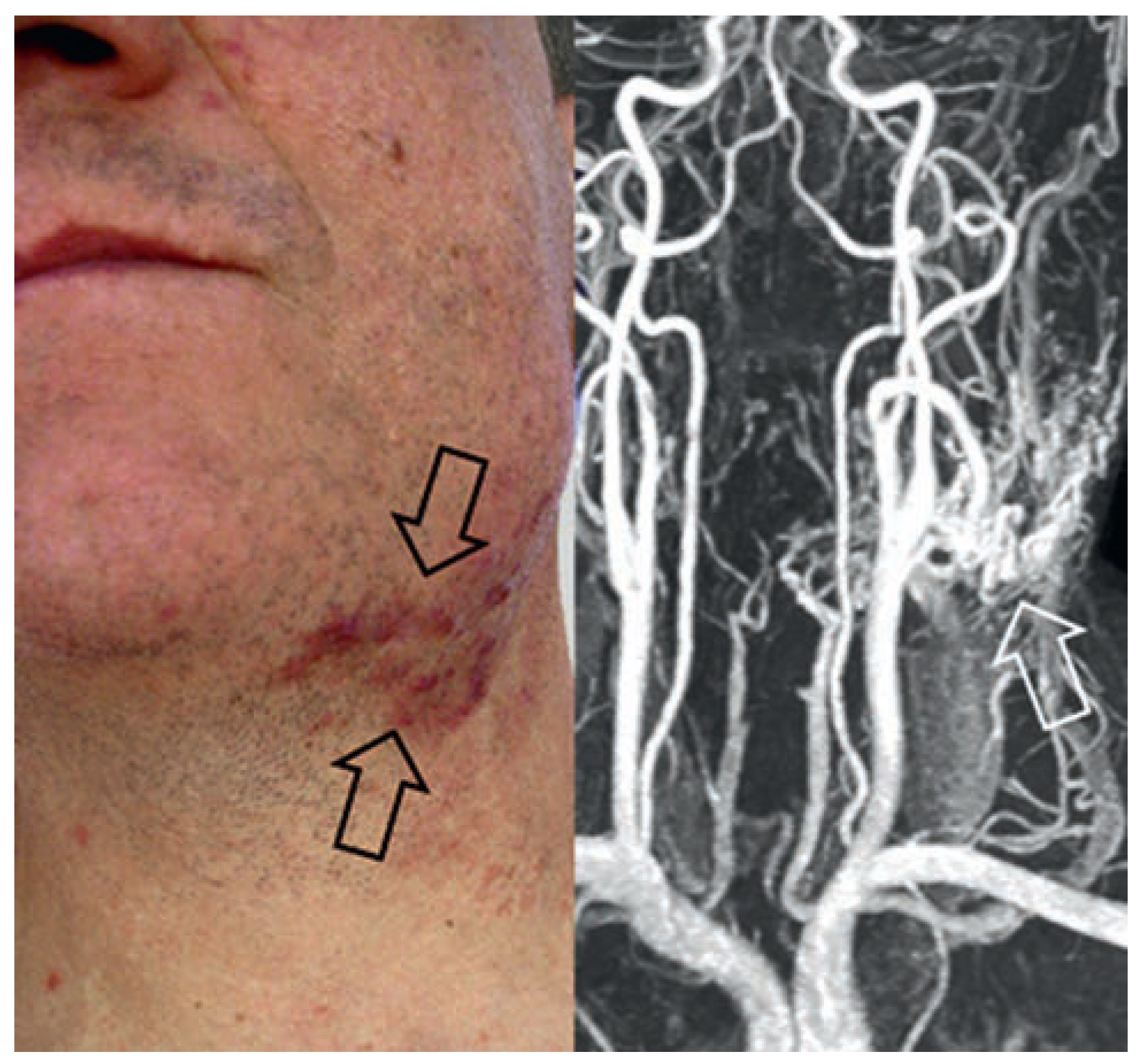
Arteriovenöse Malformation
Arterielle Malformation und arteriovenöse Fistel
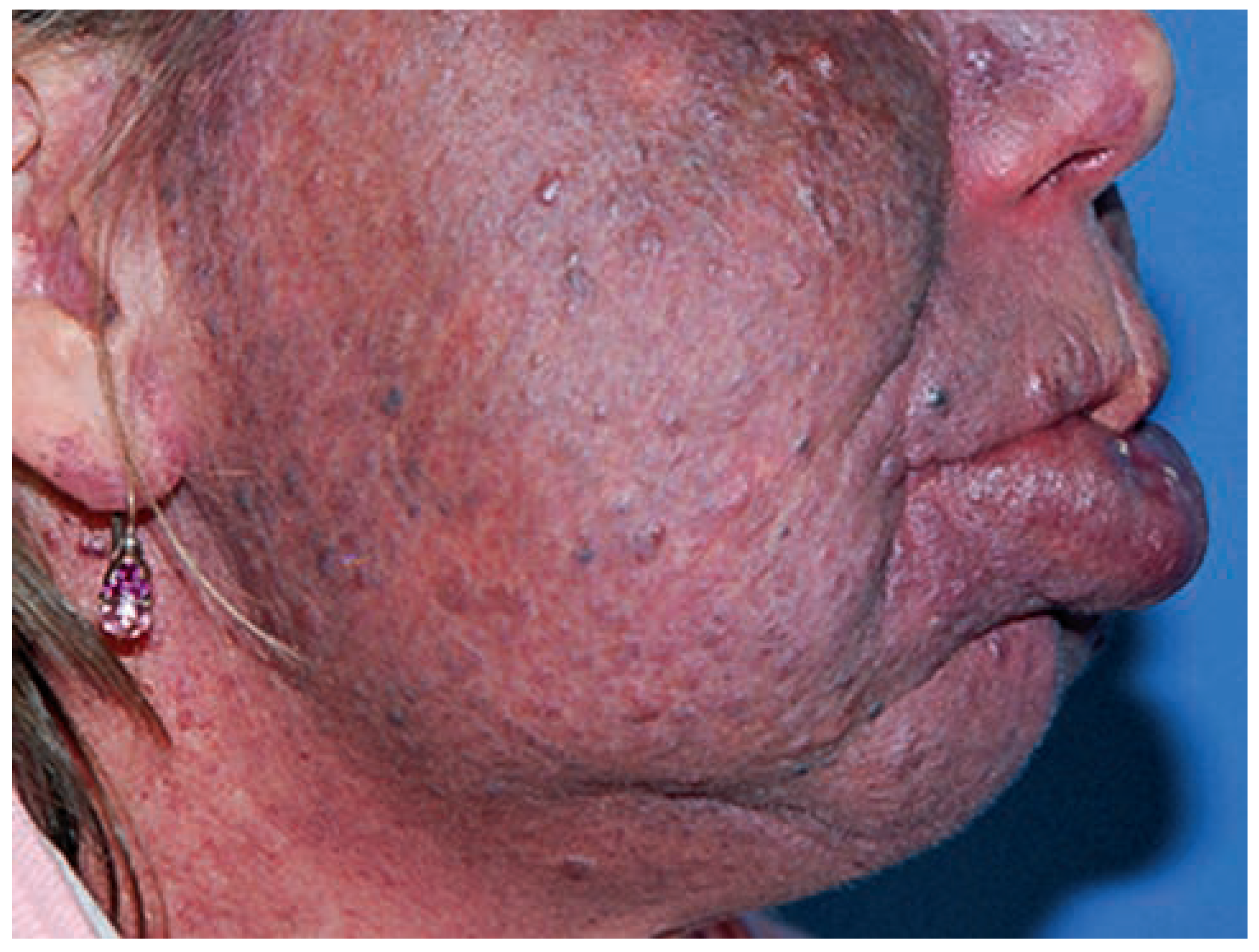
Kapilläre Malformation
Koagulopathie bei vaskulären Malformationen
Funding/potential competing interests
References
- Mulliken, J.B.; Glowacki, J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg. 1982, 69, 412–422. [Google Scholar] [CrossRef] [PubMed]
- Greene, A.K.; et al. Risk of vascular anomalies with Down syndrome. Pediatrics 2008, 121, e135.40. [Google Scholar] [CrossRef] [PubMed]
- Finn, M.C.; Glowacki, J.; Mulliken, J.B. Congenital vascular lesions: clinical application of a new classification. J Pediatr Surg. 1983, 18, 894–900. [Google Scholar] [CrossRef] [PubMed]
- Tu, J.B.; et al. Induction of apoptosis in infantile hemangioma endothelial cells by propranolol. Exp Ther Med. 2013, 6, 574–578. [Google Scholar] [CrossRef]
- Hassanein, A.H.; et al. Evaluation of terminology for vascular anomalies in current literature. Plast Reconstr Surg. 2011, 127, 347–351. [Google Scholar] [CrossRef]
- Tsai, A.; et al. Misdiagnosis of knee venous malformation as juvenile idiopathic arthritis. J Pediatr Orthop. 2011, 31, 683–690. [Google Scholar] [CrossRef]
- Belov, S. Anatomopathological classification of congenital vascular defects. Semin Vasc Surg. 1993, 6, 219–224. [Google Scholar]
- Greene, A.K.; et al. Vascular anomalies in 5,621 patients: guidelines for referral. J Pediatr Surg. 2011, 46, 1784–1789. [Google Scholar] [CrossRef]
- Alomari, A.I.; et al. Fibro-adipose vascular anomaly: clinical-radiologicpathologic features of a newly delineated disorder of the extremity. J Pediatr Orthop. 2014, 34, 109–117. [Google Scholar] [CrossRef]
- Hassanein, A.H.; et al. Venous malformation: risk of progression during childhood and adolescence. Ann Plast Surg. 2012, 68, 198–201. [Google Scholar] [CrossRef]
- Hassanein, A.H.; et al. Lymphatic malformation: risk of progression during childhood and adolescence. J Craniofac Surg. 2012, 23, 149–152. [Google Scholar] [CrossRef] [PubMed]
- Liu, A.S.; et al. Extracranial arteriovenous malformations: natural progression and recurrence after treatment. Plast Reconstr Surg. 2010, 125, 1185–1194. [Google Scholar] [CrossRef] [PubMed]
- Vikkula, M.; et al. Vascular dysmorphogenesis caused by an activating mutation in the receptor tyrosine kinase TIE2. Cell 1996, 87, 1181–1190. [Google Scholar] [CrossRef] [PubMed]
- Dompmartin, A.; et al. Elevated D-dimer level in the differential diagnosis of venous malformations. Arch Dermatol. 2009, 145, 1239–1244. [Google Scholar] [CrossRef]
- Fishman, S.J.; et al. Gastrointestinal manifestations of vascular anomalies in childhood: varied etiologies require multiple therapeutic modalities. J Pediatr Surg. 1998, 33, 1163–1167. [Google Scholar] [CrossRef]
- Jans, L.; et al. MRI demonstrates the extension of juxta-articular venous malformation of the knee and correlates with joint changes. Eur Radiol. 2010, 20, 1792–1798. [Google Scholar] [CrossRef]
- Ohlms, L.A.; Forsen, J.; Burrows, P.E. Venous malformation of the pediatric airway. Int J Pediatr Otorhinolaryngol. 1996, 37, 99–114. [Google Scholar] [CrossRef]
- Hein, K.D.; et al. Venous malformations of skeletal muscle. Plast Reconstr Surg. 2002, 110, 1625–1635. [Google Scholar] [CrossRef]
- Boon, L.M.; et al. Glomuvenous malformation (glomangioma) and venousmalformation: distinct clinicopathologic and genetic entities. Arch Dermatol. 2004, 140, 971–976. [Google Scholar] [CrossRef]
- Ralph, R.; Chrispa, A. Klippel-Trenaunay syndrome of the upper limb--a rare congenital anomaly. J Assoc Physicians India. 2013, 61, 337. [Google Scholar]
- Lee, M.S.; Liang, M.G.; Mulliken, J.B. Diffuse capillary malformation with overgrowth: a clinical subtype of vascular anomalies with hypertrophy. J Am Acad Dermatol. 2013, 69, 589–594. [Google Scholar] [CrossRef]
- Uihlein, L.C.; et al. Capillary-venous malformation in the lower limb. Pediatr Dermatol. 2013, 30, 541–548. [Google Scholar] [CrossRef] [PubMed]
- Odube, C.E.; et al. Venous thromboembolism and prothrombotic parameters in Klippel-Trenaunay syndrome. Neth J Med. 2013, 71, 246–252. [Google Scholar]
- Harrison, C.; et al. Endovenous radiofrequency ablation and combined foam sclerotherapy treatment of multiple refluxing perforator veins in a Klippel-Trenaunay syndrome patient. Phlebology 2013. [Google Scholar] [CrossRef] [PubMed]
- King, K.; et al. The use of endovenous laser treatment in toddlers. J Vasc Interv Radiol. 2013, 24, 855–858. [Google Scholar] [CrossRef]
- Alomari, A.I. Diversion venography--a modified technique in KlippelTrenaunay syndrome: initial experience. J Vasc Interv Radiol. 2010, 21, 685–689. [Google Scholar] [CrossRef]
- Savas, J.A.; et al. Carbon dioxide laser for the treatment of microcystic lymphatic malformations (lymphangioma circumscriptum): a systematic review. Dermatol Surg. 2013, 39, 1147–1157. [Google Scholar] [CrossRef]
- Oliver, G.; Harvey, N. A stepwise model of the development of lymphatic vasculature. Ann N Y Acad Sci. 2002, 979, 159–165. [Google Scholar] [CrossRef]
- Leung, M.; et al. Management of the low-flow head and neck vascular malformations in children: the sclerotherapy protocol. Eur J Pediatr Surg. 2014, 24, 97–101. [Google Scholar] [CrossRef]
- Cho, S.K.; et al. Arteriovenous malformations of the body and extremities: analysis of therapeutic outcomes and approaches according to a modified angiographic classification. J Endovasc Ther. 2006, 13, 527–538. [Google Scholar] [CrossRef]
- Lee, B.B.; et al. Consensus Document of the International Union of Angiology (IUA)-2013. Current concept on the management of arterio-venous management. Int Angiol. 2013, 32, 9–36. [Google Scholar]
- Do, Y.S.; et al. Ethanol embolization of arteriovenous malformations: interim results. Radiology 2005, 235, 674–682. [Google Scholar] [CrossRef]
- Burrows, P.E.; Mason, K.P. Percutaneous treatment of low flow vascular malformations. J Vasc Interv Radiol. 2004, 15, 431–445. [Google Scholar] [CrossRef] [PubMed]
- Shin, B.S.; et al. Effects of repeat bolus ethanol injections on cardiopulmonary hemodynamic changes during embolotherapy of arteriovenous malformations of the extremities. J Vasc Interv Radiol. 2010, 21, 81–89. [Google Scholar] [CrossRef] [PubMed]
- Tallman, B.; et al. Location of port-wine stains and the likelihood of ophthalmic and/or central nervous system complications. Pediatrics. 1991, 87, 323–327. [Google Scholar] [CrossRef] [PubMed]
- Reddy, K.K.; et al. Treatment of port-wine stains with a short pulse width 532–nm Nd:YAG laser. J Drugs Dermatol. 2013, 12, 66–71. [Google Scholar]
- Enjolras, O.; et al. Extensive pure venous malformations in the upper or lower limb: a review of 27 cases. J Am Acad Dermatol. 1997, 36 Pt 1, 219–225. [Google Scholar] [CrossRef]
- Mazereeuw-Hautier, J.; et al. Extensive venous/lymphatic malformations causing life-threatening haematological complications. Br J Dermatol. 2007, 157, 558–563. [Google Scholar] [CrossRef]
- Stein, S.R.; Perlow, J.H.; Sawai, S.K. Klippel-Trenaunay-type syndrome in pregnancy. Obstet Gynecol Surv. 2006, 61, 194–206. [Google Scholar] [CrossRef]
- Rebarber, A.; et al. Obstetric management of Klippel-Trenaunay syndrome. Obstet Gynecol. 2004, 104 Pt 2, 1205–1208. [Google Scholar] [CrossRef]
- Mazoyer, E.; et al. Coagulation abnormalities associated with extensive venous malformations of the limbs: differentiation from Kasabach-Merritt syndrome. Clin Lab Haematol. 2002, 24, 243–251. [Google Scholar] [CrossRef]
- Schobinger, R.A. [Diagnostic and therapeutic possibilities in peripheral angiodysplasias]. Helv Chir Acta. 1971, 38, 213–220. [Google Scholar]








© 2014 by the author. Attribution-Non-Commercial-NoDerivatives 4.0.
Share and Cite
Clemens, R.K.; Meier, T.O.; Amann-Vesti, B.R. Vaskuläre Malformationen—Diagnostik und Behandlung. Cardiovasc. Med. 2014, 17, 133. https://doi.org/10.4414/cvm.2014.00248
Clemens RK, Meier TO, Amann-Vesti BR. Vaskuläre Malformationen—Diagnostik und Behandlung. Cardiovascular Medicine. 2014; 17(5):133. https://doi.org/10.4414/cvm.2014.00248
Chicago/Turabian StyleClemens, Robert K., Thomas O. Meier, and Beatrice R. Amann-Vesti. 2014. "Vaskuläre Malformationen—Diagnostik und Behandlung" Cardiovascular Medicine 17, no. 5: 133. https://doi.org/10.4414/cvm.2014.00248
APA StyleClemens, R. K., Meier, T. O., & Amann-Vesti, B. R. (2014). Vaskuläre Malformationen—Diagnostik und Behandlung. Cardiovascular Medicine, 17(5), 133. https://doi.org/10.4414/cvm.2014.00248




