Dreidimensionale Echokardiographie zur Beurteilung der Mitralklappe
Abstract
Einleitung
Dreidimensionale Echokardiographie: die wichtigsten Eigenschaften
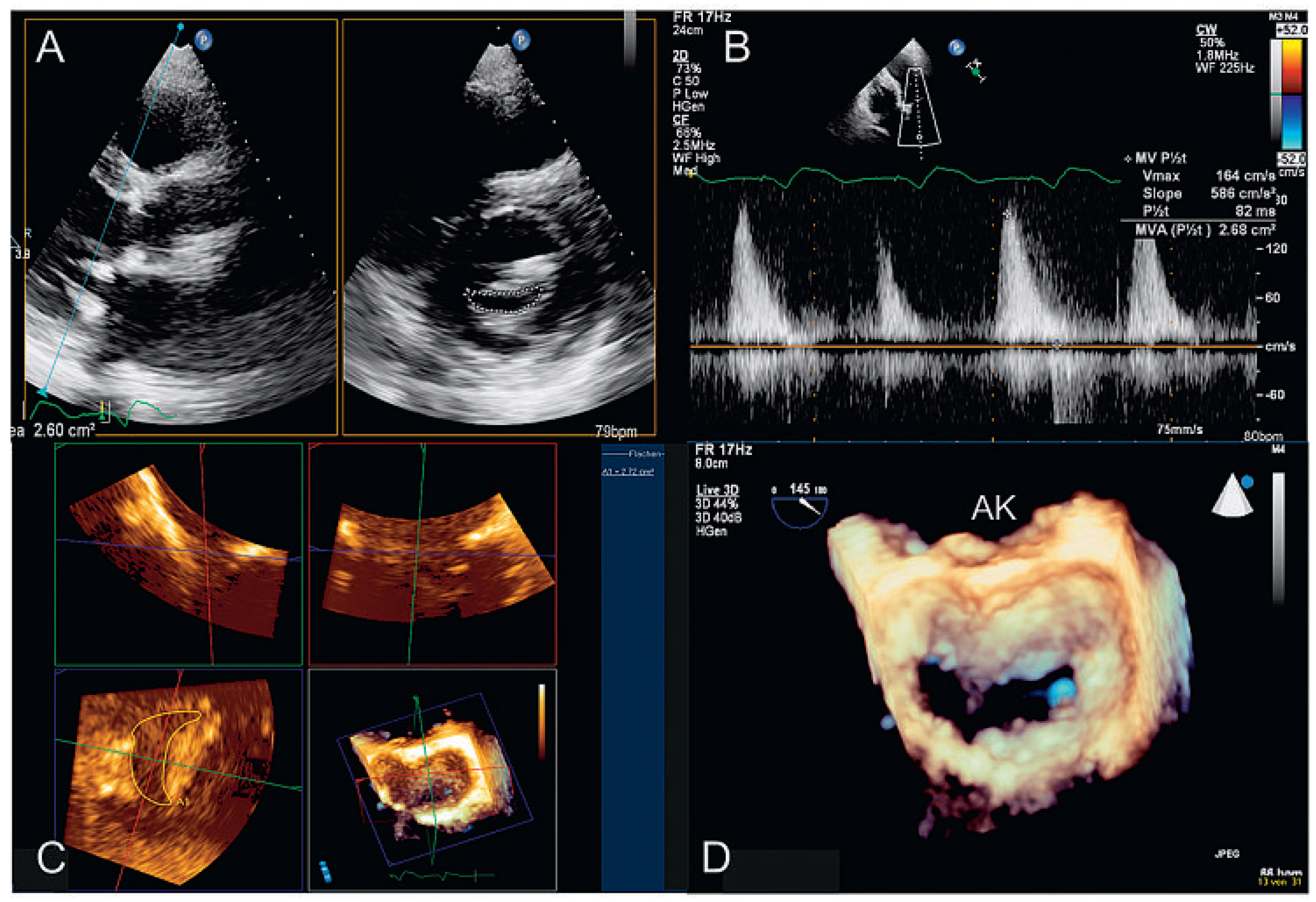
- 1.)
- «xPlane»: die Möglichkeit, gleichzeitig mehrere verschiedene Ebenen zu untersuchen, die in einem vom Untersucher wählbaren Winkel zu einander stehen (Abb. 1A). Zuschalten des Farb-Dopplers möglich (Abb. 1B).
- 2.)
- «3D zoom»: Echtzeit(«live»)-Untersuchung eines pyramidenartigen (dreidimensionalen) Sektors von bis zu 90° × 90° (Abb. 1C). Farb-Doppler nur in der neusten Generation der Geräte möglich.
- 3.)
- «full volume»: Aufnahme eines pyramidenförmigen (dreidimensionalen) Sektors, zusammengesetzt aus 4–7 Untersektoren (keine Echtzeit, Abb. 1D). In der neusten Generation der Geräte Aufnahme in einem Herzschlag. Farb-Doppler möglich (Abb. 1E).

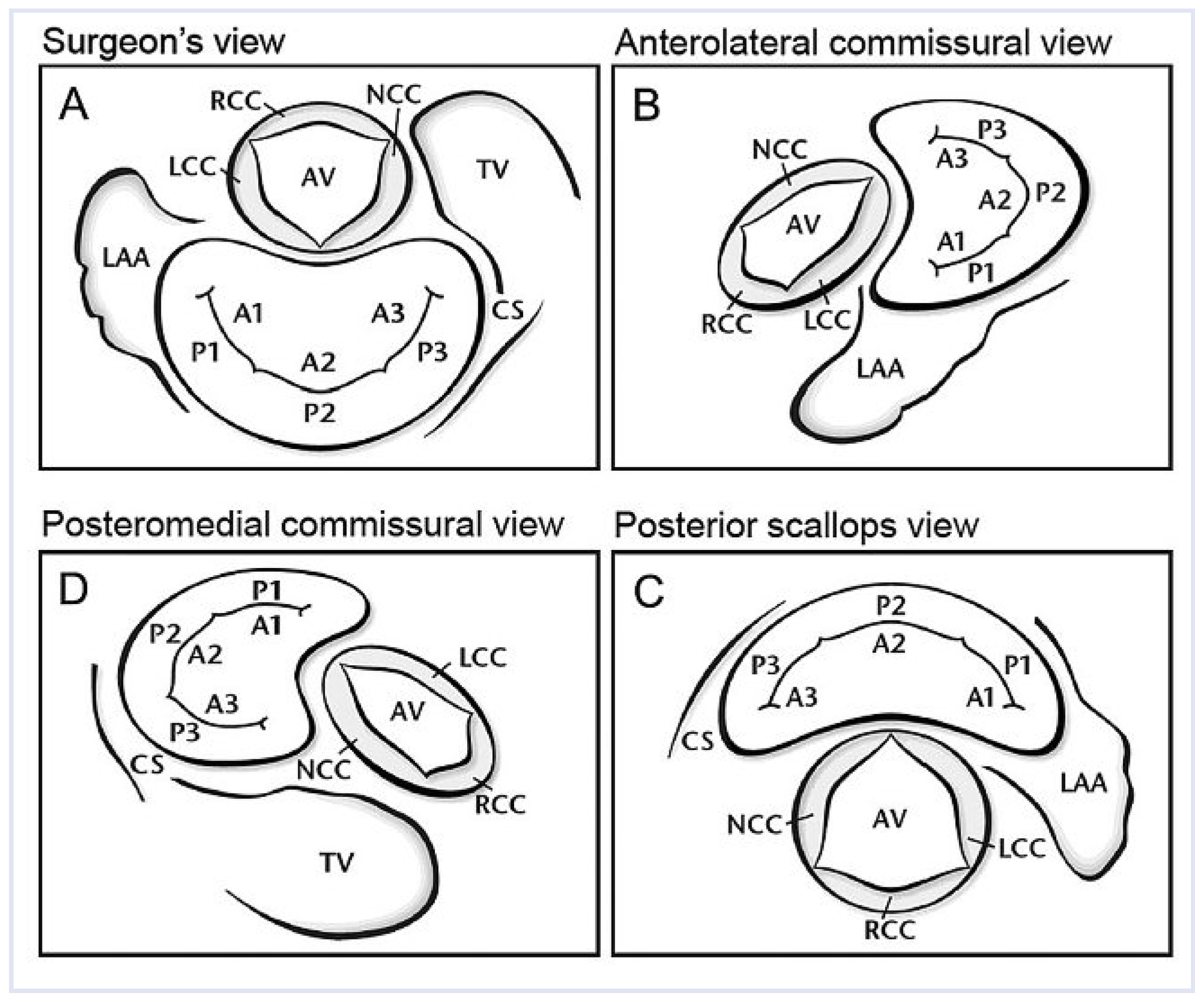
3DE zur Beurteilung der Nativklappe
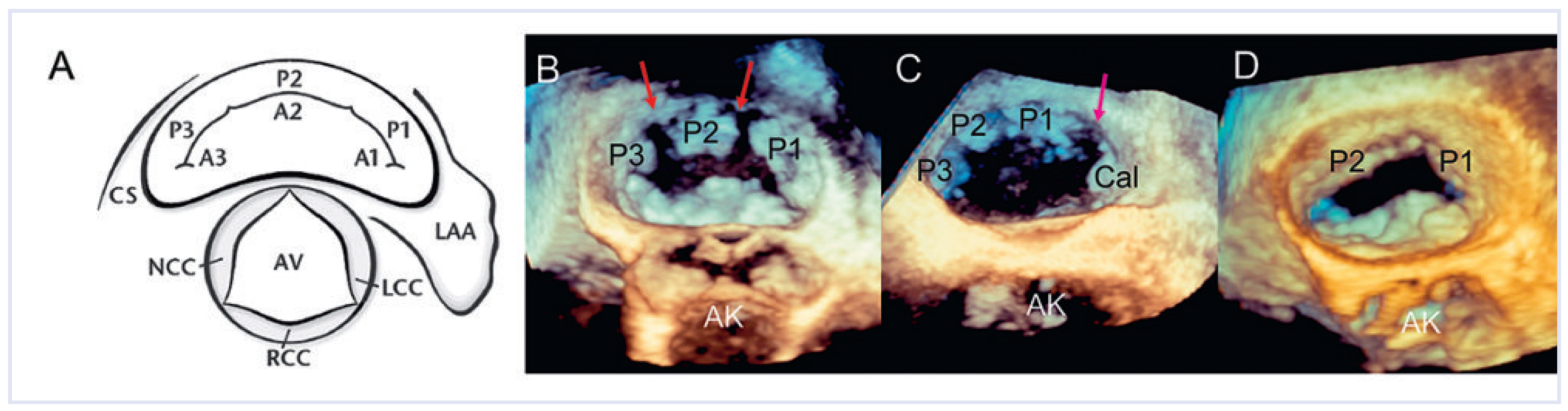
3D-TTE

3D-TEE
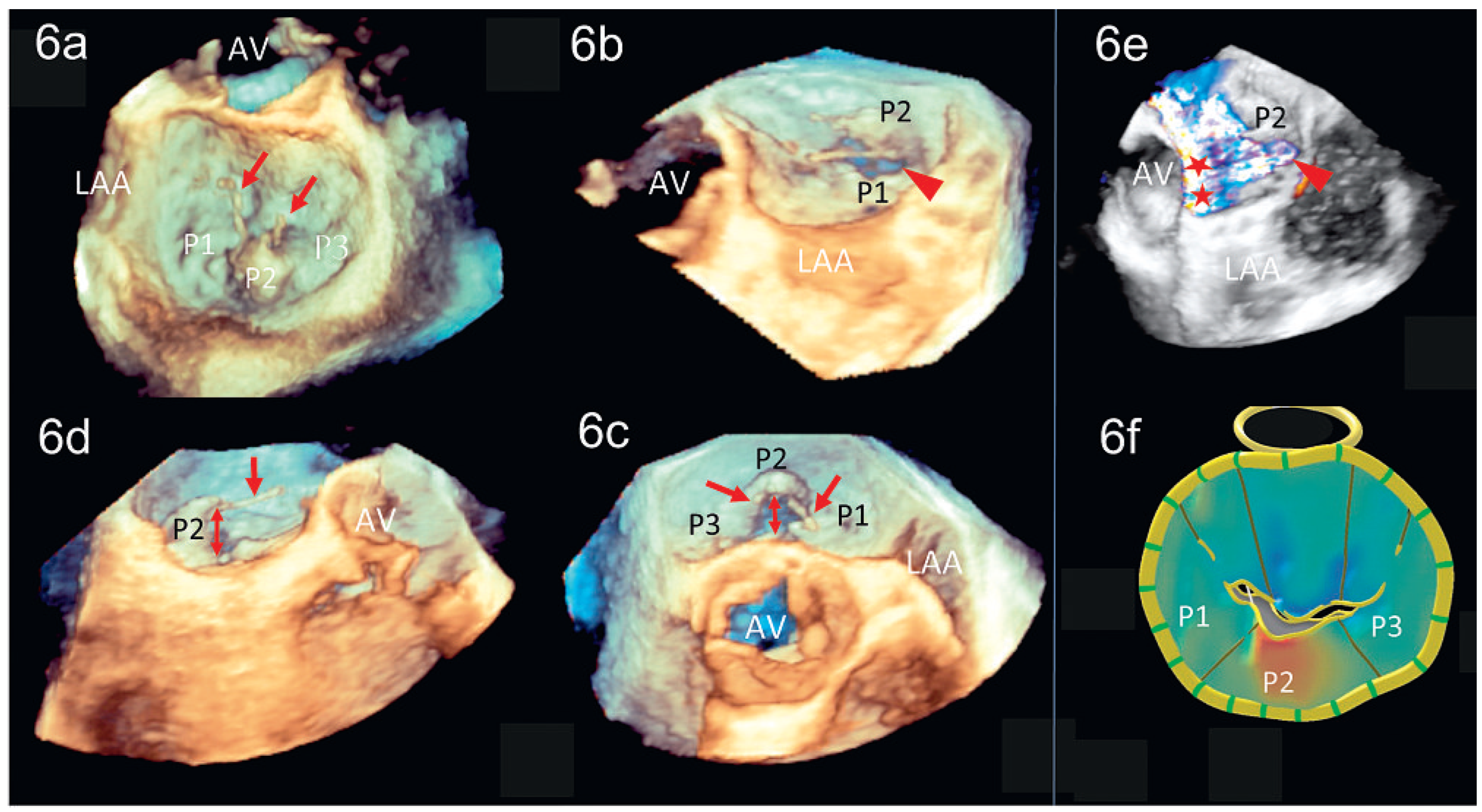
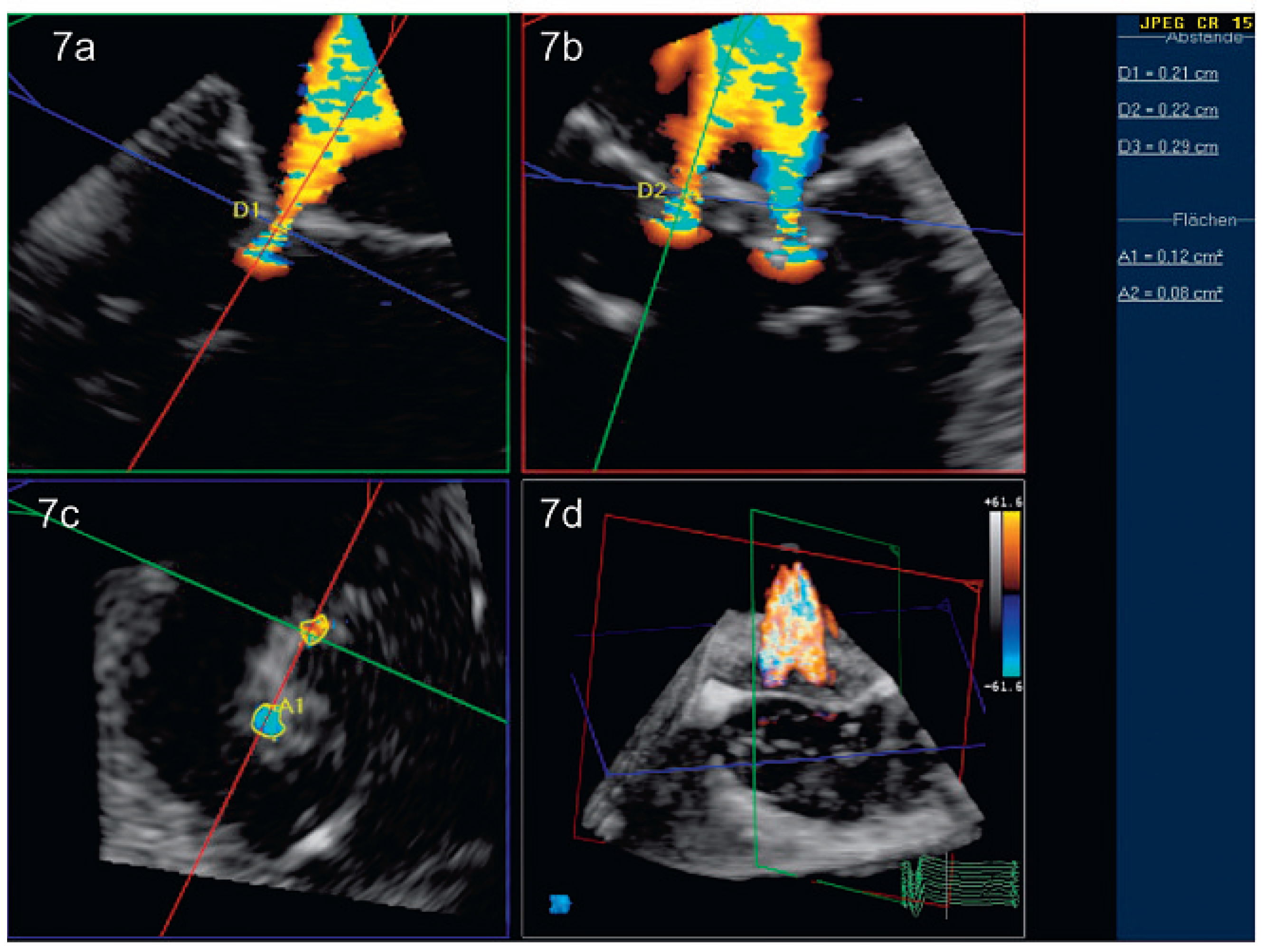
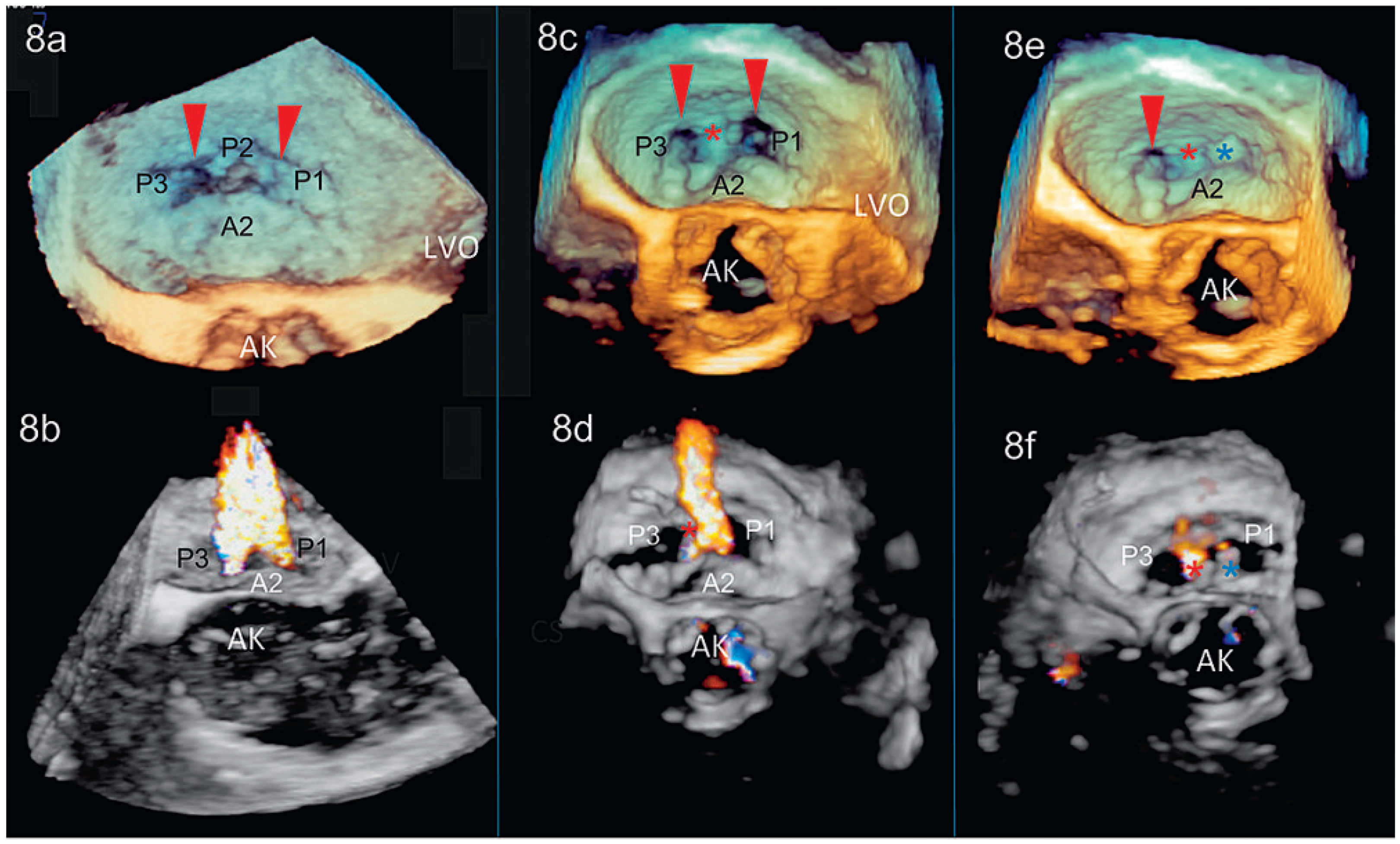
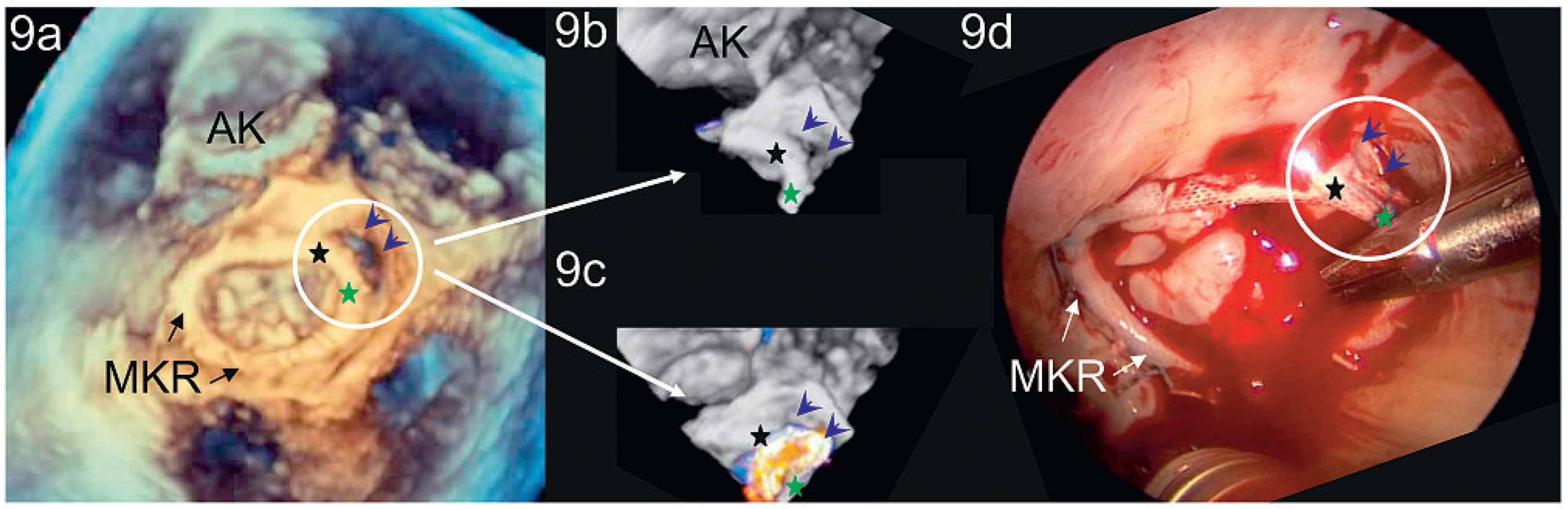
Peri- und postinterventionelle Beurteilung der Mitralklappe
Limitationen
Schlussfolgerung
Conflicts of Interest
References
- Freed, L.A.; Benjamin, E.J.; Levy, D.; Larson, M.G.; Evans, J.C.; Fuller, D.L.; et al. Mitral valve prolapse in the general population: The benign nature of echocardiographic features in the Framingham Heart Study. J Am Coll Cardiol 2002, 40, 1298–1304. [Google Scholar] [CrossRef]
- Bonow, R.O.; Carabello, B.A.; Chatterjee, K.; de Leon, A.C., Jr.; Faxon, D.P.; Freed, M.D.; et al. 2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to revise the 1998 guidelines for the management of patients with valvular heart disease). Endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2008, 52, e1–e142. [Google Scholar]
- David, T.E.; Ivanov, J.; Armstrong, S.; Christie, D.; Rakowski, H. A comparison of outcomes of mitral valve repair for degenerative disease with posterior, anterior, and bileaflet prolapse. J Thorac Cardiovasc Surg 2005, 130, 1242–1249. [Google Scholar] [CrossRef]
- Rusted, I.E.; Scheifley, C.H.; Edwards, J.E. Studies of the mitral valve. I. Anatomic features of the normal mitral valve and associated structures. Circulation 1952, 6, 825–831. [Google Scholar] [CrossRef]
- Grewal, J.; Mankad, S.; Freeman, W.K.; Click, R.L.; Suri, R.M.; Abel, M.D.; et al. Real-time three-dimensional transesophageal echocardiography in the intraoperative assessment of mitral valve disease. J Am Soc Echocardiogr 2009, 22, 34–41. [Google Scholar] [CrossRef]
- Garcia-Orta, R.; Moreno, E.; Vidal, M.; Ruiz-Lopez, F.; Oyonarte, J.M.; Lara, J.; et al. Three-dimensional versus two-dimensional transesophageal echocardiography in mitral valve repair. J Am Soc Echocardiogr 2007, 20, 4–12. [Google Scholar] [CrossRef] [PubMed]
- Pepi, M.; Tamborini, G.; Maltagliati, A.; Galli, C.A.; Sisillo, E.; Salvi, L.; et al. Head-to-head comparison of two- and three-dimensional transthoracic and transesophageal echocardiography in the localization of mitral valve prolapse. J Am Coll Cardiol 2006, 48, 2524–2530. [Google Scholar] [CrossRef]
- Mahmood, F.; Subramaniam, B.; Gorman, J.H., 3rd; Levine, R.M.; Gorman, R.C.; Maslow, A.; et al. Three-dimensional echocardiographic assessment of changes in mitral valve geometry after valve repair. Ann Thorac Surg 2009, 88, 1838–1844. [Google Scholar] [CrossRef][Green Version]
- Sugeng, L.; Weinert, L.; Lang, R.M. Real-time 3-dimensional color Doppler flow of mitral and tricuspid regurgitation: Feasibility and initial quantitative comparison with 2-dimensional methods. J Am Soc Echocardiogr 2007, 20, 1050–1057. [Google Scholar] [CrossRef]
- Veronesi, F.; Corsi, C.; Sugeng, L.; Caiani, E.G.; Weinert, L.; Mor-Avi, V.; et al. Quantification of mitral apparatus dynamics in functional and ischemic mitral regurgitation using real-time 3-dimensional echocardiography. J Am Soc Echocardiogr 2008, 21, 347–354. [Google Scholar] [CrossRef] [PubMed]
- Salcedo, E.E.; Quaife, R.A.; Seres, T.; Carroll, J.D. A framework for systematic characterization of the mitral valve by real-time three-dimensional transesophageal echocardiography. J Am Soc Echocardiogr 2009, 22, 1087–1099. [Google Scholar] [CrossRef]
- Vegas, A.; Meineri, M. Core review: Three-dimensional transesophageal echocardiography is a major advance for intraoperative clinical management of patients undergoing cardiac surgery: A core review. Anesth Analg 2010, 110, 1548–1573. [Google Scholar] [CrossRef]
- Carpentier, A.F.; Lessana, A.; Relland, J.Y.; Belli, E.; Mihaileanu, S.; Berrebi, A.J.; et al. The “physio-ring”: An advanced concept in mitral valve annuloplasty. Ann Thorac Surg 1995, 60, 1177–1185; discussion 85–86. [Google Scholar] [CrossRef]
- Quill, J.L.; Hill, A.J.; Laske, T.G.; Alfieri, O.; Iaizzo, P.A. Mitral leaflet anatomy revisited. J Thorac Cardiovasc Surg 2009, 137, 1077–1081. [Google Scholar] [CrossRef]
- Harken, D.E.; Ellis, L.B.; Dexter, L.; Farrand, R.E.; Dickson, J.F. The responsibility of the physician in the selection of patients with mitral stenosis for surgical treatment. Circulation 1952, 5, 349–362. [Google Scholar] [CrossRef]
- Kahlert, P.; Plicht, B.; Schenk, I.M.; Janosi, R.A.; Erbel, R.; Buck, T. Direct assessment of size and shape of noncircular vena contracta area in functional versus organic mitral regurgitation using real-time three-dimensional echocardiography. J Am Soc Echocardiogr 2008, 21, 912–921. [Google Scholar] [CrossRef] [PubMed]
- Little, S.H.; Pirat, B.; Kumar, R.; Igo, S.R.; McCulloch, M.; Hartley, C.J.; et al. Three-dimensional color Doppler echocardiography for direct measurement of vena contracta area in mitral regurgitation: In vitro validation and clinical experience. JACC Cardiovasc Imaging 2008, 1, 695–704. [Google Scholar] [CrossRef] [PubMed]
- Zamorano, J.; Cordeiro, P.; Sugeng, L.; Perez de Isla, L.; Weinert, L.; Macaya, C.; et al. Real-time three-dimensional echocardiography for rheumatic mitral valve stenosis evaluation: An accurate and novel approach. J Am Coll Cardiol 2004, 43, 2091–2096. [Google Scholar] [CrossRef]
- Zamorano, J.; de Agustin, J.A. Three-dimensional echocardiography for assessment of mitral valve stenosis. Curr Opin Cardiol 2009, 24, 415–419. [Google Scholar] [CrossRef] [PubMed]
- Biaggi, P.; Gruner, C.; Jedrzkiewicz, S.; Karski, J.; Meineri, M.; Vegas, A.; et al. Assessment of Mitral Valve Prolapse by Three-Dimensional Transesophageal Echocardiography: Angled Views are Key. JACC Cardiovasc Imaging. in press. 2011. [Google Scholar]
- Biaggi, P.; Greutmann, M.; Crean, A. Utility of Three-Dimensional Transesophageal Echocardiography: Anatomy, Mechanism, and Severity of Regurgitation in a Patient with an Isolated Cleft Posterior Mitral Valve. J Am Soc Echocardiogr 2010, 23, 1114.e1–1114.e4. [Google Scholar] [CrossRef]
- Shanks, M.; Siebelink, H.M.; Delgado, V.; van de Veire, N.R.; Ng, A.C.; Sieders, A.; et al. Quantitative Assessment of Mitral Regurgitation: Comparison Between Three-dimensional Transesophageal Echocardiography and Magnetic Resonance Imaging. Circ Cardiovasc Imaging 2010. published online Sep 1. [Google Scholar] [CrossRef]
- Swaans, M.J.; Van den Branden, B.J.; Van der Heyden, J.A.; Post, M.C.; Rensing, B.J.; Eefting, F.D.; et al. Three-dimensional transoesophageal echocardiography in a patient undergoing percutaneous mitral valve repair using the edge-to-edge clip technique. Eur J Echocardiogr 2009, 10, 982–983. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Kronzon, I.; Sugeng, L.; Perk, G.; Hirsh, D.; Weinert, L.; Garcia Fernandez, M.A.; et al. Real-time 3-dimensional transesophageal echocardiography in the evaluation of post-operative mitral annuloplasty ring and prosthetic valve dehiscence. J Am Coll Cardiol 2009, 53, 1543–1547. [Google Scholar] [CrossRef] [PubMed]
- Sugeng, L.; Shernan, S.K.; Weinert, L.; Shook, D.; Raman, J.; Jeevanandam, V.; et al. Real-time three-dimensional transesophageal echocardiography in valve disease: Comparison with surgical findings and evaluation of prosthetic valves. J Am Soc Echocardiogr 2008, 21, 1347–1354. [Google Scholar] [CrossRef] [PubMed]
© 2011 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Biaggi, P.; Felix, C.; Greutmann, M.; Hürlimann, D.; Bettex, D.; Tanner, F.C. Dreidimensionale Echokardiographie zur Beurteilung der Mitralklappe. Cardiovasc. Med. 2011, 14, 4. https://doi.org/10.4414/cvm.2011.01561
Biaggi P, Felix C, Greutmann M, Hürlimann D, Bettex D, Tanner FC. Dreidimensionale Echokardiographie zur Beurteilung der Mitralklappe. Cardiovascular Medicine. 2011; 14(1):4. https://doi.org/10.4414/cvm.2011.01561
Chicago/Turabian StyleBiaggi, Patric, Christian Felix, Matthias Greutmann, David Hürlimann, Dominique Bettex, and Felix C. Tanner. 2011. "Dreidimensionale Echokardiographie zur Beurteilung der Mitralklappe" Cardiovascular Medicine 14, no. 1: 4. https://doi.org/10.4414/cvm.2011.01561
APA StyleBiaggi, P., Felix, C., Greutmann, M., Hürlimann, D., Bettex, D., & Tanner, F. C. (2011). Dreidimensionale Echokardiographie zur Beurteilung der Mitralklappe. Cardiovascular Medicine, 14(1), 4. https://doi.org/10.4414/cvm.2011.01561





