Einleitung
Die kardiale Resynchronisationstherapie
(cardiac resynchronisation therapy, CRT) ist seit der ersten Anwendung 1994 [
1] zu einem Standardbehandlungsverfahren bei Patienten mit schwerer Herzinsuffizienz geworden, nicht zuletzt, da in grossen randomisierten Studien bei symptomatischen Patienten (NYHA III–IV) mit breitem QRS-Komplex (>120 ms) und reduzierter linksventrikulärer Ejektionsfraktion (EF ≤ 35%) eine Reduktion von Morbidität und Mortalität gezeigt werden konnte [
2,
3,
4]. Als Folge dieser eindrücklichen Resultate wurde in den letzten Jahren CRT auch bei Patienten eingesetzt, welche eines (oder selten mehrere) der oben genannten Kriterien nicht erfüllen. In der Tat scheinen die in den aktuellen Guidelines festgesetzten Selektionskriterien für die CRT, welche hauptsächlich auf den Einschlusskriterien oben genannter Landmarkstudien basieren, nicht alle Patienten zu identifizieren, welche am wahrscheinlichsten von einer CRT profitieren. So gibt es auf der einen Seite eine nicht unerhebliche Anzahl Patienten, welche nicht oder nur ungenügend auf eine CRT ansprechen [
5,
6]; andererseits bestätigen zahlreiche teils kleinere Studien, dass auch Patienten, welche die gegenwärtigen Kriterien heutiger CRT Guidelines nicht erfüllen, von dieser Therapie profitieren können [
7,
8,
9]. Die CRT-Implantationszahlen am UniversitätsSpital Zürich (USZ) haben seit 2003 von 11 auf 56 pro Jahr deutlich zugenommen, was dem internationalen Trend entspricht. Mit einer Häufigkeit von 56 CRT pro Million Einwohner im Jahr 2008 befindet sich die Schweiz im europäischen Mittelfeld, welches von Italien (163/Mio) angeführt wird. Am unteren Ende der Skala bewegen sich die Türkei, Rumänien oder Kroatien (alle ca. 5/Mio) [
10].
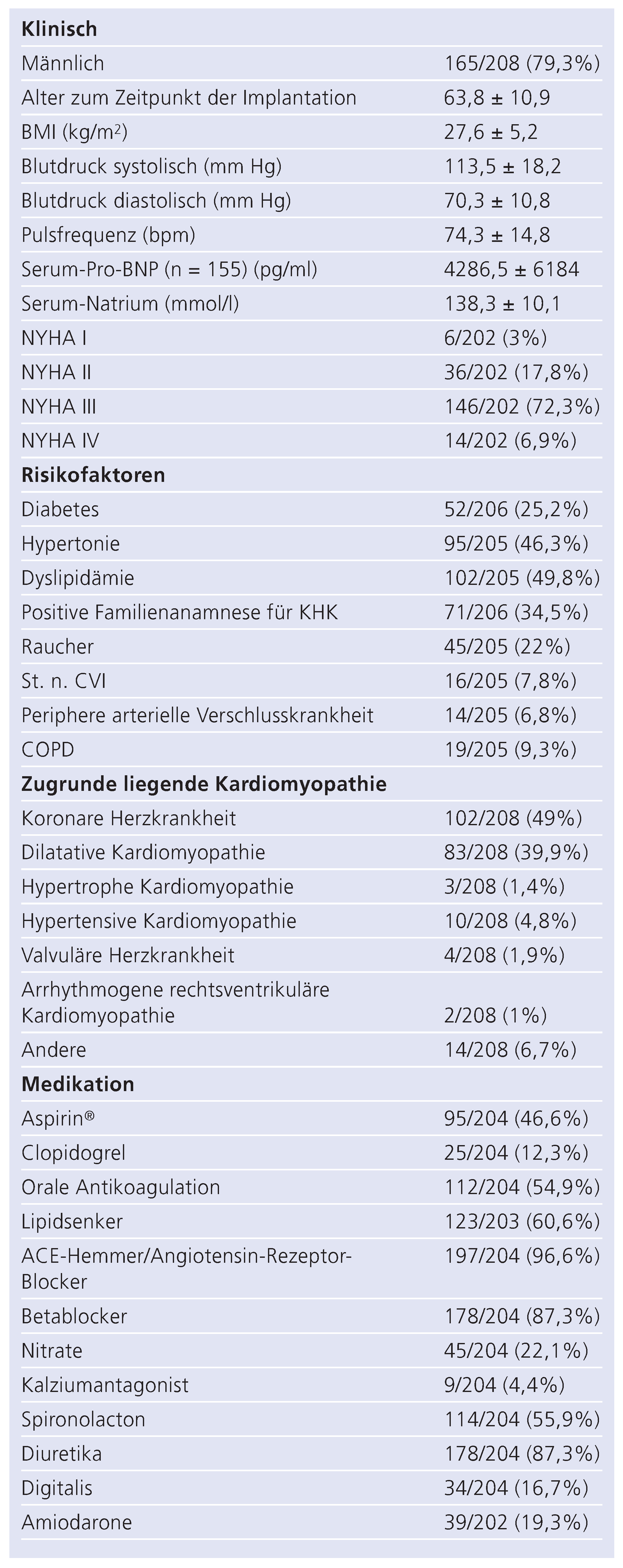
Tabelle 1.
Baseline-Charakteristika zum Zeitpunkt der CRT-Implantation. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt.
Tabelle 1.
Baseline-Charakteristika zum Zeitpunkt der CRT-Implantation. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt.
«Real World»-Register und -Surveys stellen eine elegante Methode dar, um zu untersuchen, wie eine Therapie im gegenwärtigen klinischen Alltag eingesetzt wird, was auf europäischer Ebene kürzlich in der
Euro CRT Survey dokumentiert wurde [
6,
11]. Durch den Einschluss von konsekutiven Patienten kann insbesondere der oftmals kritisierte Selektionsbias vermieden werden, welcher ein inhärentes Problem vieler klinischer Studien darstellt. So konnte in der
Euro CRT Survey gezeigt werden, dass zum Teil deutliche Unterschiede zwischen Patienten bestehen, welche im Alltag mit CRT behandelten werden, und solchen, welche in grossen Studien untersucht wurden.
Ziel der vorliegenden Studie war es daher, die Charakteristika aller während der letzten Jahre mittels CRT behandelten Patienten an einem universitären Schweizer Zentrum zusammenzustellen. Im Vordergrund standen hierbei die Erhebung der demographischen, klinischen, elektrokardiographischen und echokardiographischen Parameter zum Zeitpunkt der CRT-Implantation sowie die Evaluation der Effektivität und Sicherheit des Verfahrens unter «Real World»-Bedingungen an einem grösseren universitären Zentrum.
Resultate
Die demographischen und klinischen Charakteristika der Patienten bei Implantation sind in Tabelle 1 zusammengefasst. Die Hälfte der Patienten hatte eine zugrunde liegende koronare Herzerkrankung; die andere Hälfte verteilte sich auf dilatative (39,9%) und andere Kardiomyopathien. Zum Zeitpunkt der Implantation nahmen fast alle Patienten einen ACE-Hemmer oder Angiotensinrezeptor-Antagonisten (96,6%) bzw. einen Betablocker (87,3%), Aldosteronantagonisten (55,9%) und Diuretika (87,3%) ein. Ein CRT wurde deutlich häufiger bei symptomatischen (NYHA III & IV, 72,3% bzw. 6,9%), als bei oligo- oder asymptomatischen Patienten (NYHA I & II, 3% bzw. 17,8%) implantiert.
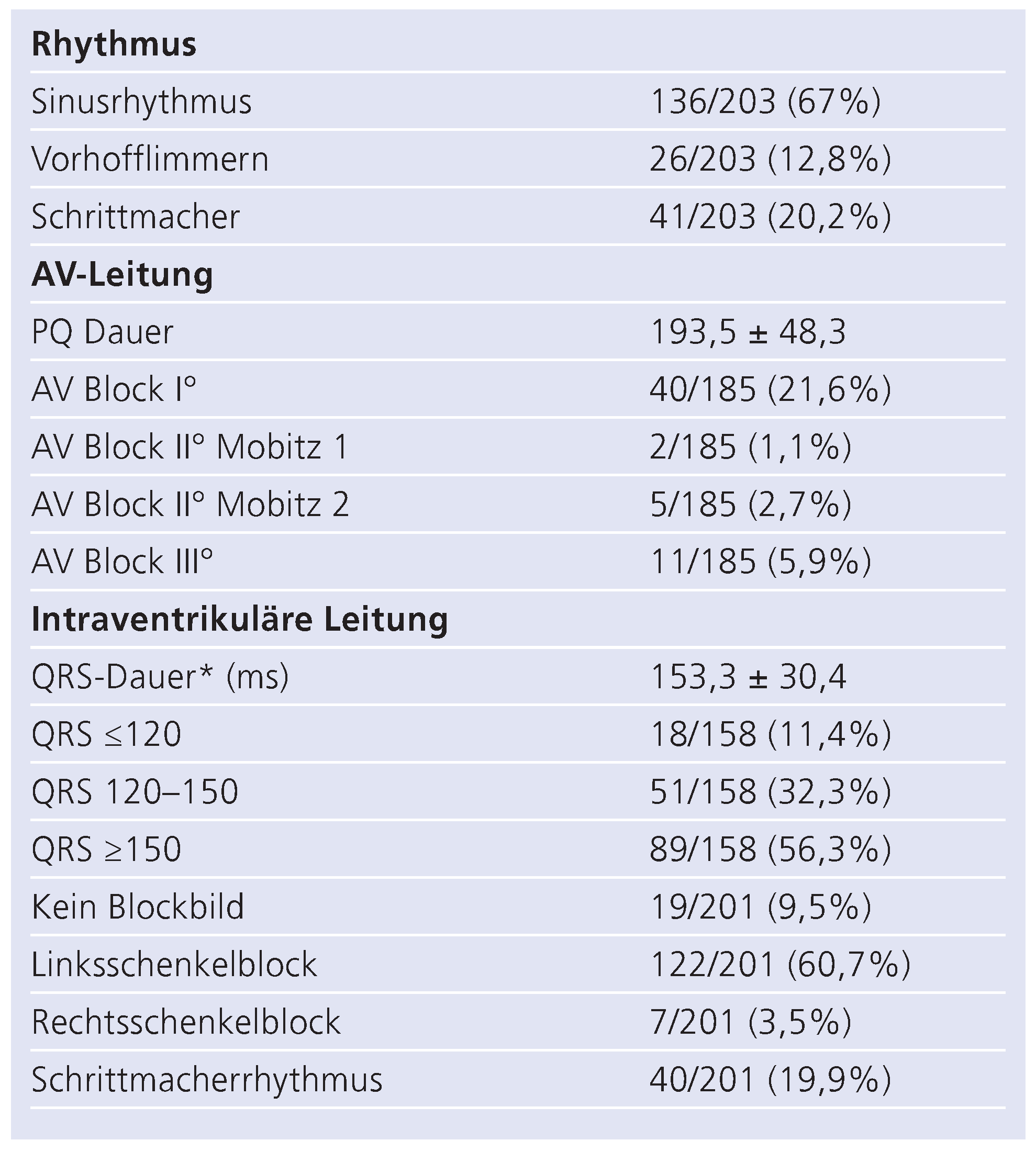
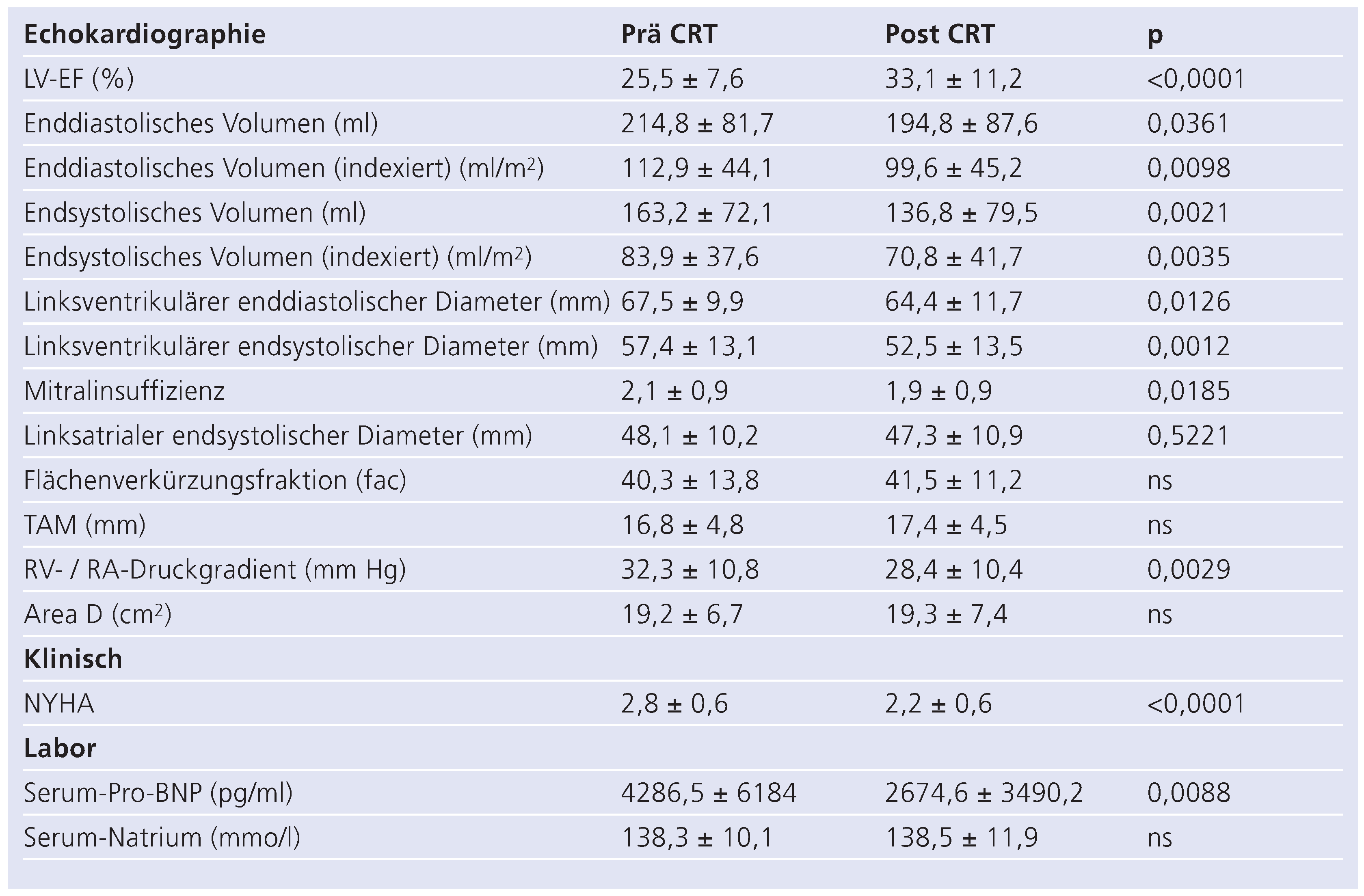
Tabelle 2 und Tabelle 3 zeigen die EKG- bzw. echokardiographischen Befunde zum Zeitpunkt der Implantation. 12,8% der Patienten waren im Vorhofflimmern, 20,2% hatten einen Schrittmacherrhythmus. Die deutliche Mehrzahl der Patienten zeigte im Eigenrhythmus einen breiten QRS-Komplex >120 ms, welcher meist (88,6%) durch einen Linksschenkelblock bedingt war. Die linksventrikuläre Auswurffraktion lag im Mittel bei 26% bei deutlich vergrösserten linksventrikulären Volumina (Tab. 3).
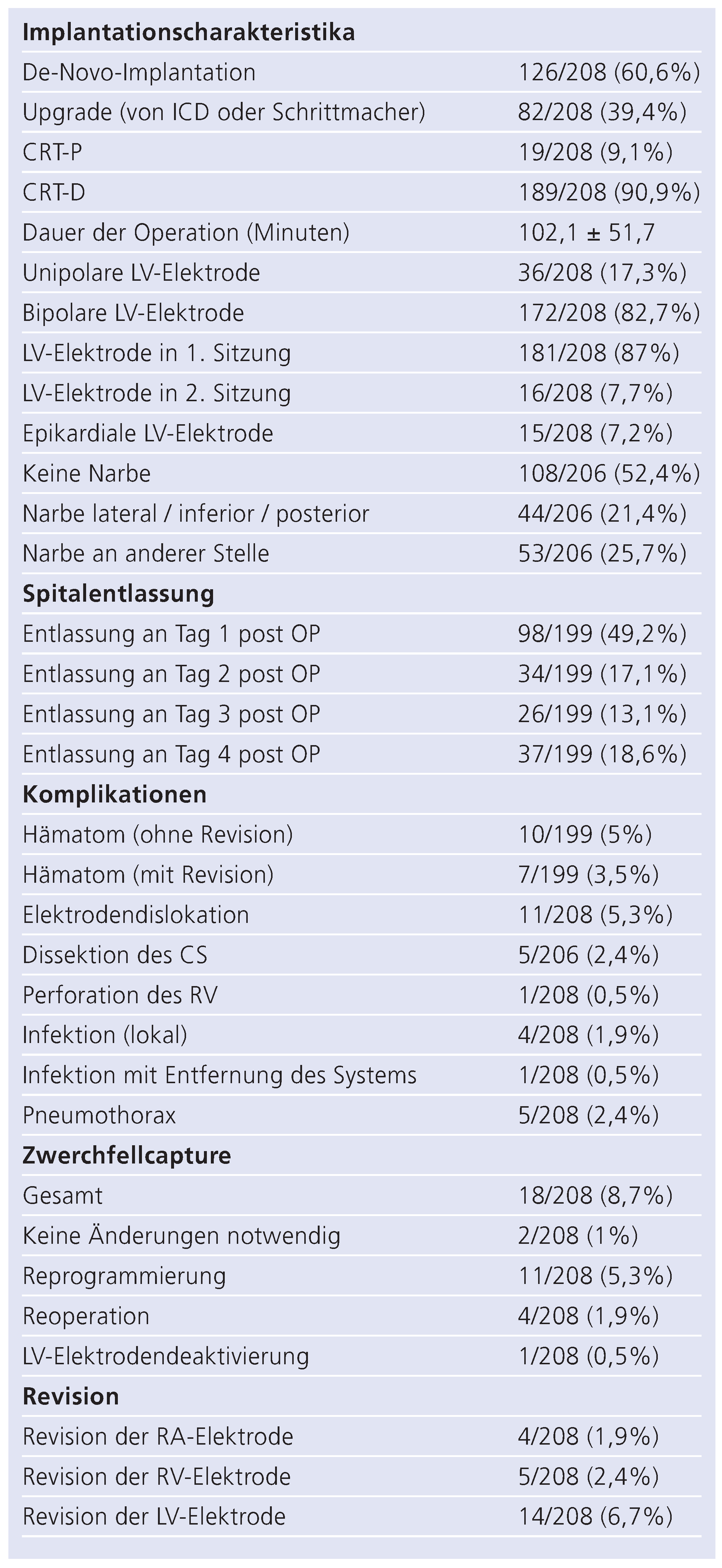
Die perioperativen Parameter und Komplikationen sind in Tabelle 4 bzw. 5 zusammengefasst. Bei der Mehrzahl der Patienten (87%) konnte die linksventrikuläre Elektrode beim ersten Eingriff implantiert werden; bei den verbliebenen Patienten wurde sie entweder in einer 2. Sitzung perkutan (7,7%) oder herzchirurgisch epikardial (7,2%) implantiert. Vier Patienten erhielten von Beginn an eine epikardiale LV-Elektrode im Rahmen eines herzchirurgischen Eingriffs. Die meisten Patienten konnten am 1. oder 2. Tag nach Implantation entlassen werden. Die mediane Aufenhaltsdauer im Spital betrug zwei Tage. Bei mehreren Patienten wurde das CRT-System im Rahmen einer von der Implantation unabhängigen längerdauernden Hospitalisation eingesetzt (Tab. 4).
Komplikationen waren insgesamt selten. Taschenhämatome, Elektrodendislokation und -revision waren die am häufigsten vorkommenden perioperativen Ereignisse (Tab. 4). Gefährlichere Komplikationen, inklusive Elektrodenperforation und Pneumothorax, waren deutlich seltener; es kam zu keinem perioperativen Todesfall. Postoperative Zwerchfellstimulation (Zwerchfell-Capture) durch die LV-Elektrode war relativ häufig (8,7%) und meist mittels Re-Programmierung behebbar. Nur wenige Fälle erforderten eine Elektrodenrevision (1,9%).
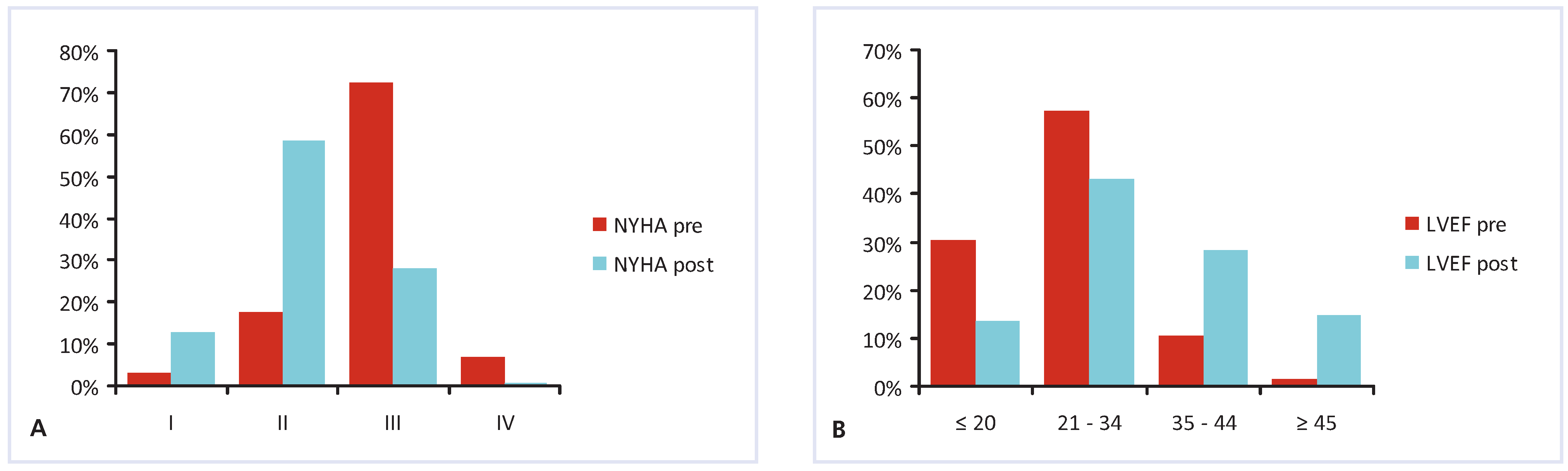
Postoperative echokardiographische, klinische und laborchemische Verlaufsparameter sind in Tabelle 5 und 6, sowie in Abbildung 1 zusammengefasst. Es konnten eine deutliche Verbesserung der linksventrikulären Funktion sowie ein beträchtlicher Rückgang der linksventrikulären Volumina verzeichnet werden. Darüber hinaus fand sich bei der Mehrzahl der Patienten nach einem medianen Follow-Up von sieben Monaten eine Verbesserung der subjektiven funktionellen Beschwerden um mindestens eine NYHA-Klasse (Abb. 1A). Konkret konnte in 58% eine Verbesserung um mindestens eine Klasse, in 37% keine Veränderung und in 5% eine klinische Verschlechterung dokumentiert werden. Laborchemisch fand sich ein signifikanter Rückgang des NT-Pro-BNPs (p = 0,01). Des weitern nahm der Schweregrad der Mitralinsuffizienz (p = 0,02) sowie der pulmonal-arterielle Druck (gemessen als RV/RA-Druckdifferenz) signifikant ab (p = 0,003).
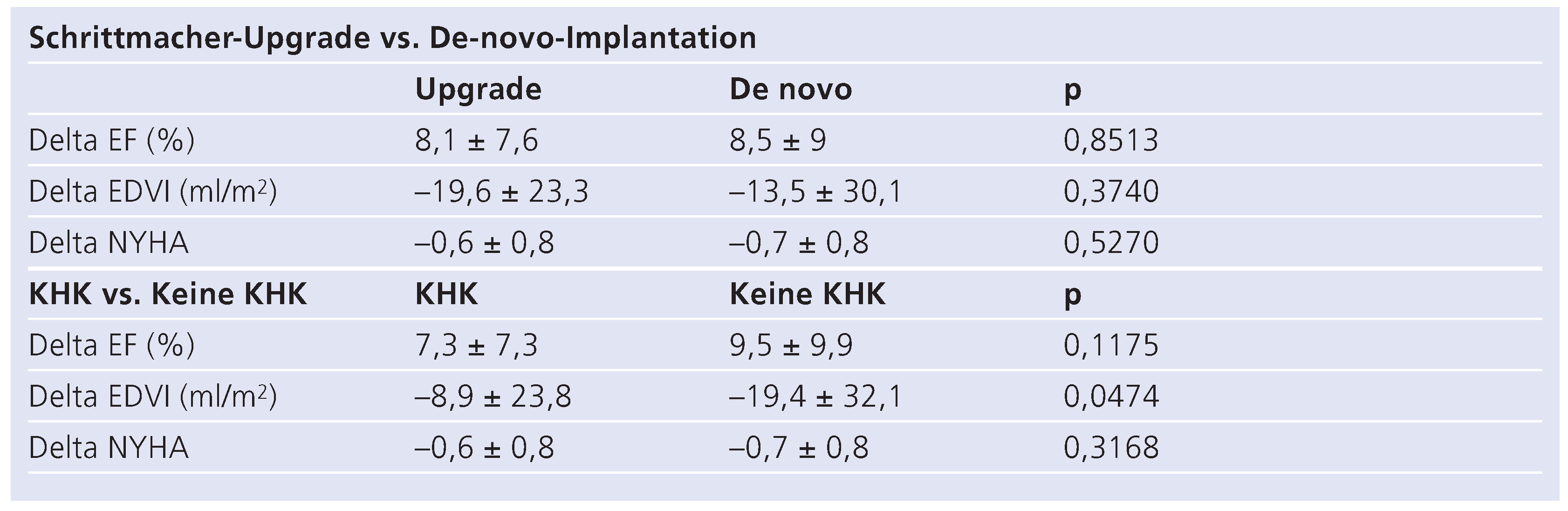
Im Vergleich verschiedener Untergruppen profitierten Patienten mit konventionellem Schrittmacher und vorwiegend rechtsventrikulärer Stimulation, welche auf eine CRT aufgerüstet wurden (sog. «Schrittmacher-Upgrades»), gleichermassen wie jene nach de novo CRT-Implantation (Tab. 6). Ebenfalls zeigte sich ein vergleichbares Ansprechen bei Patienten mit und ohne zugrunde liegender koronarer Herzkrankheit, wobei die Verbesserung des enddiastolischen Volumenindexes als Indikator für ein positives Remodeling bei letzterer Gruppe signifikant besser war (p <0,05).
Tabelle 2.
Baseline-EKG-Befunde vor CRT-Implantation. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt. (*nur bei Eigenrhythmus).
Tabelle 2.
Baseline-EKG-Befunde vor CRT-Implantation. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt. (*nur bei Eigenrhythmus).
Tabelle 3.
Baseline-Echoparameter vor CRT-Implantation. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt (*n = 169; # n = 107).
Tabelle 3.
Baseline-Echoparameter vor CRT-Implantation. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt (*n = 169; # n = 107).
Tabelle 4.
Implantationscharakteristika und Komplikationen. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt.
Tabelle 4.
Implantationscharakteristika und Komplikationen. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt.
Diskussion
Die kardiale Resynchronisationstherapie (CRT) hat sich über die vergangenen Jahre als neue therapeutische Option für Patienten mit schwerer Herzinsuffizienz etabliert. Grosse randomisierte Multizenterstudien (CARE-HF, COMPANION) haben einen günstigen Effekt der CRT auf den klinischen Verlauf eindrücklich nachweisen können. Es sind denn auch hauptsächlich diese Studien, die die heutige Indikationsstellung in den aktuellen Guidelines geprägt haben. Wie einleitend erwähnt, entsprechen aufgrund der strengen Einschluss- und Ausschlusskriterien die Patienten grosser klinischer Studien häufig nicht genau den Patienten, die im klinischen Alltag gesehen und behandelt werden. Für die Einführung neuer Therapien wie der CRT ist daher wichtig, dass sie sich auch ausserhalb strikter Studienbedingungen unter alltäglichen Bedingungen bewähren.
In unserer retrospektiven Analyse, welche mehr als 200 CRT-Implantationen umfasst, wurden alle Patienten konsekutiv eingeschlossen; es besteht daher keinerlei positiver oder negativer Selektionsbias, so dass die Analyse das gesamte CRT-Programm an unserer Institution widerspiegelt. Die Demographie der Patienten in unserer Kohorte erwies sich als sehr ähnlich derjenigen grosser Studien und entspricht in der Tat erstaunlich genau den Daten des kürzlich veröffentlichten
European CRT Survey [
11], in welchem 2438 CRT-Patienten aus 13 europäischen Ländern erfasst wurden. Dies zeigt, dass sich unsere klinische Praxis und Patientenselektion mit der grossen Mehrheit in Europa überraschend deutlich deckt.
Wir konnten dabei in unserem Kollektiv klar zeigen, dass die CRT bei einem Grossteil der Patienten zu einer klinischen Verbesserung (Abnahme der NYHA-Klasse) und zu einem reversen Remodeling, also einer Abnahme der Volumina sowie Verbesserung der Auswurffraktion des linken Ventrikels, führte. 69% der Patienten zeigten einen Rückgang des linksventrikulären endsystolischen Volumens um mindestens 15%, was in den meisten Arbeiten als CRT-Responder definiert wurde. Diese Resultate entsprechen den Ergebnissen anderer Studien [
12].
Die Definition eines sogenannten «Responders» ist allerdings bisher ungelöst, da die Frage, ab wann man von einer relevanten Verbesserung sprechen darf, schwierig zu beantworten ist. Muss ein Responder zwingend ein reverses Remodeling zeigen? Oder ist eine alleinige klinische Verbesserung auch genügend, und wenn ja, ab welchem Wert? Ist zuletzt nicht auch die Erhaltung des
Status quo (sog.
non-progressor) bei einer chronisch progressiven Erkrankung wie der Herzinsuffizienz ein Therapieerfolg? So zeigen unsere Daten beispielsweise, dass das Remodeling (Abnahme des LVEDVI) bei Patienten mit nicht-ischämischer Genese der Herzinsuffizienz – im Vergleich zur ischämischen Ätiologie – deutlich ausgeprägter ausfällt. Dies leuchtet intuitiv ein, da Ventrikel mit Narbenarealen nur eingeschränkt zum reversen Remodeling fähig sind. Im Unterschied dazu ist die klinische Verbesserung (NYHA-Klasse) zwischen den zwei Gruppen durchaus vergleichbar. Unsere Ergebnisse sind diesbezüglich in guter Übereinstimmung mit kürzlich publizierten Subgruppenanalysen der CARE-HF-Studie [
13,
14]. Obgleich in letzterer Studie zwischen Patienten mit ischämischer bzw. nicht-ischämischer Ätiologie kein signifikanter Unterschied bezüglich der Endpunkte Mortalität und Hospitalisation wegen Herzinsuffizienz gefunden wurde [
14], scheint das Vorliegen von Narbengewebe im posterolateralen Gebiet des linken Ventrikels das Ansprechen auf CRT negativ zu beeinflussen [
15]. Dies zeigt die Unklarheiten auf, welche gegenwärtig hinsichtlich der Definition des «Ansprechens» auf CRT bestehen – ob und in welchem Ausmass tatsächlich eine Zunahme der EF bzw. eine Abnahme des EDVI zwingend notwendig ist, um eine «Response» zu bewirken, ist nicht endgültig geklärt. Die Ätiologie erscheint dann auch in den aktuellen Guidelines nicht [
16] und stellt auch in der Praxis in der Regel kein Selektionskriterium dar.
Abbildung 1.
Verbesserung der Dyspnoebeschwerden (nach NYHA, A) und der linksventrikulären Ejektionsfraktion (LVEF, B) nach CRT-Implantation.
Abbildung 1.
Verbesserung der Dyspnoebeschwerden (nach NYHA, A) und der linksventrikulären Ejektionsfraktion (LVEF, B) nach CRT-Implantation.
Tabelle 5.
Vergleich ausgewählter echokardiographischer und klinischer Parameter vor und nach CRT-Implantation. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt. Medianer Follow-Up sieben Monate.
Tabelle 5.
Vergleich ausgewählter echokardiographischer und klinischer Parameter vor und nach CRT-Implantation. Anzahl der Patienten (%) bei kategorischen Variablen bzw. Mittelwert (± Standardabweichung) bei kontinuierlichen Variablen werden gezeigt. Medianer Follow-Up sieben Monate.
Tabelle 6.
Vergleich der Verbesserung von Ejektionsfraktion (EF), enddiastolischem Volumenindex (EDVI) und funktioneller NYHA-(New York Heart Association-)Klassifikation, bei neu implantierten CRT vs. Schrittmacher-Upgrades bzw. bei Patienten mit/ohne zugrunde liegender koronarer Herzerkrankung. Werte entsprechen Mittelwert (± Standardabweichung).
Tabelle 6.
Vergleich der Verbesserung von Ejektionsfraktion (EF), enddiastolischem Volumenindex (EDVI) und funktioneller NYHA-(New York Heart Association-)Klassifikation, bei neu implantierten CRT vs. Schrittmacher-Upgrades bzw. bei Patienten mit/ohne zugrunde liegender koronarer Herzerkrankung. Werte entsprechen Mittelwert (± Standardabweichung).
Die klassische CRT-Indikation beinhaltet Patienten mit breitem QRS-Komplex (meist aufgrund eines LSB), eine schwer eingeschränkte Auswurffraktion (<35%), sowie eine NYHA-Klasse III oder IV [
16]. In unserer Kohorte lag die mittlere QRS-Dauer bei 153 ms, 88,6% der Patienten hatten eine QRS-Dauer von >120 ms, und 80% befanden sich in NYHA Klasse III oder IV. Es erfüllten somit nicht alle Patienten die Kriterien gemäss heute gültigen Richtlinien. Dies dürfte verschiedene Ursachen haben: Zum einen hat sich kürzlich die Evidenz verdichtet, dass auch Patienten mit weniger ausgeprägter Symptomatik von einer biventrikulären Stimulation profitieren. So konnten zwei grössere kürzlich veröffentlichte Studien, die REVERSE [
17] und die MADIT-CRT-Studie [
7], eindrücklich aufzeigen, dass auch Patienten mit einer NYHAKlasse I/II unter einer CRT ein ausgeprägtes reverses Remodeling zeigen [
18], und dass der kombinierte Endpunkt aus Tod und Herzinsuffizienzhospitalisationen günstig beeinflusst wird. In den genannten Studien wurde allerdings der kombinierte Enpunkt entscheidend durch eine Verminderung von Hospitalisationen und nicht durch eine Reduktion der Mortalität beeinflusst. Dies erstaunt nicht weiter, da die Prognose bei oligosymptomatischen Patienten bekannterweise besser ist und harte Endpunkte wie Tod somit viel seltener auftreten. Bei Patienten mit einer NYHA-Klasse II (17,8%) und Klasse I (3%), welche in unserer Serie
de novo einen CRT implantiert erhalten hatten, wurde bei ausgeprägter Dyssynchronie grosszügig die Indikation zur CRT-Implantation gestellt. Im Nachhinein zeigt sich nun, dass diese intuitive Praxis durch die Ergebnisse von REVERSE und MADIT CRT bestätigt wurde. Da diese Patienten jedoch, wie oben aufgeführt, höchstwahrscheinlich einer längeren Therapiedauer bedürfen, bevor mit einem signifikanten Mortalitätsbenefit zu rechnen ist, bleibt letztlich abzuwarten, ob der Nutzen dieser Therapie gegenüber den mittel- und langfristigen Komplikationen (vor allem Elektrodenprobleme, häufigere Devicewechsel bei CRT-Geräten) und Risiken bei dieser Patientenpopulation überwiegt.
Eine weitere Gruppe von Patienten, die durch die aktuellen Guidelines nicht erfasst wird, umfasst solche mit einem schmalen QRS-Komplex. Nur gerade rund 30% der Patienten mit mittelschwerer bis schwerer Herzinsuffizienz haben jedoch einen breiten QRS-Komplex [
19] Interessanterweise zeigen aber auch etwa 25% der Patienten mit schmalem QRS-Komplex im Tissue-Doppler eine relevante intraventrikuläre Dyssynchronie [
20] Es gibt in der Literatur verschiedene meist kleinere Studien, die einen Nutzen von CRT bei Patienten mit schmalem QRS und mechanischer Dyssynchronie nahelegen konnten (unter Verwendung verschiedener echokardiographischer Dyssynchronieparameter), während andere grössere Studien (mit jedoch signifikanten Limitationen) eine günstige Wirkung der CRT in dieser Population anzweifeln [
9,
21,
22,
23,
24]. Letztlich kann diese Frage abschliessend nur durch eine grosse prospektive randomisierte Studie mit sog. «harten» klinischen Endpunkten (Tod, Transplantation) beantwortet werden. Die von uns initiierte EchoCRTStudie (ClinicalTrials.gov Identifier: NCT00683696) ist eine internationale Multizenterstudie, welche ca. 1300 Patienten mit schmalem QRS, NYHA III/IV und echokardiographisch nachgewiesener Dyssynchronie einschliessen und zu CRT ON, resp. OFF randomisieren wird. Unsere Kohorte umfasste nur 18 Patienten mit schmalem QRS-Komplex. Ein Teil davon wurde im Rahmen der EchoCRT-Studie implantiert, ein Teil wurde bereits vor Studienbeginn aufgrund einer ausgeprägten Dyssynchronie implantiert.
Zwanzig Prozent unserer Patienten wurden von einem konventionellen Schrittmacher auf ein biventrikuläres System aufgerüstet (Schrittmacher-Upgrade). Seit einigen Jahren ist bekannt, dass sich ein überwiegend rechtsventrikuläres Pacing insbesondere bei bereits eingeschränkter linksventrikulärer Funktion ungünstig auswirkt. Eine schwer eingeschränkte EF, NYHA III/IV, und permantentes rechtsventrikuläres Pacing stellen dementsprechend in den heutigen Richtlinien eine IIa-Indikation zur CRT-Implantation resp. zu einem Upgrade dar [
16]. Wir haben kürzlich die Ergebnisse eines Upgrades mit denen nach
de-novo-CRT-Implantationen verglichen und konnten dabei zeigen, dass das Ansprechen durchaus vergleichbar ist – und dies sogar nach bis zu 10 Jahren rechtsventrikulärer Stimulation [
25]. Kam es bei Patienten nach Schrittmacherimplantation zu einer kontinuierlichen Verschlechterung der LV-Funktion, wurde teilweise entschieden, diese auf ein CRT-System aufzurüsten, bevor die LVEF unter 35% abgefallen war. Dies erklärt auch den Hauptanteil der gut 10% an Patienten, welche eine LVEF >35% bei Implantation aufwiesen. Entsprechend stellen diese Patienten ebenfalls den Hauptanteil der Kohorte dar, welche einen CRTSchrittmacher (CRT-P) erhalten haben anstelle eines CRT-Defibrillators (CRT-D). Insgesamt wurden 19 (9,2%) CRT-P implantiert. Die Patienten, welche ein CRT-P-Gerät erhielten, waren im Schnitt neun Jahre älter als solche, welche mit einem CRT-D versorgt wurden. Darunter sind neben den Schrittmacherpatienten auch ältere Patienten, die explizit auf einen Defibrillator verzichten wollten. Hierbei erscheint wichtig zu beachten, dass in der CARE-HF-Studie ausschliesslich CRT-Schrittmacher (ohne Defibrillator) implantiert wurden, und trotzdem ein Nutzen (Abnahme des kombinierten Endpunktes von Mortalität und Herzinsuffizienzhospitalisationen, sowie der Gesamtmortalität) gezeigt werden konnte [
2]. Die Entscheidung zur Implantation eines CRT-P vs. CRT-D hat jedoch auch gesundheitsökonomische Implikationen, da der Preisunterschied zwischen einem CRT-P und einem CRT-DGerät etwa einen Faktor 4 beträgt.
Ein wichtiges Einschlusskriterium für eine CRT ist eine stabile und maximal ausgebaute Herzinsuffizienztherapie. In unserer Kohorte waren 97% der Patienten mit einem ACE-Inhibitor/AT-2-Antagonist, 87% mit einem Betablocker, sowie 56% mit Spironolacton behandelt. Diese Werte liegen erfreulicherweise über denjenigen grosser Studien oder dem
European CRTSurvey [
11]. Die Etablierung einer gut ausgebauten Herzinsuffizienztherapie ist essentiell, da es nicht selten innerhalb der ersten Monate nach Therapiebeginn zu einem Remodeling mit Verbesserung der LV-Funktion kommt und eine CRT-Indikation möglicherweise im Verlauf nicht mehr gegeben ist.
Die Implantation der linksventrikulären Elektrode hat sich durch stetige Weiterentwicklung des Materials (Katheter, Elektroden etc) über die letzten Jahre vereinfacht. So konnten in der vorliegenden Serie 87% der Elektroden in der ersten Sitzung erfolgreich implantiert werden und weitere 7,7% in einer 2. Sitzung, was einer Erfolgsrate der transvenösen Implantation von 95% entspricht. In den verbleibenden Fällen musste die Elektrode epikardial implantiert werden. Die Gründe für eine nicht erfolgreiche Implantation waren in den meisten Fällen das Fehlen von geeigneten lateralen/posterolateralen Venen. Da gezeigt wurde, dass eine anteriore Elektrodenlage für eine optimale Resynchronisation nicht geeignet ist [
26,
27], wurde eine gezielte epikardiale Implantation anstelle einer anterioren Implantation bei fehlenden lateralen Venen bevorzugt.
Die durchschnittliche Operationsdauer betrug gut 100 Minuten, und praktisch alle Implantationen wurden in Lokalanästhesie mit/ohne Analgosedation durchgeführt. Der Hauptanteil der Patienten konnte am ersten postoperativen Tag austreten. Wir verzichteten bis anhin auf ambulante CRT-Implantationen, da die Patienten im Schnitt kränker (Niereninsuffizienz etc.) sind und häufiger Antikoagulatien einnehmen als Schrittmacher- oder ICD-Patienten.
Komplikationen sind im Allgemeinen selten und beinhalten Hämatome, Pneumothorax, Infekte, Elektrodenperforationen und Zwerchfellstimulation. Die Rate dieser Komplikationen ist in unserer Kohorte vergleichbar mit andern Registern, wobei der perioperative Nachbeobachtungszeitraum in unserer Kohorte 14 Tage betrug, dies im Gegensatz zum European CRT Survey, in welchem die publizierten Daten sich nur auf den Zeitraum bis zur Entlassung beziehen. Ein nicht ganz seltenes Problem ist die Zwerchfellstimulation, entweder durch direkte Stimulation des Zwerchfells oder via den Nervus phrenicus, welcher in den posterioren Arealen des linken Ventrikels verläuft. Beinahe jeder 10. Patient (in unserer Kohorte 8,7%) verspürte initial Zwerchfellzuckungen, welche in den meisten Fällen durch Umprogrammierung des Stimulationsvektors behoben werden konnten. Dies ist aber nur bei bipolaren Elektroden möglich, weshalb wir aktuell (insbesondere seit nun auch dünne bipolare Elektroden verfügbar sind) ausschliesslich bipolare Elektroden verwenden; der Anteil an unipolaren Elektroden lag hingegen bei nur 16,9%, welche hauptsächlich in den früheren Jahren der CRT-Implantation verwendet wurden. Bei 2% der Patienten konnte die Zwerchfellstimulation nicht durch Verändern der Einstellungen behoben werden, und es wurde eine Reoperation notwendig, meist mit Implantation einer epikardialen Elektrode. Neue CRT-Systeme mit quattropolarer LVElektrode, die seit kurzem verfügbar sind, sollten diese Problematik entschärfen und die Anzahl der Reoperationen weiter vermindern.