Neue Empfehlungen zur Antibiotischen Endokarditisprophylaxe: Pädiatrische Applikation †
Summary
Einleitung


Inzidenz, Prädisposition und Mortalität der Endokarditis im Kindesalter
Rationale der Endokarditisprophylaxe
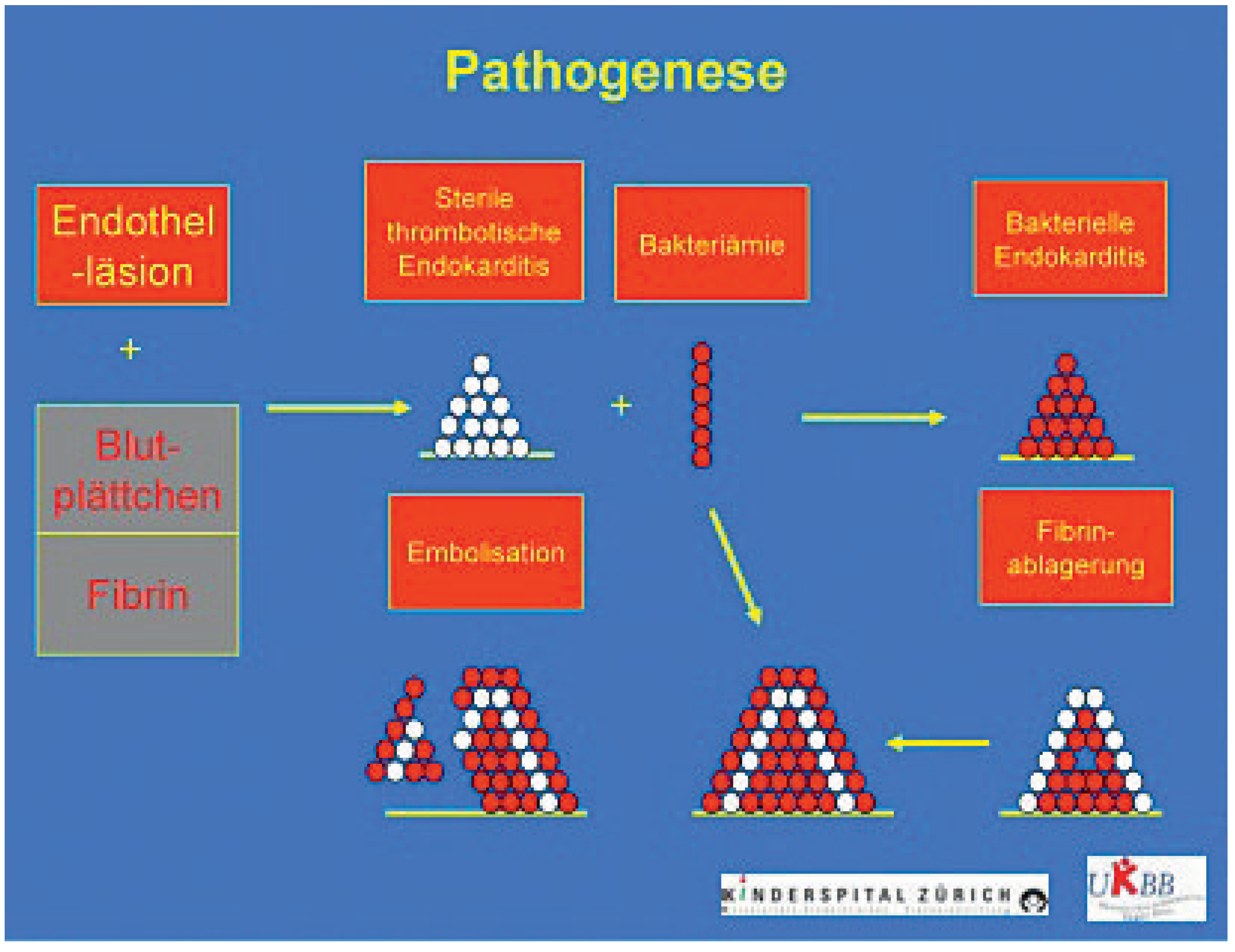

Was ist in der Pädiatrie speziell?
Konsensus der Schweizerischen Gesellschaft für Kinderkardiologie
Conflicts of Interest
Literatur
- Zuber, M.; Vuille, C.; Stocker, F. Neue Schweizerische Richtlinien für die Endokarditis-Prophylaxe. Kardiovaskuläre Medizin. 2000, 3, 266–272. [Google Scholar]
- Flückiger, U.; Jaussi, A. Revidierte schweizerische Richtlinien für die Endokarditis-Prophylaxe. Kardiovaskuläre Medizin. 2008, 11, 392–400. [Google Scholar]
- Naber, C.K.; Al-Nawas, B.; Baumgartner, H.; Becker, H.J.; Block, M.; Erbel, R.; et al. Prophylaxe der infektiösen Endokarditis. Kardiologe. 2007, 1, 243–250. [Google Scholar] [CrossRef]
- Coward, T.; Tucker, N.; Darville, T. Infective endocarditis in Arkansan children from 1990 through 2002. Ped Infect Dis J. 2003, 22, 1048–1052. [Google Scholar] [CrossRef] [PubMed]
- Schollin, J.; Bjarke, B.; Wesstrom, G. Infective endocarditis in Swedish children. Incidence, etiology, underlying factors and port of entry of infection. Acta Paediatr Scand. 1986, 75, 993–998. [Google Scholar] [CrossRef]
- Blumenthal, S.; Griffiths, S.P.; Morgan, B.C. Bacterial Endocarditis in Children with Heart Disease-a Review based on the Literature and Experience with 58 Cases. Pediatrics. 1960, 26, 993–1017. [Google Scholar] [CrossRef]
- Ferrieri, P.; Gewitz, M.H.; Gerber, M.A.; Newburger, J.W.; Dajani, A.S.; Shulman, S.T.; et al. Unique Features of Endocarditis in Childhood. Circulation. 2002, 105, 2115–2126. [Google Scholar] [CrossRef]
- Corone, P.; LevyA; Hallali, P. ; DavidoA; Wyler, Y.; CoroneA 54 cases of infectious endocarditis seen in 32 years in a population of 2038 congenital heart diseases. Arch Mal Coeur Vaiss. 1989, 82, 779–784. [Google Scholar]
- Michel, P.L. ; AcarJ Native cardiac disease predisposing to infective endocarditis. Eur Heart J. 1996, 1996 (Suppl. B), 2–6. [Google Scholar]
- Weber, R.; Berger, C.; Balmer, C. Interventions using foreign material to treat congenital heart disease in children increase the risk of infective endocarditis. Pediatr Infect Dis J. 2008, 27, 544–550. [Google Scholar] [CrossRef]
- Norman, J.; BozioA; Etienne, J. ; Sassolas, F.; Le Bris, F. Changing patterns and prognosis of infective endocarditis in childhood. Eur Heart J. 1995, 16 (Suppl. B), B):28–31. [Google Scholar] [CrossRef]
- Di Filippo, S.; Delahaye, F.; Seniod, B. Current patterns of infective endocarditis in congenital heart disease. Heart. 2006, 92, 1490–1495. [Google Scholar] [CrossRef] [PubMed]
- Ishiwada, N.; Niva, K.; Tateno, S.; Yoshinaga, M.; TeraiM; Nakazawa, M. ; et al. Causative organism influences clinical profile and outcome of infective endocarditis in pediatric patients and adults with congenital heart disease. Circulation J. 2005, 69, 1266–1270. [Google Scholar] [CrossRef][Green Version]
- Parras, F.; Bouza, E.; Romero, J.; Buzon, L.; Quero, M.; Brito, J.; et al. Infective Endocarditis in Children. Pediatr Cardiol. 1990, 11, 77–81. [Google Scholar] [CrossRef] [PubMed]
- Brusch, J.L. Infective endocarditis: Management in the Era of Intravascular Devices. New York: Informa Healthcare 2007. [Google Scholar]
- Baddour, L.M.; Bettmann, M.A.; Bolger, A.F.; Epstein, A.E.; Ferrieri, P.; Gerber MAet, a.l. Nonvalvular cardiovascular device-related infections. Circulation. 2003, 108, 2015–2031. [Google Scholar] [CrossRef]
- Donlan, R.M. Biofilm formation: a clinically relevant microbiological process. Clin Infect Dis. 2001, 33, 1387–1392. [Google Scholar] [CrossRef]
- Lockhart, P.B.; Brennan, M.T.; Kent, M.L.; Nortton, H.J.; Weinrib, D.A. Impact of amoxicillin prophylaxis on the incidence, nature and duration of bacteremia in children after intubation and dental procedures. Circulation. 2004, 109, 2878–2884. [Google Scholar] [CrossRef]
- Amstrong, M.L.; DeBoer, S.; Cetta, F. Infective endocarditis after body art: Areview of the literature and concerns. JAdolesc Health. 2008, 43, 217–225. [Google Scholar] [CrossRef]
- Blatter, M.; Francioli, P. Endocarditis prophylaxis: from experimental models to human recommendation. Eur Heart J. (Suppl. B). 1995, 16, 107–109. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Steckelberg, J.M.; Wilson, W.R. Risk factors for infective endocarditis. Infect Dis Clin North Am. 1993, 7, 9–19. [Google Scholar] [CrossRef]
- Wilson, W.; Taubert, K.A.; Gewitz, M.; Lockhart, P.B.; Baddour, L.M.; Levison, M.; et al. Prevention of infective endocarditis: a guideline from theAmerican Heart Association Rheumatic Fever, Endocarditis and Kawasaki Disease Committee, Council on cardiovascular Diserase in the Young and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation. 2007, 116, 1736–1754. [Google Scholar] [PubMed]
- Vetter, C. Impetigo contagiosa und Hautinfektionen. Zahnärztliche Mitteilung. 2003, 9, 60. [Google Scholar]
- Steelman, R.; Einzig, S.; BalianA; Thomas, J. ; Rosen, D.; Gustafson, R.; et al. Increased susceptibility to gingival colonization by specific HACEK microbes in children with congenital heart disease. J Clin Pediatr Dent. 2000, 25, 91–94. [Google Scholar] [CrossRef] [PubMed]
- Knirsch, W.; Scheifele, C.; Adam, M.; Finke, C.; Uhlemann, F.; Lange, P.E. Anti-infectiuous prophylaxis in children with congenital heart disease during dental procedures. Monatsschr Kinderheilkd. 2000, 148, 30–35. [Google Scholar] [CrossRef]
© 2010 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Günthard, J.; Knirsch, W. Neue Empfehlungen zur Antibiotischen Endokarditisprophylaxe: Pädiatrische Applikation. Cardiovasc. Med. 2010, 13, 297. https://doi.org/10.4414/cvm.2010.01534
Günthard J, Knirsch W. Neue Empfehlungen zur Antibiotischen Endokarditisprophylaxe: Pädiatrische Applikation. Cardiovascular Medicine. 2010; 13(10):297. https://doi.org/10.4414/cvm.2010.01534
Chicago/Turabian StyleGünthard, Joëlle, and Walter Knirsch. 2010. "Neue Empfehlungen zur Antibiotischen Endokarditisprophylaxe: Pädiatrische Applikation" Cardiovascular Medicine 13, no. 10: 297. https://doi.org/10.4414/cvm.2010.01534
APA StyleGünthard, J., & Knirsch, W. (2010). Neue Empfehlungen zur Antibiotischen Endokarditisprophylaxe: Pädiatrische Applikation. Cardiovascular Medicine, 13(10), 297. https://doi.org/10.4414/cvm.2010.01534



