Zusammenfassung
Nikotinsäure ist ein über 50 Jahren altes Medikament. Sie senkt die Serumsspiegel aller atherogenen Lipoproteine (VLDL, LDL und auch Lp[a]) und erhöht die protektiven HDLLipoproteine mehr als die anderen lipidsenkenden Medikamente. Viele Studien haben gezeigt, dass die Behandlung mit Nikotinsäure die Progression der Atherosklerose, die klinischen KHK-Ereignisse und die KHK-Mortalität senkt. Die Kombination der LDL-senkenden Statine mit der HDL-steigernden Nikotinsäure bietet grosse Vorteile. Die Verträglichkeit von Nikotinsäure ist aber wegen des häufigen Auftretens von Flush-Episoden ziemlich schlecht. Seit kurzer Zeit ist eine neue galenische Formulierung mit retardierter Wirkung («extended release»-Nikotinsäure) erhältlich, welche ebenfalls Flush, obwohl weniger als mit der rapiden Form von Nikotinsäure, verursacht. Die Kombination mit Laropiprant, einem Antagonisten des Prostaglandin-Rezeptors D2 Subtyp-1, ist in der Lage, die durch ESNikotinsäure verursachte Vasodilatation (Flush) zu bekämpfen, ohne die lipidsenkende Wirkung von ER-Nikotinsäure zu beeinflussen. Die gleichzeitige Senkung des LDL-Cholesterins und Erhöhung des HDL-Cholesterins wird für die Zukunft ein wichtiges Therapieziel darstellen. In dieser Hinsicht ist die Kombination eines Statins mit ER-Nikotinsäure (mit Zusatz von Laropiprant) von besonderem Interesse.
Schlüsselwörter: Nikotinsäure; Extended release (ER)-Nikotinsäure; Laropiprant; HDLCholesterin; koronare Herzkrankheit; Atherosklerose
Einleitung
Ein tiefer HDL-Cholesterin-Spiegel geht, wie prospektive epidemiologische Studien zeigen, mit erhöhter Koronarmorbidität und -mortalität einher [
1,
2,
3].
Tiefes HDL-Cholesterin ist ein unabhängiger Risikofaktor für Atherosklerose [
2].
Als tief werden bei Männern HDL-Spiegel <0,9 mmol/l und bei Frauen <1,0–1,2 mmol/l definiert [
4].
Trotz eindrücklicher Resultate aus einer Vielfalt von Endpunktstudien und Untersuchungen zur Atheroskleroseprogression mit Statinen haben diese Studien gezeigt, dass die alleinige Senkung von LDL-Cholesterin unter Standardstatindosierung ein beträchtliches Restrisiko für kardiovaskuläre Ereignisse weiter bestehen lässt.
In der Post-hoc-Analyse der TNT-Studie waren die HDL-Cholesterinwerte prädiktiv für grössere kardiovaskuläre Ereignisse auch bei Patienten unter Behandlung mit Statinen [
4]. Diese Korrelation wurde auch bei Patienten mit LDL-Cholesterinwerten unter 1,8 mmol/l beobachtet.
HDL-erhöhende Medikamente
Therapeutisch sind bei Patienten mit tiefem HDL-Cholesterin in erster Linie die Zielwerte für LDL-Cholesterin zu erreichen.
Eine Behandlung zur Erhöhung des HDLCholesterins stützt sich auf Lebensstiländerungen und Medikamente. Körperliche Bewegung, Raucherentwöhnung, Gewichtsreduktion bei Übergewicht, Verzehr von Fisch reich an Omega-3-Fettsäuren und mässiger Alkoholkonsum erhöhen das HDL-Cholesterin in der Regel um 10–20%.
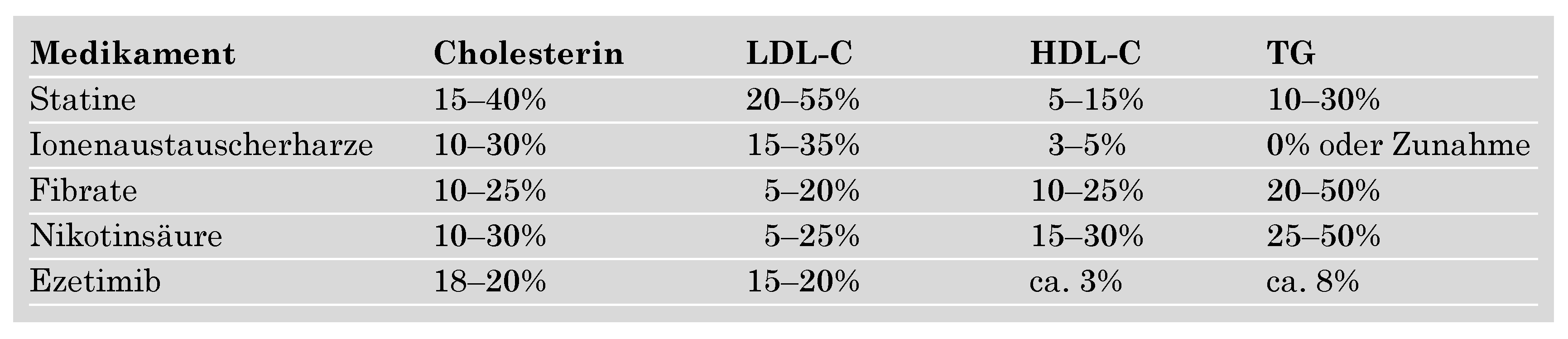
Fibrate, Nikotinsäure und weniger ausgeprägt auch Statine erhöhen das HDL-Cholesterin (Tab.1) [
5].
In kontrollierten klinischen Studien senken Fibrate und Statine bei Patienten mit tiefem HDL-Cholesterin das Koronarrisiko. Nikotinsäure, der stärkste HDL-Erhöher, scheint das Koronarrisiko ebenfalls zu vermindern [
6,
7,
8,
9,
10,
11,
12,
13].
Die grösste Steigerung der HDL-Cholesterinkonzentration wird durch die Inhibition des Cholesterinsestertransportproteins (CETP) erreicht. Dieses Protein vermittelt die Übertragung von Cholesterinestern von HDL auf VLDL/LDL und im Gegenzug von Triglyzeriden aus VLDL/LDL auf HDL. Bis jetzt wurden zwei CETP-Inhibitoren entwickelt.
Die ILLUMINATE-Studie mit dem CETPInhibitor Torcetrapib wurde abgebrochen [
14,
15]. Die Gründe für die schweren unerwünschten Nebenwirkungen von Torcetrapib sindnoch unbekannt. Man wusste bereits zu einem früheren Zeitpunkt, dass Torcetrapib den Blutdruck erhöht. Das Ausmass dieser Erhöhung erklärt aber die massive Zunahme von Todesfällen in der Torcetrapib-Gruppe keineswegs.
Untersuchungen zur Atherosklerose-Progression/Regression mit bildgebenden Methoden (ILLUSTRATE und RADIANCE1) [
16,
17], die 3 bzw. 4 Monate nach Abbruch der ILLUMINATE-Studie publiziert wurden, ergaben keine Änderung der Progression bzw. Regression der Atherosklerose. Diese Untersuchungen erklären damit in keiner Weise die negativen klinischen Wirkungen dieses Medikamentes.
Der Einsatz von rekombinantem HDL beim Menschen wurde untersucht. Im Jahr 2003 veröffentlichten Nissen et al. [
18] eine Arbeit, in der mittels seriellem intrakoronarem Ultraschall (IVUS) der Effekt einer mehrfachen intravenösen Gabe von rekonstituiertem HDL, dessen Lipoproteinfraktion aus apo-A1Milano bestand, untersucht wurde. Bei insgesamt 123 Patienten konnte gezeigt werden, dass es durch die Infusion nach fünf Wochen zu einem leichten Rückgang der PlaqueGrösse kam. Klinische Endpunkte fehlen indessen für den Einsatz von rekonstituiertem HDL noch vollständig, weshalb die Einführung dieses Behandlungsprinzips in die klinische Routine in den nächsten Jahren noch nicht zu erwarten ist.
Die Inhibition des Cannabinoid-Rezeptors-1 durch Rimonabant stellt eine weitere Möglichkeit zur Steigerung von HDL dar [
19]. Dieses Medikament senkt insbesondere Körpergewicht, Blutzucker, Triglyzeride und Blutdruck. In der Schweiz wurde Rimonabant bei adipösen Patienten (BMI >30 kg/m
2) oder bei übergewichtigen Patienten (BMI >27 kg/m
2) mit einem oder mehreren kardiovaskulären Risikofaktoren (u. a. Diabetes mellitus), bei welchen kalorienarme Diät und Bewegungstherapie nicht zum erwünschten Ziel geführt haben, zugelassen. Besondere Vorsicht ist allerdings bei Patienten mit psychischen Proble-men geboten, da es Hinweise gibt, dass unter Rimonabant verstärkt Depressionen (Suizidrisiko) auftreten können.
Tabelle 1.
Wirkung verschiedener lipidregulierender Medikamente auf einzelne Lipoproteine (nach [
5]).
Tabelle 1.
Wirkung verschiedener lipidregulierender Medikamente auf einzelne Lipoproteine (nach [
5]).
![Cardiovascmed 11 00160 i001 Cardiovascmed 11 00160 i001]() Lipid parameter Lipid parameter |
Abbildung 1.
Mechanismen der Aktion von Nikotinsäure: ABC A1-Transporter: transportiert das intrazelluläre Cholesterin an die Membranoberfläche. Apo A1 = Apolipoprotein A1; Apo B = Apolipoprotein B; FS = Fettsäuren; HDL = Lipoproteine hoher Dichte; LDL = Lipoproteine niedriger Dichte; TG = Triglyzeride; VLDL = Lipoproteine sehr niedriger Dichte.
Abbildung 1.
Mechanismen der Aktion von Nikotinsäure: ABC A1-Transporter: transportiert das intrazelluläre Cholesterin an die Membranoberfläche. Apo A1 = Apolipoprotein A1; Apo B = Apolipoprotein B; FS = Fettsäuren; HDL = Lipoproteine hoher Dichte; LDL = Lipoproteine niedriger Dichte; TG = Triglyzeride; VLDL = Lipoproteine sehr niedriger Dichte.
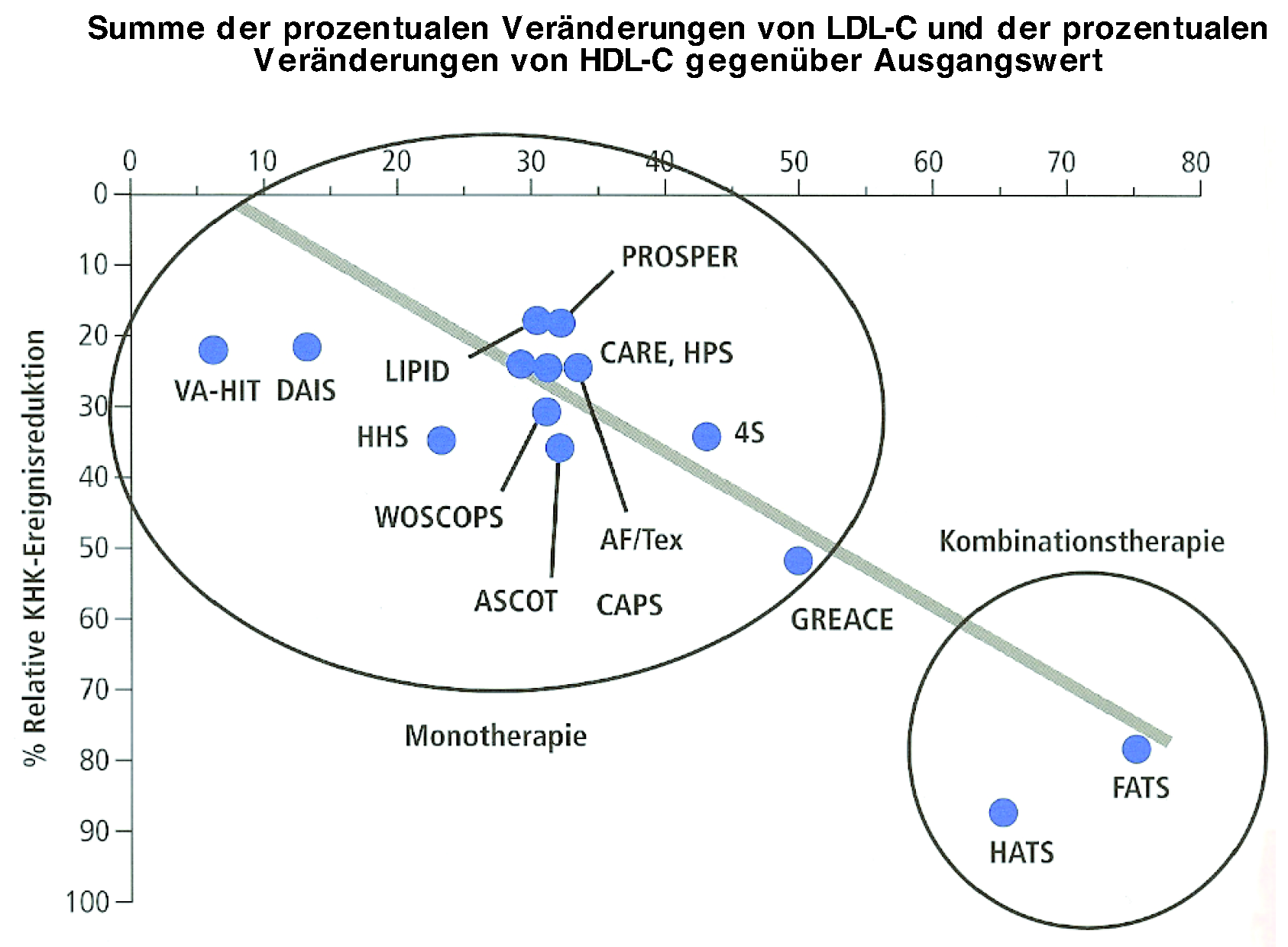
Abbildung 2.
Relative KHK-Ereignisreduktion unter Monound unter Kombinationstherapie (aus: Riesen WF, Darioli R. Dyslipidämie. In: Atheroskleroseprävention. Diagnostik und Therapie von Risikofaktoren. Edouard Battegay, Giorgio Noseda, Walter F. Riesen (eds), 1. Auflage. Bern: Hans Huber Verlag; 2007. p. 447. Mit freundlicher Genehmigung, Copyright © 2008, Verlag Hans Huber, Bern, CH). Kombinationstherapien: HATS = Simvastatin + Nikotinsäure; FATS = Colestipol + Nikotinsäure.
Abbildung 2.
Relative KHK-Ereignisreduktion unter Monound unter Kombinationstherapie (aus: Riesen WF, Darioli R. Dyslipidämie. In: Atheroskleroseprävention. Diagnostik und Therapie von Risikofaktoren. Edouard Battegay, Giorgio Noseda, Walter F. Riesen (eds), 1. Auflage. Bern: Hans Huber Verlag; 2007. p. 447. Mit freundlicher Genehmigung, Copyright © 2008, Verlag Hans Huber, Bern, CH). Kombinationstherapien: HATS = Simvastatin + Nikotinsäure; FATS = Colestipol + Nikotinsäure.
Aufgrund des überraschenden Versagens der Therapie mit dem CETP-Inhibitor Torcetrapib und da die Infusion von rekombinantem HDL für die klinische Anwendung noch nicht bereit ist, erlebt die Nikotinsäure in ihrer extended release (ER)-Form ein «Revival».
Von besonderem Interesse wird die Kombination mit dem Prostaglandin-D2-RezeptorAntagonist Laropiprant sein, welcher die Frequenz und Intensität des unter Nikotinsäure häufig auftretenden Flushes zu senken vermag.
Nikotinsäure
Die Nikotinsäure wird bereits seit einem halben Jahrhundert als lipidregulierendes Medikament eingesetzt [
20] und hat ihre gute Wirkung schon in den 1970er Jahren im «Coronary Drug Project» [
21] gezeigt.
Dieses Medikament beeinflusst sowohl HDL- als auch LDL-Cholesterin, Triglyzeride und Lp(a), ein weiteres atherogenes Lipoprotein, günstig. (Tab. 1) [
5]. Die Zunahme des HDL-Cholesterins beträgt 15–30%. Diese Änderungen sind mit einer Senkung des kardio-vaskulären Risikos und einer Verhinderung der Progression und Unterstützung der Regression atherosklerotischer Plaques verbunden [
20]. Die Wirkung der Nikotinsäure auf den HDL-Metabolismus ist von zentraler Bedeutung für seine Stellung in der Therapie von Fettstoffwechselstörungen.
Was dem Wirkungsmechanismus, über den die Nikotinsäure das Lipidprofil verändert, anbelangt, ist es bekannt, dass Nikotinsäure die Freisetzung von freien Fettsäuren aus dem Fettgewebe hemmt. Dadurch gelangen weniger freie Fettsäuren in die Leber. Da weniger freie Fettsäuren in die Leber transportiert werden, werden weniger zu Triglyzeriden verestert und anschliessend im VLDL inkorporiert. Dies kann zu einer verringerten LDL-Bildung führen. Durch Steigerung der Lipoprotein-Lipase-Aktivität kann Nikotinsäure die Elimination von triglyzeridreichen Chylomikronen aus dem Plasma steigern. Auf dieser Weise vermindert Nikotinsäure die Syntheserate von hepatischem VLDL, und nachfolgend von LDL (Abb. 1).
Obwohl es eine Vielzahl von Erklärungen zum HDL-steigernden Effekt der Nikotinsäure gibt, ist der exakte Mechanismus nach wie vor nicht gänzlich bekannt.
Vor kurzer Zeit wurde ein Rezeptor für Nikotinsäure (GPR109A) [
22] in Adipozyten entdeckt, welcher möglicherweise den Wirkungsmechanismus von Nikotinsäure zu erklären helfen kann.
Dazu wurde nachgeweisen, dass Nikotinsäure die Expression des ABCA1-Transporters erhöht [
23], welcher das intrazelluläre Cholesterin an die Membranoberfläche transportiert, wo es von lipidarmen, im Blut zirkulierenden Apo-A1-HDL-Partikeln aufgenommen wird (Abb. 1). Dies stellt die erste Phase des Cholesterin-Rücktransportes, welches die Mobilisation von Cholesterin aus den Geweben mit nachfolgender Elimination aus dem Körper als fäkale Steroide durch die Galle fördert. Dieser neue Mechanismus sollte die Anwendung von Nikotinsäure, alleine oder in Kombination mit einem Statin, in der Prävention und Behandlung der Atherosklerose steigern. Die HATS-Studie [
24] hat die Kombination Simvastatin – Niacin vs Plazebo bei Patienten mit praktisch normalem LDL-Cholesterin, sehr tiefem HDL-Cholesterin und normalen bis leicht erhöhten Triglyzeriden verglichen. Mit der medikamentösen Therapie liess sich das HDL-Cholesterin um 18–26% erhöhen, das LDL-Cholesterin um 36–42% und die Triglyzeride um 31–37% senken. Eine so starke Zunahme des HDL-Cholesterins wurde bis jetzt weder mit Statinen noch mit Fibraten erzielt. Leider wurde eine Kontrolle mit Simvastatin allein nicht durchgeführt. Unter Behandlung kam es zu einer noch nicht in einer Interventionsstudie beobachteten Reduktion der «major coronary events» um 90%.
Eine vergleichbare Wirkung wurde bereits früher bei Patienten mit kombinierter Hyperlipidämie mit Hilfe der Kombination von Nikotinsäure und Colestipol in der FATS-Studie erreicht [
25].
Die klinischen Wirkungen verschiedener Mono- und Kombinationstherapien zur Erhöhung von HDL-Cholesterin und Senkung von LDL-Cholesterin sind in Abbildung 2 dargestellt.
Während einer Kombinationstherapie von Nikotinsäure mit HMG-CoA-Reduktase-Hemmern wurden Einzelfälle von Rhabdomyolyse beobachtet. Bei Anwendung einer solchen Kombinationstherapie müssen die Patienten sorgfältig hinsichtlich Symptome einer Rhabdomyolyse überwacht werden.
Extended release (ER)-Nikotinsäure
Die hauptsächlichen unerwünschten Nebenwirkungen der Nikotinsäure sind Flush-Episoden. Dies führt gelegentlich zum Abbruch der Therapie.
Seit kurzer Zeit ist eine neue Formulierung unter dem Namen Niaspan
® («extended release», eine Form mit verzögerter Abgabe in die Zirkulation) erhältlich [
26]. Diese Formulierung zeigt gegenüber der nicht retardierten Form eine gesteigerte Wirksamkeit und Verbesserungen bezüglich der Verträglichkeit mit weniger Flush [
20,
27,
28] (Abb. 3).
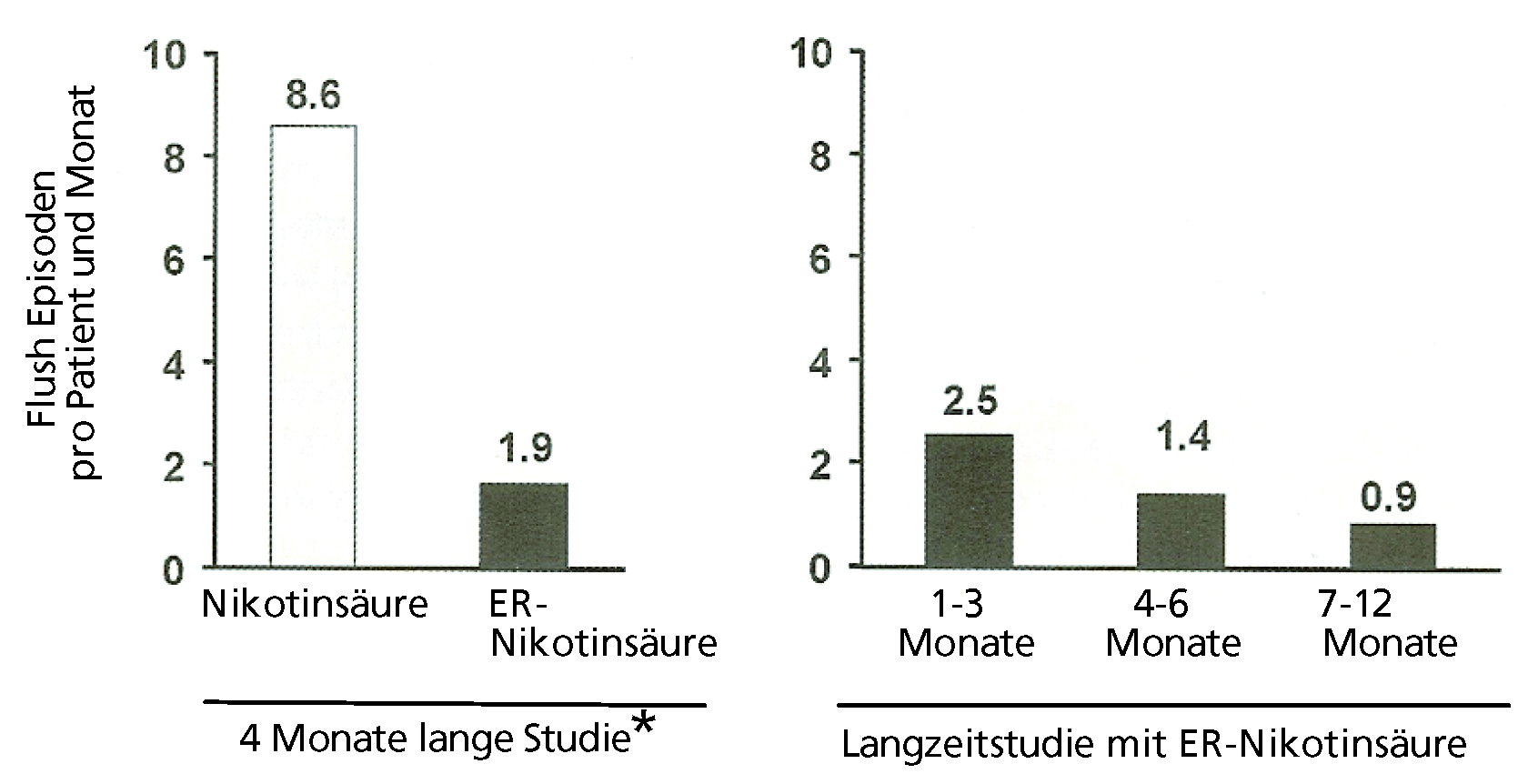
Abbildung 3.
Frequenz der Flush-Episoden mit ER-Nikotinsäure in Studien von kurzer und langer Dauer. Der Asteriskus zeigt die Flush-Episoden in den letzten 4 Wochen, als die Patienten die äquivalente Dosis von Nikotinsäure (1500 mg) und ER-Nikotinsäure (1500 mg) bekamen (aus: McGovern M. Niaspan®: dreating a new concept for raising HDL-cholesterol. European Heart Journal Supplements. 2005;7 (Suppl. F):46. Mit freundlicher Genehmigung, Copyright © 2008, Oxford University Press, Oxford, UK).
Abbildung 3.
Frequenz der Flush-Episoden mit ER-Nikotinsäure in Studien von kurzer und langer Dauer. Der Asteriskus zeigt die Flush-Episoden in den letzten 4 Wochen, als die Patienten die äquivalente Dosis von Nikotinsäure (1500 mg) und ER-Nikotinsäure (1500 mg) bekamen (aus: McGovern M. Niaspan®: dreating a new concept for raising HDL-cholesterol. European Heart Journal Supplements. 2005;7 (Suppl. F):46. Mit freundlicher Genehmigung, Copyright © 2008, Oxford University Press, Oxford, UK).
Bis jetzt wurden keine Studien publiziert, welche klinische «hard endpoints» mit dem Gebrauch von ER-Nikotinsäure allein gezeigt haben.
Neuerdings hat eine Studie belegt, dass die Kombination einer LDL-Cholesterinsenkung mit einem Statin und einer HDL-Erhöhung mittels verzögert freigesetzter Nikotinsäure tatsächlich einen unabhängigen zusätzlichen Effekt auf die Atherosklerose hat. In der ARBITER-2-Studie [
29] hielt die zusätzliche Nikotinsäure-Gabe die Progression der Atherosklerose besser auf im Gegensatz zur alleinigen Statin-Therapie. Obwohl die KHK-Patienten nach derzeit gültigen Richtlinien mit einem Statin allein korrekt behandelt wurden und im Mittel das LDL-Cholesterinziel für diese Patientengruppe von unter 2,6 mmol/l klar erreicht wurde, zeigte sich über das Behandlungsjahr doch eine signifikante Zunahme der IMT («intima media thickness»), also eine deutliche Progression der Atherosklerose. Erhielten die Patienten aber zusätzlich Nikotinsäure, dann blieb diese Progredienz der atherosklerotischen Läsionen aus.
Die Kombination eines Statins mit ER-Nikotinsäure übt einen besseren Einfluss als Statin oder Nikotinsäure allein, auch auf die Zusammensetzung der LDL-Cholesterin-Partikel, aus, indem die sehr atherogenen «small dense» LDL-Cholesterin-Partikel reduziert und die «large» LDL-Cholesterin-Partikel erhöht werden, eine Wirkung welche besonders beim metabolischen Syndrom erwünscht ist. Ebenfalls wird das Lipoprotein Lp(a), welches normalerweise von den Statinen nicht beeinflusst wird, durch Nikotinsäure erniedrigt [
20].
Kombination ER-Nikotinsäure mit Laropiprant
In plazebokontrollierten Studien mit ER-Nikotinsäure war Flush (kurzzeitiges Wärmegefühl, Hautrötung, Pruritus und/oder Kribbeln) die häufigste Nebenwirkung (bei 88% der Patienten), weshalb viele Patienten die Behandlung abbrachen. Es wird empfohlen, das Medikament vor dem Zubettgehen nach einem fettarmen Imbiss (z.B. einem Apfel, einer Scheibe Brot) einzunehmen. Ein während des Schlafes auftretender Flush wird dann häufig nicht wahrgenommen. Die Behandlung mit ER-Nikotinsäure muss in einer niedrigen Dosis gemäss eines Titrationsschemas mit stufenweiser Steigerung der Dosis begonnen werden. Die Intialdosis beträgt 500 mg. Nach 4–5 Wo-chen kann man versuchen, die Dosis auf 1000 mg zu erhöhen. Sofern der Therapieerfolg mit einer Tagesdosis von 1000 mg unzureichend ist, kann in Abständen von 4 Wochen die Dosis bis auf 2000–3000 mg pro Tag erhöht werden. Flush-Reaktionen treten normalerweise zu Behandlungsbeginn und bei Dosissteigerung auf. Nach einigen Wochen kann sich eine Toleranz gegenüber den Flush-Reaktionen entwickeln (Abb. 3).
Tabelle 2.
Wirkung der Kombination ER-Nikotinsäure mit Laropiprant auf einzelne Lipoproteine und Apoproteine bei 800 Patienten (nach [
31]). LS mean (Least squares mean) ist der mittlere Kovarianzwert (ANCOVA). Nach der Titration des Dosis von ERNikotinsäure/Laropiprant auf 2 g wurde bei den Patienten mindestens eine Messung der Lipidparameter in der Periode zwischen Woche 12 und Woche 24 durchgeführt. Die absoluten Basalwerte del Lipide sind im Abstract [
31] nicht angegeben.
Tabelle 2.
Wirkung der Kombination ER-Nikotinsäure mit Laropiprant auf einzelne Lipoproteine und Apoproteine bei 800 Patienten (nach [
31]). LS mean (Least squares mean) ist der mittlere Kovarianzwert (ANCOVA). Nach der Titration des Dosis von ERNikotinsäure/Laropiprant auf 2 g wurde bei den Patienten mindestens eine Messung der Lipidparameter in der Periode zwischen Woche 12 und Woche 24 durchgeführt. Die absoluten Basalwerte del Lipide sind im Abstract [
31] nicht angegeben.
![Cardiovascmed 11 00160 i002 Cardiovascmed 11 00160 i002]() Lipid parameter Lipid parameter |
Trotzdem treten Flush-Episoden auch mit dem «extended release»-Präparat auf. Azetylsalizylsäure und andere anti-inflammatorische Medikamente können den Flush vermindern. Man hat erkannt, dass die Flush-Reaktionen durch die Freisetzung von Prostaglandin-D2 vermittelt sind. Laropiprant ist ein selektiver Antagonist des Prostaglandin-D2-Rezeptor-Subtyps-1 (DP1).
Die gleichzeitige Verabreichung von Laropiprant in einer Dosis von 30, 100 oder 300 mg mit «extended-release»-Nikotinsäure erniedrigte die Flush-Symptome signifikant um mehr als 50% und reduzierte auch die Hautdurchblutung, gemessen mit Laser-Doppler, signifikant [
30].
Inzwischen sind die ersten Resultate der Kombination ER-Nikotinsäure und Laropiprant am letzten Kongress der Europäischen Kardiologie Gesellschaft vorgestellt worden [
31].
In einer doppelblinden Studie, welche 24 Wochen dauerte, wurden dyslipidämische Patienten (von denen 66% in Behandlung mit einem Statin waren) in drei Gruppen randomisiert. 800 Patienten erhielten ER-Nikotinsäure 1 g (nach 4 Wochen 2 g) zusammen mit Laropiprant 20 mg, 543 Patienten ER-Nikotinsäure 1 g (nach 4 Wochen 2 g) allein (Kontrollgruppe für Flush) und 270 Patienten Plazebo (Kontrollgruppe für die Lipidverände-rungen). Die Basalwerte der Lipide sind im Abstract [
31] nicht angegeben. Die Patienten mit der Kombinationstherapie wiesen praktisch keine Flush-Reaktion (0,2 Tage/Woche, statistisch signifikant weniger als in der Gruppe mit ER-Nikotinsäure). Die Lipidparameter wurden in der Gruppe mit der Kombinationstherapie vs Plazebo statistisch signifikant verbessert. Gegenüber Plazebo wurden das HDL-Cholesterin um 20% und das Apo A-1 um rund 7% erhöht (Tab. 2).
Ausblick
Die Kombination von 2 g/Tag ER-Nikotinsäure und Laropiprant wird zur Zeit in zwei grossen Studien mit Messung der IMT (Intima Media Dicke) (ACHIEVE) und von klinischen Endpunkten (HPS2-THRIVE, mit 20 000 Patienten) [
32] untersucht. Es ist zu hoffen, dass diese Studien den Vorteil der Nikotinsäure zeigen und somit ihren Gebrauch in der modernen Prävention und Therapie der Atherosklerose wieder aktualisieren und fördern werden. Kombinationen dieses Medikamentes mit Statinen lassen für die Zukunft weitere Verbesserungen der medikamentösen Primär- und Sekundärprävention bei Patienten mit hohem Risiko für kardiovaskuläre Krankheiten erwarten
 Lipid parameter
Lipid parameter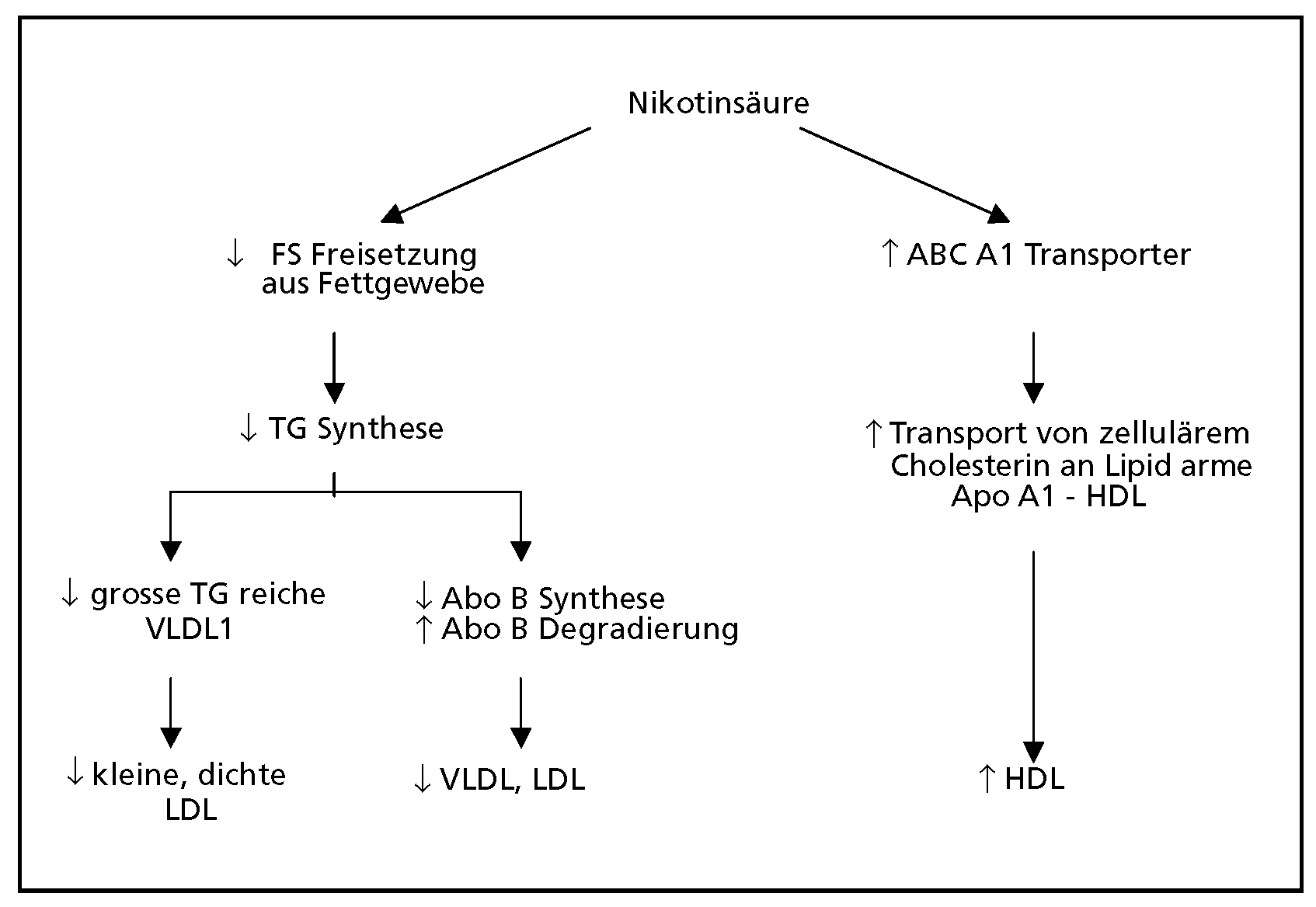
 Lipid parameter
Lipid parameter



