Le Traitement Chirurgical Moderne de la Fibrillation Auriculaire †
Summary
Résumé
Introduction
Définitions et physiopathologie
Historique de l’expérience chirurgicale
- Expériences initiales
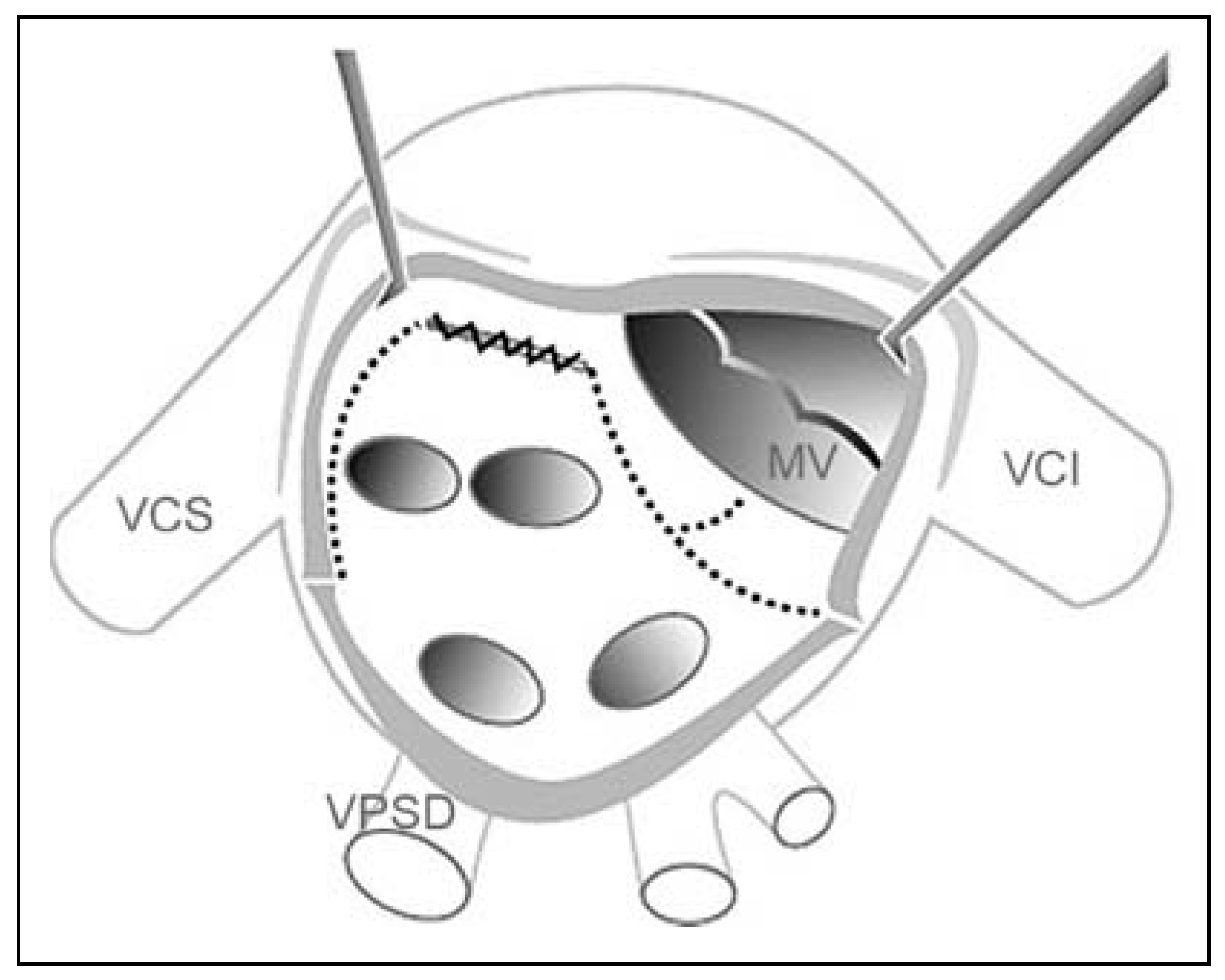
- Opération du «labyrinthe»
Nouveaux concepts pour le traitement chirurgical de la FA
Les indications chirurgicales actuelles
- (1)
- Tout patient devant subir une chirurgie cardiaque et qui présente une anamnèse de FAparoxystique ou une FApermanente est candidat à une ablation de sa FA pour autant que le geste n’apporte pas une morbidité supplémentaire et que l’espérance de vie du patient soit supérieure à 5 ans.
- (2)
- Un patient avec une FAisolée paroxystique est candidat à une ablation endocavitaire, mais dans la FApermanente, l’ablation chirurgicale pourrait être une alternative amenant à un taux de conversion plus élevé. L’évolution des approches chirurgicales minimales invasives par thoracoscopie permettent des ablations épicardiques complètes à cœur battant [24,25].
Casuistique lausannoise
Conclusions
Conflicts of Interest
References
- Fuster, V.; Ryden, L.E.; Asinger, R.W.; Cannom, D.S.; Crijns, H.J.; Frye, R.L.; et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation: executive summary a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to develop guidelines for the management of patients with atrial fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology. Circulation 2001, 104, 2118–2150. [Google Scholar] [PubMed]
- Benjamin, E.J.; Wolf, P.A.; D’Agostino, R.B.; Silbershatz, H.; Kannel, W.B.; Levy, D. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation 1998, 98, 946–952. [Google Scholar] [CrossRef]
- Bando, K.; Kasegawa, H.; Okada, Y.; Kobayashi, J.; Kada, A.; Shimokawa, T.; et al. Impact of preoperative and postoperative atrial fibrillation on outcome after mitral valvuloplasty for nonischemic mitral regurgitation. J. Thorac. Cardiovasc. Surg. 2005, 129, 1032–1040. [Google Scholar] [CrossRef]
- Hohnloser, S.H.; Kuck, K.H.; Lilienthal, J. Rhythm or rate control in atrial fibrillation – Pharmacological Intervention in Atrial Fibrillation (PIAF): a randomised trial. Lancet 2000, 356, 1789–1794. [Google Scholar] [CrossRef] [PubMed]
- Van Gelder, I.C.; Hagens, V.E.; Bosker, H.A.; Kingma, J.H.; Kamp, O.; Kingma, T.; et al. Acomparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N. Engl. J. Med. 2002, 347, 1834–1840. [Google Scholar] [CrossRef]
- Cox, J.L.; Schuessler, R.B.; Lappas, D.G.; Boineau, J.P. An 8 1/2year clinical experience with surgery for atrial fibrillation. Ann. Surg. 1996, 224, 267–273. [Google Scholar] [CrossRef] [PubMed]
- Ruchat, P.; Dang, L.; Virag, N.; Schlaepfer, J.; von Segesser, L.K.; Kappenberger, L. Abiophysical model of atrial fibrillation to define the appropriate ablation pattern in modified maze. Eur. J. Cardiothorac. Surg. 2007, 31, 65–69. [Google Scholar] [CrossRef] [PubMed]
- Haissaguerre, M.; Jais, P.; Shah, D.C.; Takahashi, A.; Hocini, M.; Quiniou, G.; et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. New Engl. J. Med. 1998, 339, 659–666. [Google Scholar] [CrossRef] [PubMed]
- Natale, A.; Pisano, E.; Beheiry, S.; Richey, M.; Leonelli, F.; Fanelli, R.; et al. Ablation of right and left atrial premature beats following cardioversion in patients with chronic atrial fibrillation refractory to antiarrhythmic drugs. Am. J. Cardiol. 2000, 85, 1372–1375. [Google Scholar] [CrossRef]
- Moe, G.; Abildskov, J. Atrial fibrillation as a self-sustaining arrhythmia independent of focal discharge. Am. Heart J. 1959, 58, 59–70. [Google Scholar] [CrossRef]
- Nattel, S. New ideas about atrial fibrillation 50 years on. Nature 2002, 415, 219–226. [Google Scholar] [CrossRef]
- Allessie, M.A.; Konings, K.; Kirchhof, C.J.; Wijffels, M. Electrophysiologic mechanisms of perpetuation of atrial fibrillation. Am. J. Cardiol. 1996, 77, A10–A23. [Google Scholar] [CrossRef]
- Boldt, A.; Wetzel, U.; Lauschke, J.; Weigl, J.; Gummert, J.; Hindricks, G.; et al. Fibrosis in left atrial tissue of patients with atrial fibrillation with and without underlying mitral valve disease. Heart 2004, 90, 400–405. [Google Scholar] [CrossRef] [PubMed]
- Sealy, W.C.; Gallagher, J.J.; Kasell, J. His bundle interruption for control of inappropriate ventricular responses to atrial arrhythmias. Ann. Thorac. Surg. 1981, 32, 429–438. [Google Scholar] [CrossRef] [PubMed]
- Williams, J.M.; Ungerleider, R.M.; Lofland, G.K.; Cox, J.L. Left atrial isolation: new technique for the treatment of supraventricular arrhythmias. J. Thorac. Cardiovasc. Surg. 1980, 80, 373–380. [Google Scholar] [CrossRef] [PubMed]
- Graffigna, A.; Pagani, F.; Minzioni, G.; Salerno, J.; Vigano, M. Left atrial isolation associated with mitral valve operations. Ann. Thorac. Surg. 1992, 54, 1093–1097. [Google Scholar] [CrossRef]
- Leitch, J.W.; Klein, G.; Yee, R.; Guiraudon, G. Sinus node-atrioventricular isolation: long term results with the corridor operation for atrial fibrillation. J. Am. Coll. Cardiol. 1991, 17, 970–975. [Google Scholar] [CrossRef]
- Cox, J.L.; Boineau, J.P.; Schuessler, R.B.; Jaquiss, R.D.; Lappas, D.G. Modification of the maze procedure for atrial flutter and atrial fibrillation. I. Rationale and surgical results. J. Thorac. Cardiovasc. Surg. 1995, 110, 473–484. [Google Scholar] [CrossRef]
- Ferguson, T.; Cox, J. Surgery for Atrial Fibrillation. In Cardiac Electrophysiology: From Cell To Bedside, 2nd ed.; Zipes, D.P., Jalife, J., Eds.; W.B. Saunders Company: Philadelphia, 1995; pp. 1563–1576. [Google Scholar]
- Ishii, Y.; Nitta, T.; Fujii, M.; Ogasawara, H.; Iwaki, H.; Ohkubo, N.; et al. Serial change in the atrial transport function after the radial incision approach. Ann. Thorac. Surg. 2001, 71, 572–576. [Google Scholar] [CrossRef]
- Melo, J.; Adragao, P.; Neves, J.; Ferreira, M.M.; Pinto, M.M.; Rebocho, M.J.; et al. Surgery for atrial fibrillation using radiofrequency catheter ablation: assessment of results at one year. Eur. J. Cardio. Thorac. Surg. 1999, 15, 851–854. [Google Scholar] [CrossRef]
- Kottkamp, H.; Hindricks, G.; Autschbach, R.; Krauss, B.; Strasser, B.; Schirdewahn, P.; et al. Specific linear left atrial lesions in atrial fibrillation: intraoperative radiofrequency ablation using minimally invasive surgical techniques. J. Am. Coll. Cardiol. 2002, 40, 475–480. [Google Scholar] [CrossRef] [PubMed]
- Khargi, K.; Hutten, B.A.; Lemke, B.; Deneke, T. Surgical treatment of atrial fibrillation; a systematic review. Eur. J. Cardiothorac. Surg. 2005, 27, 258–265. [Google Scholar] [CrossRef] [PubMed]
- Ruchat, P.; Schlaepfer, J.; Von Segesser, L.K. Off-pump epicardial compartmentalization for ablation of atrial fibrillation. Interact. Cardiovasc. Thorac. Surg. 2002, 1, 55–57. [Google Scholar] [CrossRef] [PubMed]
- Maessen, J.G.; Nijs, J.F.; Smeets, J.L.; Vainer, J.; Mochtar, B. Beating-heart surgical treatment of atrial fibrillation with microwave ablation. Ann. Thorac. Surg. 2002, 74, S1307–S1311. [Google Scholar] [CrossRef]
- Ruchat, P.; Schlaepfer, J.; Delabays, A.; Hurni, M.; Milne, J.; Von Segesser, L.K. Left atrial radiofrequency compartmentalization for chronic atrial fibrillation during heart surgery. Thorac. Cardiovasc. Surg. 2002, 50, 155–159. [Google Scholar] [CrossRef]

© 2008 by the authors. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Ruchat, P.; Eisa, K.; von Segesser, L.K.; Schläpfer, J. Le Traitement Chirurgical Moderne de la Fibrillation Auriculaire. Cardiovasc. Med. 2008, 11, 90. https://doi.org/10.4414/cvm.2008.01316
Ruchat P, Eisa K, von Segesser LK, Schläpfer J. Le Traitement Chirurgical Moderne de la Fibrillation Auriculaire. Cardiovascular Medicine. 2008; 11(3):90. https://doi.org/10.4414/cvm.2008.01316
Chicago/Turabian StyleRuchat, Patrick, Karam Eisa, Ludwig K. von Segesser, and Jürg Schläpfer. 2008. "Le Traitement Chirurgical Moderne de la Fibrillation Auriculaire" Cardiovascular Medicine 11, no. 3: 90. https://doi.org/10.4414/cvm.2008.01316
APA StyleRuchat, P., Eisa, K., von Segesser, L. K., & Schläpfer, J. (2008). Le Traitement Chirurgical Moderne de la Fibrillation Auriculaire. Cardiovascular Medicine, 11(3), 90. https://doi.org/10.4414/cvm.2008.01316



