Zusammenfassung
Die Fallot-Tetralogie ist der häufigste angeborene zyanotische Herzfehler. Wie kaum ein anderer angeborener Herzfehler illustriert seine Behandlungsgeschichte medizinische Fortschritte der vergangenen fünf Jahrzehnte. Ohne Eingriff stirbt ein Drittel der Fallot-Patienten im ersten Lebensjahr, nur die Hälfte erreicht das dritte und deutlich weniger als 10% das 30. Lebensjahr. Palliative Eingriffe insbesondere der Blalock-Taussig-Shunt, anschliessend eine Ära der «staged corrective surgery», die dann vom Konzept der «primären Korrektur» ungeachtet des Alters abgelöst wurde, haben die Aussichten für die Betroffenen deutlich gebessert. Man vermutet, dass aktuell >90% der Neugeborenen mit Fallot-Tetralogie dank der Chirurgie das 30. Lebensjahr erreichen werden. Trotz dieser Fortschritte gibt es auch heute noch keine «Totalkorrektur». Eine residuelle Pulmonalinsuffizienz mit progressiver Rechtsherzdilatation und -dysfunktion, Rhythmusstörungen und plötzlicher Herztod sind die häufigsten Langzeitfolgen trotz «Korrektur» im Kindesalter. Der nachbehandelnde Kardiologe sollte sich bewusst sein, was bereits 1993 prägnant in einem NEJM Editorial zusammengefasst wurde: «Adults with tetralogy of Fallot – repaired yes, cured no».
Schlüsselwörter: Fallot-Tetralogie; Überleben; Chirurgie
Einleitung
Das Buch «King of hearts» beschreibt den chirurgischen Werdegang Walton Lillehei’s, der am 31. August 1954 einem zehnjährigen Knaben aus Minnesota mit Fallot-Tetralogie den Ventrikelseptum-Defekt (VSD) verschloss und die Stenose im rechtsventrikulären Ausflusstrakt (RVOT) behob [
1,
2]. Die Operation gelang dank der Hilfe eines Fremden. Da dazumal die Herz-Lungen-Maschine noch nicht klinisch einsetzbar war, diente dem Knaben mit der seltenen Blutgruppe AB-negativ ein 29-jähriger Strassenarbeiter als «menschliche» Herz-Lungen-Maschine. Der 29-jährige «ECC-Ersatz» wurde durch die Blutspende-Kartei des roten Kreuzes identifiziert und angefragt, ob er bereit wäre, im Rahmen einer «Controlled Cross Circulation»-Operation sich die Femoralarterie und -vene kanülieren zu lassen und auf diese Weise den Körper des Knaben während des zwingend nötigen Herzstillstandes zu perfundieren und oxygenieren. Beide überlebten den Eingriff komplikationslos. Die Mortalität bei vorausgegangenen Eingriffen unter «Controlled Cross Circulation» war so hoch, dass die Kinderkardiologin Helen Taussig die gelungene Operation von Lillehei mit den Worten kommentiert haben soll: «Too bad, now he will continue». Von den nachfolgenden neun Fallot-Patienten, die von Lillehei in gleicher Weise operiert wurden, überlebten fünf den Eingriff nicht [
3]. Der im Anschluss an Lillehei‘s Operationen aufkommende Begriff «Fallot-Totalkorrektur» orientierte sich an der spektakulären Abnahme der Zyanose überlebender «Blue babies» in den ersten Wochen und Monaten nach dem Eingriff, die in der Tat eine «totale» Korrektur des Herzfehlers nahe legte.
Die folgenden Abschnitte fassen das heutige anatomische Verständnis dieses komplexen zyanotischen Herzfehlers zusammen, geben einen groben Überblick über chirurgische Fortschritte und zeigen auf, wie sich die Therapiemöglichkeiten von einer initialen Palliation zu einer möglichst langfristigen Reparatur bei immer jüngeren Patienten mit immer tieferer Mortalität wandelten. Ebenso eindrücklich zeigt die Geschichte der Fallot-Korrektur aber auch, dass weiterhin keine «Totalkorrektur» möglich ist und dieser Begriff lediglich Hoffnungen weckt, die in der Vergangenheit nie und auch heute oft nicht erfüllt werden können.
Definition und Anatomie
Das Eponym Fallot-Tetralogie ist auf eine 1888 veröffentlichte Fallbeschreibung von Etienne-Louis Arthur Fallot zurückzuführen, in der das anatomisch-pathologische Substrat der «Maladie bleu» als Kombination einer (1.) Pulmonalstenose, (2.) interventrikulären Kommunikation, (3.) Rechts-Verlagerung der Aorta sowie (4.) rechtsventrikulären (RV-)Hypertrophie beschrieben wird [
4]. Nach heutigem Wissensstand ist diese klinische Viererkombination Ausdruck zweier morphogenetischer Fehlentwicklungen: Das muskuläre Outlet-Septum des RVOT verlagert sich und rotiert während der Herzentwicklung nach anterior und superior und lässt eine subaortale Lücke zwischen rechtem und linkem Ventrikel entstehen. Diese Lücke wird als «Malalignement»VSD bezeichnet, der typischerweise gross und nicht-restriktiv ist, und es auch bleibt. Zum Zweiten wird eine Hypertrophie der muskulären Trabekel im RVOT beobachtet, die in Kombination mit der Septumverlagerung die subpulmonale Obstruktion akzentuiert [
5,
6].
RV-Hypertrophie und biventrikulärer Ursprung der Aorta sind Konsequenzen dieser Entwicklungsanomalien. Oft liegt nicht nur eine subpulmonale Obstruktion vor, sondern die Pulmonalklappe selbst ist verengt, zeitweise unikuspid oder bikuspid, und weist einen kleinen Anulus auf. Der Truncus pulmonalis ist oft hypoplastisch und periphere Pulmonalstenosen können zusätzlich vorkommen. Wie stark die Aorta über dem VSD reitet, hängt vom Ausmass der Septumverlagerung ab: bis 90% der Aorta können rechtsventrikulären Ursprungs sein [
7], so dass in bestimmten Fällen (>50% Überreiten) auch von einem «double outlet right ventricle» gesprochen wird. Typischerweise reitet die Aortenwurzel nicht nur, sondern hat sich im Uhrzeigersinn (vom Apex aus betrachtet) gedreht, so dass die rechtskoronare Cusp mehr anterior orientiert ist [
8].
Assoziierte Anomalien
In 10–20% der Fallot-Patienten ist die Aorta ascendens dilatiert, unabhängig von vorgängigen Eingriffen [
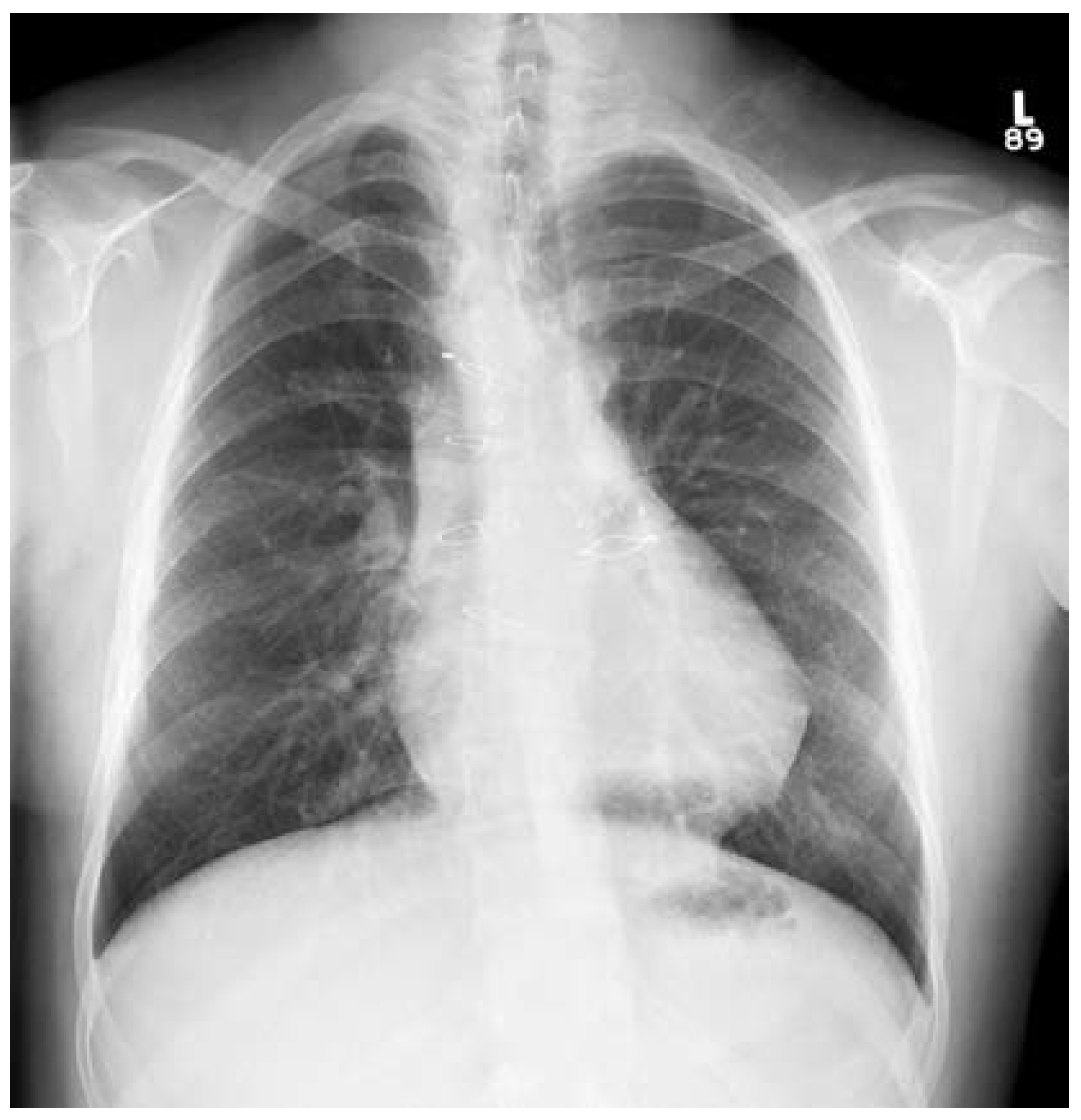
9]. Einerseits lässt sich histologisch in solchen Fällen eine intrinsische Aortopathie (ähnlich wie bei der bikuspiden Aortenklappe) nachweisen, andererseits dürfte die Volumenüberladung der Aorta vor VSDVerschluss ein Trigger der Dilatation sein. Je höhergradig die RVOT-Stenose vor der Korrektur ist, je mehr Volumen somit die Aortenklappe passieren musste, desto öfter dilatiert die Aorta im späteren Verlauf. Bei rund einem Viertel der Patienten liegt ein Arcus aortae dexter vor (
Abb. 1), d.h. die deszendierende Aorta kreuzt den rechten Hauptbronchus, ab und zu zusätzlich kombiniert mit einer Arteria lusoria.
Bei rund 5% der Fallot-Patienten finden sich für den Chirurgen wichtige Koronaranomalien, insbesondere der Abgang des Ramus interventrikularis anterior (RIVA) aus der rechten Kranzarterie. In diesem Falle kreuzt der RIVA den RVOT in variabler Distanz zur Pulmonalklappe und limitiert die infundibulären Inzisionsmöglichkeiten. Weitere 5% der Fallot-Patienten weisen zusätzlich einen Vorhofseptum-Defekt auf (Fallot-Pentalogie). Selten liegt eine persistierende linke obere Hohlvene vor, noch seltener zusätzliche interventrikuläre Defekte (muskulärer VSD oder ein Endokardkissen-Defekt)
Fallot-Varianten
Findet sich bei Fallot-typischer Septumdeviation eine Atresie der Pulmonalklappe, wird von einer «extremen» Fallot-Tetralogie gesprochen bzw. von einer Pulmonalatresie mit VSD. In dieser Situation ist der Pulmonalis-Hauptstamm kaum ausgebildet, nicht selten liegt lediglich ein fibröses Band ohne Lumen vor (
Abb. 2A). Die Lungenperfusion wird in dieser Situation primär durch den Ductus Botalli und aorto-pulmonale Kollateralen (sogenannte MAPCA major aortopulmonary collateral arteries) oft ausgehend von der Aorta thoracica gewährleistet. Die linke und rechte Lungenarterie konfluieren oder auch nicht. Entscheidend für das chirurgische Vorgehen bei diesen Patienten ist zu wissen, wie viel Lunge durch Kollateralgefässe versorgt wird und ob sich eine Kontinuität mit intraperikardialen Lungengefässen herstellen lässt («Unifokalisation der Lungengefässe»). Eine Pulmonalatresie findet sich bei 20–30% aller Fallot-Patienten, und insbesondere falls eine Mikrodeletion auf Chromosom 22 vorhanden ist [
10].
Eine andere Klinik herrscht bei der «atypischen Fallot-Tetralogie» vor. Hier ist die Pulmonalklappe nicht atretisch, sondern sie fehlt (oder die Taschen sind nur rudimentär ausgebildet), womit der rechte Ventrikel in offener Kommunikation mit dem Pulmonalis-Hauptstamm steht. Nicht desto trotz liegt ebenfalls ein nicht restriktiver Malalignement-VSD und eine gewisse subpulmonale Obstruktion vor. Kennzeichnend für diese Fallot-Variante sind massiv dilatierte zentrale Pulmonal arterien, die den anliegenden Bronchus komprimieren können (
Abb. 2B). Diese anatomische Variante liegt bei 2–5% aller Fallot-Patienten vor.
Fallot-Physiologie
Im Jahre 1929 wurde im JAMA das Leben von Henry Gilbert, einem 1868 geborenen Komponisten, Musiker, Autor und Editor aus Somerville, Massachusetts, beschrieben [
11]. Das aus medizinischer Sicht faszinierende an seinem Leben war, dass er trotz Fallot-Tetralogie erst kurz nach seinem 60. Geburtstag an den Folgen eines zerebrovaskulären Insults verstarb. Es wurde im Artikel diskutiert, wie ein solch günstiger natürlicher Verlauf einer Fallot-Tetralogie möglich sein kann.
Prognostisch im Vordergrund steht bei Fallot-Patienten das Ausmass der antegraden pulmonalen Perfusion. Die Lungendurchblutung ist primär entscheidend für das Ausmass der möglichen Sauerstoffaufnahme. Die Lungenperfusion hängt, lässt man die Pulmonalatresie mit MAPCA ausser Betracht, im Wesentlichen von zwei Faktoren ab: dem Ausmass der RVOT-Obstruktion sowie der systemischen Nachlast. Da der Malalignement-VSD nicht drucktrennend ist, ergeben sich die Grösse und Richtung des interventrikulären Shunts aus der Differenz der Widerstände die intrakardial dem pulmonalen und systemischen Ausstrom entgegen wirken. Übersteigt der Widerstand der RV-Ausflussbehinderung den Systemwiderstand, liegt ein Netto «Rechts-Links-Shunt» vor. Entscheidend für die Grösse des Rechts-Links-Shunts ist nicht das Ausmass der Aortenverlagerung in den RV, sondern das Ausmass der RVOT-Obstruktion. Je kleiner die Lungenperfusion desto geringer ist die längerfristige Überlebenswahrscheinlichkeit. Liegt der durch die RVOTObstruktion bewirkte Widerstand unter dem Systemwiderstand, liegt ein Netto «Links-Rechts-Shunt» mit pulmonaler Hyperzirkulation vor. Bei einem grossem Links-Rechts-Shunt droht initial das Lungenödem und längerfristig die Ausbildung einer irreversiblen pulmonalen Vaskulopathie. Bei Vorliegen einer «balancierten» Physiologie, d.h. einer mässigen RVOT-Obstruktion, ist die Lungenstrombahn vor einer übermässigen Hyperzirkulation geschützt, gleichzeitig aber eine ausreichende Oxygenierung, also ein längerfristiges Überleben als «pink»-Fallot möglich. Diese «balancierte» Physiologie ist verständlicherweise die Ausnahme und somit sind die Aussichten für die Mehrheit der Fallot-Patienten wenig «rosig». Gemäss historischen Daten aus der dänischen Bevölkerung überlebten 66% aller Fallot-Patienten ohne medizinische Intervention das erste Lebensjahr, 48% das dritte Lebensjahr und 24% das zehnte Lebensjahr. Das 30. Lebensjahr erreichten weniger als 10% [
12].
Fallot-Chirurgie im Wandel der Zeit
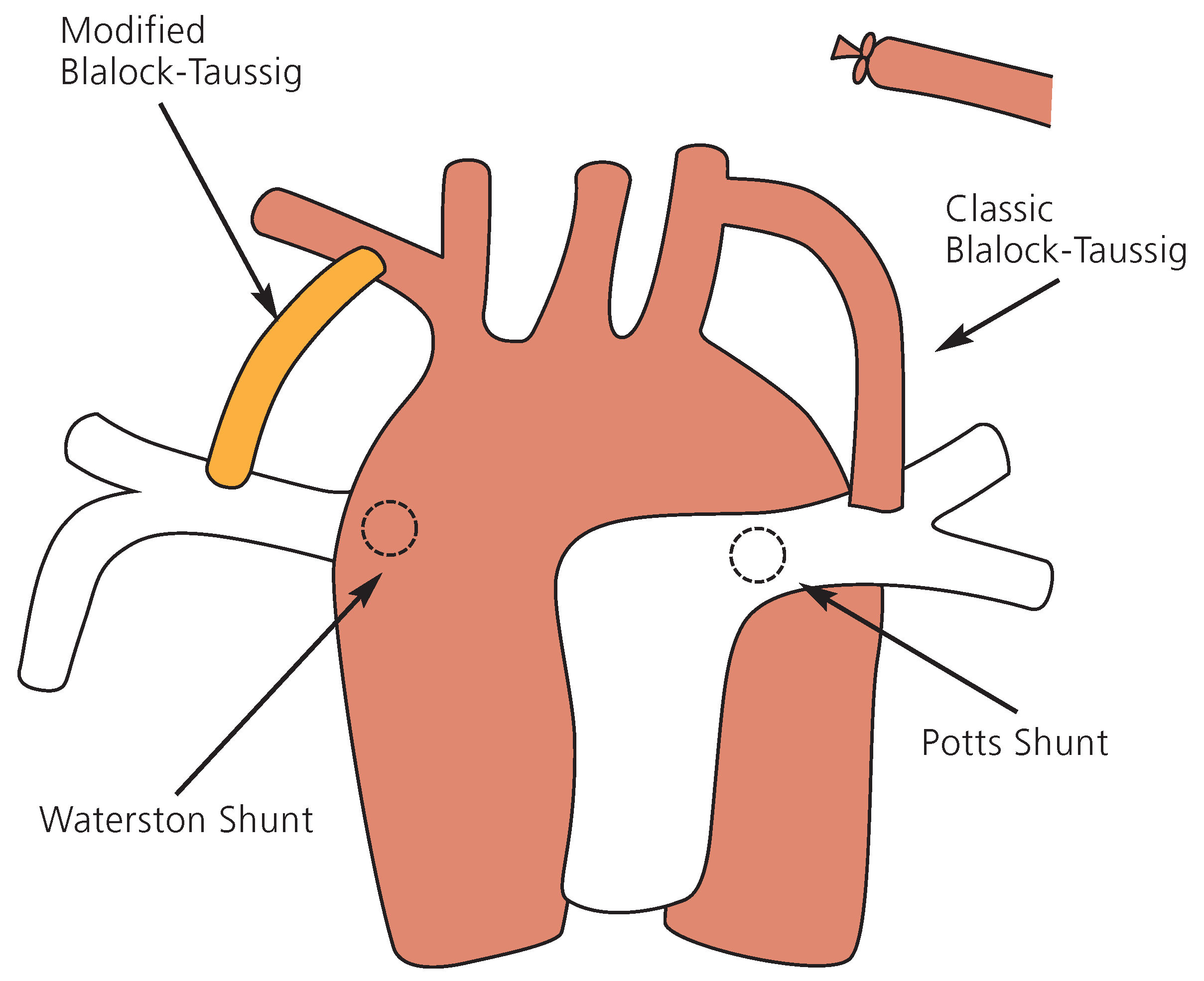
Die erwähnte Ablehnung von Helen Taussig gegenüber Lillehei’s Eingriffen mit «Controlled Cross Circulation» und ihrer potentiell 200%-Mortalität beruht auf der Tatsache, dass bereits zum damaligen Zeitpunkt mittels palliativ angelegtem aorto-pulmonalem Shunt das Überleben der «blue babies» deutlich verbessert werden konnte. Helen Taussig hatte in den 1930er Jahren beobachtet, dass sich der Zustand von zyanotischen Neugeborenen zum Zeitpunkt des spontanen Ductus-Botalli-Verschlusses oft verschlechterte. Sie war überzeugt, dass das Anlegen eines «künstlichen» Ductus Botalli die Klinik gewisser zyanotischer Patienten verbessern könnte. Diese Idee diskutierte sie mit Alfred Blalock, einem Chirurgen aus Baltimore. Alfred Blalock hatte zuvor vergeblich versucht, durch die Anastomose der Arteria subclavia auf die Lungenarterie beim Hund ein Modell einer Shunt-induzierten pulmonalen Hypertonie zu entwickeln. Diese glückliche Fügung führte am 29. November 1944 zum Anlegen der ersten chirurgisch kreierten aorto-pulmonalen Verbindung bei Fallot-Patienten, dem klassischen Blalock-Taussig-Shunt (
Abb. 3). Die Lungendurchblutung wurde durch eine End-zu-Seit Anastomose der A. subclavia auf die entsprechende linke (beim Arcus aortae sinister) oder rechte (beim Arcus aortae dexter) Lungenarterie verbessert [
13].
Die Nachteile dieser Anastomose waren die Volumenbelastung des linken Ventrikels sowie eine nun von Kollateralen abhängige Perfusion des entsprechenden Armes. Letzteres konnte ab den 1970er Jahren durch die Interposition eines Gore-Tex-Shunts zwischen A. subclavia und A. pulmonalis (modifizierter Blalock-Taussig-Shunt) anstelle der direkten End-zu-Seit-Anastomose vermieden werden.
Die Potts- und Waterston-Anastomose wurden 1946 bzw. 1962 eingeführt, und beinhalteten eine direkte Anastomose der linken oder rechten Lungenarterie mit der benachbarten Aorta descendens (Potts-Anastomose,
Abb. 3) oder Aorta ascendens (Waterston-Anastomose,
Abb. 3). Diese Anastomosen wurden im späteren Verlauf vermieden, da sie einerseits im Rahmen des Körper-Wachstums oft zu einer Distorsion der mit der Aorta verbundene Lungenarterie und dadurch zu Stenosen führten und andererseits der letztendlich geschaffene Anastomosen-Diameter für den Chirurgen nur beschränkt voraussehbar war. Vernarbung konnte die Anastomose sowohl vergrössern als auch verkleinern mit dem Risiko einer pulmonalen Hyperzirkulation und irreversiblen pulmonalen Hypertonie bzw. einer anhaltenden pulmonalen Hypoperfusion.
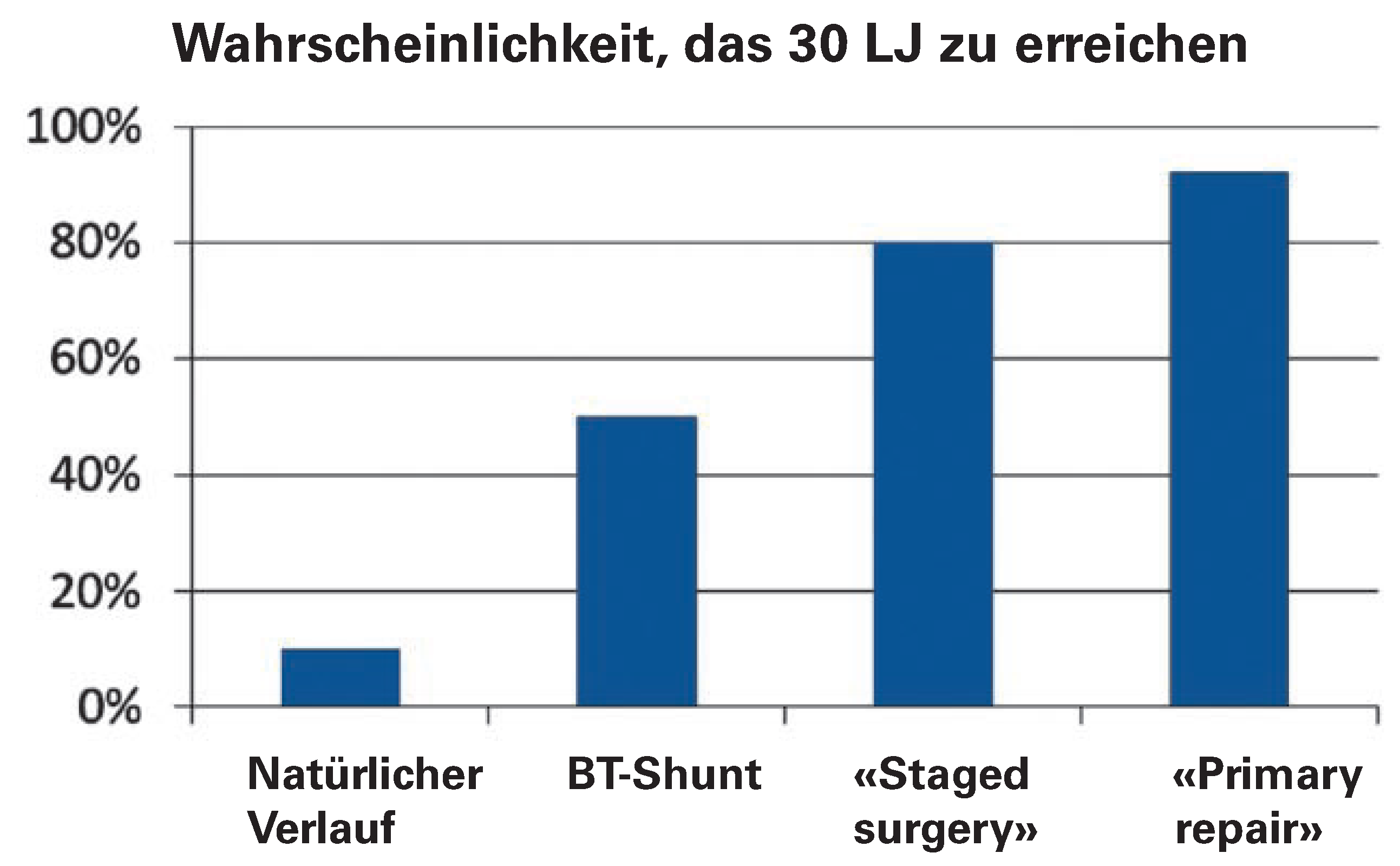
Insgesamt verbesserte die Einführung chirurgisch angelegter aorto-pulmonaler Verbindungen, insbesondere der Blalock-Taussig-Shunt, die Prognose der Fallot-Tetralogie deutlich. Die Wahrscheinlichkeit, das 30. Lebensjahr zu erreichen, stieg von 10% auf 50% [
14]. Weitere chirurgische Versuche, die Lungenperfusion bei Fallot-Tetralogie zu verbessern waren die geschlossene Infundibulektomie nach Brock, bei der die RVOT-Obstruktion partiell behoben und der VSD offen gelassen wurde, die Pleurektomie und Pleurodese (mit der Absicht das Wachstum von Kollateralgefässen zur Lunge zu fördern), die chirurgische Verlagerung des Omentum majus in den Thorax-Raum mit Kontakt zur Lunge (mit dem gleichen Ziel wie die Pleurodese), oder die Formalin-Injektion in den noch offenen Ductus Botalli (mit dem Ziel ihn längerfristig offen belassen zu können). Der Erfolg dieser Massnahmen, mit Ausnahme der Infundibulektomie nach Brock, war bescheiden.
Nach Einführung der Herz-Lungen-Maschine etablierte sich bis in die 1980er Jahre die Ära der «staged corrective surgery». Symptomatische Neugeborene und Kleinkinder mit Fallot-Tetralogie wurden initial mit einer aorto-pulmonalen Verbindung palliativ versorgt, und erst beim älteren Kind wurde der VSD verschlossen und die RVOT-Obstruktion behoben. Lillehei et al. publizierten 1986 die Ergebnisse der ersten 106 an der University of Minnesota operierten Fallot-Patienten [
15]. Die Überlebensraten nach erfolgreicher Korrektur betrugen 93%, 80% und 77% nach 10, 20 und 30 Jahren. Mitte der 1990er Jahre lag die 30-Jahre-Überlebensrate nach Fallot «Totalkorrektur» weiterhin unter der normalen Lebenserwartung (86% vs. 96%, p <0,01 in einer Arbeit aus der Mayo Klinik [
16]), konnte aber im Vergleich zur Überlebensrate mit lediglich aorto-pulmonale Anastomosen erneut um 25–30% verbessert werden.
In den 1970er Jahren begann Castaneda in Boston für eine «primäre» Fallot-Korrektur, d.h. ohne vorgängigen Shunt-Eingriff und unabhängig vom Alter des Fallot-Kindes zu plädieren. Dieser Ansatz wurde 1976 durch die Einführung von Prostaglandin E zusätzlich gefördert. Prostaglandin E verzögert den Verschluss des Ductus Botalli in den ersten Lebenstagen. Auf diese Weise kann das zynanotische Neugeborene mit Fallot-Tetralogie medikamentös stabilisiert werden und ist für die primäre Korrektur in einer besseren Ausgangslage. Die nun aufkommende Tendenz zur immer früheren Primär-Korrektur der Fallot-Tetralogie hatte zur Folge, dass vermehrt ein transanulärer Patch verwendet werden musste [
17]. Der Pulmonal-Anulus war zum Korrekturzeitpunkt oft zu klein um das pulmonale Schlagvolumen ohne grösseren Gradienten passieren zu lassen. In der Annahme, dass eine radikale Korrektur mit tiefem Gradienten die beste Lösung sei, wurde der RV-Ausflussbahn durch ein Aufschneiden des Anulus und eine Erweiterung mittels Patch vergrössert. Dieser transanuläre Patch führt in aller Regel längerfristig zu einer schweren Pulmonalinsuffizienz. Abschliessende Zahlen bezüglich des 30-Jahres-Outcome nach Primärkorrektur fehlen noch, die Überlebenswahrscheinlichkeit dürfte mittlerweile >90% liegen [
18].
Auch heute noch ist die Primärkorrektur der angestrebte Eingriff. Diskussionen drehen sich mittlerweile nebst der Frage, in welchen Lebensmonaten der Eingriff durchgeführt werden sollte, um Aspekte des chirurgischen Zugangs (transventrikulär vs transatrial und transpulmonal), sowie der Radikalität der Aufhebung der RVOT-Obstruktion [
19]. In diesem Zusammenhang wird nunmehr wenn immer möglich eine postoperative Pulmonalinsuffizienz vermieden. Die Überlebenschancen mit Fallot-Tetralogie im Wandel der Zeit sind in
Abbildung 4 zusammengefasst.
Der adulte Fallot-Patient von heute
Die Verbesserung der Überlebensrate von Kindern mit Fallot-Tetralogie hat zur Folge, dass die Anzahl Erwachsener mit Fallot-Tetralogie die Anzahl pädiatrischer Patienten bald übertreffen wird [
20]. Wichtig ist sich zu vergegenwärtigen, dass Erwachsene mit «Fallot-Totalkorrektur» nicht «total korrigiert» sind, sondern mit verschiedenen residuellen anatomischen, hämodynamischen oder rhythmogenen Problemen konfrontiert werden.
Tabelle 1 macht deutlich, inwieweit der Begriff «Fallot-Totalkorrektur» irreführend ist.
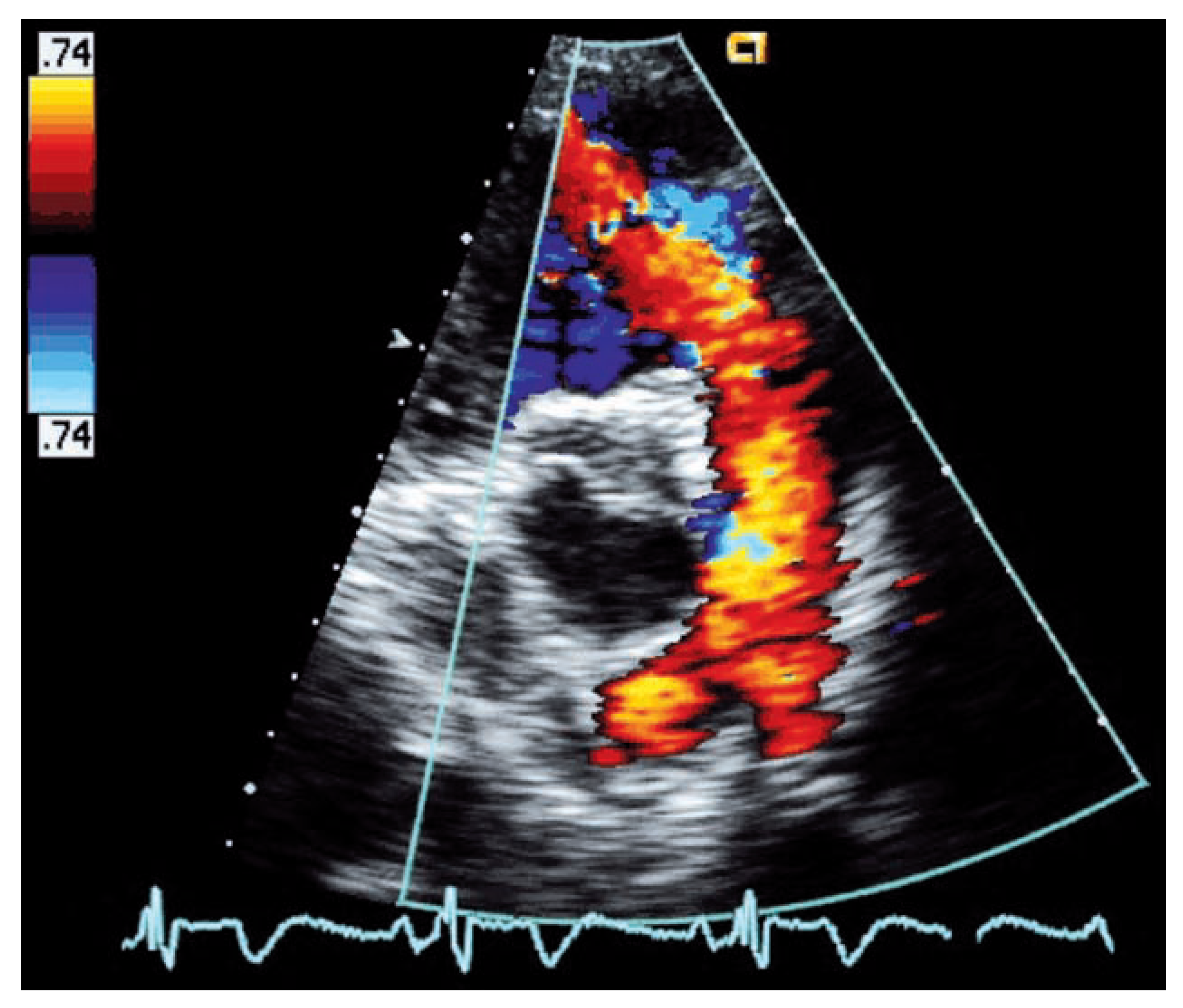
Am häufigsten führt beim adulten Fallot-Patienten eine schwere Pulmonalinsuffizienz bei transanulärem Patch oder ausgiebiger Valvulotomie zu Problemen. Der Schweregrad der Pulmonal-insuffizienz wird aufgrund des tiefen diastolischen Druckgradienten zwischen Pulmonalis-Hauptstamm und rechtem Ventrikel echo-kardiographisch oft unterschätzt, da je nach Grösse der Regurgitationsöffnung ein beinahe laminares Regurgitations-Flussprofil auftreten kann (
Abb. 5). Hinweise für eine schwere Pulmonalinsuffizienz sind, nebst dem laminaren retrograden Flussprofil, eine kurze Pressure-Halftime (<100 ms) [
21] im Doppler-Si-gnal und damit verbunden eine kurze Dauer des diastolischen Rückfluss-Signales bezogen auf die diastolische Füllungszeit (Pulmonary Regurgitant Index <0,77) [
22]. Ein Regurgitationssignal im CW-Doppler, das eine vergleichbare Signalintensität wie der systolische Vorwärtsfluss aufweist, ist ein weiterer Hinweis für ein beträchtliches Regurgitationsvolumen. Die kurze Dauer des diastolischen Rückflusses einer schweren Pulmonalinsuffizienz führt in der Auskultation zu einem kurzen Decrescendo-Diastolikum, das ab und zu den Kliniker fälschlicherweise zur Annahme verleiten lässt, das Regurgitationsvolumen sei unbedeutend. Zur Quantifizierung des Regurgitationsvolumens sowie der zuverlässigen Bestimmung der RV-Volumina wird je länger je mehr das kardiale MRI eingesetzt.
Die negativen Folgen der Pulmonalinsuffizienz sind wiederholt beschrieben worden: Eine progressive Abnahme der RV-Funktion und Zunahme der RV-Volumina, Häufung von atrialen und ventrikulären Arrhythmien und damit verbunden ein erhöhtes Risiko des plötzlichen Herztodes [
23]. Herzinsuffizienz und plötzlicher Herztod sind die häufigsten Todesursachen des adulten «korrigierten» Fallot-Patienten. In einer vielzitierten retrospektiven Studie wurde beobachtet, wie 25 Jahre nach Fallot-Korrektur die postoperative Mortalität von 0,24%/Jahr auf 0,94%/Jahr anstieg [
24]. Insbesondere die Häufigkeit des plötzlichen Herztodes, wahrscheinlich aufgrund von Arrhythmien, nimmt 20 Jahre nach der Korrektur-Operation deutlich zu und dürfte unter anderem auf die negativen Langzeitfolgen einer schweren Pulmonalinsuffizienz zurückzuführen sein. Ein transanulärer Patch mit der Prädisposition zur schweren Pulmonalinsuffizienz sowie eine progressive Verlängerung der QRS-Dauer sind mittlerweile etablierte Prädiktoren des plötzlichen Herztodes beim adulten «korrigierten» Fallot-Patienten [
25].
Auch wenn die Langzeitfolgen der schweren Pulmonalinsuffizienz mittlerweile bekannt sind, ist weiterhin unklar, zu welchem Zeitpunkt eine schwere Pulmonalinsuffizienz beim adulten Fallot-Patienten behoben werden sollte. Wird der Pulmonalklappenersatz anhand klinischer Kriterien (Abnahme der Leistungsfähigkeit, Rechtsherzinsuffizienz, Arrhythmien) geplant, besteht die Gefahr dass zum Interventionszeitpunkt bereits eine irreversible RV-Kardiopathie besteht und keine Regression der RV-Volumina oder Verbesserung der RV-Funktion erreicht werden kann [
26]. Verschiedene Studien versuchten in den vergangenen Jahren mittels kardialem MRI RV-Cut-offs zu definieren, ab denen eine vollständige Erholung der Ventrikeldimension und -funktion trotz Klappenersatz unwahrscheinlich wird [
27].
Tabelle 2 listet nicht abschliessend eine Reihe publizierter Parameter zur Indikationsstellung auf. Zusammengefasst besteht keine allgemein akzeptierte Klarheit über den optimalen Zeitpunkt des Klappenersatzes beim «korrigierten» Fallot-Patienten mit schwerer Pulmonalinsuffizienz, weswegen die Entscheidung individuell unter Berücksichtigung der Klinik und verschiedener Untersuchungsbefunde gefällt wird. Die seit kurzem bestehenden Möglichkeiten des perkutanen Klappenersatzes dürften in Zukunft einen weiteren Faktor darstellen, der den Entscheidungsprozess zur Intervention mit beeinflussen dürfte [
28,
29].
Unvermeidlich ist, dass jeder Klappenersatz beim adulten Fallot-Patienten mit hoher Wahrscheinlichkeit nicht der letzte gewesen sein wird.