CETP-Inhibitoren (Torcetrapib und JTT-705)
Summary
Zusammenfassung
Einleitung
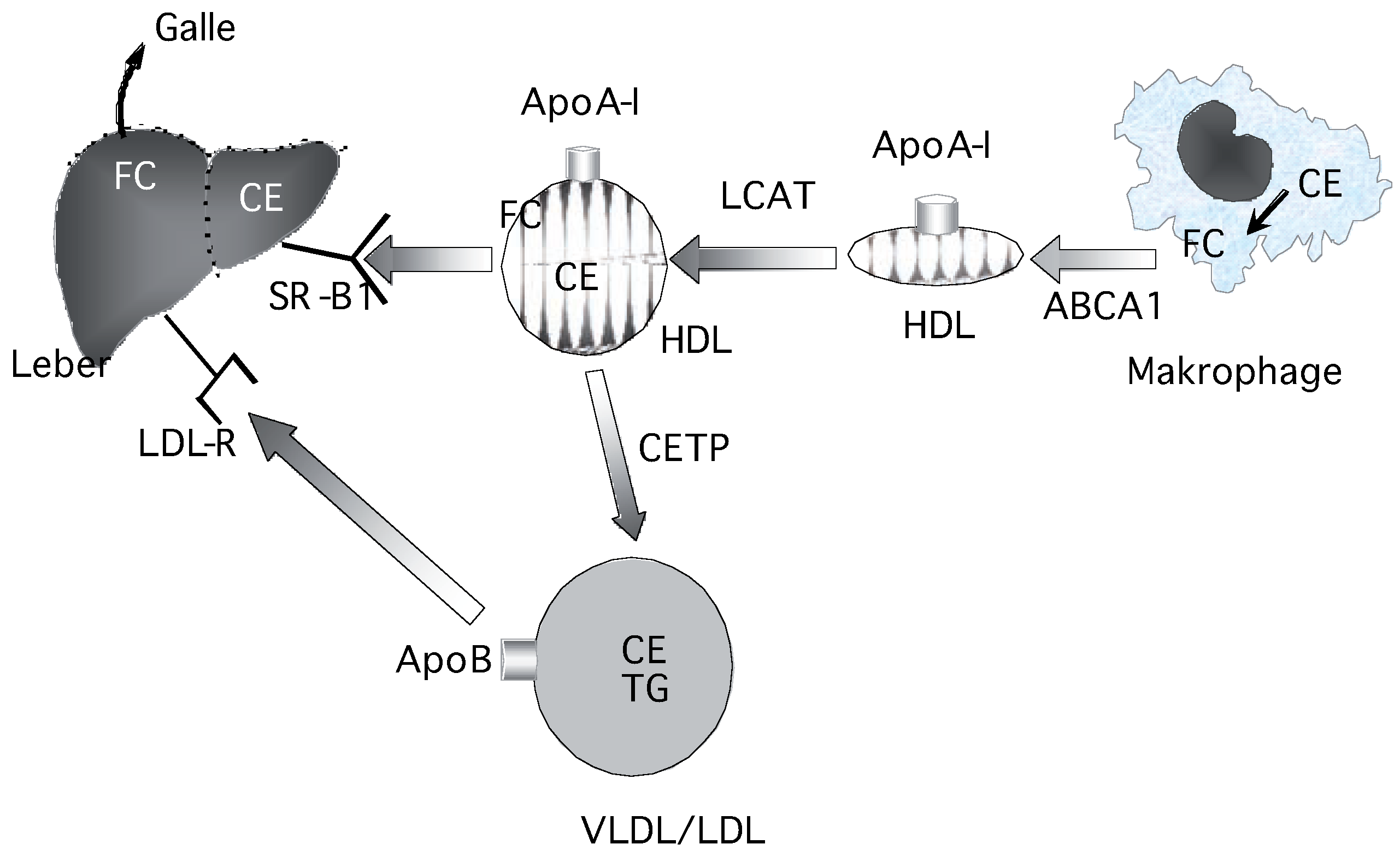
Atheroprotektive Mechanismen von HDL
- (1.)
- HDL kann Cholesterin aus nichthepatischen Zellen aufnehmen und zur Leber transportieren. Dieser Mechanismus wird reverser Cholesterintransport genannt.
- (2.)
- HDL vermag biologisch aktive und zytotoxische Lipidperoxidationsprodukte aus LDL zu inaktivieren, d.h. aufzunehmen und entweder enzymatisch zu inaktivieren oder zur Leber zu transportieren.
- (3.)
- HDL besitzt antiinflammatorische Eigenschaften.
- (4.)
- HDL weist antikoagulante bzw. profibrinolytische Aktivitäten auf.
Klinische Bedeutung von HDL
Medikamentöse Steigerung der HDL-Cholesterinkonzentration
Biochemie von CETP
Faktoren, die CETP beeinflussen
Genetische Mutationen von CETP und ihre klinische Bedeutung
CETP und Atherogenität
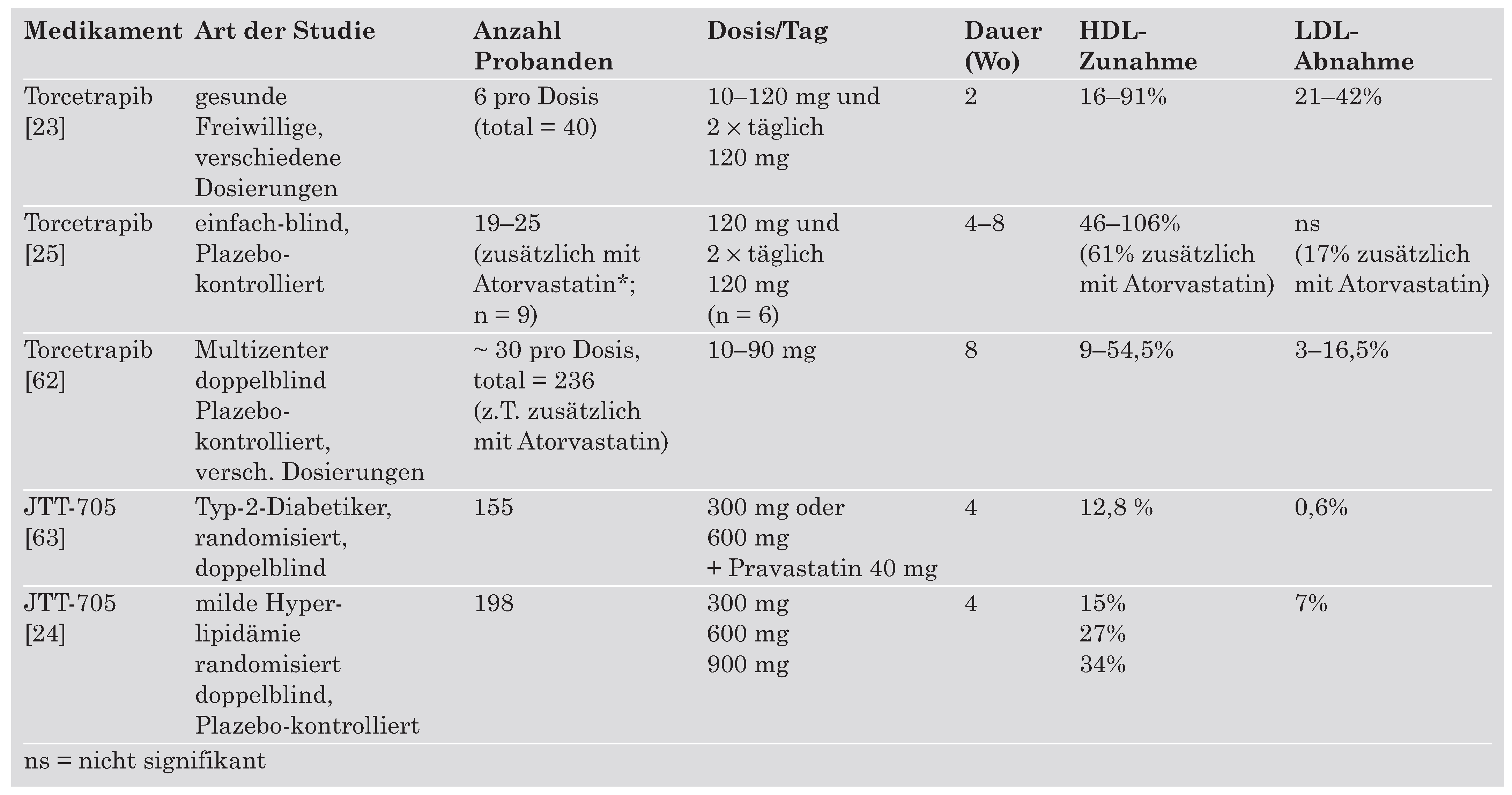
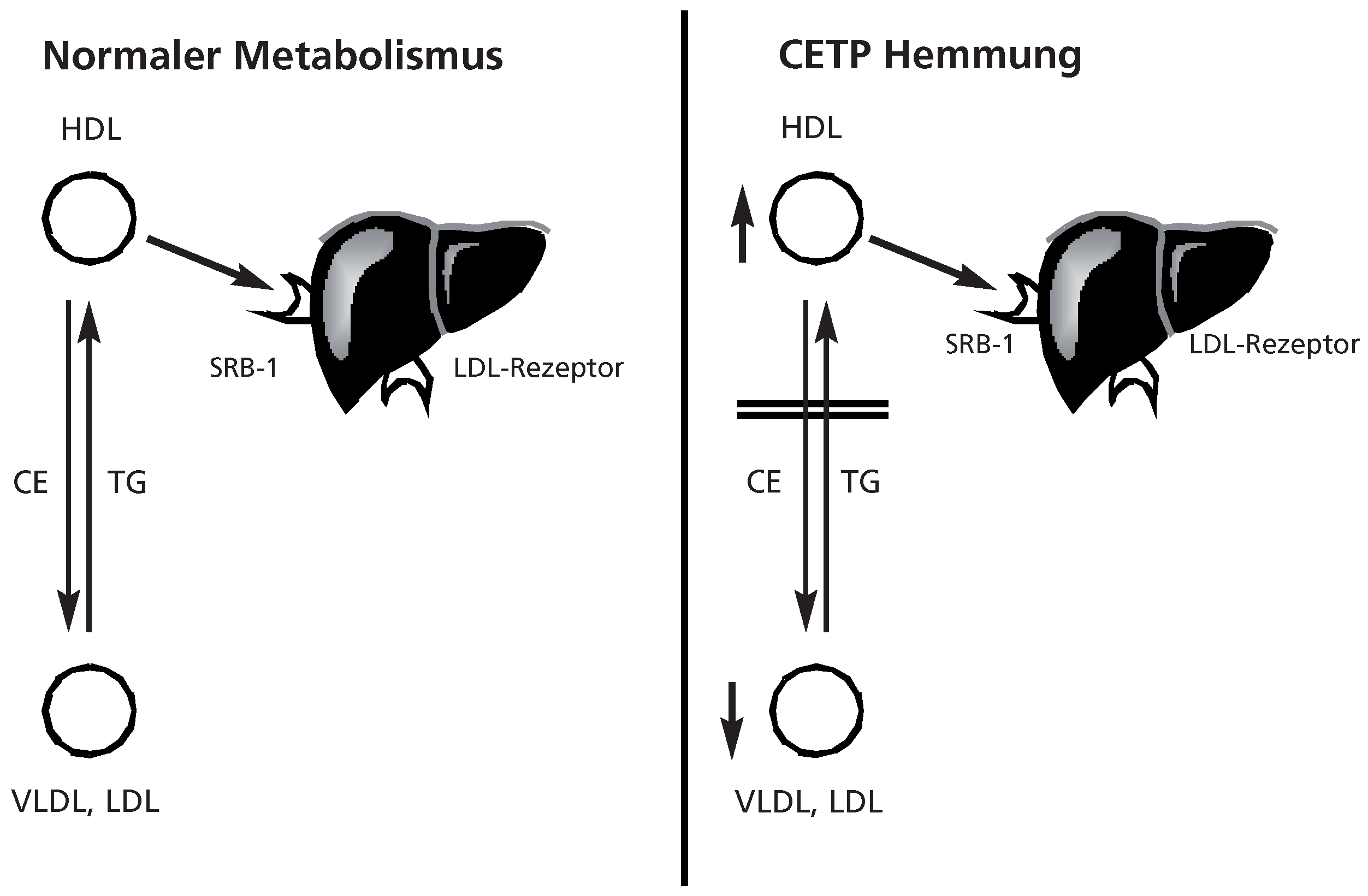
Pharmakologische Modulation von CETP—ein neues Ziel in der Behandlung der atherogenen Dyslipidämie
 |
Ausblick
Note added in proof
Conflicts of Interest
References
- Baigent, C.; Keech, A.; Kearney, P.M.; Blackwell, L.; Buck, G.; et al. Efficacy and safety of cholesterol-lowering treatment: Prospective meta-analysis of data from 90056 participants in 14 randomised trials of statins. Lancet 2005, 366, 1267–1278. [Google Scholar]
- Cannon, C.P.; Steinberg, B.A.; Murphy, S.A.; Mega, J.L.; Braunwald, E. Meta-analysis of cardiovascular outcome trials comparing intensive care versus moderate statin therapy. J Am Coll Cardiol. 2006, 48, 438–445. [Google Scholar] [CrossRef]
- Talbert, R.L. Safety issues with statin therapy. J Am Pharm Assoc. 2006, 46, 479–488. [Google Scholar] [CrossRef]
- National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and treatment of high Blood Cholesterol in Adults (Adult Treatment Panel III). Third report of the NCEP (ATP III) final report. Circulation 2002, 106, 3143–3421. [Google Scholar]
- International Atherosclerosis Society: Harmonized Guidelines on prevention of atherosclerotic cardiovascular diseases, full report. Available online: http://www.athero.org (accessed on 30 April 2003).
- Sikorski, J.A.; Connolly, D.T. The discovery of new cholesteryl ester transfer protein inhibitors. Curr Opin Drug Discov Devel. 2001, 4, 602–613. [Google Scholar] [PubMed]
- Le Goff, W.; Guerin, M.; Chapman, M.J. Pharmacological modulation of cholesteryl ester transfer protein, a new therapeutic target in atherogenic dyslipidemia. Pharmacol Ther 2004, 101, 17–38. [Google Scholar] [CrossRef] [PubMed]
- Yancey, P.G.; Bortnick, A.E.; Kellner-Weibel, G.; De la LleraMoya, M.; et al. Importance of different pathways of cholesterol efflux. Arteriocler Thromb Vasc Biol 2003, 23, 712–719. [Google Scholar] [CrossRef]
- Williams, D.L.; Connelly, A.M.; Temel, R.E.; Swarnakar, S.; Phillips, M.C.; de la Llera-Moya, M.; et al. Scavenger receptor B1 and cholesterol. Curr Opin Lipidol 1999, 10, 329–339. [Google Scholar] [CrossRef]
- Oram, J.F.; Lawn, R.M. ABCA1: The gatekeeper for eliminating excess tissue cholesterol. J Lipid Res 2001, 42, 1173–1179. [Google Scholar] [CrossRef]
- Mackness, M.I.; Arrol, S.; Abbott, C.; Durrington, P.N. Protection of low-density lipoprotein against oxidative modification by high-density lipoprotein associated paraoxonase. Atherosclerosis 1993, 104, 129–135. [Google Scholar] [CrossRef]
- Barter, P.J.; Baker, P.W.; Rye, K.A. Effects of high-density lipoproteins on the expression of adhesion molecules in endothelial cells. Curr Opin Lipidol. 2002, 13, 285–288. [Google Scholar] [CrossRef]
- Castelli, W.P.; Anderson, K.; Wilson, P.W.; Levy, D. Lipids and risk of coronary heart disease. The Framingham Study. Ann Epidemiol. 1992, 2, 23–28. [Google Scholar] [CrossRef] [PubMed]
- Assmann, G.; Schulte, H.; von Eckardstein, A.; Huang, Y. High density lipoprotein cholesterol as a predictor of heart disease. The PROCAM experience and pathophysiological implications for reverse cholesterol transport. Atherosclerosis 1996, 124 (Suppl S11–20), Suppl–S11. [Google Scholar] [CrossRef] [PubMed]
- Castelli, W.P.; Garrison, R.J.; Wilson, P.W.F.; Abbott, R.D.; Kalous dian, S.; Kannel, W.B. Incidence of coronary heart disease and lipoprotein levels. The Framingham Study. JAMA 1986, 256, 2835–2838. [Google Scholar] [CrossRef] [PubMed]
- Gordon, D.J.; Probstfield, J.L.; Neaton, J.D.; Castelli, W.P. High density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies. Circulation 1989, 79, 8–15. [Google Scholar] [CrossRef]
- Assmann, G.; Cullen, P.; Schulte, H. The Munster Heart Study (PROCAM). Results of follow-up at 8 years. Eur Heart J. 1998, 19 (Suppl A), A2–11. [Google Scholar]
- Assmann, G.; Schulte, H.; von Eckardstein, A. Hypertriglyceridemia and elevated levels of Lp(a) are major risk factors for major coronary events in middle-aged men. Am J Cardiol. 1996, 77, 1179–1184. [Google Scholar] [CrossRef]
- Summary of the second National Cholesterol Education Program (NCEP) Expert panel on Detection, Evaluation, and treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II). JAMA 1993, 269, 3015–3023. [CrossRef]
- Robins, S.J.; Collins, D.; Wittes, J.T.; Papademetriu, V.; Deedwania, P.C.; Schaefer, E.J.; et al. VA-HIT Study Group. Veterans Affairs High-Density Lipoprotein Intervention Trial. Relation of gemfibrozil treatment and lipid levels with major coronary events. VA-HIT: A randomized controlled trial. JAMA 2001, 285, 1585–1591. [Google Scholar] [CrossRef]
- Taylor, A.J.; Sullenberger, L.E.; Lee, H.J.; Lee, J.K.; Grace, K.A. Arterial Biology for the Investigation of Treatment Effects of Reducing Cholesterol (ARBITER 2): A double-blind, placebocontrolled study of extended-release niacin on atherosclerosis progression in secondary prevention patients treated with statins. Circulation 2004, 110, 3512–3517. [Google Scholar] [CrossRef]
- Knopp, R.H.; Alagona, P.; Davidson, M.; Goldberg, A.C.; Kafonek, S.D.; Kashyap, M.; et al. Equivalent efficacy of a time-release form of niacin (Niaspan) given once-a-night versus plain niacin in the management of hyperlipidemia. Metabolism 1998, 47, 1097–1104. [Google Scholar] [CrossRef]
- Clark, R.W.; Sutfin, T.A.; Ruggeri, R.B.; et al. Raising high-density lipoprotein cholesterol in humans through inhibition of cholesteryl ester transfer protein: An initial multidose study of torcetrapib. Arteriosler Thromb Vasc Biol. 2004, 24, 490–497. [Google Scholar] [CrossRef] [PubMed]
- de Grooth, G.J.; Kuivenhoven, J.A.; Stalenhoef, A.F.; de Graaf, J.; Zwinderman, A.H.; Posma, J.L.; et al. Efficacy and safety of a novel cholesteryl ester transfer protein inhibitor, JTT-705, in humans: A randomized phase II dose-response study. Circulation 2002, 105, 2159–2165. [Google Scholar] [CrossRef] [PubMed]
- Brousseau, M.E.; Schaefer, E.J.; Wolfe, M.L.; Bloedon, L.T.; Digenio, A.G.; Clark, R.W.; et al. Effects of an inhibitor of cholesteryl ester transfer protein on HDL metabolism. N Engl J Med. 2004, 350, 1505–1515. [Google Scholar] [CrossRef] [PubMed]
- Despres, J.P.; Golay, A.; Sjostrom, L. Rimonabant in obesity-lipids Study Group. Effects of rimonabant on metabolic risk factors in overweight patients with dyslipidemia. N Engl J Med. 2005, 353, 2121–2134. [Google Scholar] [CrossRef]
- Spieker, L.; Sudano, I.; Hürlimann, D.; Lerch, P.G.; Lang, M.G.; Binggeli, C.; et al. High density lipoprotein restores endothelial function in hypercholestolemic men. Circulation 2002, 105, 1399–1402. [Google Scholar] [CrossRef]
- Chiesa, G.; Monteggia, E.; Marchesi, M.; Lorenzon, P.; Laucello, M.; Lorusso, V.; et al. Recombinant apolipoprotein A-I (Milano) infusion in rabbit carotid artery rapidly removes lipid from fatty streaks. Circulation Res. 2002, 90, 974–980. [Google Scholar] [CrossRef]
- Nissen, S.E.; Tsunoda, T.; Tuzcu, E.M.; Schoenhagen, P.; Cooper, C.J.; Yasin, M.; et al. Effect of recombinant Apo A-I Milano on coronary atherosclerosis in patients with acute coronary syndromes: A randomized controlled trial. JAMA 2003, 290, 2292–2300. [Google Scholar] [CrossRef]
- Okamoto, H.; Yonemori, F.; Wakitani, K.; Minowa, T.; Maeda, K.; Shinkai, H. A Cholesteryl ester transfer protein inhibitor attenuates atherosclerosis in rabbits. Nature 2000, 406, 203–207. [Google Scholar] [CrossRef]
- Rittershaus, C.W.; Miller, D.P.; Thomas, L.J.; Picard, M.D.; Honan, C.M.; Emmett, C.D.; et al. Vaccine-induced antibodies inhibit CETP activity in vivo and reduce aortic lesions in a rabbitmodel of atherosclerosis. Arterioscl Thromb Vasc Biol. 2000, 20, 2106–2112. [Google Scholar] [CrossRef]
- Sugano, M.; Makino, N.; Sawada, S.; Otsuka, S.; Watanabe, M.; Okamoto, H.; et al. Effect of antisense oligonucleotides against cholesteryl ester transfer protein on the development of atherosclerosis in cholesterol-fed rabbits. J Biol Chem. 1998, 273, 5033–5036. [Google Scholar] [CrossRef]
- Marotti, K.R.; Castle, C.K.; Boyle, T.P.; Lin, A.H.; Murray, R.W.; Melchior, G.W. Severe atherosclerosis in transgenic mice expressing simian cholesteryl ester transfer protein. Nature 1993, 364, 73–75. [Google Scholar] [CrossRef]
- Hayek, T.; Masucci-Magoulas, L.; Jiang, X.; Walsh, A.; Rubin, E.; Breslow, J.L.; et al. Decreased early atherosclerotic lesions in hypertriglyceridemic mice expressing cholesteryl ester transfer protein transgene. J Clin Invest. 1995, 96, 2071–2074. [Google Scholar] [CrossRef] [PubMed]
- Hannuksela, M.; Marcel, Y.L.; Kesaniemi, Y.A.; Savolainen, M.J. Reduction in the concentration and activity of plasmacholesteryl ester transfer protein by alcohol. J Lipid Res. 1992, 33, 737–744. [Google Scholar] [CrossRef] [PubMed]
- Dullaart, R.P.K.; Hoogenberg, K.; Dikkeschei, B.D.; van Tol, A. Higher lasma lipid transfer protein activities and unfavourable lipoprotein changes in cigarette-smoking men. Arterioscler Thromb Vasc Biol. 1994, 14, 1581–1585. [Google Scholar] [CrossRef]
- Foger, B.; Ritsch, A.; Doblinger, A.; Wessels, H.; Patsch, J.R. Relationship of plasma cholesteryl ester transfer protein to HDL cholesterol: Studies in normotriglyceridemia and moderate hypertriglyceridemia. Arterioscler Thromb Vasc Biol. 1996, 16, 1430–1436. [Google Scholar] [CrossRef] [PubMed]
- Matsuzawa, Y.; Yamashita, S.; Kameda, T.; Kubo, M.; Tarui, S.; Hara, I. l. Marked hyper HDL2–cholesterolemia associated with premature corneal opacity: A case report. Atherosclerosis 1984, 53, 207–212. [Google Scholar] [CrossRef]
- Tall, A.R. Plasma cholesteryl ester transfer protein and high density lipoproteins: New insights from molecular genetic studies. J Intern Med 1995, 237, 5–12. [Google Scholar] [CrossRef]
- Thompson, J.F.; Lira, M.E.; Durham, L.K.; Clark, R.W.; Bamberger, M.J.; Milos, P.M.; et al. Polymorphism in the CETP gene and association with CETP mass and HDL levels. Atherosclerosis 2003, 167, 195–204. [Google Scholar] [CrossRef]
- Klerkx, H.E.M.; Tanck, W.T.; Kasteleien, J.J.; Molhuizen, H.O.; Jukema, J.W.; Zwinderman, A.H.; et al. Haplotype analysis of the CETP gene: Not TaqIB, but the closely linked-629C Æ A polymorphism and a novel promoter variant are independently associated with CETP concentration. Hum Mol Genetics 2003, 12, 111–123. [Google Scholar] [CrossRef]
- Kuivenhoven, J.A.; de Knijff, P.; Boer, J.M.; Smalheer, H.A.; Botma, G.J.; Seidell, J.C.; et al. Heterogeneity at the CETP gene locus Influence on plasma CETP concentrations and HDL cholesterol levels. Arterioscler Thromb Vasc Biol. 1997, 17, 560–568. [Google Scholar] [CrossRef] [PubMed]
- Blankenberg, S.; Tiret, L.; Bickel, C.; Schlitt, A.; Jungmair, W.; Genth-Zotz, S.; et al. Einfluss genetischer Variationen des Cholesterinestertransferproteingens auf die Prävalenz der koronaren Herzerkrankung. Zeitschr Kardiol. 2004, 93 (Suppl 4), 16–23. [Google Scholar]
- Asztalos, B.F.; Roheim, P.S.; Milani, R.I.; Lefevre, M.; McNamara, J.R.; Horvath, K.V.; et al. Distribution of Apo A-I containing HDL subpopulations in patients with coronary heart disease. Arterioscler Thromb Vasc Biol. 2000, 20, 2670–2676. [Google Scholar] [CrossRef] [PubMed]
- Curb, J.D.; Abbott, R.D.; Rodriguez, B.L.; Masaki, K.; Chen, R.; Sharp, D.S.; et al. A prospective study of HDL-C and cholesterylester transfer protein gene mutation and the risk of coronary heart disease in the elderly. J Lipid Res. 2004, 45, 948–953. [Google Scholar] [CrossRef]
- Maruyama, T.; Sakai, N.; Ishigami, M.; Hirano, K.; Arai, T.; Okada, S.; et al. Prevalence and phenotypic spectrum of cholesteryl ester transfer protein gene mutations in Japanese hyperalphalipoproteinemia. Atherosclerosis 2003, 166, 177–185. [Google Scholar] [CrossRef]
- Borggreve, S.E.; Hillege, H.L.; Wolffenbuttel, B.H.; de Jong, P.E.; Zuurman, M.W.; van der Steege, G.; et al. An increased coronary risk is paradoxically associated with common cholesteryl ester transfer protein gene variations that relate to higher high-density lipoprotein cholesterol: A population-based study. J Clin Endocrinol Metab. 2006, 91, 3382–3388. [Google Scholar] [CrossRef]
- Brousseau, M.E.; O’Connor JJJr Ordovas, J.M.; Collins, D.; Otvos, J.D.; Massov, T.; et al. Cholesteryl ester transfer protein TaqI B2B2 genotype is associated with higher HDL cholesterol levels and lower risk of coronary heart disease end points in men with HDL deficiency: Veterans Affairs HDL Cholesterol Intervention Trial. Arterioscler Thromb Vasc Biol. 2002, 22, 1148–1154. [Google Scholar] [CrossRef]
- Moriyama, Y.; Okamura, T.; Inazu, D.; Doi, M.; Iso, H.; Mouri, Y.; et al. A low prevalence of coronary heart disease among subjects with increased high-density lipoprotein cholesterol levels, including those with plasma cholesteryl ester transfer protein deficiency. Prev Med 1998, 27, 659–667. [Google Scholar] [CrossRef]
- de Grooth, G.J.; Zerba, K.E.; Huang, S.P.; Tsuchihashi, Z.; Kirchgessner, T.; Belder, R.; et al. The cholesteryl ester transfer protein (CETP) TaqIB polymorphism in the cholesterol and recurrent events study: No interaction with the response to pravastatin therapy and no effects on cardiovascular outcome: A prospective analysis of the CETP TaqIB polymorphism on cardiovascular outcome and interaction with cholesterol-lowering therapy. J Am Coll Cardiol. 2004, 43, 854–857. [Google Scholar]
- Bruce, C.; Sharp, D.S.; Tall, A.R. Relationship of HDL and coronary heart disease to a common amino acid polymorphism in the cholesteryl ester transfer protein in men with and without hypertriglyceridemia. J Lipid Res 1998, 39, 1071–1078. [Google Scholar] [CrossRef]
- Kimura, H.; Geiyo, F.; Suzuki, S.; Yamaguchi, T.; Imura, T.; Miyazaki, R.; et al. A common mutation of cholesteryl ester transfer protein gene in dialysis patients. Kidney Int. 1999, 71 (Suppl), S186–S189. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Tenkanen, H.; Koshinen, P.; Kontula, K.; Aalto-Setala, K.; Manttari, M.; Manninen, V.; et al. Polymorphisms of the gene encoding cholesterol ester transfer protein and serum lipoprotein levels in subjects with and without coronary heart disease. Hum Genet. 1991, 87, 574–578. [Google Scholar] [CrossRef] [PubMed]
- Klerkx, A.H.; de Grooth, G.J.; Zwinderman, A.H.; Jukema, J.W.; Kuivenhoven, J.A.; Kastelein, J.J. Cholesteryl ester transfer protein concentration is associated with progression of atherosclerosis and response to pravastatin in men with coronary artery disease (REGRESS). Eur J Clin Invest. 2004, 34, 21–28. [Google Scholar] [CrossRef] [PubMed]
- Zhong, S.; Sharp, D.S.; Grove, J.S.; Bruce, C.; Yano, K.; Curb, J.D.; et al. Increased coronary heart disease in Japanese-American men with mutations in the cholesteryl ester transfer protein gene despite increased HDL levels. J Clin Invest 1996, 97, 2917–2923. [Google Scholar] [CrossRef]
- Plump, A.S.; Masucci-Magoulas, L.; Bruce, C.; Bisgaier, C.L.; Breslow, J.L.; Tall, A.R. Increased atherosclerosis in apo E and LDL receptor knock-out mice as a result of human cholesterol ester transfer protein transgene expression. Arterioscler Thromb Vasc Biol. 1999, 19, 1105–1110. [Google Scholar] [CrossRef]
- Inazu, A.M.; Brown, M.L.; Hesler, C.B.; Agellon, L.B.; Koizumi, J.; Takata, K.; et al. Increased high-density lipoprotein levels caused by a common cholesterol-ester transfer protein gene mutation. N Engl J Med. 1990, 323, 1234–1238. [Google Scholar] [CrossRef]
- Okamoto, H.; Iwamoto, Y.; Maki, M.; Sotani, T.; Yonemori, F.; Wakitani, K. Effect of JT-705 on cholesteryl ester transfer protein and plasma lipids in normolipidemic rabbits. Eur J Pharmacol. 2003, 466, 147. [Google Scholar] [CrossRef]
- Huang, Z.; Inazu, A.; Nohara, A.; Higashikata, T.; Mabuchi, H. Cholesteryl ester transfer protein inhibitor (JT-705) and the development of atherosclerosis in rabbits with severe hypercholesterolemia. Clin Sci 2002, 103, 587–594. [Google Scholar] [CrossRef]
- Barzilai, N.; Atzmon, G.; Schechter, C.; Schaefer, E.J.; Cupples, A.L.; Lipton, R.; et al. Unique lipoprotein phenotype and genotype associated with exceptional longevity. JAMA 2003, 290, 2030–2040. [Google Scholar] [CrossRef]
- Boekholdt, S.M.; Kuivenhoven, J.A.; Wareham, N.J.; Peters, R.J.; Jukema JWLuben, R.; et al. Plasma levels of cholesteryl ester transfer protein and the risk of future coronary artery disease in apparently healthy men and women. Circulation 2004, 110, 1418–1423. [Google Scholar] [CrossRef]
- Davidson, M.; McKenney, J.; Shear, C.; Revkin, J. Efficacy and safety of a torcetrapib a novel cholesteryl ester transfer protein inhibitor, in individuals with below average high-density lipoprotein cholesterol levels. JACC. 2006, H8, 1774–1781. [Google Scholar] [CrossRef]
- Kuivenhoven, J.A.; de Grooth, G.J.; Kawamura, H.; Klerkx, A.H.; Wilhelm, F.; Trip, M.D.; et al. Effectiveness of inhibition of cholesteryl ester transfer protein JTT-705 in combination with pravastatin in type II dyslipidemia. Am J Cardiol. 2005, 95, 1085–1088. [Google Scholar] [CrossRef]
- Nissen, S.E.; Tardif, J.C.; Nicholls, S.J.; Revkin, J.H.; Shear, C.L.; Duggan, W.T.; et al. ILLUSTRATE Investigators. Effect of torcetrapib on the progression of coronary atherosclerosis. N Engl J Med. 2007, 356, 1364–1366. [Google Scholar] [CrossRef]
- Kastelein, J.J.; van Leuven, S.I.; Burgess, L.; Evans, G.W.; Kuivenhoven, J.A.; Barter, P.J.; et al. RADIANCE 1 Investigators. Effect of torcetrapib on carotid atherosclerosis in familial hypercholesterolemia. N Engl J Med. 2007, 356, 1620–1630. [Google Scholar] [CrossRef]
© 2007 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Riesen, W.F. CETP-Inhibitoren (Torcetrapib und JTT-705). Cardiovasc. Med. 2007, 10, 285. https://doi.org/10.4414/cvm.2007.01265
Riesen WF. CETP-Inhibitoren (Torcetrapib und JTT-705). Cardiovascular Medicine. 2007; 10(9):285. https://doi.org/10.4414/cvm.2007.01265
Chicago/Turabian StyleRiesen, Walter F. 2007. "CETP-Inhibitoren (Torcetrapib und JTT-705)" Cardiovascular Medicine 10, no. 9: 285. https://doi.org/10.4414/cvm.2007.01265
APA StyleRiesen, W. F. (2007). CETP-Inhibitoren (Torcetrapib und JTT-705). Cardiovascular Medicine, 10(9), 285. https://doi.org/10.4414/cvm.2007.01265




