Summary
Cardiogenic shock complicates up to 7% of acute myocardial infarctions and is associated with high mortality despite aggressive revascularization therapy. Percutaneous left ventricular assist devices have been developed to serve as temporary circulatory support during those periods of insufficient intrinsic pump function. The TandemHeartTM is the currently available percutaneous left ventricular assist device consisting of a left atrial inflow cannula and an arterial outflow cannula, which are connected to a non-pulsatile, centrifugal pump rotating at up to 7500 rpm providing systemic flow of up to 4 L/minute. The device markedly improves the haemodynamic condition of patients with cardiogenic shock thus preventing circulatory collapse and multi-organ failure. Clinical results from single center and registry experiences report promising survival data albeit occasionally associated with serious complications. Randomised clinical trials currently explore the role of percutaneous left ventricular devices in patients with cardiogenic shock (circulatory assistance) and acute extensive anterior myocardial infarction (left ventricular remodeling).
Zusammenfassung
Der kardiogene Schock kompliziert den Verlauf von bis zu 7% aller akuten Herzinfarkte. Perkutane linksventrikuläre Unterstützungssysteme wurden dazu entwickelt, die Episoden unzureichender intrinsischer linksventrikulärer Pumpfunktion während des kardiogenen Schocks zu überbrücken. Das Tandem HeartTM ist das derzeit zur Verfügung stehende perkutane linksventrikuläre Unterstützungssystem, welches aus einer linksatrialen Einflussschleuse und einer arteriellen Ausflussschleuse besteht, die an eine nicht-pulsatile Zentrifugalpumpe angeschlossen sind und bei Umdrehungen von bis zu 7500/min einen systemischen Fluss von 4 l/min gewährleisten kann. Das perkutane linksventrikuläre Unterstützungssystem führt zu einer markanten Stabilisierung der Hämodynamik von Patienten mit kardiogenem Schock und verhindert so ein Kreislaufund Multiorganversagen. Die klinischen Resultate einzelner Zentren sowie eines weltweiten Registers sind zwar vielversprechend im Hinblick auf Überlebensraten, jedoch teilweise mit schweren Komplikationen vergesellschaftet. Randomisierte klinische Studien versuchen derzeit den Nutzen des perkutanen linksventrikulären Unterstützungssystems bei Patienten mit kardiogenem Schock (Kreislaufunterstützung) und ausgedehntem Vorderwandinfarkt (linksventrikuläres Remodeling) zu validieren.
Einsatz von perkutanen linksventrikulären Unterstützungssystemen
Die Inzidenz des kardiogenen Schocks hat sich während der letzten 20 Jahre nicht wesentlich verändert [
1,
2] und kompliziert etwa 7% der akuten ST-Hebungsinfarkte und 2,5% der Nicht-ST-Hebungsinfarkte [
3,
4]. Die rasche koronarangiografische Definition der Koronarzirkulation, gefolgt von einer perkutanen oder chirurgischen Revaskularisation, hat sich in randomisierten klinischen Studien als Therapie der Wahl erwiesen [
5,
6]. Die Mortalität des kardiogenen Schocks hat zwar in den 1990er Jahren abgenommen, führt jedoch trotz rascher Revaskularisation bei über der Hälfte (50–70%) der Betroffenen innerhalb von 30 Tagen zum Tod [
4,
5,
6,
7]. Dies ist einerseits auf ein irreversibles Pumpversagen mit konsekutiver Kompromittierung der Vitalfunktionen zurückzuführen. Andererseits häufen sich Hinweise für eine zusätzliche systemisch inflammatorische Reaktion mit Aktivierung des Komplementsystems sowie der Expression von Zytokinen und der Nitridoxid (NO)-Synthase, die eine unverhältnismässige Vasodilatation und Myokarddepression bewirken und somit zu einer temporären Verschlechterung beitragen [
8].
Der akute Nutzen von ventrikulären Unterstützungssystemen bei Patienten mit kardiogenem Schock besteht in der Wiederherstellung einer normalen Hämodynamik und damit der Endorganperfusion, selbst im Falle eines kompletten myokardialen Pumpversagens. Darüber hinaus postulieren Protagonisten des Prinzips der ventrikulären Entlastung (ventricular unloading) einen chronischen Langzeitnutzen von ventrikulären Unterstützungssystemen durch die reduzierte Wandspannung während Phasen der akuten Ischämie aufgrund eines günstigen Remodelings. Tierexperimentelle Untersuchungen haben eine reduzierte Infarktgrösse und verbesserte Mikroperfusion in Anwesenheit eines perkutanen linksventrikulären Unterstützungssystems im Vergleich zu Kontrollund mittels intraaortaler Ballonpumpe (IABP)-assistierten Tieren ergeben [
9]. Da das Ausmass der Mikroperfusion mit linksventrikulärem Remodeling korreliert, könnte dies ein möglicher Mechanismus für den beobachteten Nutzen von ventrikulären Unterstützungssystemen sein [
10]. Weitere Hinweise für ein begünstigtes Remodeling durch ventrikuläre Unterstützungssysteme konnten in isolierten humanen Herzpräparaten gewonnen werden. So zeigten die zum Zeitpunkt der Herztransplantation entnommenen Herzpräparate eine geringere linksventrikuläre Grösse und reduzierten Myozyten-Durchmesser, wenn sie im Vergleich zu medikamentös behandelten Patienten zuvor ventrikulär assistiert wurden [
11]. Dieser Effekt war um so ausgeprägter, je länger die Patienten (>30 Tage) ventrikulär assistiert wurden. In der nachfolgenden Übersicht werden das Funktionsprinzip sowie die ersten klinischen Erfahrungen mit dem derzeit verfügbaren perkutanen linksventrikulären Unterstützungssystem, dem TandemHeart
TM, thematisiert.
Funktionsprinzip und Implantationstechnik
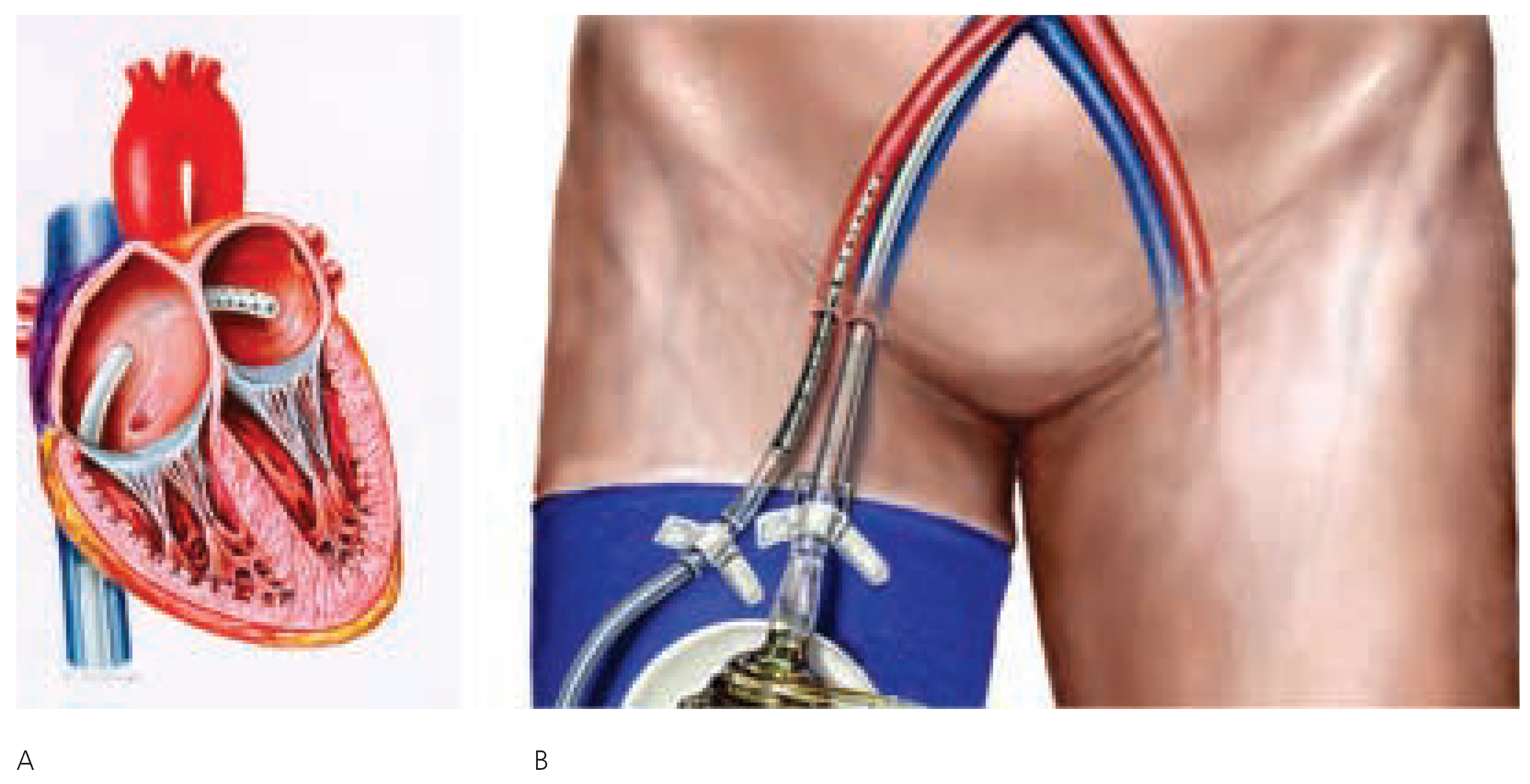
Im Gegensatz zur intraaortalen Ballonpumpe, die das Myokard entlastet, aber nicht aktiv unterstützt, und eine residuelle Pumpleistung zur Voraussetzung hat, gewährleisten ventrikuläre Unterstützungssysteme eine assistierte Herz-Kreislauf-Zirkulation, selbst bei Abwesenheit einer intrinsischen Pumpleistung. Linksventrikuläre Unterstützungssysteme benötigen im Unterschied zu extrakorporellen Membranoxygenatoren keinen Oxygenator, sondern verwenden oxygeniertes Blut aus dem linken Vorhof bzw. Ventrikel. Das TandemHeartTM ist ein perkutanes linksventrikuläres Unterstützungssystem (PLVAD), welches mittels interventionell kardiologischer Techniken einfach implantiert wird und einen linksatrialen-zu-femoral-arteriellen Bypass etabliert.
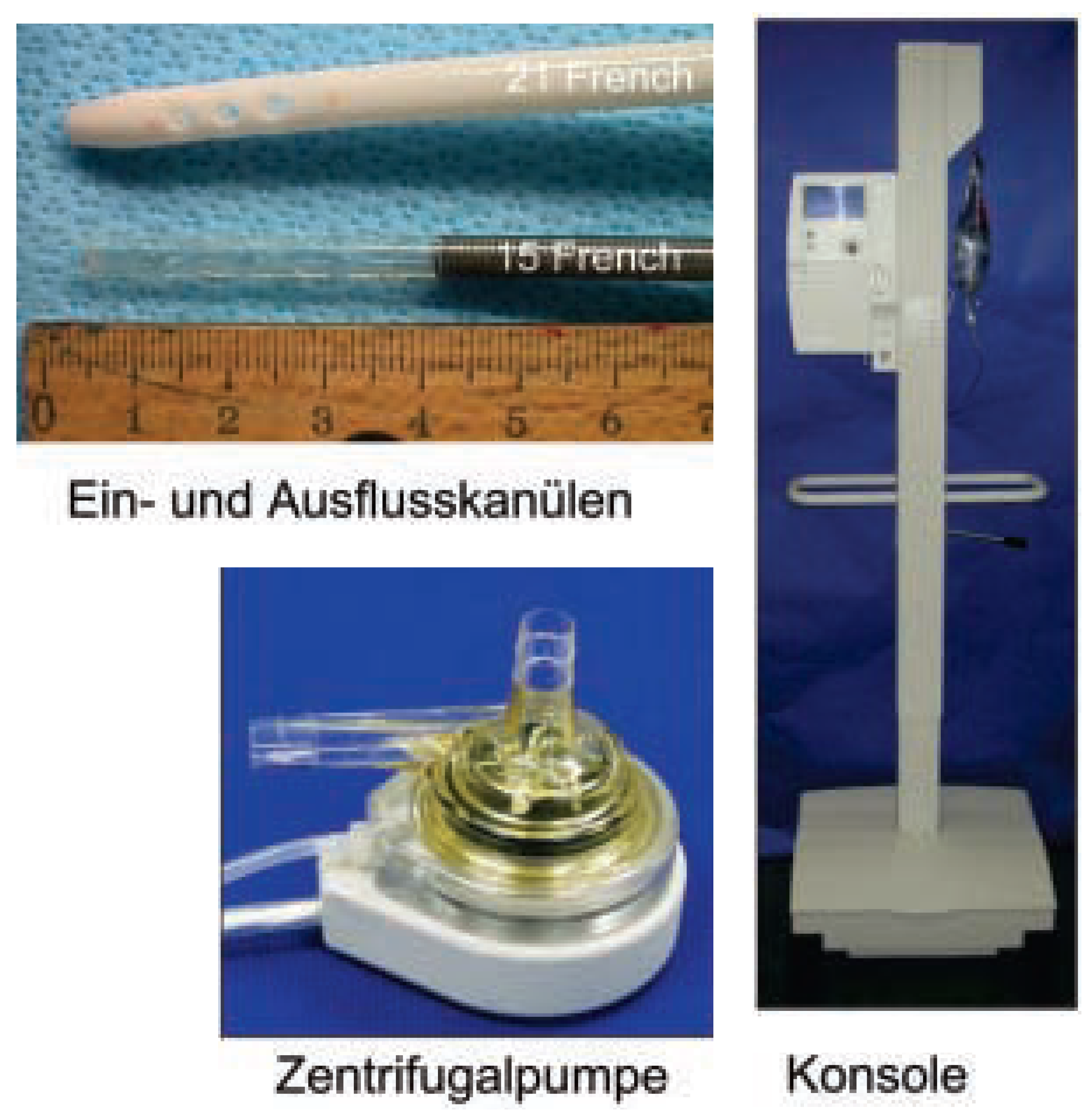
Die Implantation eines PLVAD erfordert einen femoral venösen Zugang, um mittels transseptaler Punktion die 21 French-messende Ausflusskanüle im linken Vorhof zu positionieren (
Abb. 1 and
Abb. 2). Des weiteren wird mittels Seldinger-Technik eine 15–17 French grosse Einflusskanüle retrograd in der Femoralarterie plaziert. Bei Femoralarterien, die aufgrund ihrer Grösse oder einer peripher arteriellen Verschlusserkrankung kleinere Einflusskanülen erforderlich machen, können alternativ zwei 12 French grosse Einflusskanülen in beiden Femoralarterien separat eingelegt und via Y-Verzweigungsstück verbunden werden. Einund Ausflussschleusen werden sorgfältig mittels lokaler Naht gesichert, um eine allfällige Dislokation zu vermeiden. Vor Einlage der arteriellen Einflusskanülen sollte eine Angiographie der Bauchaorta, Iliakalund Femoralgefässe zur Beurteilung der Gefässgrösse und -qualität durchgeführt werden. Die jeweils im linken Vorhof bzw. der Femoralarterie plazierten Einund Ausflusskanülen werden mittels kleiner Verbindungsschläuche unter Beachtung einer sorgfältigen Entlüftung an das Herzstück der assistierten Zirkulation, eine Zentrifuge mit kontinuierlichem Fluss, angeschlossen. Die Zentrifuge hat einen zweikammerigen Aufbau mit einer oberen Kammer, die den Einund Ausfluss des oxygenierten Bluts gewährleistet und das Turbinenrad beherbergt. Die untere Kammer birgt den Rotor sowie kleine Kanäle zur Infusion von heparinisierter Kochsalzlösung in das obere Gehäuse. Der Rotor selbst wird durch die umspülte heparinisierte Kochsalzlösung lubrifiziert und gekühlt. Die Zentrifuge verfügt über einen Mikroprozessor-gesteuerten elektromechanischen Antrieb, welcher Rotationen von 3500–7500/min und einen systemischen Blutfluss von bis zu 4 l/min gewährleistet.
Indikationen für ein perkutanes linksventrikuläres Unterstützungssystem
Drei Patientenpopulationen kommen für die Verwendung eines perkutanen linksventrikulären Unterstützungssystems in Betracht:
- —
temporäre hämodynamische Unterstützung als Brücke zu einem permanenten Unterstützungssystem oder zur Herztransplantation
- 2.
Patienten mit einer reversiblen ventrikulären Dysfunktion
- —
temporäre hämodynamische Unterstützung bis zur Erholung bzw. Revaskularisation
- 3.
Patienten mit grossem ischämischem Risikoareal
- —
temporäre hämodynamische Unterstützung zur Durchführung von Revaskularisationseingriffen mit erhöhtem Risiko (PCI und ACB)
Prinzipiell konstituieren alle Ursachen eines kardiogenen Schocks eine potentielle Indikation für ein PLVAD. Ein besonderer Nutzen kann bei temporärer ventrikulärer Dysfunktion wie akuten Myokarditiden, Überdosierungen, Hypothermie und therapierefraktären ventrikulären Rhythmusstörungen (electrical storm) erwartet werden. Patienten, die für den Einsatz eines PLVAD evaluiert werden, erfüllen typischerweise die hämodynamischen Kriterien des kardiogenen Schocks (kardialer Index <2 l/min/m2, systolischer Blutdruck <90 mm Hg, pulmonalkapillärer Wedgedruck ≥20 mm Hg, linksatrialer Druck ≥20 mm Hg, Urin ≤20 ml/Std, systemisch vaskulärer Widerstand >2100 dynes-sec-cm—5). Die Ausnahme von dieser Regel konstituieren diejenigen Patienten, die einem HochrisikoEingriff, z.B. mittels PCI, unter Schutz eines PLVAD unterzogen werden. Hier wird das Unterstützungssystem unter elektiven Bedingungen implantiert und dient dazu, die Perioden unzureichender Myokardperfusion während der Intervention sowie allfällige Komplikationen zu überbrücken (z.B. Interventionen am Hauptstamm oder letztem verbleibenden Koronargefäss) [
12]. Eine weitere wichtige Indikation ist die der Überbrückung (in der Abwesenheit einer spontanen Reversibilität der ventrikulären Dysfunktion) zu einer permanenten Therapie entweder in Form eines permanenten chirurgisch implantierten Unterstützungssystems oder einer Herztransplantation. Der Vorteil der Überbrückungsstrategie mittels PLVAD besteht darin, dass bis zum definitiven Entscheid über den Einsatz der technisch und finanziell aufwendigeren Therapieformen mehr Zeit zur Verfügung steht, um weitergehende Abklärungen zu treffen, welche häufig in der Akutphase der ventrikulären Dekompensation sonst nicht zur Verfügung steht. Eine Zusammenfassung der Indikationen findet sich in
Tabelle 1.
Kontraindikationen für ein PLVAD beinhalten ein schweres Rechtsherzversagen, eine schwere peripher-arterielle Verschlusskrankheit sowie Blutungsdiathesen.
Hämodynamische Auswirkungen
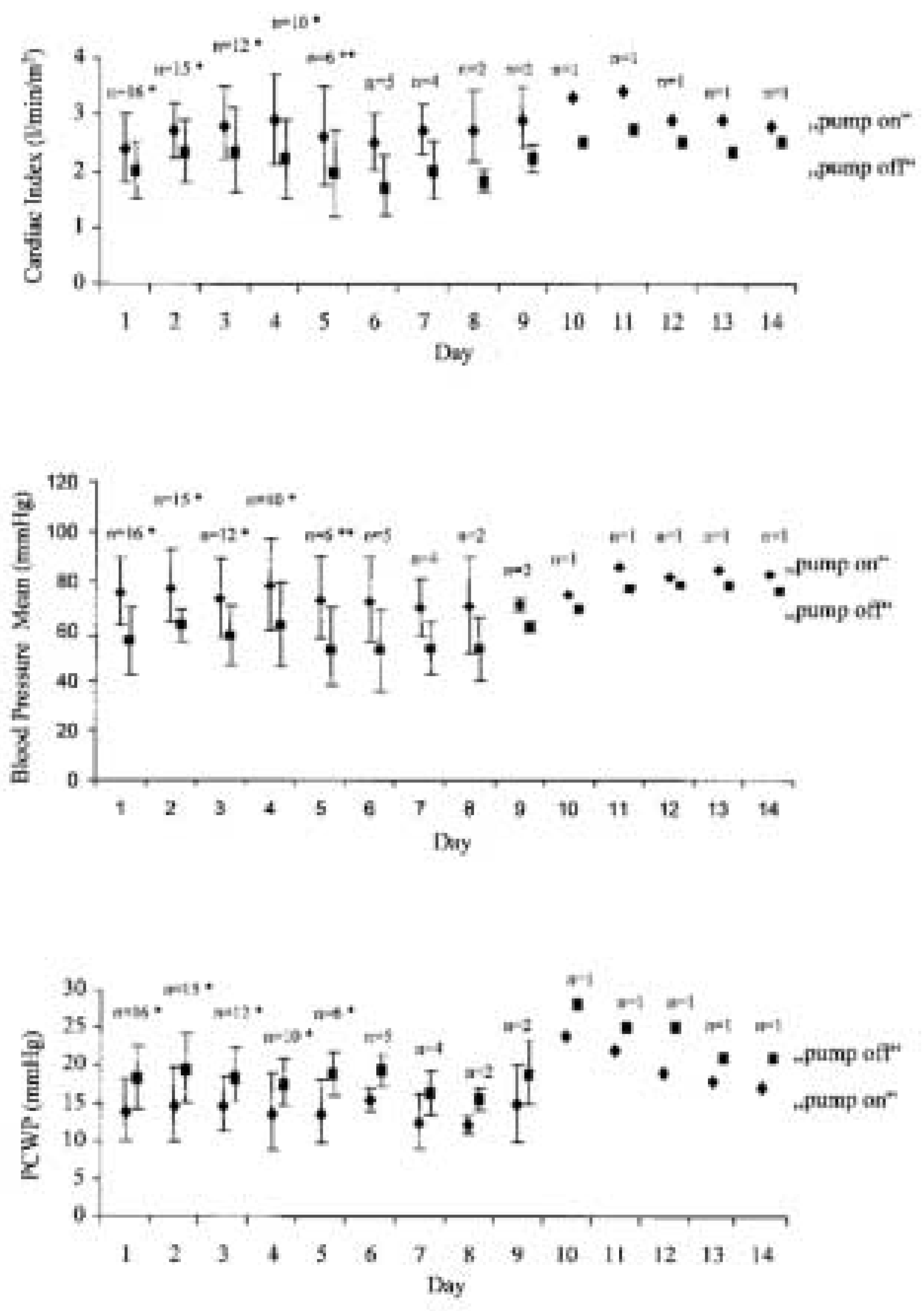
Die hämodynamischen Auswirkungen einer linksventrikulären Unterstützung mittels PLVAD wurden durch Thiele und Mitarbeiter [
13] bei 18 Patienten mit kardiogenem Schock infolge eines Myokardinfarkts untersucht. Es zeigte sich ein signifikanter Anstieg des Herzminutenvolumens (nicht assistiert: 3,5 ± 0,8 l/min vs. assistiert: 4,8 ± 1,1 l/min, p <0,001) und des mittleren arteriellen Blutdrucks (nicht assistiert: 63,1 ± 7,8 mm Hg vs. assistiert: 80,2 ± 8,9 mm Hg, p <0,001). Diese linksventrikuläre Unterstützung der Kreislaufzirkulation war begleitet von einer Vorlastsenkung mit einem signifikanten Abfall des pulmonalkapillären Wedge-Drucks (nicht assistiert: 20,8 ± 3,6 mm Hg vs. assistiert: 14,2 ± 3,5 mm Hg, p <0,001), des mittleren pulmonalarteriellen Drucks (nicht assistiert: 31,2 ± 8,1 mm Hg vs. assistiert: 23,2 ± 6,3 mm Hg, p <0,001) und des zentralvenösen Drucks (nicht assistiert: 12,7 ± 3,7 mm Hg vs. assistiert: 9,3 ± 3,0 mm Hg, p <0,001). Die eindrücklichen Auswirkungen auf die hämodynamischen Herz-Kreislauf-Parameter bei individuellen Patienten sind in
Abb. 3 zusammengefasst.
Das PLVAD bypasst oxygeniertes Blut des linken Vorhofs in die systemische Zirkulation. Im Gegensatz zu chirurgisch implantierten linksventrikulären Unterstützungssystemen, die Blut aus dem linken Ventrikel direkt in die Aorta ascendens umleiten und einen antegraden physiologischen Blutfluss ermöglichen, erfolgt der systemische Blutfluss des PLVAD retrograd durch die Arteria femoralis von kaudal nach kranial. Folglich muss das Myokard gegen die assistierte Zirkulation des PLVAD kontrahieren, was möglicherweise eine Nachlasterhöhung zur Folge haben könnte. Ob das PLVAD daher tatsächlich eine linksventrikuläre Entlastung durch Herabsetzung der Wandspannung und eine verbesserte myokardiale Energetik bewirkt, ist zum jetzigen Zeitpunkt nicht konklusiv beantwortet. Zusammenfassend lässt sich festhalten, dass das PLVAD eine markante Erhöhung des Herzminutenvolumens sowie eine Vorlastsenkung sicherstellen, die ausreichen, um auch Patienten ohne residuelle myokardiale Pumpleistung hämodynamisch zu stabilisieren.
Klinische Resultate
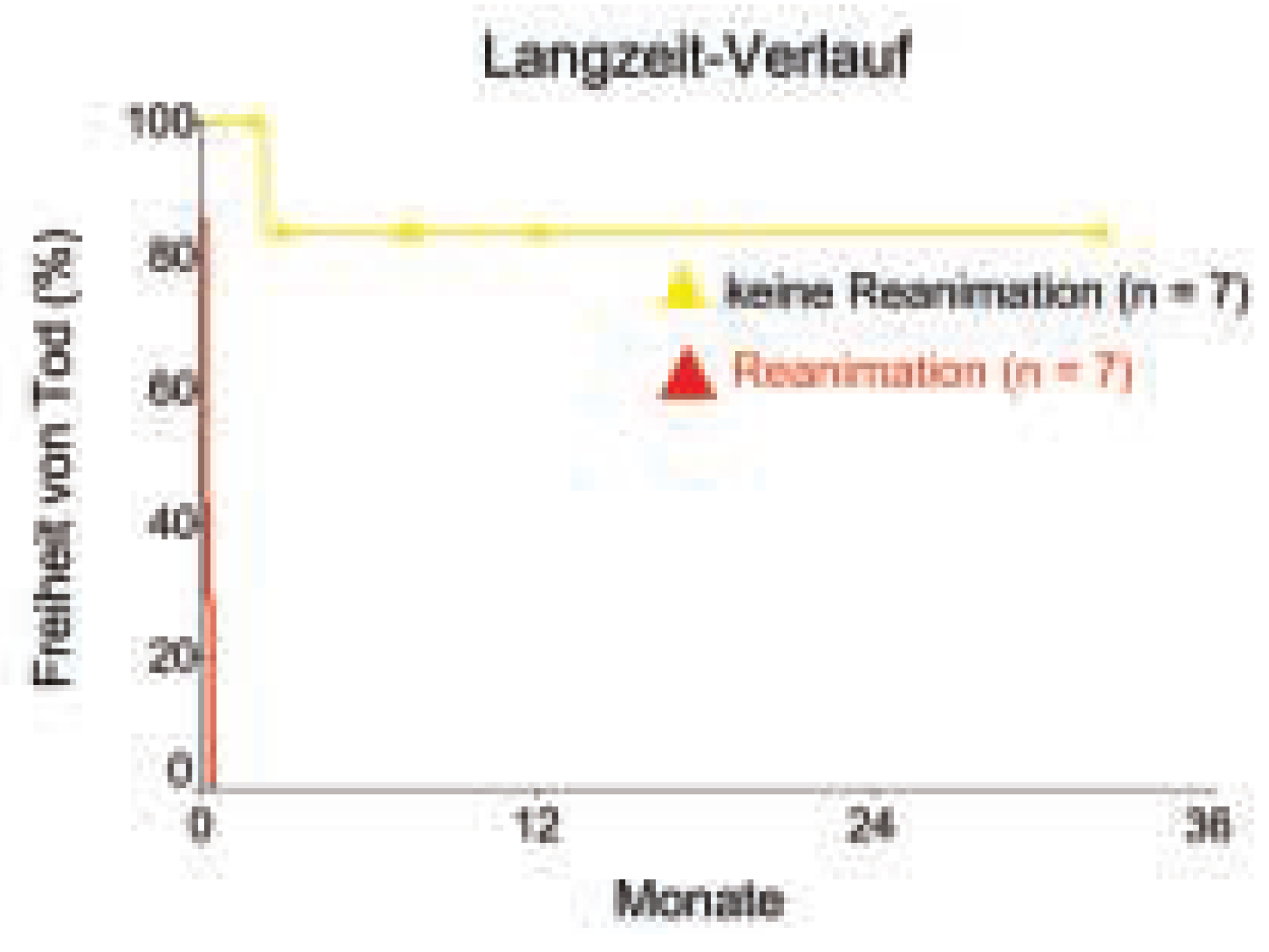
Am Inselspital Bern wurde das PLVAD zwischen November 2000 und Mai 2003 bei 14 Patienten verwendet. Ursache der linksventrikulären Funktionsstörung war eine ischämische Kardiomyopathie bei 12 Patienten (86%) sowie eine akute Myokarditis und Chemotherapie-induzierte Kardiomyopathie bei jeweils einem Patienten (7%). Das PLVAD konnte bei 13 Patienten (93%) erfolgreich implantiert werden, während es bei einem reanimationsbedürftigen Patienten zu einer Dislokation der linksatrialen Einflussschleuse in den rechten Vorhof kam. Während einer mittleren PLVADTherapiedauer von 3 ± 5 Tagen (1–18 Tage) wurden 10 Patienten (71%) einer perkutanen Koronarintervention, 2 Patienten einer aortokoronaren Bypass-Operation und 2 Patienten einer medikamentösen Therapie zugeführt. Schwere Komplikationen wurden bei 5 Patienten (36%) verzeichnet, bestehend aus Beinischämien bei 2 Patienten (14%), die bei einem Patienten eine Vorderfussamputation notwendig machte, Sepsis (1 Patient), Hirnschlag (1 Patient) und intrakranielle Blutung (1 Patient). Die Spitalmortalität belief sich auf 50% (7 Patienten). Alle während der PLVADImplantation reanimationsbedürftigen Patienten verstarben im Spital (n = 7, 100%), während nicht-reanimationspflichtige Patienten eine Mortalität von 17% im Langzeitverlauf aufwiesen (
Abb. 4).
Die weltweit in einem Register erfassten PLVAD-Patienten umfassen derzeit über 160 Patienten. Die mittlere PLVAD-Unterstützungsdauer belief sich auf 3,3 ± 3,6 Tage. Schwere Komplikationen bestanden in Beinischämien (4%), Dislokation der linksatrialen Einflusskanüle (3%), arterieller Gefässdissektion (2,5%), Tamponade (1%) und Infektion (1%). Die Mortalität bis zur Entfernung des PLVAD betrug 24%, während sich die Spitalmortalität auf 40% belief.
Randomisierte klinische Studien
Der klinische Nutzen einer linksventrikulären Unterstützung mittels PLVAD wird derzeit in zwei randomisierten Studien mit unterschiedlichen Patientenpopulationen untersucht. Eine randomisierte multizentrische Studie vergleicht das PLVAD mit der Standardtherapie einer intraaortalen Ballonpumpe bei 100 Patienten mit kardiogenem Schock. Endpunkte der Studie umfassen die Sicherheit und Überlebensrate 6 Wochen nach Explantation.
Eine weitere randomisierte multizentrische Studie (the TandemHeartTM in large anterior myocardial infarctions) vergleicht den Nutzen des PLVAD mit konventioneller Therapie (mit oder ohne intraaortaler Ballonpumpe) bei 40 Patienten mit ausgedehntem Vorderwandinfarkt im Hinblick auf das linksventrikuläre Remodeling. Endpunkte dieser Studie umfassen die Sicherheit des Systems sowie die Bestimmung der Infarktgrösse mittels Magnetresonanz.