Einleitung
Diagnostische und therapeutische Möglichkeiten zur Behandlung kardiovaskulärer Erkrankungen haben in den letzten Jahren deutlich zugenommen; dennoch ist die koronare Herzerkrankung (KHK) weiterhin die führende Ursache für Mortalität und Morbidität in der westlichen Welt [1].
Die optimale Nutzung therapeutischer Möglichkeiten, wie neue medikamentöse Strategien, innovative interventionelle Ansätze oder auch der Einsatz von kardialen Unterstützungssystemen bei Patienten im Endstadium einer Herzinsuffizienz, bedarf genauer und reproduzierbarer diagnostischer Werkzeuge zur klinischen Entscheidungsfindung und Therapiesteuerung. Die kardiale Magnetresonanztomographie (Herz-MRI) konnte im letzten Jahrzehnt ihre Bedeutung für die nicht-invasive Diagnostik der koronaren Herzerkrankung festigen. Sie hat als diagnostisches Tool zur nichtinvasiven Ischämiediagnostik und zum Nachweis myokardialer Viabilität bei Patienten mit Verdacht auf eine KHK und intermediärer Vortestwahrscheinlichkeit sowie bei Patienten mit bekannter KHK (Patienten mit Status nach Myokardinfarkt und residuellen Koronarstenosen) Eingang in die europäischen Guidelines gefunden (Klasse-IA-Empfehlung) [2,3]. Sie erlaubt es, eine Vielzahl von Parametern der kardiovaskulären Funktion und Morphologie zu bestimmen, so beispielsweise die Ejektionsfraktion (EF) beider Ventrikel, myokardiale Viabilität bzw. die Erfassung von Narben oder myokardialer Fibrose und den Nachweis myokardialen Ödems. Ausserdem ermöglicht sie über die Durchführung von Flussmessungen die Bestimmung des Blutflusses und somit die Beurteilung von Klappenvitien. Durch die in den letzten Jahren eingeführten Untersuchungstechniken (z.B. parallel imaging, k-t undersampling, compressed sensing) liessen sich die Untersuchungszeiten verkürzen. Ausserdem konnte die Zahl an Patienten, die aufgrund einer Klaustrophobie nicht untersuchbar waren, durch die Vergrösserung des MRI-Innendurchmessers reduziert werde n. Vor dem Hintergrund der epidemiologischen Relevanz der koronaren Herzerkrankung und der Fortschritte, die das Herz-MRI in den letzten Jahren erreicht hat, wird im Folgenden über klinische Indikationen und den Stellenwert des Herz-MRI als diagnostisches Hilfsmittel bei Patienten mit Verdacht auf Vorliegen einer KHK, ischämischer Kardiomyopathie und dem akuten Koronarsyndrom berichtet.
| Abkürzungen: |
| ACS: | acute coronary syndrome |
| ACB: | aortokoronarer Bypass |
| CAD: | coronary artery disease |
| CMR: | cardiac magnetic resonance |
| EF: | Ejektionsfraktion |
| ESC: | European Society of Cardiology |
| FDG-PET: | fluordesoxyglucose-positron emission tomography |
| KHK: | koronare Herzerkrankung |
| LGE: | late gadolinium enhancement |
| LV: | left ventricle |
| ICD: | implantierbarer Kardioverter-Defibrillator |
| ICM: | ischemic cardiomyopathy |
| CRT: | cardiac resynchronisation therapy |
| ED: | emergency department |
| MRI: | magnetic resonance imaging |
| DSMR: | Dobutaminstress-Magnetresonanztomographie |
| MACE: | major adverse cardiac events |
| MVO: | microvascular obstruction |
| MRCA: | magnetic resonance coronary angiography |
| NSTEMI: | non-ST-elevation myocardial infarction |
| PET: | positron emission tomography |
| SPECT: | single-photon-emission-computed tomography |
| STEMI: | ST-elevation myocardial infarction |
| STICH: | surgical treatment for ischemic heart failure |
Koronare Herzerkrankung
Zentraler Bestandteil der Diagnostik von Patienten mit vermuteter oder bekannter KHK insbesondere auch nach einem Myokardinfarkt sind die Bestimmung der LV-Funktion in Ruhe, der Nachweis und die Beurteilung der Ausdehnung einer myokardialen Ischämie sowie die Bestimmung myokardialer Viabilität [3].
Ischämiediagnostik
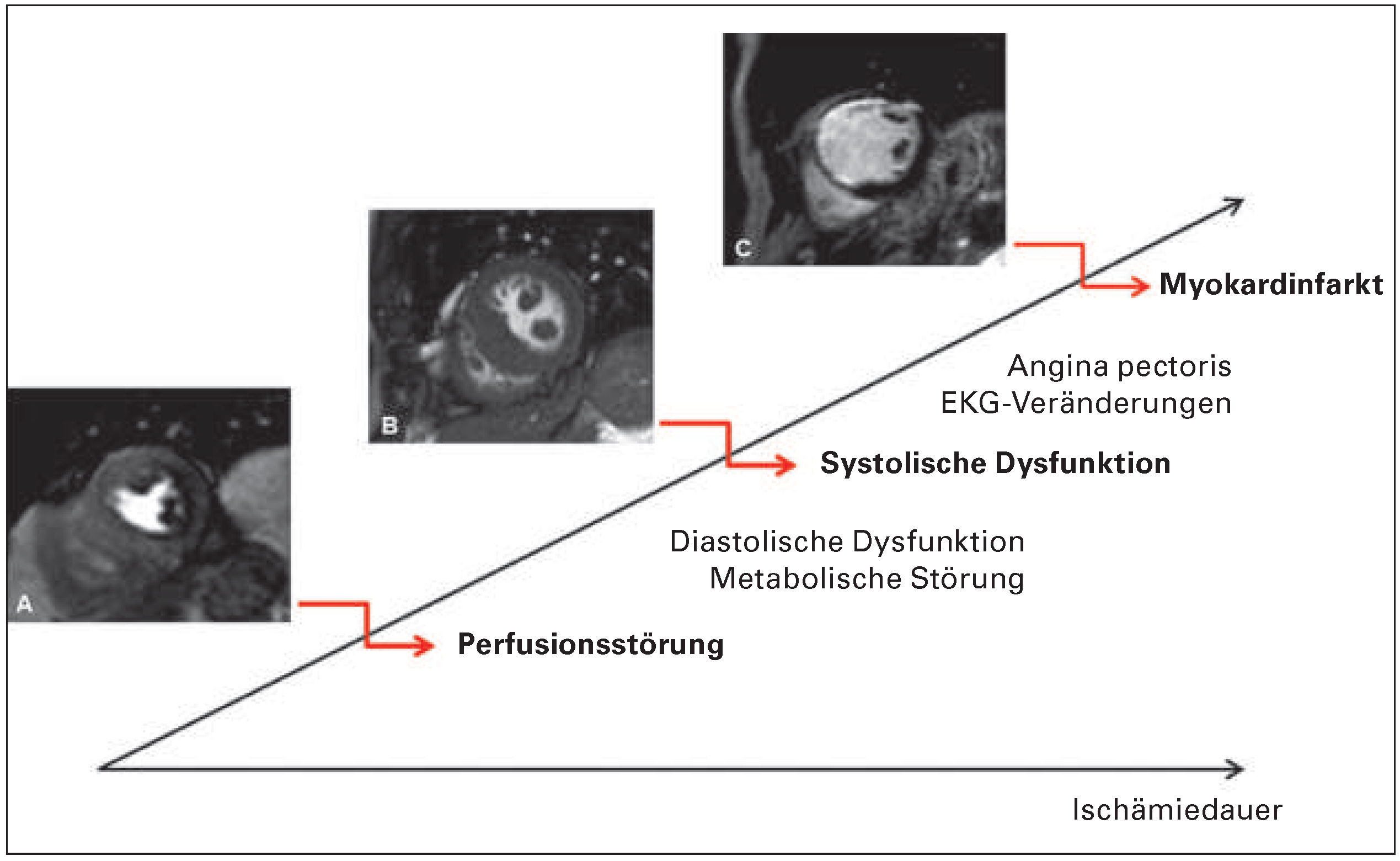
Die klinische Manifestation der Ischämiereaktion des Myokards reicht vom asymptomatischen Patienten über das Auftreten einer eingeschränkten linksventrikulären Funktion bis hin zum akuten Myokardinfarkt.
Figure 1 zeigt die Ischämiekaskade und Einsatzmöglichkeiten des Herz-MRI auf den verschiedenen Ischämiestufen.
Im klinischen Alltag kommen zwei Verfahren zur Beurteilung der myokardialen Ischämie zum Einsatz: zum einen die myokardiale Perfusionsuntersuchung während einer Hyperämie und zum anderen die Dobut amin-Stressuntersuchung (DSMR), bei der induzierbare Wandbewegungsstörungen erfasst werden. Die Ischämiediagnostik mittels Herz-MRI hat eine hohe prognostische Relevanz bei Patienten mit bekannter oder vermuteter KHK [5,6]. Die Indikation reicht vom Verdacht auf KHK [7–9] über die Risikostratifizierung und Beurteilung der funktionellen Relevanz einer Koronarstenose bei Patienten mit bekannter KHK [10–13] bis hin zur Abklärung symptomatischer Patienten nach erfolgter Koronarintervention [14,15].
Myokardiale Perfusionsuntersuchung
Die Herz-MRI-Perfusionsuntersuchung beruht auf der Darstellung der Passage eines gadoliniumhaltigen Kontrastmittels während der Hyperämiereaktion, die durch einen pharmakologischen Vasodilatator erzielt wird. Da Gadolinium ein positives Kontrastmittel ist (hell in T1-gewichteten Aufnahmen), stellt sich normal perfundiertes Myokard während der pharmakologisch induzierten Hyperämie hell in T1-gewichteten Aufnahmen dar. Myokardsegmente, die unter pharmakologischer Hyperämie nicht oder verzögert perfundiert werden, kommen dunkel zur Darstellung (
Figure 2A). Um die Anzahl falsch-positiver Befunde aufgrund von Arte fakten zu minimieren, kann eine Ruheperfusion angeschlossen werden (
Figure 2B). Die Kontrastmitteldosis beträgt zwischen 0,05 und 0,1 mmol/kg Körpergewicht. Üblicherweise kommt als Vasodilatator Adenosin zum Einsatz, das intravenös über mindestens 3 Minuten verabreicht wird. Adenosin hat eine kurze Halbwertszeit (ca. 12 Sekunden) und ist eine sichere Substanz für die klinische Verwendung [16]. Als wichtigste Kontraindikationen sind allergisches Asthma bronchiale, schwere obstruktive Lungenerkrankungen und höhergradige AV-Blockierungen zu nennen, als weitere Kontraindikationen sind Sinusknotendysfunktionen und schwere Hypo- oder Hypertonie aufzuführen. Seltene Nebenwirkungen sind Bronchospasmus und eine transiente AV-Knotenblockierung. Mittlerweile gibt es alternative Substanzen, wie den selektiven A2a-spezifischen Adenosinrezeptoragonisten Regadenoson, der in Europa verfügbar ist und ein geringeres Neben wirkungsspektrum aufweist [17,18]. Die überwiegende Anzahl klinischer Studien wurde bei Feldstärken von 1,5 Tesla durchgeführt, so dass die grösste Evidenz hierauf beruht. Neuere vergleichende Studien zur Diagnostik relevanter Koronarstenosen zeigen eine Überlegenheit der Perfusionsuntersuchung bei einer Feldstärke von 3 Tesla [19,20]. Die Aufnahmesequenz sollte T1-gewichtet und EKG-getriggert sein [21]. Die Perfusionsaufnahme dauert ca. 10 Sekunden und wird unter Atemanhalt durchgeführt, um Bewegungsartefakte möglichst gering zu halten [22]. In der Regel werden drei Schichten (basal, midventrikulär und apikal) des linken Ventrikels in axialer Orientierung aufgenommen. Neuere Verfahren erlauben mittlerweile auch die dreidimensionale (3D-)Erfassung myokardialer Perfusion und somit auch die Bestimmung des prozentualen Anteils ischämischen Myokards [15,23–25]. In der klinischen Routine wird die Perfusion visuell analysiert. Bei speziellen Fragestellungen oder wissenschaftlichen Untersuchungen kann eine quantitative, automatisierte Auswertung durchgeführt werden.
Durch Implementierung der koronaren MR-Angiographie (MRCA) in das Standard-Herz-MRI-Perfusionsprotokoll wird eine weitere Verbesserung der diagnostischen Aussagekraft erwartet [26]. Auch wenn noch nicht für die klinische Routine anwendbar, verspricht die Hybrid-Bildgebung mit der Fusion von 3D-Perfusionsuntersuchung und der koronaren MR-Angiographie oder der koronaren Low-dose-Computertomographie eine weitere Verbesserung nicht-invasiver Untersuchungstechniken bei KHK [27,28].
Im Vergleich zu anderen nicht-invasiven Methoden, wie der Myokardszintigraphie (SPECT), kommt die Herz-MRI ohne ionisierende Strahlung aus, ausserdem weist das Herz-MRI eine deutlich höhere örtliche Auflösung auf [29]. Untersuchungen an grossen Studienpopulationen zeigen eine signifikant höhere Sensitivität (86,5 vs. 66,5%) und eine leicht höhere Spezifität (83,4 vs. 82,6%) zugunsten der Herz-MRI-Perfusionsuntersuchung im Vergleich zur SPECT [21]. Dies gilt insbesondere bei Patienten mit Mehrgefässerkrankung und Frauen [30]. Der Einsatz der Herz-MRI-Perfusionsuntersuchung stellt damit eine valide Alternative zur Ischämiediagnostik bei Patienten mit KHK dar. Um gekehrt ist die SPECT-Untersuchung bei Patienten mit Klaustrophobie und/oder nicht MRI-gängigem Schrittmacher oder ICD vorzuziehen. Im Vergleich zur Stressechokardiographie ist die Herz-MRI-Perfusionsuntersuchung mit Adenosin deutlich weniger unter-sucherabhängig und auch bei echokardiographisch eingeschränkt untersuchbaren Patienten einsetzbar [31].
Dobutaminstress-Magnetresonanz tomographie (DSMR)
Die DSMR beruht – ähnlich wie die Stressechokardiographie – auf dem Nachweis von induzierbaren Wandbewegungsstörungen unter der Gabe von Dobutamin [22]. Während der kontinuierlichen Dobutamingabe wird die Wandbewegung des linken Ventrikels in den Standardebenen (4-, 2-, 3-Kammer-Blick und Kurzachsen ebene) erfasst. Die Dobutamindosis wird sukzessive gesteigert, bis die submaximale Herzfrequenz ([220–Alter] × 0,85/min) erreicht wird. Sollte diese bei maximaler Dobutamindosis nicht erreicht werden, wird zur weiteren Herzfrequenzsteigerung Atropin verabreicht. Im direkten Vergleich zur Stressechokardiographie konnte mit der DSMR eine höhere diagnostische Genauigkeit erzielt werden [32]. Im Vergleich zur Herz-MRI-Perfusionsuntersuchung mit Adenosin konn te die DSMR vergleichbare Ergebnisse für den Nachweis einer koronaren Herzerkrankung erbringen [33,34]. Insbesondere bei Patienten mit einer linksventrikulären Hypertrophie und Ruhewandbewegungsstörungen lässt sich durch eine zusätzliche durchgeführte Perfusionsaufnahme unter Dobutaminstress die Sensitivität zur Diagnostik einer KHK verbessern [13]. Für Patienten mit bestehenden Kontraindikationen für Adenosin ist die DSMR eine gute Untersuchungsalternative. Mit einer Ereignisrate von 0,1% für das Auftreten einer anhaltenden, 0,4% für das Auftreten einer nicht anhaltenden ventrikulären Tachykardie und 1,6% für das Auftreten von Vorhofflimmern ist das Sicherheitsprofil der DSMR vergleichbar mit anderen Untersuchungsverfahren, die Dobutamin oder Atropin als Stressor verwenden. Eine Monitorüberwachung und das Vorhandensein eines Defibrillators müssen daher gewährleistet sein [35]. Kontraindikationen für die Verabreichung von Dobutamin oder Atro pin sind das akute Koronarsyndrom (ACS), eine schwere Aortenklappenstenose (Klappenöffnungsfläche <1,0 cm2), schwere unkontrollierte arterielle Hy per tonie, eine hypertroph obstruktive Kardiomyopathie und eine akute Peri-/Myokarditis.
Viables Myokard und Narbengewebe
Neben dem Nachweis einer myokardialen Ischämie ist es für die Therapiesteuerung bei KHK von zentraler Bedeutung, viables Myokardgewebe zu identifizieren. Ischä misches und dysfunktionales, aber viables Myokardgewebe erholt sich nach Wiederherstellung der Perfusion, wohingegen nekrotisches Myokard und Narbengewebe von einer Reperfusion nicht profitiert. Durch Reduktion des koronaren Blutflusses und somit des myokardialen Sauerstoffangebotes kommt es in viablem Myokard zu Funktionsstörungen, die sich in der Bildgebung als Wandbewegungsstörungen darstellen. Zwei Begriffe, die in diesem Zusammenhang eine Rolle spielen, sind «Stunning» und «Hibernation».
Stunning beschreibt eine andauernde myokardiale Dysfunktion als Antwort auf eine transiente, prolongierte oder auch wiederholte Minderperfusion, die über die Zeit spontan und nach Revaskularisation reversibel ist [36,37]. Hibernation beschreibt dysfunktionales Myokard, welches durch eine chronische Minderperfusion bedingt ist und sich nach Revaskularisation prinzipiell erholen kann [38]. Um viables von nicht viablem Myokard zu unterscheiden, wird bei der Herz-MRI-Untersuchung ein sich überwiegend extrazellulär anreicherndes gadoliniumhaltiges Kontrastmittel eingesetzt. Diese Eigenschaft ist Grundlage des sogenannten
late gadolinium enhancement (LGE) (
Figure 2C) [39,40]. Via bles Myokard weist einen geringen Extrazellulärraum auf. Sind die sarkolemmalen Membranen intakt, verhindern sie die intrazelluläre Anreicherung des Kontrastmittels. Im Rahmen eines akuten Myokardinfarktes kommt es zu Membranschäden und Zelluntergang und somit zur Vergrösserung des Extrazellulärraums, was die Einlagerung gadoliniumhaltigen Kontrastmittels ermöglicht [41]. Im chronischen Stadium wird nekrotisches Myokardgewebe durch Narbengewebe ersetzt, das einen vergrösserten Extrazellulärraum im Vergleich zu Myokardgewebe aufweist. 10 bis 20 Minuten nach Kontrastmittelgabe wird die Anreicherung in T1-gewichteten inversion-recovery-Gradientenecho-Sequenzen aufgenommen, die als Hyperenhancement zur Darstellung kommt [42]. Die Zeit zwischen der Präparation des Inversionspulses und der Aufnahme wird so gewählt, dass ein optimaler Kontrast von viablem Myokard zu Bereichen mit LGE erzielt wird (
Figure 3). Die Aufnahmen werden in Standardorientierungen (4-, 2-, 3-Kammer-Blick und Kurzachsenebene) vorgenommen. Neuere Verfahren, wie das 3D-LGE, ermöglichen eine Quantifizierung und Bestimmung der Trans muralität des Narbengewebes [43], die invers mit dem Potential zur Erholung nach Revaskularisation zusammenhängt, was für die Planung koronarer Eingriffe bedeutsam ist [44]. Durch die hohe räumliche Auflösung lassen sich auch Mikroinfarkte, subendokardiale Infarktnarben oder Infarktnarben des rechtsventrikulären Myokards darstellen (
Figure 3B,C) [45]. Hierin liegt der Vorteil zu anderen Verfahren, wie der Positronen-Emissions-Tomographie (PET) oder SPECT [46,47]. Die Bedeutung des Nachweises von viablem Myokardgewebe vor einer Revaskularisierung ist durch die Ergebnisse des STICH(surgical treatment for ischemic heart failure)-Trials in Frage gestellt worden. Hier wurde festgestellt, dass der Nachweis von viablem Myokard nicht dazu beigetragen hat, Patienten, die von einer ACB(aortokoronarer Bypass)-Operation profitieren würden, zu identifizieren [48]. Zur Bestimmung der Viabilität wurden hier Dobutamin-Stressecho, myokardiale Perfusion mittels SPECT oder beide Methoden eingesetzt. Es wurde viel Kritik am STICH-Trial geäussert, da der Einsatz neuerer Verfahren, wie das Herz-MRI oder FDG-PET (fluordesoxyglucose-positron emission tomography) wahrscheinlich zu einem besseren Outcome der Studie geführt hätte [49]. Das Standarduntersuchungsprotokoll für einen KHK-Patienten mit der Frage nach Erholung von Myokardgewebe nach Revaskularisation sollte deshalb die Kombination aus Ischämieuntersuchung und Viabilitätsuntersuchung vorsehen.
Ischämische Kardiomyopathie
Patienten mit einer ischämischen Kardiomyopathie haben bei Nachweis einer bestehenden Myokardischämie ein erhöhtes Risiko für zukünftige kardiovaskuläre Ereignisse. Eine Risikostratifizierung auf der Grundlage einer Ischämie- und Viabilitätsdiagnostik ist, gerade vor dem Hintergrund, dass eine unauffällige Untersuchung eine hohe Wahrscheinlichkeit für die Freiheit von kardiovaskulären Ereignissen für die nächsten 3 Jahre voraussagt (hoher negativ prädiktiver Wert), für die Therapiesteuerung entscheidend [7]. Aus serdem zeigen Patienten mit linksventrikulärer Dysfunktion bei ischämischer Kardiomyopathie ein besseres Outcome nach Revaskularisation im Vergleich zu medikamentöser Therapie alleine, wenn vorgängig viables Myokard nachgewiesen wurde [50].
Devicetherapie
Auch auf dem Gebiet der Devicetherapie hilft das Herz-MRI bei der Entscheidungsfindung. Aktuelle Behandlungsrichtlinien empfehlen die Implantation eines primärprophylaktischen ICD bei Patienten nach Herzinfarkt mit einer EF <35% und einem NYHA-Stadium II–III [51]. Aufgrund der hohen Genauigkeit und Reproduzierbarkeit ist das Herz-MRI der Goldstandard für die Bestimmung der links- und rechtsventrikulären Volumina bzw. Ejektionsfraktion [51,52]. Moderne Tagging verfahren bieten die Möglichkeit, regionale bzw. globale Dyssynchronie bei herzinsuffizienten Patien ten z.B. nach Herzinfarkt oder Linksschenkelblock zu bestimmen [53,54]. In Zukunft wäre es vielleich t möglich, diese Informationen aus Dyssynchronie und dem Nachweis myokardialer Viabilität für die Indikation zur Resynchronisationstherapie mittels CRT (cardiac resynchronisation therapy) zu nutzen [55]. Zusätzlich könnte die Information über das Vorhandensein und die Verteilung myokardialer Narben eine Orientierungshilfe bei der Platzierung von Schrittmacherelektroden darstellen, da die Schrittmacherstimulation myokardialer Narben mit einer schlechteren Prognose assoziiert ist [56,57].
Kardiale Thromben
Eine Komplikation, die wesentlich zu Mortalität und Morbidität herzinsuffizienter Patienten beiträgt, ist das Auftreten eines Ventrikelthrombus (
Figure 4). Sowohl bei Patienten mit ischämischer Kardiomyopathie als auch bei Patienten nach akutem Myokardinfarkt können linksventrikuläre Thromben auftreten. Das Herz-MRI zeigt die höchste Sensitivität und Spezifität zur Detektion von Ventrikelthromben verglichen mit der transösophagealen bzw. transthorakalen Echokardiographie und auch der kontrastmittelverstärkten Echokardiographie [58,59].
Kardiomyopathien
Für die differentialdiagnostische Abklärung einer chronischen Herzinsuffizienz und hier insbesondere zur Abklärung nicht ischämischer Ursachen trägt die Herz-MRI entscheidend bei. Als charakteristisch stellt sich das Verteilungsmuster des LGE für verschiedene Entitäten der Kardiomyopathien dar. Bei der dilatativen Kardiomyopathie lässt sich ein eher midmyokardiales LGE des Septums [60] nachweisen, für dessen Quantifizierung eine prognostische Relevanz gezeigt werden konnte [61]. Bei der Myokarditis hingegen stellt sich das LGE subepikardial dar und ist eher im Bereich der inferioren oder lateralen LV-Wand zu finden [62] (
Figure 5B). In diesen Fällen kann mittels T2-gewichteter Aufnahmen ein vorliegendes myokardiales Ödem dargestellt werden [63]. Das LGE bei der kardialen Amyloidose zeigt eine globale transmurale oder auch subendokardial betonte Verteilung (
Figure 5C). Eine mögliche myokardiale Eisenüberladung bei Patienten mit einer Thalassämie kann anhand von T2*-Aufnahmen bestimmt werden und ist ausserdem ein bedeutsamer Parameter für die Therapiesteuerung [22,64].
Akutes Koronarsyndrom
Aufgrund ihrer flexiblen Einsetzbarkeit und hohen Verfügbarkeit hat die Echokardiographie einen festen Platz in der Diagnostik von akuten kardiovaskulären Ereignissen wie dem akuten Koronarsyndrom (ACS). Das Herz-MRI oder nuklearmedizinische Bildgebung sind dagegen – vor allem aus logistischen Gründen – noch nicht in die Routinediagnostik bei ACS implementiert. Beim ST-Streckenhebungsinfarkt (STEMI) bedarf es keiner ausgedehnten Bildgebung; hier ist vielmehr der möglichst rasche Zugang zum Herzkatheterlabor entscheidend. Beim Nicht-ST-Streckenhebungsinfarkt (NSTEMI) könnte die Herz-MRI wichtige Informationen zur Planung einer perkutanen Intervention bzw. einer ACB-Operation liefern und wird deshalb auch in den ESC-Richtlinien zur Behandlung von Patienten mit NSTE-ACS aufgeführt [65]. Das Herz-MRI zeigt eine hohe Sensitivität (100%) und hohe Spezifität (85%) für den Nachweis eines NSTEMI bei Patienten, die sich mit Thoraxschmerzen in einer Notaufnahme vorstellen [39]. Ausserdem konnte für das Herz-MRI eine höhere Sensitivität, als durch klinische
Parameter, wie TIMI-Riskscore, initiales Troponin-I, peak Troponin-I und EKG-Veränderungen, zur Dia gnostik eines NSTEMI erreicht werden. Der wichtigste Parameter der kardialen MRI ist dabei, neben dem LGE und der myokardialen Perfusion, der Nachweis von Wandbewegungsstörungen. Zusätzliche Aufnahmetechniken, wie T2-gewichtete Aufnahmen zur Darstellung eines myokardialen Ödems, steigern die diagnostische Aussagekraft weiter und erlauben, akute von chronischen Geschehen zu unterscheiden [66].
Die Verfügbarkeit und die Untersuchungszeit des Herz-MRI ist im Moment noch nicht zu vergleichen mit dem kurzen Zeitbedarf der Computertomographie (CT); zusätzlich bietet die MRI-Untersuchung jedoch die Möglichkeit, andere Differentialdiagnosen, wie Tako-Tsubo-Kardiomyopathie oder Myokarditis zu verifizieren [67, 68]. Voraussetzung für den Einsatz des Herz-MRI zur Notfalldiagnostik ist allerdings eine örtliche Nähe und eine 24-Stunden-Verfügbarkeit geschulten Personals, eine Voraussetzung, die nur an wenigen Institutionen gegeben ist.
Durch den Verschluss eines Koronargefässes und der daraus resultierenden Sauerstoffunterversorgung des Myokards kommt es zu einem myokardialen Zellschaden, der unterschiedlich zur Darstellung kommt. Im Einzelnen kann Periinfarktzone, mikrovaskuläre Obstruktion (MVO) oder intramyokardiale Hämorrhagie (IMH) auftreten. Diese Entitäten haben unterschiedliche prognostische Bedeutung. Die Periinfarktzone wird als Substrat für potentiell lebensbedrohliche rhythmogene Ereignisse verantwortlich gemacht. Im LGE stellt sie sich mit intermediärer Intensität um das zentrale, infarzierte Gewebe dar. Die Grösse der Periinfarktzone ist ein unabhängiger Prädiktor für Mortalität nach Myokardinfarkt [69].
Nach erfolgreicher Revaskularisation kann es durch Auftreten eines Ödems (
Figure 6A) und dadurch bedingte Kompression der Kapillaren, Aktivierung von Neutrophilen und Thrombozyten im Infarktgewebe, Mikroembolisation von atherosklerostischem Material nach Koronarintervention und Nekrose von Kapillaren zur Ausbildung von MVO kommen [70]. Die MVO stellt sich in den LGE-Aufnahmen als dunkles Areal im Zentrum eines Infarktes umgeben von deutlich helleren Arealen dar (
Figure 6B) und ist ein starker Prädiktor für ungünstiges myokardiales Remodelling, das Ausbilden einer eingeschränkten LV-Funktion und den kombinierten Endpunkt aus Tod, nicht tödlichem Reinfarkt und Herzinsuffizienz [71,72].
Wenn prolongierte Ischämie zum Verlust der kapillaren Endothelzellintegrität führt, kann nach Reperfusion durch Extravasation von Erythrozyten eine IMH auftreten. Diese stellt sich in T2-gewichteten Aufnahmen als hypointense Areale im infarzierten Myokardgewebe dar. Auch diese Entität ist mit einer eingeschränkten linksventrikulären Funktion und einer erhöhten Rate an major adverse cardiovascular events (MACE) nach einem Myokardinfarkt assoziiert [73]. Prinzipiell reversibel ist das ischämiebedingte myokardiale Ödem, das sich in T2-gewichteten Aufnahmen hyperintens darstellt. Legt man diese, in den T2- gewich te ten Aufnahmen, hyperintensen Areale zugrun de, kann durch Subtraktion der irreversibel ge schädigten Areale (hyperintense Areale in den LGEAufnahmen) der Anteil myokardialen Gewebes bestimmt werden, der sich nach einem Infarkt erholen kann. Die Grösse dieses Parameters korreliert invers mit der Zeit, die bis zur Reperfusion benötigt wurde, und ist ein starker Prädiktor für die Prognose nach akutem Myokardinfarkt [74].
Sicherheitsaspekte des Herz-MRI
Das Herz-MRI bietet aufgrund der Vielfältigkeit der bestimmbaren Parameter eine breite Einsatzmöglichkeit bei Patienten mit einer KHK. Da keine ionisierende Strahlung zur Anwendung kommt, sind kurzfristige Befundkontrollen und repetitive Untersuchungen möglich. In den letzten Jahren sind MRI-taugliche Herzschrittmacher und ICDs entwickelt worden, so dass diese Patienten dem Herz-MRI zugänglich bleiben, wobei die Herstellerinformationen zur MRI-Tauglichkeit und empfohlene Geräte- bzw. Untersuchungseinstellungen stets beachtet werden müssen. Hüft- oder Knieimplantate, Koronarstents oder implantierte Herzklappen stellen in der Regel keine Kontraindikation für das Herz-MRI bei 1,5 Tesla oder niedri ger dar. Zusätzlich gibt es zunehmend mehr und einfach erhältliche Herstellerinformationen bezüglich solcher passiver Implantate [75,76].
Vorhofflimmern stellt keine Kontraindikation für die Untersuchung dar, auch wenn mit einer eingeschränkten Bildqualität bei Tachyarrhythmie und hoher Herzfrequenzvariabilität gerechnet werden muss. Die Vergrösserung des Röhreninnendurchmessers und die Anwendung von Midazolam als Nasenspray hat die Anzahl der Patienten, die aufgrund einer Klaustrophobie die Untersuchung ablehnen, reduziert [77]. Lineare Gadolinium-haltige Kontrastmittel sind kontraindiziert bei Patienten mit einer glomerulären Filtrationsrate <30 ml/min/m2. Neue aktuell verwendete makrozyklische Gadolinium-haltige Kontrastmittel haben ein besseres Sicherheitsprofil und können bei Patienten mit fortgeschrittener Niereninsuffizienz unter Berücksichtigung einer reduzierten Gesamtdosis verwendet werden.
Kosteneffektivität
Gerade neue diagnostische Verfahren mit einer hohen technischen Komplexität und hohen Unterhaltskosten wie das Herz-MRI werden neben dem Nachweis ihrer Validität von Sicherheitsaspekten und ihrer diagnostischen und therapeutischen Relevanz auch auf ihre Kosteneffektivität geprüft.
Untersuchungen hierzu konnten für das schweizerische, deutsche und britische Gesundheitssystem zeigen, dass die primäre Durchführung einer Herz-MRI mit Ischä mienachweis bei Vorhandensein von viablem Myokard und anschliessender wohlbegründeter Koronarangiographie zu einer Kostenreduktion von 23– 50% im Falle einer ambulanten Koronarangiographie und von 46–50% im Falle einer stationären Koronarangiographie führt [78].
Ausblick
Verbesserte Aufnahmetechniken werden in Zukunft eine noch genauere Beurteilung des Myokards zulassen. Quantitative T1- und T2-Aufnahmeverfahren werden eine Bestimmung der lokalen T1- und T2-Werte und damit die Kartierung des Myokards ermöglichen und z.B. das Ausmass eines myokardialen Ödems nach einem Myokardinfarkt genauer bestimmen lassen [79,80]. Mit Hilfe von Kontrastmittel können Prä- und Post -Kontrastmittel-T1-Werte bestimmt werden, die eine Aussage über das extrazelluläre Volumen zulassen und in Bezug auf Mortalität und weitere Endpunkte der ischämischen Kardiomyopathie prognostische Relevanz haben [81,82].
Weitere Verfahren und Techniken befassen sich mit der Verwendung von endogenen anstelle von gadoliniumhaltigen Kontrastmitteln. Die Blood-Oxygen-Level- Dependent(BOLD)-MRI stellt den Sauerstoffgehalt des Myokards dar und kann so eine belastungsinduzierte myokardiale Ischämie nachweisen [83,84]. Diese Verfahren sind im klinischen Setting bereits untersucht worden. Ein Verfahren, das gerade Eingang in klinische Studien findet, ist das Hyperpolarisations-MRI, welches die Untersuchung von metabolischen Prozessen bei Herzerkrankungen ermöglicht [85,86].
Schlussfolgerung
Im letzten Jahrzehnt hat das Herz-MRI grosse Fortschritte gemacht und ist zur führenden Methode bei der Beurteilung von LV-Funktion, myokardialer Viabilität und myokardialer Ischämie bei Patienten mit KHK gereift, ohne dass ionisierende Strahlung zum
Einsatz kommt. Aufgrund der hohen Genauigkeit und Reproduzierbarkeit hat das Herz-MRI einen festen Stellenwert im klinischen Alltag und trägt relevant zur Steuerung und Entscheidungsfindung sowohl interventioneller als auch medikamentöser Therapiekonzepte bei.
Disclosure statement
Die Autoren erhielten Forschungsgrants von Bayer Health Care, Züri ch, Schweiz. Teile der berichteten Ergebnisse der Autoren wurden durch die Stiftung für Herz- und Kreislaufforschung – Zurich Heart House, Zürich, unterstützt.