Sicherheit der TEE
Basierend auf einem Referat an der SGK/SGHC-Jahrestagung 2014 in Interlaken
Seit der Einführung der transösophagealen Echokardiographie (TEE) zu Beginn der 1980er Jahre hat sich diese Untersuchungsmodalität weit verbreitet und in der allgemeinen Routine etabliert. Sie dient einerseits der intraoperativen Monitorisierung, speziell im Rahmen von kardiovaskulären oder transplantationschirurgischen Eingriffen, andererseits der Diagnostik von kardiovaskulären Erkrankungen im nicht-chirurgischen oder ambulanten Setting.
Die TEE gilt als vergleichsweise sichere Methode. Ernsthafte, zum Teil lebensbedrohliche Zwischenfälle kommen nur sehr selten vor. Deren Inzidenz wird im ambulanten Setting mit 0,2% bis 0,5% angegeben, die Mortalität wird auf <0,01% geschätzt [
1]. Die rapportierten Zahlen für die intraoperative TEE liegen geringfügig höher.
Im Wesentlichen handelt es sich um mechanische Verletzungen. Sie entstehen durch traumatisches Einführen des Instrumentes (oft begünstigt durch atypische anatomische Gegebenheiten) oder als Folge von Manipulationen mit der Instrumentenspitze im Laufe der Untersuchung. Fraglich bleibt, ob eine Druckschädigung der gastrointestinalen Mukosa durch eine lange intraoperative Liegedauer des Instrumentes ebenfalls eine pathogenetische Rolle spielt [
2]. Über die Hälfte der Komplikationen manifestieren sich klinisch erst mit einer Verzögerung von mehr als 24 Stunden, was bei der postoperativen Überwachung und bei der Komplikationenerfassung berücksichtigt werden muss [
1,
3].
Mehrere anatomische Lokalisationen, von der Mundhöhle bis in den Magen, können von traumatischer Einwirkung betroffen sein; seltener sind extraluminale Verletzungen (insbesondere der Milz) beschrieben worden [
4]. Dementsprechend sind unterschiedliche Fachgebiete ins Management von TEE-Komplikationen involviert, vorrangig aber die Gastroenterologie und Viszeralchirurgie.
Zu den gefürchtetsten Komplikationen zählt die Ösophagusperforation. Deren Inzidenz im intraoperativen Setting wird mit bis zu 0,3% etwas höher angegeben als bei der diagnostischen TEE (<0,01%) [
5].
Es liegt auf der Hand, dass gewisse gastrointestinale Pathologien das Risiko für TEE-Komplikationen erhöhen. Dies wird in einschlägigen Guidelines berücksichtigt, indem Kontraindikationen gegen die TEE formuliert wurden [
5]. Im Folgenden sollen einige der involvierten Diagnosen bezüglich ihres TEE-Gefahrenpotentials kommentiert werden.
Absolute Kontraindikationen gegen die TEE
Die Liste der absoluten Kontraindikationen (Tab. 1) ist grundsätzlich selbsterklärend. Ebenso klar sind die praktischen Konsequenzen einer absoluten Kontraindikation, das heisst eine TEE verbietet sich grundsätzlich. Die betreffenden Pathologien und Diagnosen lassen sich in aller Regel ohne grosse Schwierigkeiten aus der Krankengeschichte des Patienten herauslesen oder anamnestisch erfragen. Es gehört zur Sorgfaltspflicht, nach solchen «Red Flags» vor jeder TEE eingehend zu fahnden. Einige Krankheitsbilder seien im Folgenden kurz kommentiert.
Ösophagusstenose
Die häufigste strikturierende Pathologie ist die
peptische Stenose als Folge einer gastroösophagealen Refluxkrankheit [
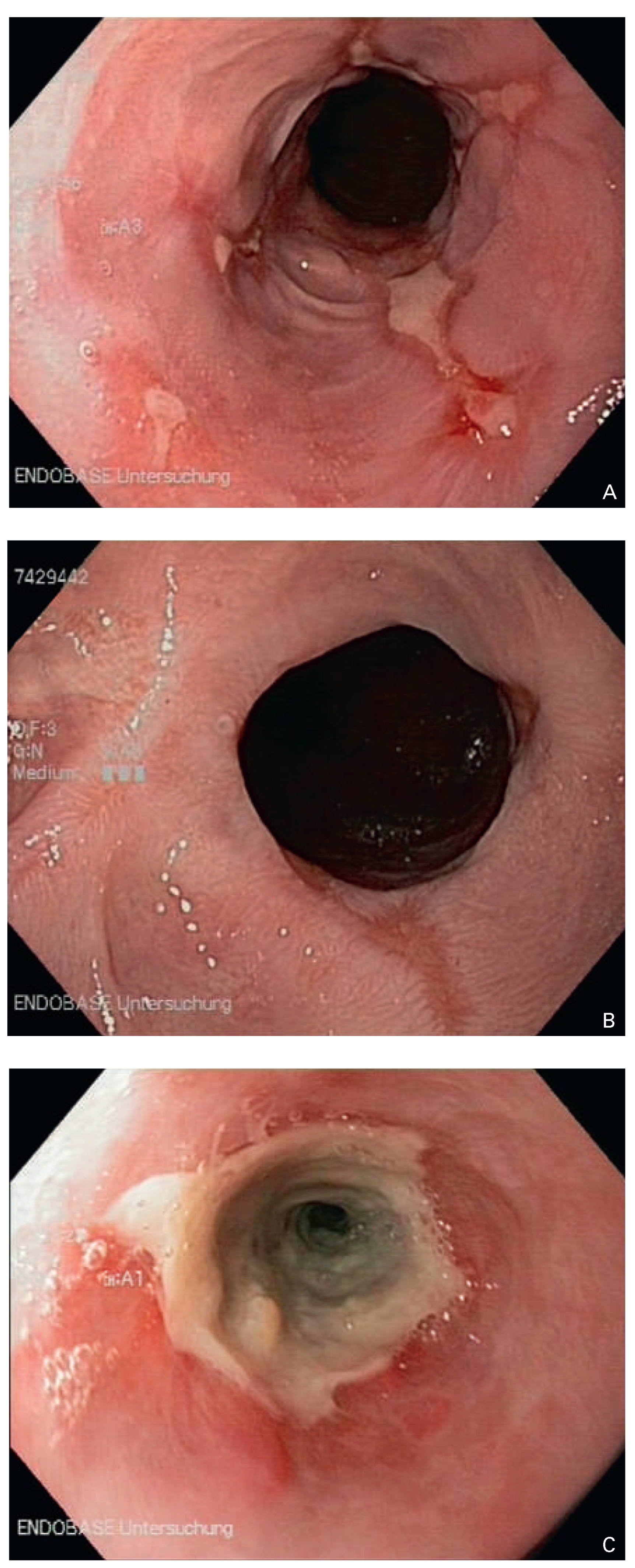
6]. Saurer Reflux in hochgradig pathologischem Ausmass führt zu Ulzerationen am gastroösophagealen Übergang. Die chronische, bisweilen zirkulär ulzerierende Refluxösophagitis, aber auch der Abheilungsprozess derselben unter säuresekretionshemmender medikamentöser Therapie, kann zu sanduhrförmigen Lumeneinengungen führen (Abb. 1A–C). Nicht selten resultiert eine höhergradige narbige Stenose, die mit dem TEE-Instrument – und desgleichen mit dem Gastroskop – nicht mehr passierbar ist. Klassischerweise deutet ein charakteristischer Symptomwandel auf eine solche Krankheitsprogression hin, was dem aufmerksamen Arzt nicht entgehen sollte. Die vormals quälenden, meist langjährigen Refluxsymptome (saures Aufstossen, Magen-/Sodbrennen) verschwinden und gehen über in eine Dysphagie (Schwierigkeiten beim Schlucken, Steckenbleiben und Hochwürgen von Nahrung). Als effiziente Behandlungsmethode steht die endoskopischen Bougierung zur Verfügung, parallel zur medikamentösen säurehemmenden Therapie (gefolgt von einer Dauerrezidivprophylaxe) mit einem Protonenpumpeninhibitor.
Ösophagusneoplasie
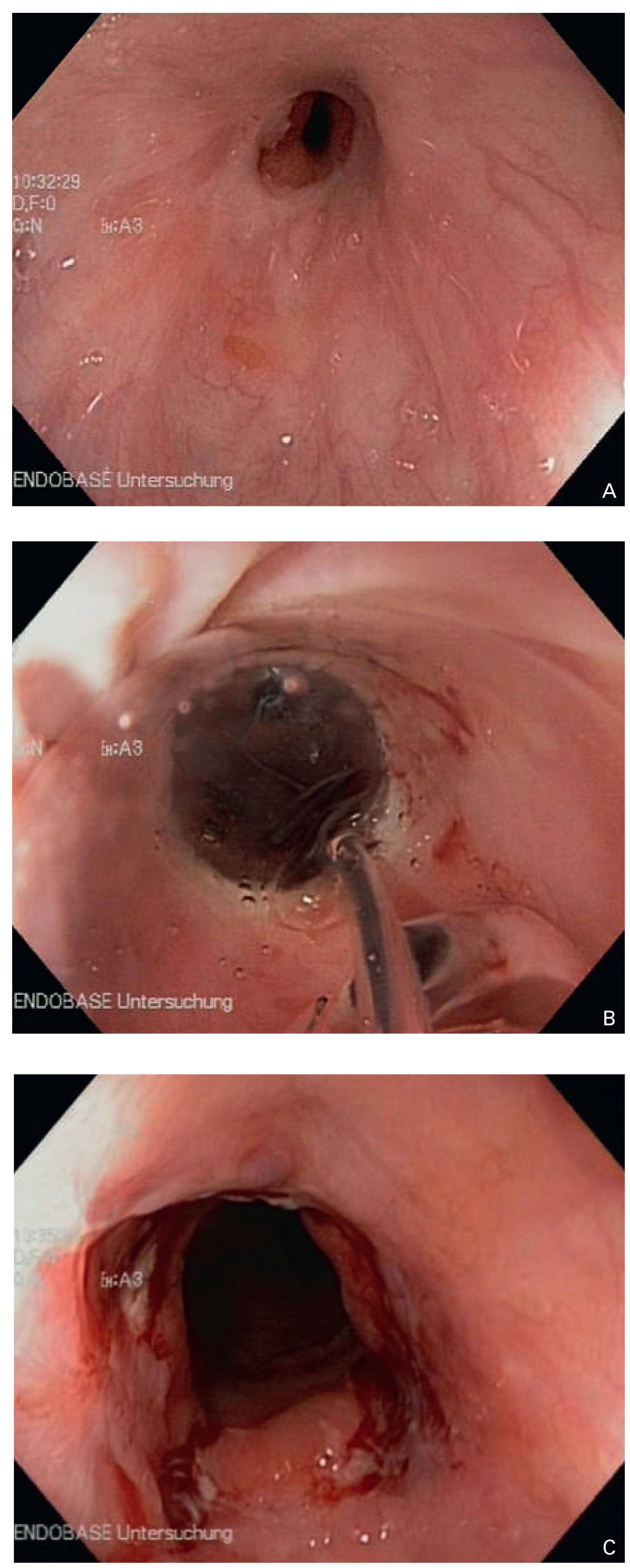
Die Inzidenz der ösophagealen Tumoren, insbesondere des Adenokarzinoms des distalen Ösophagus, ist im Zunehmen begriffen. Unbehandelt bewirken diese Neoplasien rasch eine Einengung des ösophagealen Lumens, welche für das Leitsymptom der Dysphagie verantwortlich ist. Dementsprechend ist die Passage des TEE-Gerätes of stark erschwert bis verunmöglicht, was das Perforationsrisiko erhöht. Auch nach Behandlung der Neoplasie bleibt ein Risiko bestehen. Die chirurgische Resektion geht mit einer tiefgreifenden Alteration der Anatomie einher. Zudem ist sie mit dem Risiko einer Anastomosenstenose behaftet, welche klinisch bisweilen unterschätzt wird, weil die Betroffenen von ihrem präoperativen Zustand her an ein gewisses Ausmass an Dysphagie gewöhnt sind. Therapeutisch können solche Stenosen mit endoskopischer Ballondilatation angegangen werden (Abb. 2A–C). Nach kurativ intendierter oder palliativer Radiotherapie steht das Risiko einer Strahlenösophagitis (vgl. unten), mit oder ohne Stenosierung, einer TEE entgegen. Ein häufiger palliativer Therapieansatz ist die Ösophagusstent-Einlage. Damit kann zwar die Tumorstenose effektiv überbrückt und die Dysphagie weitgehend behoben werden; dennoch wäre eine TEE – so es in diesem Kontext überhaupt sinnvolle Indikationen gibt – wegen der manipulationsbedingten Stent-Dislokationsgefahr kontraindiziert.
Abbildung 1.
Ösophagoskopische Befunde bei gastroösophagealer Refluxkrankheit. (A) Ulzerierende Re-fluxösophagitis, (B) mässiggradige peptische Stenose, (C) zirkulär ulzerierende Refluxösophagitis mit höhergradiger Stenose.
Abbildung 1.
Ösophagoskopische Befunde bei gastroösophagealer Refluxkrankheit. (A) Ulzerierende Re-fluxösophagitis, (B) mässiggradige peptische Stenose, (C) zirkulär ulzerierende Refluxösophagitis mit höhergradiger Stenose.
Abbildung 2.
Ösophagoskopischer Befund bei Anastomosenstenose nach Ösophagusteilresektion. (A) Ösophagogastrische Anastomose, (B) endoskopische Ballondilatation, (C) Resultat nach Ballondilatation
Abbildung 2.
Ösophagoskopischer Befund bei Anastomosenstenose nach Ösophagusteilresektion. (A) Ösophagogastrische Anastomose, (B) endoskopische Ballondilatation, (C) Resultat nach Ballondilatation
Zenker-Divertikel
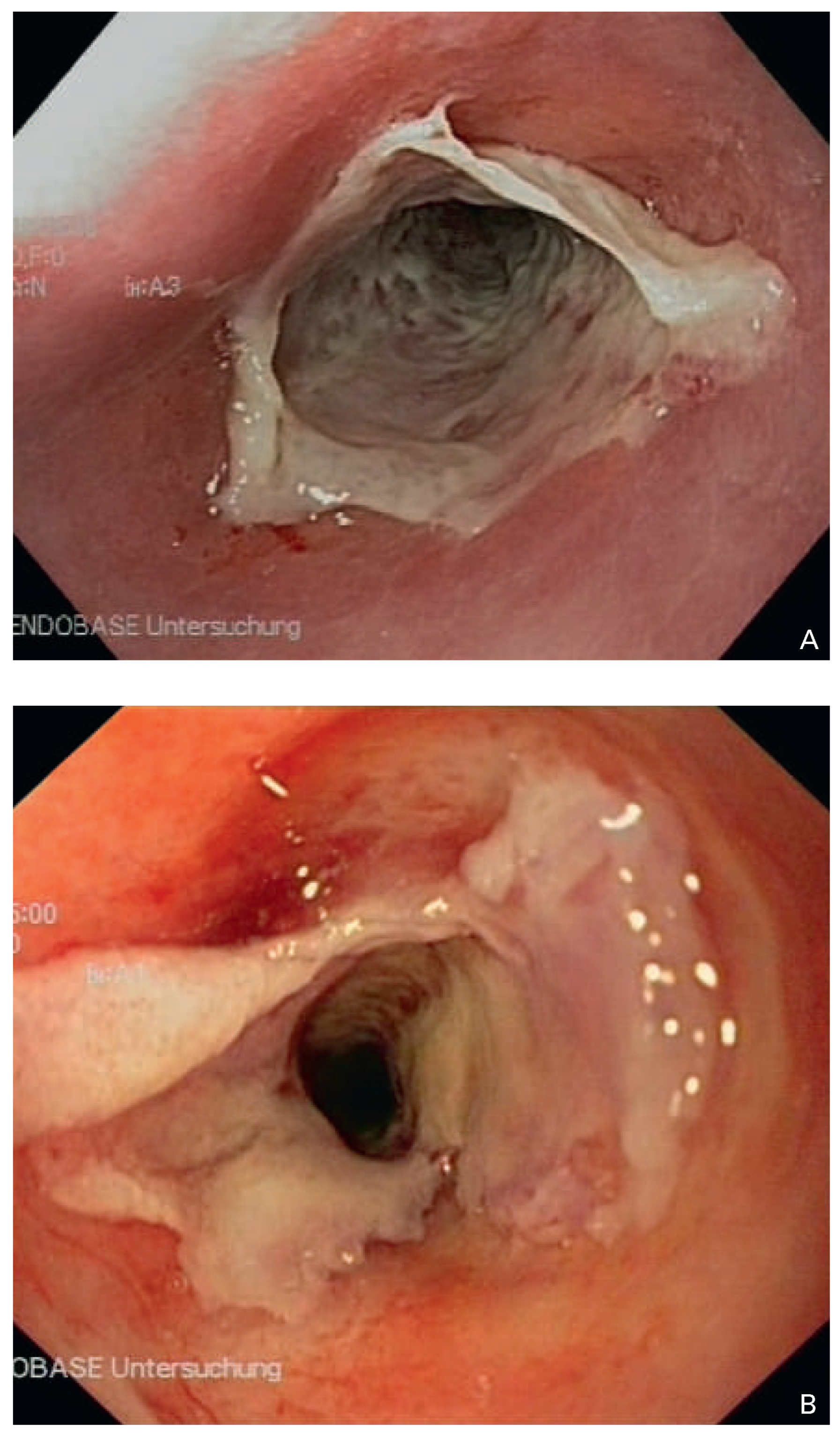
Unter dem Zenker-Divertikel versteht man eine pharyngoösophageale Aussackung der Schleimhaut durch eine Muskellücke unmittelbar über dem oberen Ösophagussphinkter [
7]. Diese Entität ist zwar selten, bedeutet aber eine notorische Fallgrube, notabene nicht nur für den Kardiologen, sondern auch für den Gastroenterologen. Das Divertikel liegt ungünstigerweise in der Achse der Intubation, während das wahre Ösophaguslumen komprimiert durch den oberen Sphinkter exzentrisch abgeht (Abb. 3). Eine Intubation des Ösophagus ist nur unter Sicht möglich und erfordert selbst dann noch besondere Sorgfalt und Geschick. Auch nach Divertikel-Operation verbleibt manchmal ein asymptomatisches Residuum, so dass auch bei behandeltem Zenker-Divertikel grosse Vorsicht geboten ist.
Abbildung 3.
ZenkerDivertikel (Abgang des Ösophaguslumens mit Pfeil markiert).
Abbildung 3.
ZenkerDivertikel (Abgang des Ösophaguslumens mit Pfeil markiert).
Relative Kontraindikationen gegen die TEE
Im Falle von relativen Kontraindikationen (Diagnosen: vgl. Tab. 2) bleibt für das praktische Vorgehen ein Ermessensspielraum offen. Es gilt, im individuellen Fall den Nutzen der TEE gegen potentielle gastrointestinale Risiken abzuwägen. Die Liste umfasst eine heterogene Gruppe mit sehr unterschiedlichem Risikopotential. Beispielsweise stellt ein Barrett-Ösophagus per se, d.h. ohne begleitende peptische Stenose oder anderweitige Komplikationen, kaum eine nennenswerte Risikoerhöhung dar, während ein Zustand nach Bestrahlung grundsätzlich als Hochrisikosituation einzustufen ist. Praktisch alle aufgeführten Entitäten umfassen aber ein Spektrum von Schweregraden und pathologischen Manifestationen, so dass in jedem Fall eine differenzierte Betrachtung angebracht ist.
Konkret bedeutet dies, dass in der Regel eine gastroenterologische Beurteilung vor einer TEE eingeholt werden sollte, sobald eine relative Kontraindikation erkannt wird. Je nach klinischer Einschätzung empfiehlt der gastroenterologische Konsiliarius eine Vorabklärung vor TEE, meist eine Ösophago-Gastro-Duodenoskopie und/oder eine Ösophaguspassage. In speziellen Situationen gibt es die Option, dass der Gastroenterologe dem Kardiologen bei der TEE eine optische Orientierungshilfe mittels parallel eingeführten, dünnkalibrigen Gastroskopes bietet oder vor TEE gastroskopisch eine Overtube platziert, durch welche das TEE-Gerät problemlos eingeführt werden kann [
8].
Im Folgenden sollen einige der als relative Kontraindikationen eingestuften Krankheitsbilder kommentiert werden.
Tabelle 1.
Absolute Kontraindikationen gegen die TEE (nach [
5]).
Tabelle 1.
Absolute Kontraindikationen gegen die TEE (nach [
5]).
| Gastrointestinale Perforation |
| Ösophagusstenose |
| Ösophagusneoplasie |
| Ösophageale Perforation oder Lazeration |
| Ösophagusdivertikel |
| Aktive obere Gastrointestinaltrakt-Blutung |
Tabelle 2.
Relative Kontraindikationen gegen die TEE (nach Hahn).
Tabelle 2.
Relative Kontraindikationen gegen die TEE (nach Hahn).
| Status nach Bestrahlung (HNO-Bereich, Ösophagus, Mediastinum) |
| Status nach chirurgischen Eingriffen im oberen Gastrointestinaltrakt |
| Kürzliche obere Gastrointestinalblutung |
| Barrett-Ösophagus |
| Dysphagieanamnese |
| Einschränkung der HWS-Beweglichkeit |
| Symptomatische Hiatushernie |
| Ösophagusvarizen |
| Koagulopathie |
| Floride Ösophagitis |
| Floride peptische Ulkuskrankheit |
Zustand nach chirurgischem Eingriff im oberen Gastrointestinaltrakt
Diese Erwägung betrifft in erster Linie Resektionen an Ösophagus und Magen. Sie gehen wesensgemäss mit einer Veränderung der Anatomie einher, welche den Untersuchungsablauf der TEE und deren Aussagekraft beeinflusst, eventuell beeinträchtigen kann. Es liegt im Interesse des Kardiologen, sich über die genauen Verhältnisse – nötigenfalls anhand des Operationsberichts – ein Bild zu machen.
Von zunehmender Aktualität sind
bariatrische Operationen. In der Schweiz werden gegenwärtig rund 4000 Eingriffe pro Jahr durchgeführt, Tendenz steigend [
9]. Die Population der Operierten ist vergleichsweise jung. Somit wird sich mittel- und längerfristig ein zahlenmässig erhebliches Kollektiv an bariatrisch Operierten akkumulieren. Mehrere Operationsverfahren kommen zur Anwendung. Diese sind in einschlägigen Übersichten didaktisch aussagekräftig dargestellt [
10]. Bei allen bleibt der Ösophagus intakt, d.h. die post-chirurgische anatomische Alteration beginnt knapp distal des ösophagogastrischen Übergangs. Somit gibt es für ösophageale Positionen des TEE-Gerätes keine Einschränkungen. Die Untersuchung muss in der Regel auf die ösophagealen Positionen beschränkt bleiben. Die Sicherheit kann möglicherweise erhöht werden, wenn die Höhedes ösophagogastrischen Übergangs (in cm ab Zahnreihe) vorgängig endoskopisch eruiert und eventuelle Stenosen im Operationsgebiet feststellt werden.
Floride Ösophagitis
Das Leitsymptom der akuten, floriden Ösophagitis sind massive retrosternale Schmerzen beim Schlucken (Odynophagie) – oft patientenseitig unscharf als Schluckbeschwerden rapportiert und vom Arzt als Dysphagie fehlklassiert. Die Schmerzen können pektanginösen Charakter annehmen. Die ätiologische Differentialdiagnose umfasst in erster Linie Infekte (Soor, Herpes simplex, Zytomegalie, HIV), ferner die Strahlenösophagitis (vgl. unten). Die infektiöse Ösophagitis wird endoskopisch-bioptisch diagnostiziert. Sie nimmt bei viraler Genese in der Mehrzahl der Fälle einen selbstlimitierten Verlauf, andernfalls ist eine entsprechende antiinfektiöse Therapie vonnöten. Je nach Ätiologie und Ausprägung der Entzündung sollte ein Aufschub der TEE bis zur Abheilung erwogen werden. Eine weitere Ursache von Odynophagie ist das tabletteninduzierte Ulkus der Speiseröhre (z.B. unter Bisphosphonat-Behandlung).
Abbildung 4.
Strahlenösophagitis. (A) Akute segmentale Ösophagitis nach Bestrahlung einer Wirbelkörpermetastase eines Pankreaskarzinoms, (B) chronischstrikturierende Form nach Bestrah-lung eines Ösophaguskarzinoms.
Abbildung 4.
Strahlenösophagitis. (A) Akute segmentale Ösophagitis nach Bestrahlung einer Wirbelkörpermetastase eines Pankreaskarzinoms, (B) chronischstrikturierende Form nach Bestrah-lung eines Ösophaguskarzinoms.
Zustand nach Bestrahlung
Sowohl im Rahmen der Radiotherapie von ösophaguseigenen als auch gewissen extraösophagealen Tumoren (HNO-Bereich; Mediastinum; Wirbelsäule usw.) ist eine strahlenbedingte Schädigung der Speiseröhre zu gewärtigen [
11,
12]. Die
akute Strahlenösophagitis (Abb. 4 A–B) äussert sich klinisch ähnlich wie die floride infektiöse Ösophagitis (vgl. oben). Sie kann entweder ohne grössere Folgen abheilen oder in eine chronisch-strikturierende,
postaktinische Ösophagitis übergehen. In letzterem Fall muss mit einem Verlust der Elastizität und mit erhöhter Brüchigkeit der Ösophaguswand gerechnet werden. Dies erhöht die Perforationsgefahr bei Manipulationen erheblich. Bei chronischem Verlauf entstehen oft längerstreckige Stenosen. Dies sollte vor einer TEE mittels flexibler Ösophagoskopie abgeklärt werden.
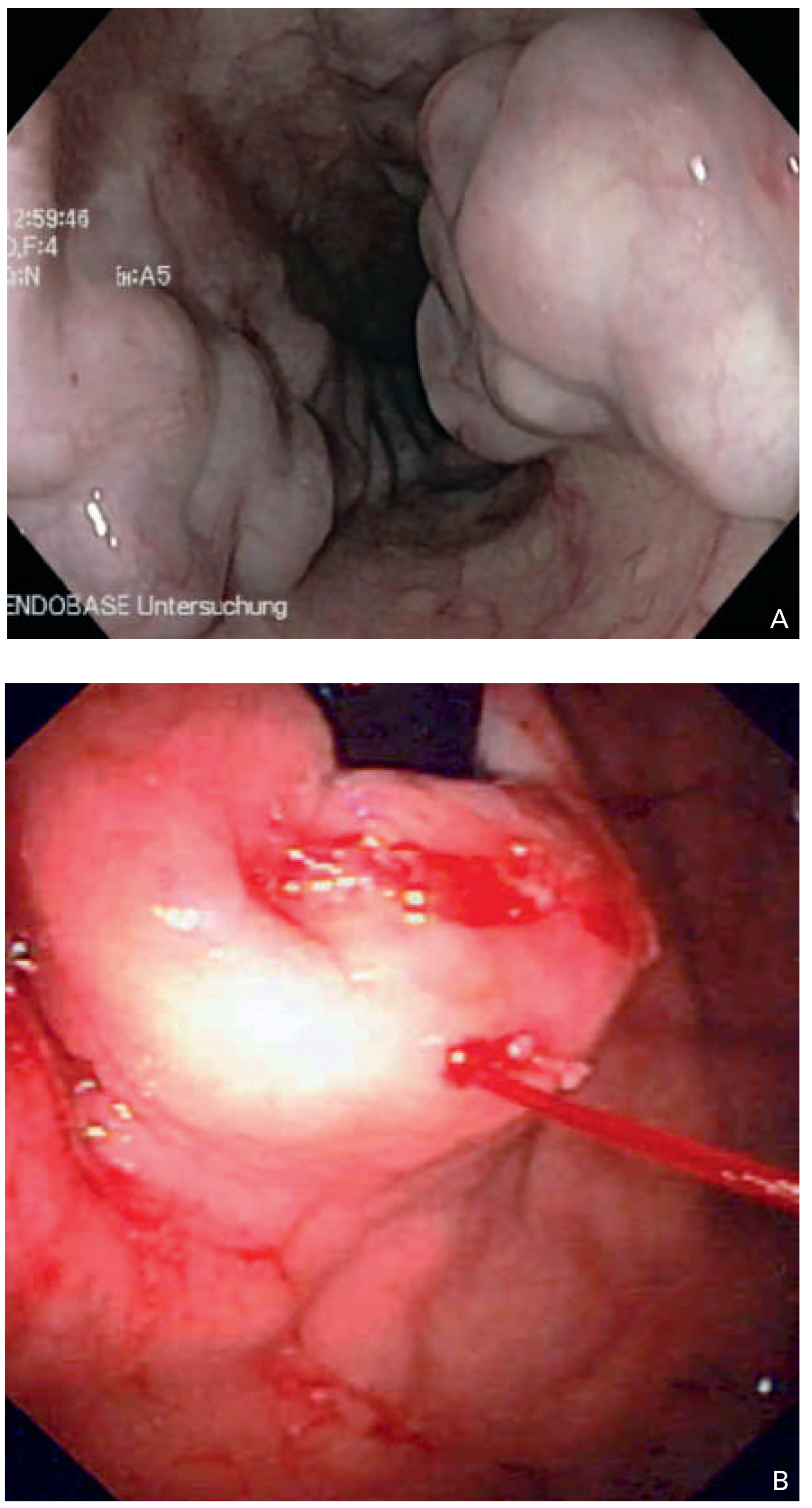
Abbildung 5.
Ösophagusvarizen. (A) Ausgeprägte Ösophagusvarizen bei einem 37jährigen Patienten mit chronischer Hepatitis C im Stadium einer Leberzirrhose, (B) strahlförmige akute Kardiavarizenblutung.
Abbildung 5.
Ösophagusvarizen. (A) Ausgeprägte Ösophagusvarizen bei einem 37jährigen Patienten mit chronischer Hepatitis C im Stadium einer Leberzirrhose, (B) strahlförmige akute Kardiavarizenblutung.
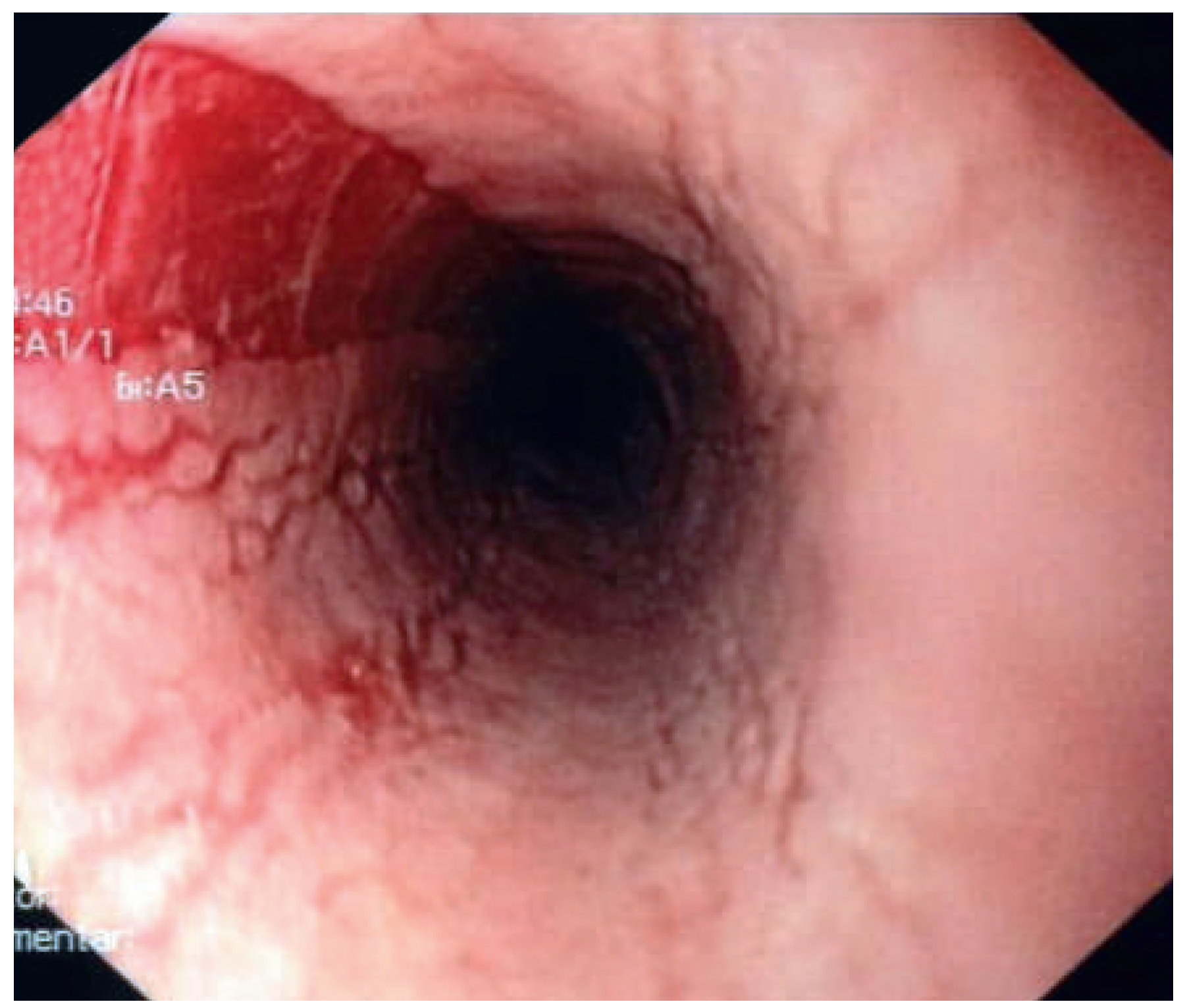
Ösophagusvarizen
Ösophagusvarizen entstehen als Folge eines Pfortaderhochdrucks, meist im Rahmen einer Leberzirrhose. Sie erstrecken sich als grosskalibrige submuköse Kollateralgefässe entlang des Ösophagus. Übersteigt der Pfortaderhochdruck ein bestimmtes Mass, steigt das Risiko für eine Varizenruptur, mit der dramatischen Folge einer akuten Varizenblutung (Abb. 5 A–B). Trotz moderner endoskopisch-interventioneller Blutstillungsmöglichkeiten wie Varizenligatur oder Injektionstherapie ist die akute Varizenblutung immer noch ein lebensbedrohliches Ereignis, mit einer Letalität in der Grössenordnung von 20% nach einer ersten Blutung [
13]. Daher ist die Sorge berechtigt, mit der TEE eine Varizenblutung auszulösen und dadurch eine potentiell fatale Komplikation zu provozieren. Bis in die jüngste Vergangenheit wardas tatsächliche Risiko schwer abschätzbar, da in den meisten Studien, welche die Sicherheit der TEE evaluiert haben, Patienten mit Varizen von vornherein ausgeschlossen waren und nur vereinzelte kleine Studien der Frage gezielt nachgegangen sind. Besondere Beachtung verdient daher eine 2012 publizierte retrospektive Studie, welche ein grösseres Kollektiv von Patienten einschloss, die einer orthotopen Lebertransplantation mit intraoperativer TEE unterzogen wurden [
14]. 287 Patienten (72,5% des Kollektivs) hatten Ösophagusvarizen. In gut der Hälfte der Fälle lagen höhergradige Varizen vor, zum Teil mit Indikatoren für erhöhtes Blutungsrisiko («red spot signs») und hepatogen kompromittierten Gerinnungsverhältnissen. 22% der Patienten hatten Varizenblutungen in der Vorgeschichte, bei 42% waren bereits Interventionen wie endoskopische Varizenbehandlung oder transjuguläre intrahepatische portovenöse Stent-Shunts (TIPS) zur Therapie oder Prävention von Blutungen vorgenommen worden. Obschon es sich demnach um ein Risikokollektiv handelte, war nur eine einzige intraoperative Varizenblutung (0,3%) zu verzeichnen, welche notabene erfolgreich mittels Ballontamponade kontrolliert werden konnte. Soweit aufgrund des retrospektiven Studiendesigns und einiger weiterer Limitationen beurteilbar, scheint das Risiko einer TEE-induzierten Ösophagusvarizenblutung nicht prohibitiv hoch zu sein, so dass eine TEE unter der Voraussetzung einer harten Indikation auch bei Ösophagusvarizenpatienten durchaus vertretbar ist.
Dysphagieanamnese
Sofern als Erklärung für eine Dysphagieanamnese keine der unter den TEE-Kontraindikationen (Tab. 1–2) aufgeführten Diagnosen vorliegt, sind spezielle Entitäten zu bedenken, die notorisch verkannt oder verzögert diagnostiziert werden.
Die
Eosinophile Ösophagitis (Populärbezeichung: «Asthma der Speiseröhre») ist eine chronische, immunvermittelte Krankheit, welche pathologisch-anatomisch durch eosinophile Entzündungsinfiltrate charakterisiert ist und mit Symptomen einer ösophagealen Dysfunktion einhergeht [
15]. Sie zählt im weitesten Sinne zum atopischen Formenkreis und ist oft mit weiteren atopischen Manifestationen assoziiert. Erst seit den 1990er Jahren bekannt, wird sie zunehmend häufig diagnostiziert, zum einen wegen gesteigerter ärztlicher Aufmerksamkeit, zum anderen aufgrund einer echten Inzidenzzunahme. Mittlerweile zählt sie zu den häufigsten Ursachen von dysphagischen Beschwerden überhaupt. Betroffen sind in erster Linie junge Erwachsene, mit einer Dominanz des männlichen Geschlechts.
Die akute Bolusobstruktion ist eine typische Erstmanifestation, welche eine notfallmässige endoskopische Behandlung erfordert. Andere Betroffene leiden über Jahre hinweg an einer unterschiedlich ausgeprägten, zeitlich fluktuierenden Dysphagie, bevor die Diagnose mittels Ösophagoskopie und Biopsie gestellt wird. Die Behandlung besteht in der Regel in einer topischen Steroidtherapie. Der Krankheitsverlauf ist chronisch. Ein substantieller Anteil der Patienten erleidet eine Progression in Form eines Elastizitätsverlusts der Speiseröhre (sog. «Remodelling»). Daraus können längerstreckige Stenosen resultieren, die zwar anfänglich nur mässiggradig ausgeprägt sind, trotzdem aber schon eine markante Rigidität und Brüchigkeit des Gewebes aufweisen. Schon die vorsichtige diagnostische Endoskopie kann zu erheblichen Verletzungen führen (Abb. 6). Somit muss die TEE-Komplikationsgefahr als erhöht eingestuft werden. Patienten mit Verdacht auf (oder nachgewiesener) eosinophiler Ösophagitis sollten vor einer TEE endoskopiert werden, um die Frage von Stenosen zu klären.
Abbildung 6.
Einriss der Ösophagusmukosa infolge diagnostischerflexibler Ösophagoskopie bei Elastizitätsverlust bei Eosinophiler Ösophagitis.
Abbildung 6.
Einriss der Ösophagusmukosa infolge diagnostischerflexibler Ösophagoskopie bei Elastizitätsverlust bei Eosinophiler Ösophagitis.
Abbildung 7.
Ösophaguspassage (Ausschnitt auf Höhe gastroösophagealer Übergang) bei primärer Achalasie, mit Dilatation des distalen Ösophagus und Engstellung des Übergangs in den Magen.
Abbildung 7.
Ösophaguspassage (Ausschnitt auf Höhe gastroösophagealer Übergang) bei primärer Achalasie, mit Dilatation des distalen Ösophagus und Engstellung des Übergangs in den Magen.
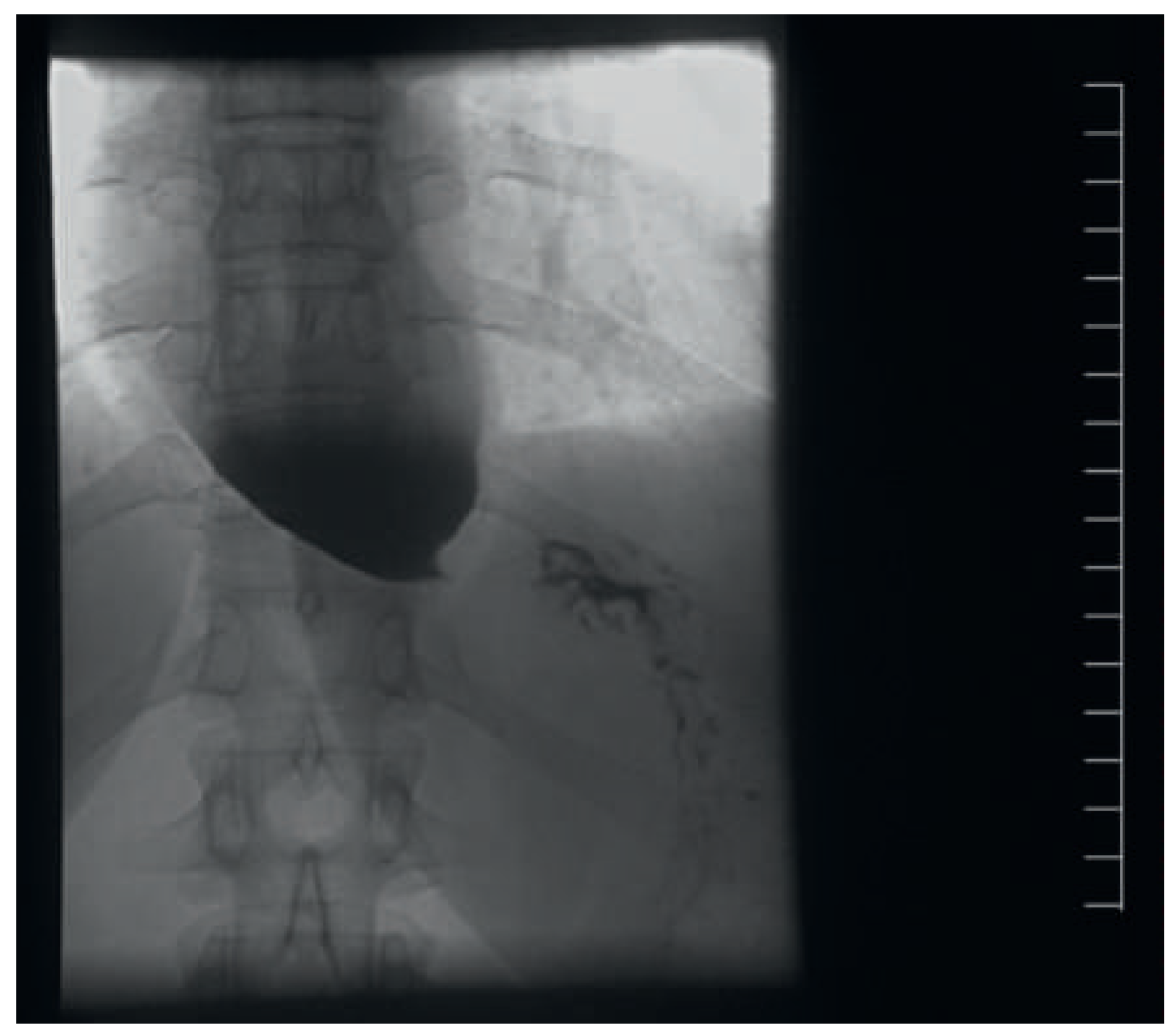
Die
primäre Achalasie ist eine weitere, oft verzögert diagnostizierte Entität mit dem Leitsymptom einer Dysphagie. Es handelt sich um eine ösophageale Motilitätsstörung, charakterisiert durch aufgehobene Peristaltik im tubulären Abschnitt und fehlende schluckinduzierte Erschlaffung des unteren Ösophagussphinkters [
16]. Als Ursache wird eine durch virale Infekte getriggerte autoimmune Ganglionitis angenommen. Die Verdachtsdiagnose kann bereits radiologisch gestellt werden (Abb. 7); für eine definitive Diagnose ist aber in jedem Fall eine endoskopische Abgrenzung gegenüber sekundären Formen (wie z.B. Kardiakarzinom) und eine manometrische Bestätigung nötig. Therapeutisch stehen wahlweise mehrere endoskopisch-interventionelle Methoden oder die chirurgische Myotomie zur Verfügung. Kritisch für die TEE ist der Umstand, dass der untere Ösophagussphinkter dem Gerät einen erhöhten Widerstand entgegensetzt oder unter Umständen gar nicht passierbar ist. Im fortgeschrittenen Stadium ist der distale Ösophagus zudem dilatiert und siphonartig dekonfiguriert. Dies erschwert die Passage in den Magen zusätzlich und akzentuiert die Perforationsgefahr.
Praktische Konsequenzen
Die TEE ist eine sichere Untersuchung und führt nur selten zu ernsthaften gastrointestinalen Komplikationen. Diverse vorwiegend gastroenterologische Pathologien können aber das Komplikationsrisiko erhöhen. Dementsprechend sind Kontraindikationen in einschlägigen Guidelines formuliert worden. Es empfiehlt sich, die vollständige Krankenakte des Patienten vor einer TEE eingehend auf potentielle Fallgruben zu begutachten. Treten relative Kontraindikationen auf, ist ein gastroenterologisches Konsilium und fallweise eine endoskopische Vorabklärung ratsam. Zudem sollten Patienten vor einer TEE eingehend nach ösophagealen Symptomen befragt werden. Spezielles Augenmerk liegt auf einer aktuellen oder anamnestischen Dysphagie (Schwierigkeiten beim Schlucken; Steckenbleiben und/ oder Regurgitation von Nahrung) oder einer Odynophagie (schmerzhafter Schluckakt, schluckassoziierte pektanginöse Beschwerden).
Trotz Einhaltung solcher Vorgaben wäre es ein unrealistisches Ziel, die Komplikationsrate der TEE auf null absenken zu können. So hat eine Analyse von 22 Studien über insgesamt 35 Fälle von TEE-assoziierten Ösophagusperforationen gezeigt, dass in rund 40% der Fälle auch retrospektiv kein Risikofaktor identifizierbar war [
17]. Nur in vier Fällen (11%) hatte eine eigentliche – notabene bloss relative – Kontraindikation bestanden. Dies kann als Hinweis darauf gelesen werden, dass kardiologischerseits gute Kenntnisse der Kontraindikationen vorhanden sind und die entsprechenden Richtlinien adäquat umgesetzt werden. Komplikationen als Folge der Nicht-Berücksichtigung von Kontraindikationen scheinen – wenn überhaupt – extrem selten vorzukommen. Aufgrund der vorliegenden Daten entspricht das typische Patientenprofil bei einer TEE-Perforation einer älteren weiblichen Person ohne erkennbare Kontraindikationen, die einer intraoperativen TEE unterzogen wird. Diese Beobachtung reflektiert eine allgemeine, auf jegliche medizinischen Interventionen zutreffende Erfahrung, dass auch bestes Bemühen und die Einhaltung der Regeln der Kunst ein Restrisiko von unerwünschten, manchmal schicksalhaften Ereignissen nicht vollkommen ausschliessen kann. Eine Komplikation bedeutet nicht in jedem Fall einen Kunstfehler. Dies ist im Falle von mediko-legalen Auseinandersetzungen zu berücksichtigen.