Introduction
L’insuffisance artérielle des membres inférieurs est une pathologie fréquemment rencontrée. Si la prise en charge médicale se base avant tout sur le dépistage d’autres atteintes vasculaires (cardiaques et cérébrales), la prévention des facteurs de risque cardiovasculaires et les exercices de marche, la prise en charge invasive endovasculaire ou chirurgicale constituent le deuxième volet souvent nécessaire pour diminuer la symptomatologie de ces patients.
La définition d’insuffisance artérielle des membres inférieurs se base sur l’association d’une symptomatologie compatible avec une hypo-perfusion circulatoire périphérique (par ex. claudication), combiné à des mesures non invasives confirmant une atteinte de la circulation artérielle (par ex. mesure de l’index cheville-bras <0,9). On parlera d’ischémie critique des membres inférieurs, dans les stades plus avancés et lorsque le patient présente des douleurs au repos ou des lésions trophiques au niveau des pieds, combiné à la mesure des pressions à la cheville <50–60 mm Hg ou à des pressions au gros orteil <30 mm Hg, ou des mesures de la pression transcutanée d’oxygène (TcpO2) < à 30 mm Hg [
1,
2].
Deux types de classification sont en vigueur actuellement pour définir les différents stades de la claudication – la classification de Leriche-Fontaine et celle de Rutherford-Baker [
3,
4]. Vu que la première est largement la plus utilisée en Europe et que la deuxième n’est utilisée principalement qu’aux Etats-Unis et que surtout elle est plus difficile à retenir, dans la revue suivante on ne parlera que de claudication selon la classification de Fontaine: stade I = asymptomatique; stade IIa = claudication >200 m; stade IIb = claudication <200 m, stade III = douleurs ischémiques de repos; stade IV = lésions trophiques.
Au vu de la complexité du choix thérapeutique en présence d’une insuffisance artérielle, une approche multidisciplinaire, incluant les angiologues, les cardiologues, les radiologues interventionnels et les chirurgiens vasculaires est souhaitable. La prise en charge de patients avec artériopathie périphérique dépend néanmoins de quelques principes relativement simples:
le degré d’agressivité thérapeutique sera toujours moindre pour une claudication artérielle que pour des troubles trophiques. En particulier, dans le cadre d’un sauvetage de membre, des traitements complexes sont justifiés.
les comorbidités du patient et leurs influences sur la mortalité/morbidité d’un geste, notamment chirurgical, devront être évaluées.
la possibilité de réalisation technique du geste devra être évaluée, notamment en tenant compte d’un matériel endovasculaire adéquat à disposition pour le type d’intervention programmée ou la présence de matériel veineux de qualité pour un pontage.
Dans la revue qui suit, nous allons discuter des possibilités techniques endovasculaires puis chirurgicales en nous basant principalement sur les nouvelles guidelines TASC II (= Trans-Atlantic Inter-Society Consensus).
La nouvelle classification TASC II
Au début des années 2000, un consensus multidisciplinaire international incluant beaucoup de spécialistes vasculaires a été publié pour faciliter et guider le choix d’une revascularisation au niveau des membres inférieurs [
1]. Au vu de l’apparition de nouvelles données, un nouveau consensus de la «Task force» transatlantique a été publié en 2007: c’est le TASC II consensus, sur lequel nous nous basons pour cet article [
2].
Même si la base de ces recommandations reste la même, suggérant que les lésions simples doivent être traitées de façon endovasculaire, et les lésions complexes plutôt chirurgicalement, la définition de lésion simple ou complexe a considérablement changé entre les années 2000 et 2007. A titre d’exemple, une lésion TASC D (qui, par définition, est du domaine chirurgical) correspondait en 2000 à une occlusion de l’artère fémorale superficielle (AFS) de >5 cm. Toutefois, en 2007, il faut que l’occlusion de l’AFS soit de plus de 20 cm de longueur pour qu’elle soit définie de niveau TASC II D [
2]. Les développements très rapides de ces dernières années, surtout au niveau endovasculaire, ont obligé le même groupe de spécialistes à se remettre au travail déjà en 2009, pour rédiger une nouvelle version (TASC IIb: probablement disponible en 2010– 2011) qui abordera mieux le sujet des lésions jambières ou infra-poplitées et révisera également la nomenclature des lésions (type A-B-C-D).
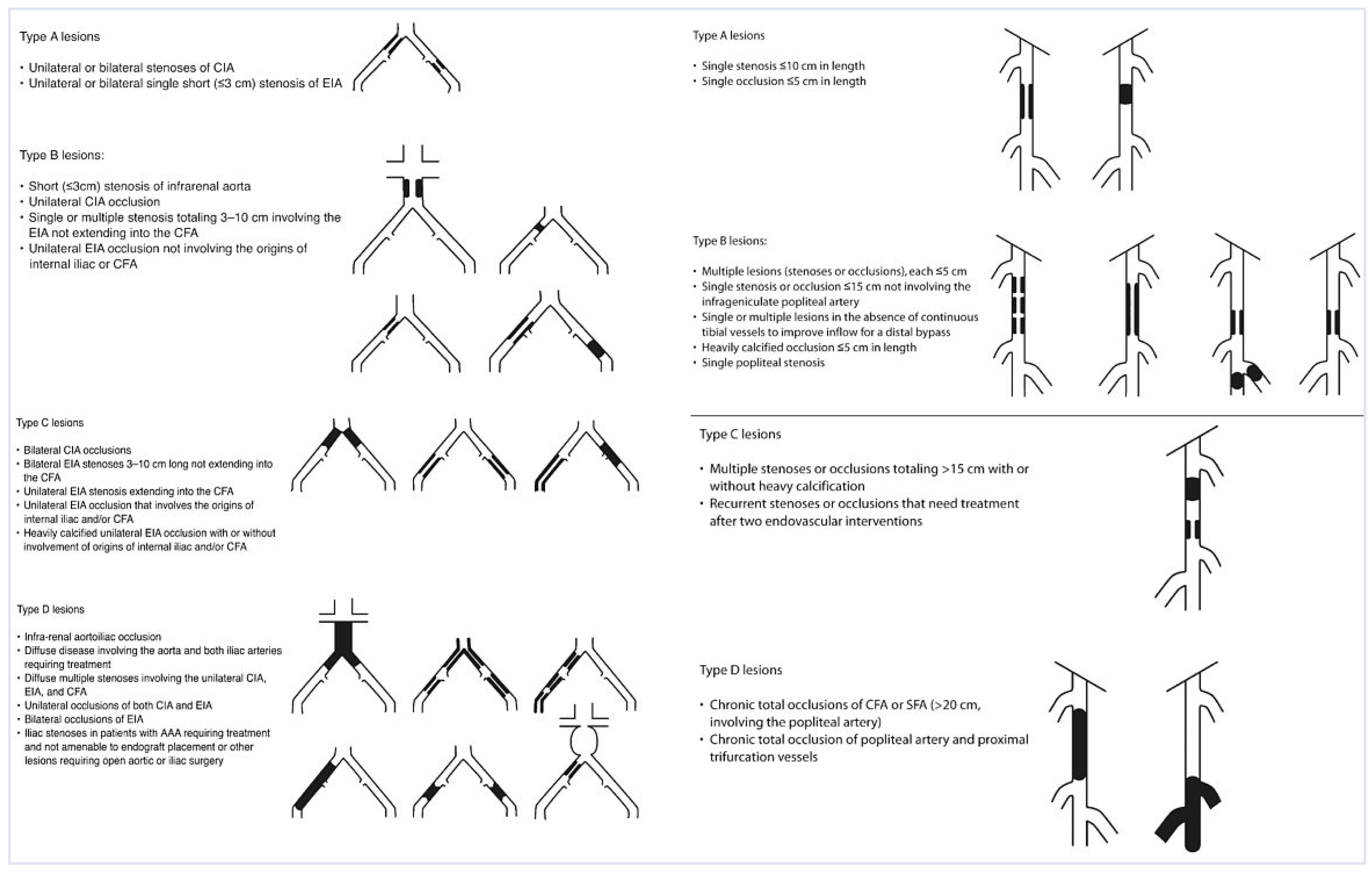
Basés sur les recommandations TASC II, les schémas suivants suggèrent l’attitude à prendre selon le type de lésion à revasculariser [
2] (
Figure 1A: lésions aorto-iliaques; 1B: lésions fémoro-poplitées). Si les lésions TASC II A et B, de localisation iliaque ou fémorale, sont abordées de façon percutanée, les lésions TASC II D le seront de façon plutôt chirurgicale. Concernant les lésions TASC II C, elles peuvent être traitées de façon percutanée ou chirurgicale selon l’expertise locale, les comorbidités et la préférence du patient.
Ce n’est que très récemment qu’il a pu être démontré que les lésions TASC II D peuvent aussi être abordées de façon percutanée avec un excellent taux de succès immédiat (>90%) et un taux de perméabilité secondaire à 2 ans acceptable [
5,
6,
7]. En effet, chez des patients avec multiples comorbidités ou qui ne présentent pas des conduits veineux acceptables (mauvaise qualité de la veine saphène), l’approche percutanée donnera des résultats à 2 ans superposables à ceux après pontage prothétique, même en cas de lésions relativement complexes [
2].
Néanmoins, il est important de souligner que toute intervention percutanée, surtout lorsqu’il s’agit d’une longue occlusion fémorale, ne doit pas compromettre la possibilité de ponter par la suite le même vaisseau. En particulier, on fera très attention à ne pas endommager l’artère poplitée de façon à ce que le chirurgien puisse toujours effectuer un pontage fémoro-poplité et ne soit pas obligé de descendre au niveau distal (par ex. fémoro-jambier) à cause d’une intervention endovasculaire qui aurait compromis le lit vasculaire d’aval [
5].
En ce qui concerne les lésions infra-poplitées («below the knee»), très souvent associées à une ischémie critique des membres inférieurs, même la nouvelle classification TASC II ne fait pas de recommandations spécifiques sur le type de revascularisation (chirurgicale vs endovasculaire) [
2]. L’approche endovasculaire des lésions infra-poplitées est très souvent pratiquée en présence d’une ischémie critique (lésions trophiques, douleurs au repos), tandis que la claudication isolée ne devrait qu’exceptionnellement être l’indication à une intervention à ce niveau. Pour cette raison et surtout suite à l’augmentation exponentielle des patients présentant une ischémie critique (vieillissement de la population, prévalence accrue de malade diabétique, etc.), la nouvelle classification TASC IIb, qui abordera mieux ce sujet, est attendue avec impatience. Il est bien possible que l’approche percutanée soit recommandée comme premier choix pour la revascularisation des artères jambières et que le pontage soit réservé aux échecs endovasculaires ou aux cas réfractaires.
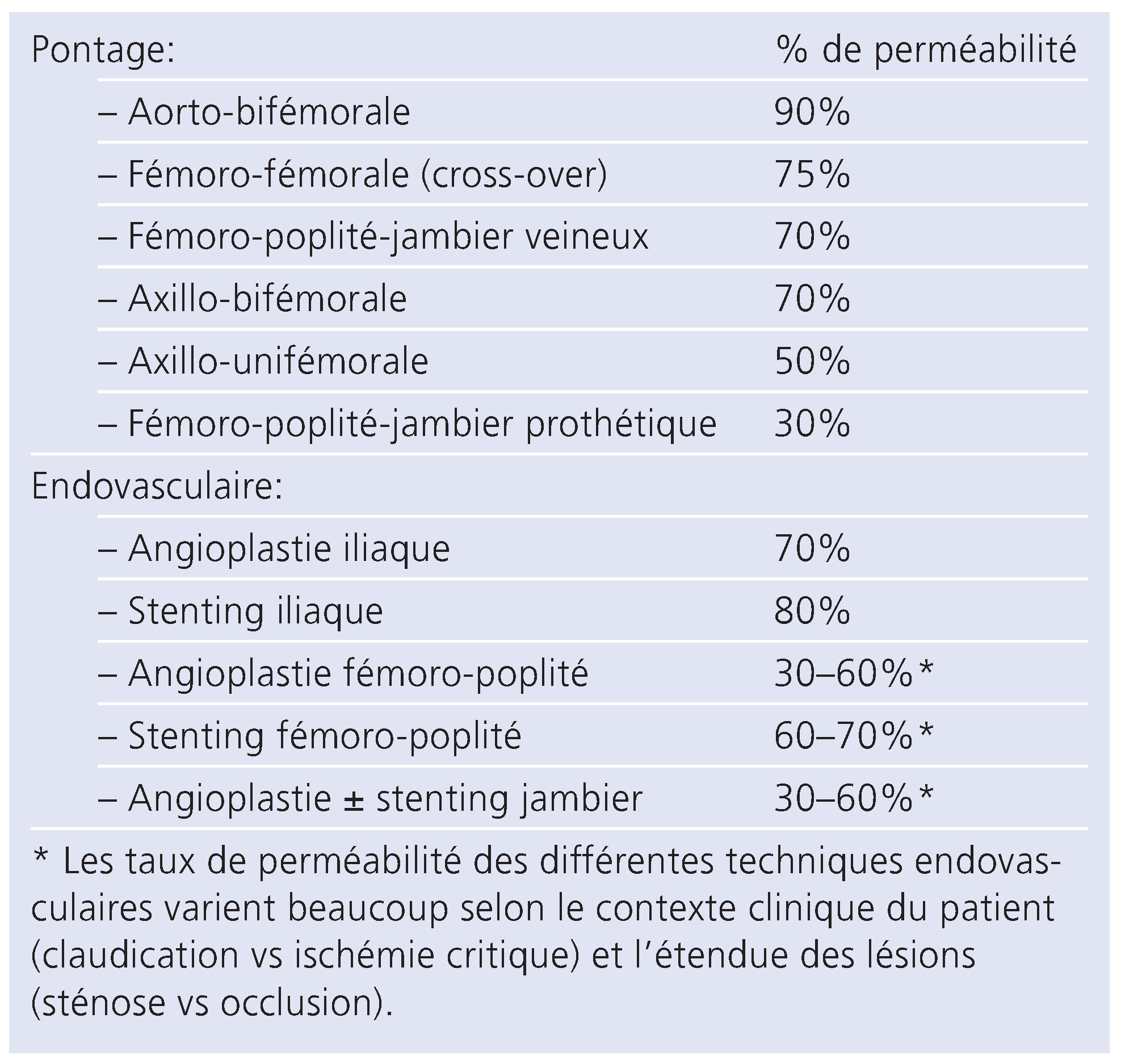
Le
Tableau 1 montre les taux de perméabilité attendus à 2–5 ans, selon le type de revascularisation effectuée (endovasculaire [angioplastie ou stent] ou chirurgical [bypass veineux ou prothétique]) mais surtout selon la localisation des lésions à revasculariser. On notera que plus le contexte clinique est lourd (claudication vs ischémie critique), plus la lésion est distale ou complexe (sténose vs occlusion) et plus la perméabilité à 2–5 ans de toute sorte de revascularisation est réduite [
2].
Traitement endovasculaire
Depuis plus de 30 ans, ce sont les spécialistes cardiovasculaires, et en particulier les angiologues interventionnels suisses, qui ont été des pionniers dans ce domaine, suivant l’évolution des techniques de revascularisation percutanée [
6,
7,
8]. C’est grâce à des progrès considérables surtout dans le matériel utilisé que le traitement endovasculaire peut à l’heure actuelle être proposé dans un grand nombre de situations chez les patients souffrant d’insuffisance artérielle. Les avantages principaux d’une approche percutanée par rapport à une approche chirurgicale sont un taux de complication cardiovasculaire faible (0,5–4%) [
2], un taux de succès immédiat qui approche les 90%, même dans les lésions complexes [
2,
5,
9], et finalement des taux de perméabilité et d’amélioration clinique satisfaisantes. La grande limitation de toute approche endovasculaire reste, même en 2010, la resténose [
2]. Généralement, la formation de néo-intima, secondaire à un processus inflammatoire complexe, survient dans les premiers 6–12 mois après l’angioplastie et elle dépend étroitement du type d’artère traitée (musculaire, élastique, etc.), du calibre de l’artère, de la présence de calcification, du diabète, etc.
S’il est admis qu’au niveau iliaque la resténose n’est pas un problème majeur (resténose à un an: 5–15%) [
10,
11], au niveau infra-inguinal (artère fémorale superficielle, artère poplitée et artères jambières), les taux de resténose ont été pendant plusieurs décades très élevés [
11,
12,
13].
Tableau 1.
Taux de perméabilité estimé à 2–5 ans pour les différentes méthodes de revascularisation (modifié selon [
2,
12]).
Tableau 1.
Taux de perméabilité estimé à 2–5 ans pour les différentes méthodes de revascularisation (modifié selon [
2,
12]).
L’artère fémorale superficielle est l’artère la plus longue du corps humain et elle est fixée à deux points de flexion majeurs (la hanche et le genou). Lors des mouvements (marche, montée d’escalier, etc.), l’AFS est soumise à différentes sollicitations mécaniques. Cette situation très particulière est certainement une des raisons du taux de resténose très élevé observé dans l’AFS (resténose de 40–60% à une année après angioplastie) [
12,
13].
La frustration concernant le faible taux de perméabilité du traitement endovasculaire des lésions infra-inguinales a été soulagée récemment, suite à l’apparition de plusieurs nouvelles technologies, dont nous discutons ci-dessous.
Technologies endovasculaires actuellement à disposition
La dilatation au ballon simple (PTA = percutaneous transluminal angioplasty) reste le traitement de base de tout traitement endovasculaire [
8]. En ce qui concerne les lésions iliaques et fémorales, le stenting est de plus en plus utilisé de manière systématique. Par contre, en ce qui concerne les lésions infra-poplitée, le PTA est encore le traitement de choix, surtout à cause du risque de compression des stents implantés au niveau du mollet, du peu d’études importantes validant cette technologie dans les artères jambières et de la rareté des stents spécifiquement dédiés aux lésions infra-poplitées [
14,
15].
A l’origine, l’implantation de stent a été associée uniquement lors de résultats insuffisants après ballonnet simple (par ex. sténose résiduelle >30% ou dissection avec limitation du flux).
Au niveau des artères iliaques, le stenting est devenu de plus en plus systématique surtout au niveau de l’artère iliaque commune, avec de très bons résultats sur le long terme (perméabilité à 5 ans >80%) [
9,
10].
En ce qui concerne les lésions infra-inguinales, la situation est bien plus complexe. En effet l’AFS reste, même en 2010, le talon d’Achille de tout traitement endovasculaire. A la fin des années 90, plusieurs études ont démontré que la resténose au niveau de l’AFS restait élevée [
12,
13,
16,
17]. Ce n’est que depuis 2002 qu’un peu d’espoir pour vaincre la resténose de l’AFS est apparu dans le domaine interventionnel. En effet, l’étude SIROCCO I-II [
18,
19], comparant des stents à élution (DES) dans l’AFS à des stents normaux («bare metal stent»: BMS), a montré pour la première fois des taux de resténose acceptables à 2 ans (taux de resténose: 25%). Mais la bonne nouvelle ne venait pas des DES mais plutôt des nouveaux BMS en nitinol (alliage avec du Nickel et du Titanium) utilisés dans l’étude. Sans grande surprise mais avec beaucoup de déception, les DES n’avaient montré aucun avantage par rapport aux mêmes BMS en nitinol. C’est grâce à ce nouvel alliage, probablement beaucoup plus performant que les anciens stents en acier («stainless steel»), que pour la première fois la resténose était inférieure à 30% à 2 ans. Depuis cette découverte fortuite, l’industrie et toute la communauté scientifique ont beaucoup investi dans le développement des nouveaux stents en nitinol. Ces efforts ont abouti à plusieurs études cliniques randomisées qui ont démontré statistiquement que le stenting était supérieur à l’angioplastie seule, surtout lorsqu’il s’agissait de lésions longues ou complexes ou chez des patients présentant une ischémie critique du membre inférieur [
12,
20].
Après avoir étudié le concept au niveau coronarien, le ballon à élution a aussi fait son apparition dans le domaine des interventions périphériques. L’idée d’administrer pour une durée très courte (temps de l’inflation du ballon: 2 min.) une forte dose de médicament antiprolifératif, s’est avérée efficace en ce qui concerne les taux de resténose et de revascularisation comparés à la dilatation au ballon seul [
21]. Pour le moment, beaucoup d’enthousiasme est associé à cette nouvelle technologie qui aurait l’avantage de combiner un traitement simple (PTA), relativement bon marché avec des taux de resténose tout à fait acceptables, sans les désavantages associés aux stents (coût, fracture de stent, etc.). Même si ce type de ballon est déjà dans les armoires des salles d’angiographie en Suisse, des nouvelles études au niveau fémoro-poplité et au niveau infra-poplitée sont en cours et l’efficacité de cette technologie attend une validation définitive [
22].
Nouvelles technologies endovasculaires
C’est surtout grâce à l’apparition de nouveaux instruments endovasculaires que les interventions percutanées sont devenues plus sûres (taux de complication <4%) [
2], plus efficaces (taux de succès >90%), et plus rapides. Voici un court résumé des nouveaux instruments actuellement à disposition.
Le «crossing device» le plus ancien et le plus étudié est l’excimer Laser™ (Spectranetic, Colorado Spring, CO, Etats-Unis) qui a montré de bons taux de succès pour la recanalisation des longues occlusions fémoro-poplitées et infra-politées [
23]. A cause de son coût élevé et du fait qu’un passage sous-intimal peut toujours arriver, ce type de «device» doit être réservé aux centres tertiaires à très haut volume ou pour des indications de recherche.
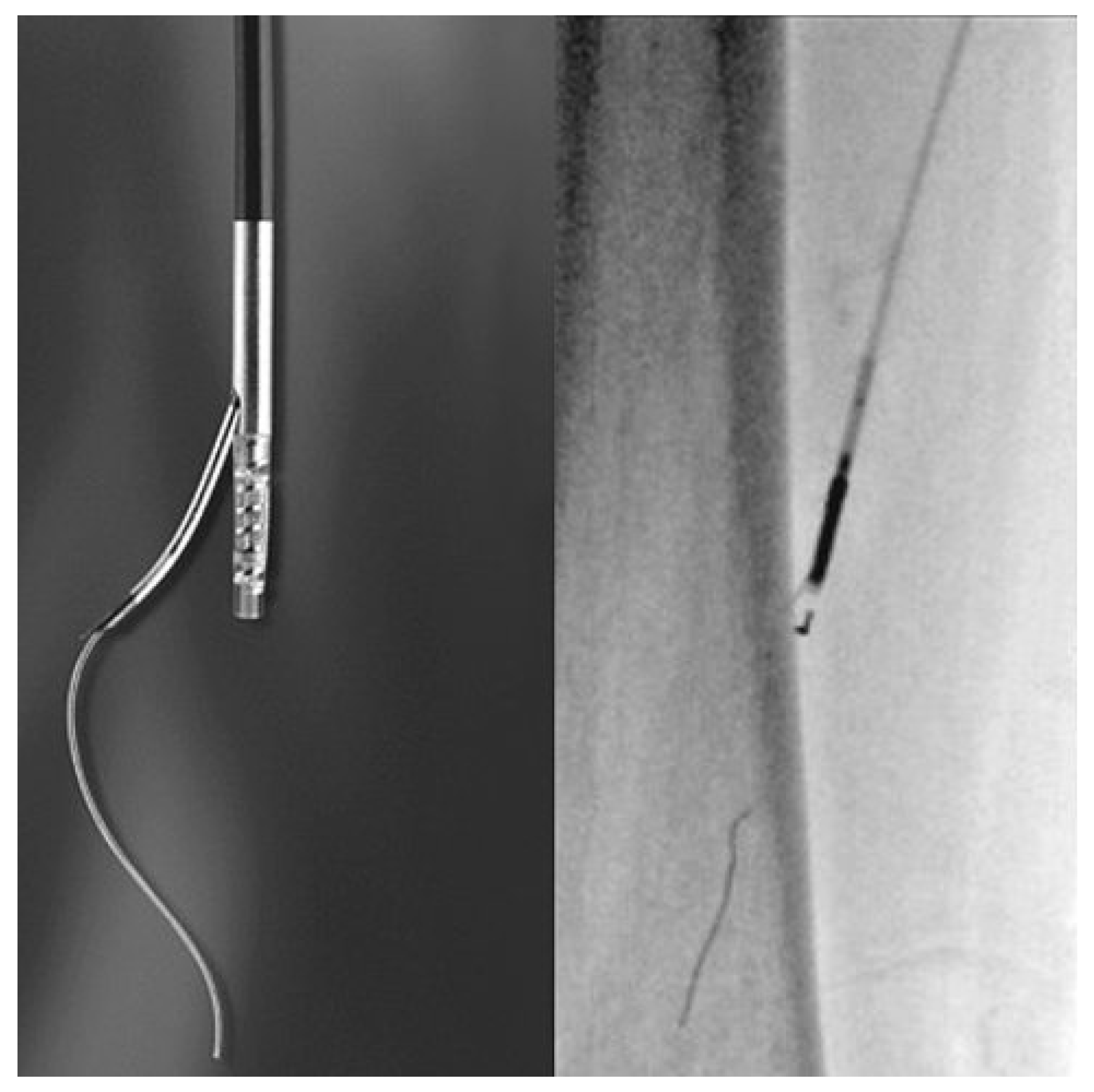
Une avancée dans le monde interventionnel, surtout en ce qui concerne la recanalisation sous-intimale des longues occlusions fémorales, est l’apparition depuis quelques années, des «reentry devices»: Le Outback™ (Cordis, Miami, FL, Etats-Unis,
Figure 2) [
5] et le Pioneer™ (Medtronic, Santa Rosa, CA, Etats-Unis) [
20]. L’avantage de ce type de cathéter est qu’ils permettent de pouvoir rétablir de façon rapide la connexion entre l’espace sous-intimal et la vraie lumière en réduisant par conséquence à <10% le taux d’échec des recanalisations des longues occlusions des artères fémorales [
5,
24].
Le rationnel pour utiliser des «debulking devices», surtout au niveau de l’AFS, est de pouvoir éliminer le plus possible la plaque d’athérome, donc de gagner de la lumière dans des vaisseaux souvent très infiltrés par l’athérosclérose et aussi d’éviter les désavantages liés au baro-trauma du vaisseau lors de l’inflation du ballonnet. Il existe plusieurs modes pour effectuer l’athérectomie:
l’athérectomie directionnelle en utilisant le Silverhawk™ device (ev3, Paris, France,
Figure 3),
l’athérectomie rotationnelle avec aspiration avec le Pathway PV Atherectomy system™ (Pathway medical, Redmond, WA, Etats-Unis),
l’athérectomie rotationnelle à haute vitesse avec le Rotablator system™ (Boston Scientific, Natick, MA, Etats-Unis) et
l’athérectomie orbital avec le Diamondback 360° Orbital Atherectomy device (Cardiovascular system, St-Paul, MN, Etats-Unis).
Traitement chirurgical
Malgré les progrès intéressants des techniques endovasculaires dont les résultats ne cessent de s’améliorer, la progression exponentielle de la maladie artérielle périphérique et plus particulièrement de l’ischémie critique chez les patients âgés confronte les différents spécialistes à des patients présentant des atteintes de plus en plus complexes et étendues et qui, de prime abord, restent du domaine chirurgical.
Ainsi, après plus de 60 ans de revascularisation des membres inférieurs, il ne fait aujourd’hui aucun doute que le substitut de choix, en terme de facilité d’emploi, de stabilité dans le temps et de perméabilité est de toute évidence la veine saphène interne autologue, ou veine grande saphène, utilisée comme autogreffe veineuse. Ceci est particulièrement vrai pour les pontages à destinée distale, où les artères de petit calibre souffrent d’une éventuelle incongruence de calibre avec le conduit utilisé. Pour cette raison, la veine saphène interne est universellement considérée comme le «gold standard» pour la réalisation d’un pontage infra-géniculé. Son utilisation en greffon inversé ou in situ après dévalvulation semble être équivalente en termes de perméabilité, mais toutefois, l’utilisation de la veine saphène in situ semble apporter une meilleure congruence de calibre. Malheureusement, il est de plus en plus courant qu’un patient candidat à une revascularisation distale ne possède pas forcément de veine utilisable, la plupart du temps en raison d’un prélèvement préalable dans le cadre d’une revascularisation myocardique. De plus, jusqu’à 12% des veines intactes présentent, lors du prélèvement, une atteinte dégénérative et plus de 5% sont simplement inutilisables pour un pontage. Dans toutes ces situations, l’utilisation de conduits alternatifs inclut les veines prélevées au membre controlatéral, mais avec le risque de compromettre un pontage futur. Les veines prélevées au membre supérieur semblent donner des résultats encourageants avec des taux de perméabilité et de sauvetage de membre assez comparables à ceux obtenus avec des conduits prothétiques; mais chez des patients multi-opérés ayant souvent séjourné longtemps en milieu hospitalier, les veines des bras sont généralement de qualité médiocre et les segments obtenus sont courts.
Les autres substituts autologues comme l’autogreffe artérielle, ont une utilisation extrêmement restreinte malgré leur avantage intuitivement supérieur, en raison du nombre très limité de sites de prélèvement possibles.
Les
substituts vasculaires prothétiques constituent quant à eux une alternative utilisée depuis le début des années 1950, sous différentes formes; dans la reconstruction fémorale, c’est en 1976 que Campbell décrit leur utilisation pour la première fois [
25]. Elles ont démontré leur utilité et leur taux de perméabilité tout à fait acceptable pour les pontages supra-géniculés [
26,
27]. En revanche, leur utilisation dans les pontages longs, fémoro-distaux infra-géniculés n’a pas montré d’aussi bons résultats [
27].
Considérant les différents types de matériaux utilisés, polytetrafluoroéthylène (PTFE) et polyester (Dacron©), une méta-analyse incluant neuf études randomisées-contrôlées n’a pas permis de démontrer de nets avantages pour l’un ou l’autre des deux matériaux [
28]. Il convient de citer également l’usage des différents types de
substituts vasculaires biologiques, qu’ils soient d’origine humaine (homogreffes) ou animale (xénogreffes). En effet, malgré l’absence de consensus, la plupart des auteurs s’accordent à reconnaître l’utilité de leur emploi dans un champ opératoire infecté, où, en particulier, les homogreffes artérielles semblent montrer une meilleure résistance [
29].
Les perspectives futures de la revascularisation chirurgicale semblent bien résider dans la
prise en charge combinée hybride des lésions. En effet, il a été clairement démontré que dans l’association de l’atteinte iliaque et infra-inguinale, ce type d’approche associant l’angioplastie proximale et le pontage sous-jacent était la plus à même de permettre une revascularisation adéquate, avec l’avantage de garantir le meilleur bénéfice des deux gestes, sans risque de compromettre l’un ou l’autre par la synchronicité de leur exécution [
30,
31].
Finalement, dans le domaine de la revascularisation distale, nécessitant des conduits de très petite taille – qui font le plus cruellement défaut en absence de veine autologue utilisable –, de nouvelles voies prometteuses sont en plein développement et parmi cellesci, l’ingénierie vasculaire semble ouvrir des possibilités futures captivantes. Des expériences d’ensemencement cellulaire à l’aide de tissu endothélial autologue cultivé in vitro puis déposé sur des prothèses synthétiques en PTFE ont montré des résultats spectaculaires avec un taux de perméabilité et de sauvetage de membre à 10 ans de 61% et 71% respectivement [
32]. Parallèlement, un autre axe d’investigation est actuellement en évaluation: le développement d’une
prothèse vasculaire biodégradable dont le concept repose sur le modeling d’une matrice, susceptible d’être implantée de manière conventionnelle, capable d’assurer une intégrité initiale du pontage mais également de permettre une substitution progressive par des tissus autologues. Des résultats préliminaires prometteurs requièrent bien entendu d’autres investigations avant de pouvoir prétendre à une utilisation dans le cadre d’études cliniques chez l’homme [
33].