Abstract
Platelet inhibition in coronary artery disease. Acetylsalicylic acid has been used for over 100 years but its potential to inhibit platelets has only been taken advantage of for about 30 years. For about 10 years the thienopyridines (initially ticlopidine and then clopidogrel) have been used as alternatives or complements (in particular in the context of coronary artery stents). Thienopyridines block the ADP receptor of the platelet which stimulates the GP IIb/IIIa receptors (subreceptor P2Y12) to appear at the platelet surface and to permanently ligate to a fibrinogen molecule. Each fibrinogen molecule can attach to 2 GP IIb/IIIa receptors. If they belong to two individual platelets, the two are aggregated irreversibly. Recently a second thienopyridine (prasugrel) has come to market. It is a prodrug like clopidogrel but activated faster and more reliably. In the examined doses it has proved to be more efficacious but also more bleed prone than clopidogrel. Soon to come is another oral ADP antagonist (ticagrelor) which is ingested in the active form and binds to the receptor reversibly. This entails that it be given twice a day. Clinical results so far show enhanced efficacy compared with clopidogrel without a significant increase of bleeding risk. Future clinical use will show whether we will continue to use all three modern platelet inhibitiors in addition to acetylsalicylic acid, narrow it down to one or two of them, or perhaps drop acetylsalicylic acid. The quest to find an oral direct inhibitor of the GP IIb/IIIa receptor goes on as does the search for other indirect platelet inhibitors acting for instance on the thrombin receptor, the thromboxane A2 receptor (also the target of acetylsalicylic acid), the epinephrine receptor, the serotonin receptor, or the collagen receptors.
Allgemeines
Obwohl Azetylsalizylsäure schon seit 100 Jahren im Gebrauch ist, wurde seine blutplättchenhemmende Wirkung erst spät erkannt und z.B. bei der weltweit ersten Koronardilatation (38-jähriger Patient in Zürich am 16. September 1977) noch nicht eingesetzt. Heute werden Koronarpatienten generell mit Azetylsalizylsäure behandelt. Ein zunehmender Prozentsatz erhält zusätzlich ein Thienopyridin (derzeit zumeist Clopidogrel), vor allem, wenn eine kathetergestützte Intervention erfolgt ist. Solche Interventionen beinhalten heute regelhaft eine Stent-Implantation. Meistens handelt es sich um medikamenteabgebende Stents. Die lebenslange Verschreibung von Azetylsalizylsäure ist unbestritten, die Dauer der Verschreibung zusätzlicher Blutplättchenhemmer hingegen kontrovers. Während für das erste Jahr nach Stent-Implantation der Nutzen der doppelten Blutplättchenhemmung nachgewiesen ist, sind die Daten für die Zeit danach weniger klar. In der grossen CHARISMA-Studie hat sich der Zusatz von Clopidogrel zu Azetylsalizylsäure zwar für die Primärprävention als wirkungslos, für die Sekundärprävention aber als signifikant nützlich erwiesen [1]. Blutungsprobleme sind häufiger bei doppelter Blutplättchenhemmung. Sie treten indes typischerweise in den ersten Monaten auf. Hat ein Patient doppelte Blutplättchenhemmung im ersten Jahr gut ertragen, ist das verbleibende Risiko einer Blutung kein Grund, die Therapie auf Azetylsalizylsäure allein zurückzufahren. Prasugrel, ein Thienopyridin, das sich effizienter und schneller in den aktiven Metaboliten umwandelt als Clopidogrel, wurde kürzlich im Schweizer Markt eingeführt [2]. Ticagrelor, ein reversibler und direkt aktiver Inhibitor des ADP-Blutplättchenrezeptors, erfüllt ebenfalls die Bedingungen zur Markteinführung [3]. Durch diese beiden Medikamente werden die teuren und nur intravenös verabreichten Glykoprotein-(GP-) IIb/IIIa-Rezeptor-Antagonisten (Abciximab, Eptifibatid, Tirofiban) selbst in der Spitalmedizin zu Nischenprodukten werden.
Möglichkeiten der Blutplättchenhemmung
Die Abbildungen 1 und 2 geben die Möglichkeiten der Blutplättchenhemmung wieder. Verschiedene Mechanismen führen zur Aktivierung der einzelnen Rezeptoren und bieten sich zur indirekten Plättchenhemmung an. Jedes Blutplättchen verfügt über ungefähr 100,000 GP-IIb/IIIa-Rezeptoren, welche nur bei aktivierten Blutplättchen an der Oberfläche sind.
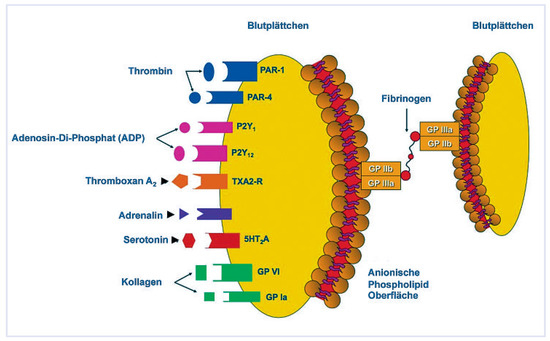
Abbildung 1.
Der Glykoprotein (GP)-IIb/IIIa-Rezeptor ist der eigentliche Koppelungsrezeptor (ca. 100 000 pro Blutplättchen), der durch die Aktivierung der Rezeptoren links an die Oberfläche gebracht und aktiviert wird.
Abbildung 1.
Der Glykoprotein (GP)-IIb/IIIa-Rezeptor ist der eigentliche Koppelungsrezeptor (ca. 100 000 pro Blutplättchen), der durch die Aktivierung der Rezeptoren links an die Oberfläche gebracht und aktiviert wird.
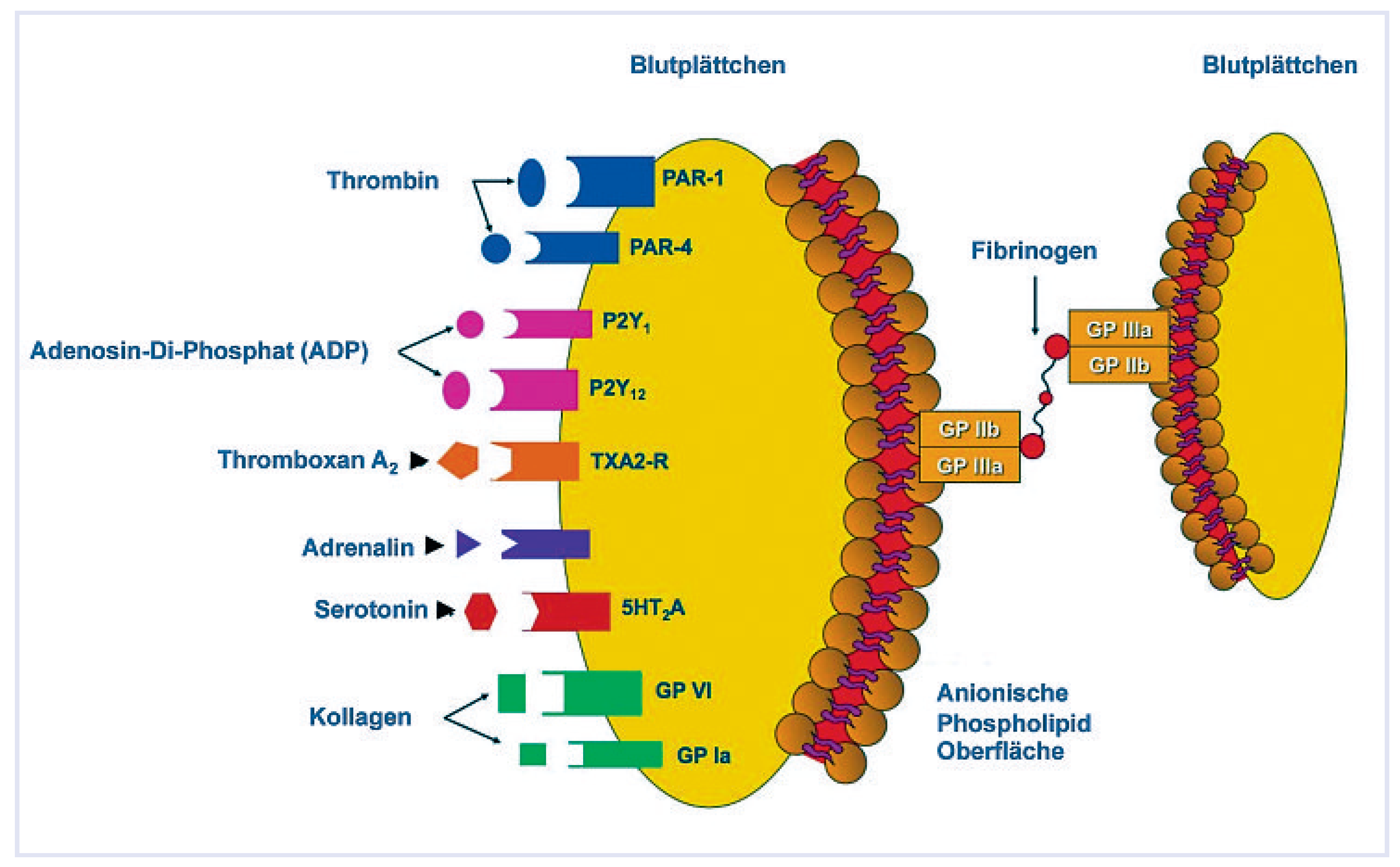
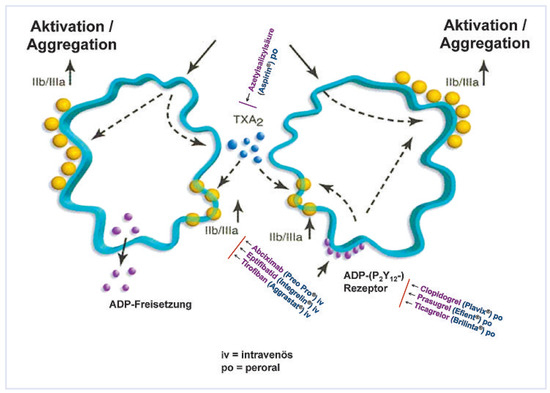
Abbildung 2.
Die derzeit möglichen klinisch benutzten Angriffspunkte zur Verhinderung der Aktivation/Aggregation sind eingezeichnet. Die Markennamen sind in Klammern angegeben.
Abbildung 2.
Die derzeit möglichen klinisch benutzten Angriffspunkte zur Verhinderung der Aktivation/Aggregation sind eingezeichnet. Die Markennamen sind in Klammern angegeben.
Die naheliegendste Blutplättchenhemmung erfolgt sinngemäss durch die direkte Blockierung der GPIIb/IIIa-Rezeptoren. Hiefür gibt es bis anhin indes lediglich intravenöse und relativ teure Medikamente.
Die Thromboxan-A2-Hemmung ist mit der Azetylsalizylsäure möglich. Von den ADP-Rezeptoren wird der P2Y12-Rezeptor durch die beiden Thienopyridine Clopidogrel und Prasugrel irreversibel, durch das Zyklopentyl-Triazolopyrimidin Ticagrelor reversibel gehemmt. Die Hemmung der Adrenalin- und Serotonin-Rezeptoren haben sich wegen Nebenwirkungen entsprechender Medikamente nicht bewährt. Die Hemmung der Thrombin-Rezeptoren wird gegenwärtig klinisch mittels direktem Thrombin-Rezeptor-Hemmer untersucht. Die Kollagen-Rezeptoren werden indirekt durch EndothelStabilisierung durch die Statine gehemmt.
Zur Langzeittherapie stehen derzeit in Europa Azetylsalizylsäure und Clopidogrel im Vordergrund. Prasugrel wird derzeit eingeführt und Ticagrelor kann 2010 erwartet werden.
Zusätzlich werden vorwiegend in Asien Cilostazol (Phosphodiesterase-Hemmer) und in den USA Dipyridamol (Adenosin-Wiederaufnahmehemmer) verwendet. Während Dipyridamol nur im Doppelpack mit Azetylsalizylsäure gute klinische Daten hat, hat Cilostazol nach Koronarstenting sogar zusätzlich zu Azetylsalizylsäure und Clopidogrel einen Nutzen bewiesen [4,5].
Azetylsalizylsäure hat sich in fast allen Studien in der Sekundärprävention als wirksam erwiesen. Bei der Primärprävention gibt es negative Studien bzw. Teilerfolge. So scheint es bei Männern gegen Herzinfarkte, bei Frauen gegen Hirnschläge zu wirken. Eine neue Studie, welche keinen Effekt zeigte bei Gesunden mit einem pathologischen ABI (Ankle Brachial Index) ist kontrovers. Die kurze Verlaufszeit bei Gesunden (der ABI ist nur ein sehr indirekter Hinweis auf Atherosklerose bzw. Risikoerhöhung) liess keinen Wirkungsnachweis erwarten. Bezüglich Dosierung haben sich eindeutig niedrige Dosierungen mit gleicher Wirksamkeit und geringerem Blutungsrisiko sowie besserer Magenverträglichkeit durchgesetzt. In Europa sind dies in der Regel 100 mg, in den USA 80 mg (¼ der ursprünglichen 5 Körner, welche 324 mg wiegen) [6].
Clopidogrel hat das an sich etwas wirksamere Ticlopidin vollständig ersetzt, weil letzteres 2 × täglich verabreicht werden musste und in einigen Prozenten zur Myelodepression führte, was regelmässige Blutbildkontrollen erforderte. Clopidogrel wird gegenwärtig 1 × täglich mit 75 mg dosiert. Die bessere Wirksamkeit des Prasugrels hat indes die Tendenz zu höherer Clopidogrel-Dosierung verstärkt. Beide Thienopyridine sind inaktive Vorformen und in vitro gleich aktiv, wenn man die aktiven Metaboliten identisch dosiert [7,8]. Clopidogrel hat indessen einen langsameren und komplizierteren Aktivierungsmechanismus als Prasugrel [9,10]. Sowohl im Darm als auch in der Leber sind verschiedene Enzyme notwendig, darunter 2-mal das Allel CYP2C19 des Zytochroms P450. Die Tatsache, dass diese Zytochrome von Statinen und Protonenpumpen-Inhibitoren ebenfalls beansprucht werden, hat zu Laboruntersuchungen geführt, die zeigten, dass die Aktivierung des Clopidogrels durch die bei Koronarikern häufig gleichzeitig verwendeten Lipidsenker und Säurehemmer gehemmt werden. Die diesbezüglichen klinischen Untersuchungen waren indes durchwegs negativ und eine beeinträchtigte Wirksamkeit des Clopidogrels wurde nicht gefunden [11,12]. Dem Clopidogrel haftet der Nachteil des relativ langsamen Wirkungseintritts, der schlechten Aktivierung bei über 20% der Bevölkerung (partielle Resistenz) sowie der irreversiblen Hemmung der Blutplättchen an. Um den Wirkungseintritt beim akuten Koronarsyndrom zu beschleunigen, werden heute mindestens 600 mg oder gar 900 mg orale Ladedosis Clopidogrel empfohlen [13]. Auch Coumadin soll im Labor die Clopidogrel-Aktivität vermindern. Dies würde wohl selbst, wenn es klinisch relevant wäre, durch die zusätzliche blutverdünnende Wirkung des Coumadins überdeckt. Um eine Wirkung auch bei schlechten Aktivierern zu erreichen, kann die Clopidogrel-Dosis verdoppelt werden, was kürzlich eine klinisch verbesserte Wirkung gezeigt hat (CURRENT-Studie) [14]. Die irreversible Wirkung bedingt, dass eine normale Blutplättchenfunktion erst nach einigen Tagen wieder erreicht wird. Clopidogrel bewirkt eine etwa 60prozentige Blutplättchenhemmung. Geht man davon aus, dass pro Tag 10% der Blutplättchen erneuert werden, sind nach 4 Tagen nur noch 20% der Blutplättchen gehemmt, was bei Zahneingriffen oder Operationen keine signifikante Blutungserhöhung verursachen sollte.
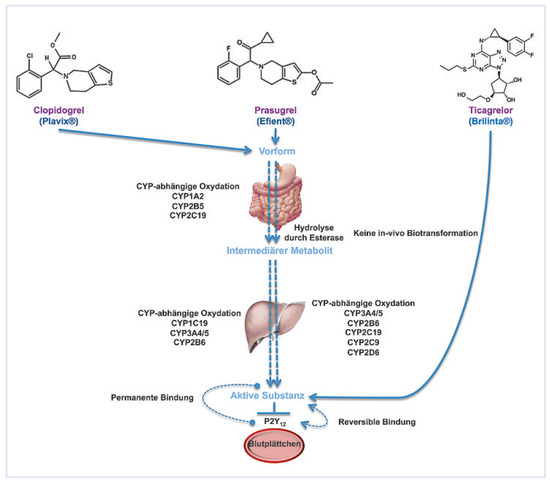
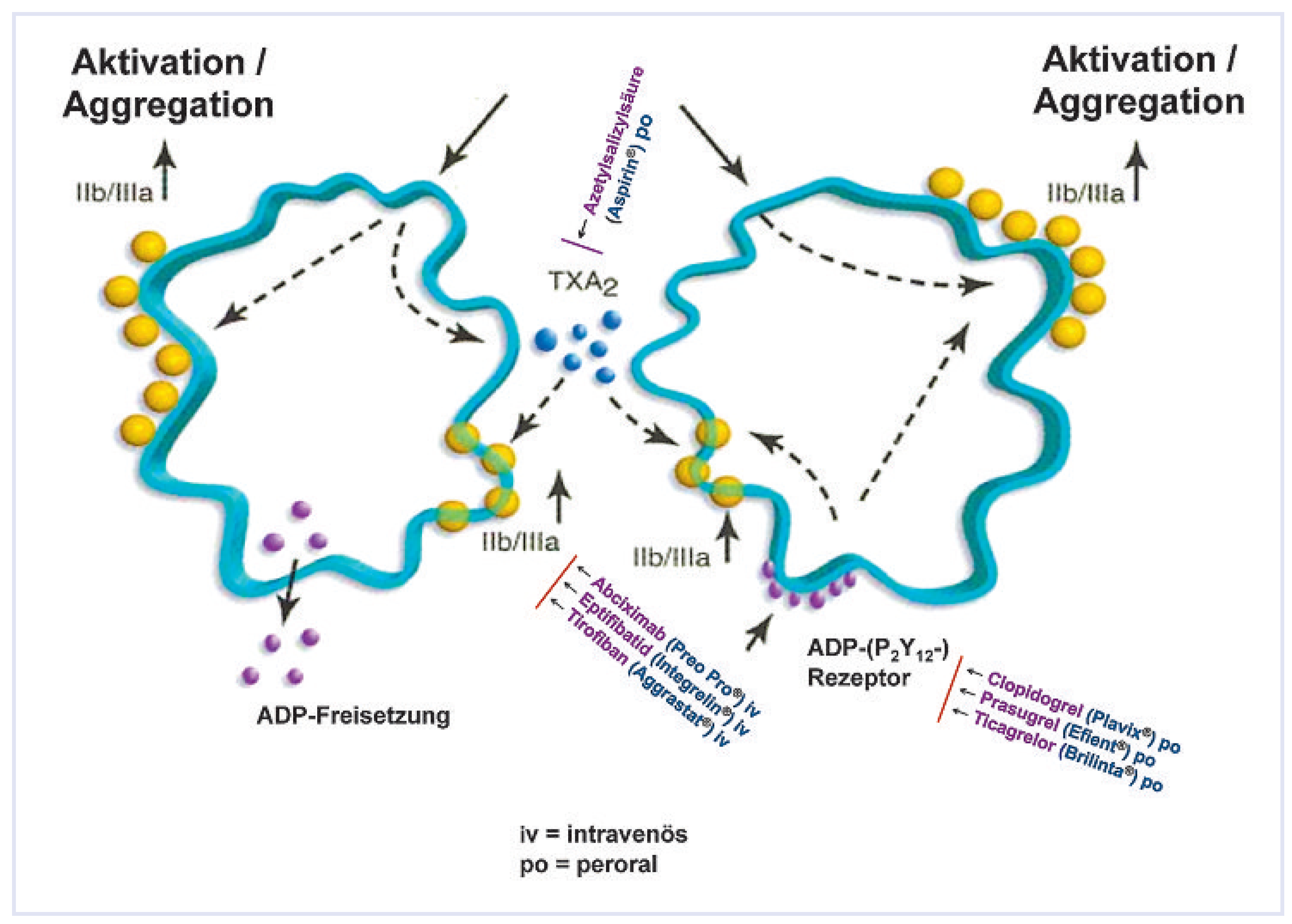
Abbildung 3.
Metabolismus und Wirkungsweg der klinisch getesteten P2Y12-Blutplättchenhemmer. Die Markennamen sind in Klammern angegeben.
Abbildung 3.
Metabolismus und Wirkungsweg der klinisch getesteten P2Y12-Blutplättchenhemmer. Die Markennamen sind in Klammern angegeben.
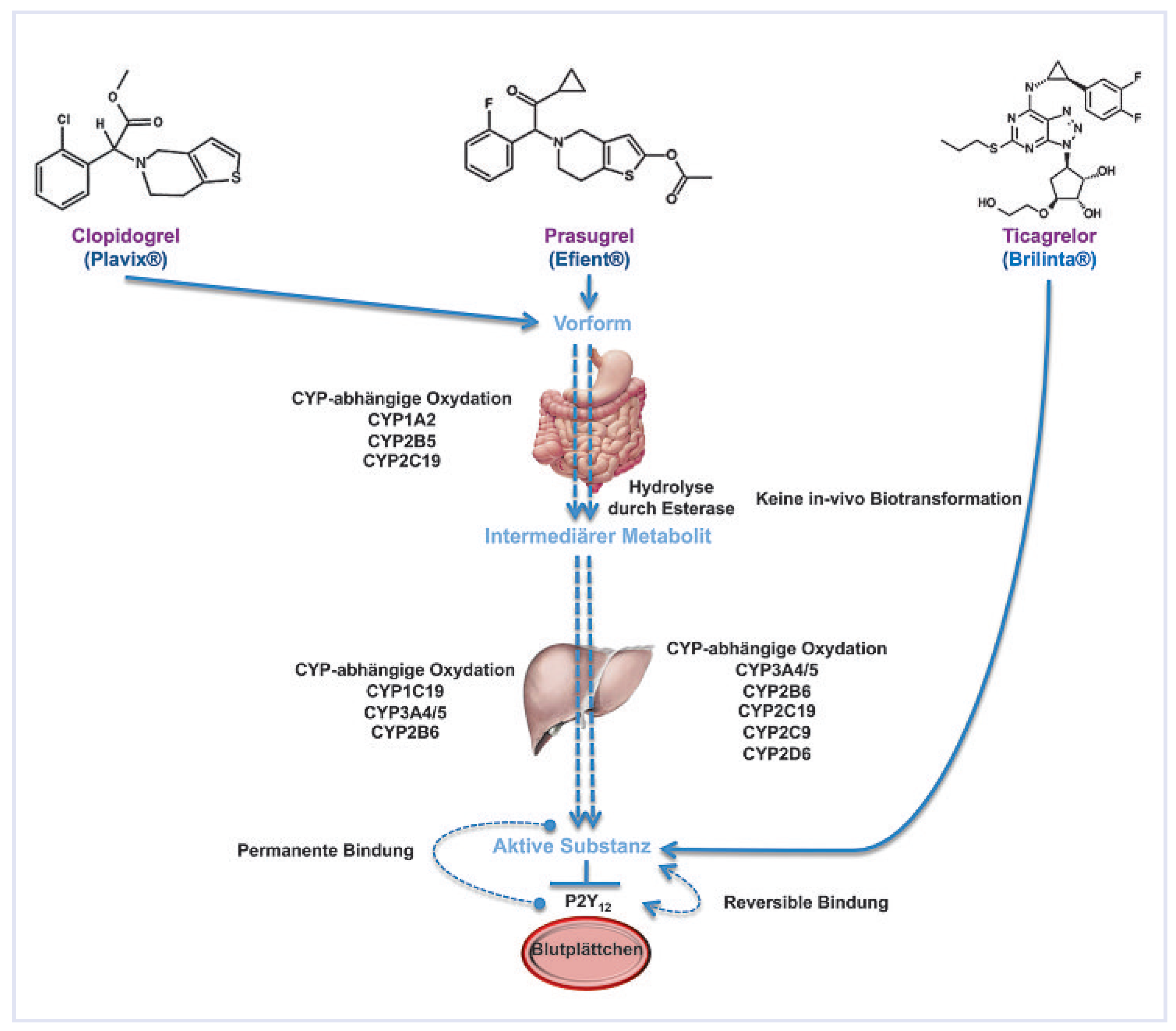
Prasugrel ist wie das Clopidogrel ein Thienopyridin, muss in der Leber aktiviert werden und hemmt die Blutplättchen irreversibel. Die Aktivierung erfolgt indes schneller und in einfacheren Schritten. Das kompetitiv von den Protonenpumpen-Inhibitoren verwendete CYP2C19 spielt dabei eine wesentlich geringere Rolle als beim Clopidogrel. In der TRITON-Studie [2] wurde bei Patienten mit akutem Koronarsyndrom auf dem Hintergrund von Azetylsalizylsäure mit 60 mg Ladedosis und 10 mg oraler Erhaltungsdosis von Prasugrel eine bessere Wirkung bezüglich Prävention von Herzinfarkt und Hirninfarkt bewirkt als mit Clopidogrel (300 mg Ladedosis und 75 mg Erhaltungsdosis). Allerdings war das Blutungsrisiko unter Prasugrel erhöht, weshalb bei der Markteinführung bei Patienten unter 60 kg eine kleinere Dosis Prasugrel empfohlen wird sowie vom Prasugrel-Einsatz bei Patienten über 75 Jahren und solchen mit vorangegangenem Hirninfarkt eher abgeraten wird. Zudem steht noch die Sorge einer etwas erhöhten Tumoranfälligkeit unter Prasugrel-Einnahme im Raum, welche offenbar nicht ausschliesslich dadurch bedingt ist, dass Magen-Darm-Tumoren oft durch blutverdünnende Mittel nur aufgedeckt und nicht verursacht werden.
Ticagrelor hat in der PLATO-Studie [3] vor einem Hintergrund mit Azetylsalizylsäure mit einer Ladedosis von 180 mg gefolgt von 2 × täglich 90 mg oraler Erhaltensdosis gegenüber Clopidogrel mit einer Ladedosis von 300 bis 600 mg und 75 mg Erhaltungsdosis sogar einen Überlebensvorteil gezeigt. Die Studie war riesig mit fast 20,000 Patienten und einem Jahr Verlaufsbeobachtung. Im Gegensatz zu Prasugrel wurde dieser Vorteil ohne erhöhtes Blutungsrisiko erreicht. Allerdings traten bei etwa 10% der Patienten unter Ticagrelor Atembeschwerden auf. Das Ticagrelor hat den Vorteil, ohne Metabolisierung aktiv zu sein. Damit wirkt es unabhängig von anderen Medikamenten. Ausserdem hemmt es die Blutplättchen reversibel, was einerseits eine rasche Neutralisierung der Wirkung ermöglicht, anderseits aber 2 × tägliche Verabreichung erfordert.
Die wesentlichen Merkmale der drei modernen oralen Blutplättchenhemmer sind in Abbildung 3 zusammengefasst.
Zusammenfassung
Seit bekannt ist, dass sowohl Herzinfarkt wie auch Hirnschlag auf einer Endothel-Ruptur mit initial vorwiegend blutplättchenbedingtem Thrombus basieren, liegt die Blutplättchenhemmung im Präventivfokus. Azetylsalizylsäure, der erste Blutplättchenhemmer der Geschichte, hat ihren Platz behauptet. Andere Blutplättchenhemmer wie Anturan, Dipyridamol oder Cilostazol sind entweder wieder verschwunden oder werden nur noch für einzelne Indikationen bzw. in wenigen Ländern verwendet. Clopidogrel hat seit zehn Jahren einen gesicherten Platz bei der Behandlung der Koronaren Herzkrankheit, vor allem im Zusammenhang mit kathetergestützten Eingriffen (Stenting). Es sieht sich der zunehmenden Konkurrenz von ähnlichen Medikamenten (Prasugrel, Ticagrelor) ausgesetzt, welche sowohl theoretisch als auch in klinischen Vergleichen Vorteile aufweisen. Die neuen Medikamente haben indes auch spezifische Nachteile, so dass wir von einer willkommenen Ergänzung des Therapiespektrums, nicht aber von einer Ablösung des Clopidogrels sprechen. Für die Sekundärprävention der Koronaren Herzkrankheit ist ein Blutplättchenhemmer obligatorisch und zwei sind empfehlenswert. Bei der Primärprävention ist die Datenlage unsicher und höchstens eine niedrige Dosis von Azetylsalizylsäure angezeigt.
Conflicts of Interest
Resarch grants und speaker bureau von Sanofi, Eli-Lilly, Astra Zeneca.
References
- Bhatt, D.L.; Flather, M.D.; Hacke, W.; Berger, P.B.; Black, H.R.; Boden, W.E.; et al. Patients with prior myocardial infarction, stroke, or symptomatic peripheral arterial disease in the CHARISMA trial. J Am Coll Cardiol. 2007, 49, 1982–1988. [Google Scholar] [CrossRef] [PubMed]
- Wiviott, S.D.; Braunwald, E.; McCabe, C.H.; Montalescot, G.; Ruzyllo, W.; Gottlieb, S.; et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2007, 357, 2001–2015. [Google Scholar] [CrossRef] [PubMed]
- Wallentin, L.; Becker, R.C.; Budaj, A.; Cannon, C.P.; Emanuelsson, H.; Held, C.; et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009, 361, 1045–1057. [Google Scholar] [CrossRef] [PubMed]
- Douglas, J.S., Jr; Holmes, D.R., Jr; Kereiakes, D.J.; Grines, C.L.; Block, E.; Ghazzal, Z.M.; et al. Coronary stent restenosis in patients treated with cilostazol. Circulation. 2005, 112, 2826–2832. [Google Scholar] [CrossRef] [PubMed]
- Jeong, Y.H.; Lee, S.W.; Choi, B.R.; Kim, I.S.; Seo, M.K.; Kwak, C.H.; et al. Randomized comparison of adjunctive cilostazol versus high maintenance dose clopidogrel in patients with high post-treatment platelet reactivity: results of the ACCEL-RESISTANCE (Adjunctive Cilostazol Versus High Maintenance Dose Clopidogrel in Patients With Clopidogrel Resistance) randomized study. J Am Coll Cardiol. 2009, 53, 1101–1109. [Google Scholar] [PubMed]
- Collaboration ATs. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002, 324, 71–86. [Google Scholar] [CrossRef] [PubMed]
- Brandt, J.T.; Payne, C.D.; Wiviott, S.D.; Weerakkody, G.; Farid, N.A.; Small, D.S.; Jakubowski, J.A.; Naganuma, H.; Winters, K.J. A comparison of prasugrel and clopidogrel loading doses on platelet function: magnitude of platelet inhibition is related to active metabolite formation. Am Heart J. 2007, 153, 66. [Google Scholar] [CrossRef] [PubMed]
- Sugidachi, A.; Ogawa, T.; Kurihara, A.; Hagihara, K.; Jakubowski, J.A.; Hashimoto, M.; Niitsu, Y.; Asai, F. The greater in vivo antiplatelet effects of prasugrel as compared to clopidogrel reflect more efficient generation of its active metabolite with similar antiplatelet activity to that of clopidogrel’s active metabolite. J Thromb Haemost. 2007, 5, 1545–1551. [Google Scholar] [CrossRef] [PubMed]
- Schomig, A. Ticagrelor—is there need for a new player in the antiplatelet-therapy field? N Engl J Med. 2009, 361, 1108–1111. [Google Scholar] [CrossRef] [PubMed]
- Bhatt, D.L. Prasugrel in clinical practice. N Engl J Med. 2009, 361, 940–942. [Google Scholar] [CrossRef] [PubMed]
- Williams, D.O. Clopidogrel pretreatment for percutaneous coronary intervention: double, double, dose in trouble? Circulation. 2005, 111, 2019–2021. [Google Scholar] [CrossRef] [PubMed][Green Version]
- O’Donoghue, M.L.; Braunwald, E.; Antman, E.M.; Murphy, S.A.; Bates, E.R.; Rozenman, Y.; et al. Pharmacodynamic effect and clinical efficacy of clopidogrel and prasugrel with or without a proton-pump inhibitor: an analysis of two randomised trials. Lancet. 2009, 374, 989–997. [Google Scholar] [CrossRef] [PubMed]
- Wiviott, S.D.; Trenk, D.; Frelinger, A.L.; O’Donoghue, M.; Neumann, F.J.; Michelson, A.D.; et al. Prasugrel compared with high loading- and maintenance-dose clopidogrel in patients with planned percutaneous coronary intervention: the Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44 trial. Circulation. 2007, 116, 2923–2932. [Google Scholar] [PubMed]
- Mehta, S.R.; Bassand, J.P.; Chrolavicius, S.; Diaz, R.; Fox, K.A.; Granger, C.B.; Jolly, S.; Rupprecht, H.J.; Widimsky, P.; Yusuf, S. Design and rationale of CURRENT-OASIS 7: a randomized, 2 × 2 factorial trial evaluating optimal dosing strategies for clopidogrel and aspirin in patients with ST and non-ST-elevation acute coronary syndromes managed with an early invasive strategy. Am Heart J. 2008, 156, 1080–1088. [Google Scholar] [CrossRef] [PubMed]
© 2010 by the author. Attribution-Non-Commercial-NoDerivatives 4.0.
