Einleitung
Der Zigarettenkonsum ist weltweit immer noch vor allem in Entwicklungsländern am Wachsen [
1]. Das Aufgeben des Rauchens kann nicht nur das Fortschreiten von Folgeerkrankungen bremsen, sondern unter anderem das kardiovaskuläre Risiko praktisch halbieren [
2]. Mit der Motivation zur Rauchfreiheit kann schliesslich das Ausmass an relevanter Morbidität und frühzeitiger Mortalität reduziert werden. Rauchfrei werden bleibt jedoch häufig ein schwieriges Unterfangen, weil damit nicht nur eine Lebensstil-Anpassung verbunden, sondern auch eine Nikotinabhängigkeit zu überwinden ist. Das Suchtpotential von N ikotin kann mit demjenigen einer Alkohol- oder Opiatabhängigkeit verglichen werden. Ein wiederholter Nikotinkonsum führt über zentrale nikotinerge Acetylcholin-Rezeptoren (nAChR) zu einer Stimulation von diversen Neurotransmittern, wobei dem Dopamin wegen seiner Wirkung auf die Befindlichkeit die wichtigste Rolle zukommt. Der Nikotine ntzug kann zu psychischen und physischen Symptomen führen wie Craving, dem heftigen Verlangen, weiterzurauchen. Zur Basisbehandlung der Abhängigkeit von Tabak gehören Verhaltensmassnahmen, die durch eine pharmakologische Therapie unterstützt werden können [
3].
Zur Rauchentwöhnung wurde 1984 erstmals Nikotin als Kaugummi durch die FDA zugelassen. Dem Konzept der Nikotinersatztherapie (NRT) folgten diverse Formulierungen von Nikotinersatzprodukten. Bei deutlich geringeren negativen biologischen Effekten und vor allem fehlender Kanzerogenität kann mit Hilfe von NRT praktisch eine doppelt so hohe Erfolgsrate der Raucherabstinenz erreicht werden wie mit Plazebo [
4].
Mit anderem Therapieansatz folgte 1997 Bupropion als erstes nikotinfreies Medikament zur Rauchentwöhnung. Ursprünglich wurde die Substanz als Antidepressivum entwickelt. Der Aufnahmehemmer von Dopamin und Noradrenalin mit gleichzeitiger Blockade zentraler nAChR hat sich wegen seiner Wirksamkeit schliesslich als medikamentöse Begleittherapie bei der Aufgabe des Rauchens durchgesetzt. Im Vergleich zu Plazebo konnte auch hier eine doppelt so hohe Erfolgsrate mit Raucherabstinenz über 12 Monate belegt werden [
5].
Rimonabant, ein Cannabinoid-Rezeptor-Antagonist, entwickelt zur Gewichtsreduktion, hat im Tierversuch zwar erfolgversprechende, in Phase-IIIUntersuchungen beim Menschen aber inkonsistente Resultate zur Nikotinabstinenz ergeben [
6]. Kürzlich wurde für Rimonabant sogar aufgrund psychiatrischer und neurologischer Nebenwirkungen die Zulassung sistiert.
Mit der Einführung 2006 erweitert Vareniclin als partieller Agonist zentraler nikotinerger AcetylcholinRezeptoren das Therapiespektrum zur medikamentös unterstützten Rauchentwöhnung.
Chemie und Pharmakologie
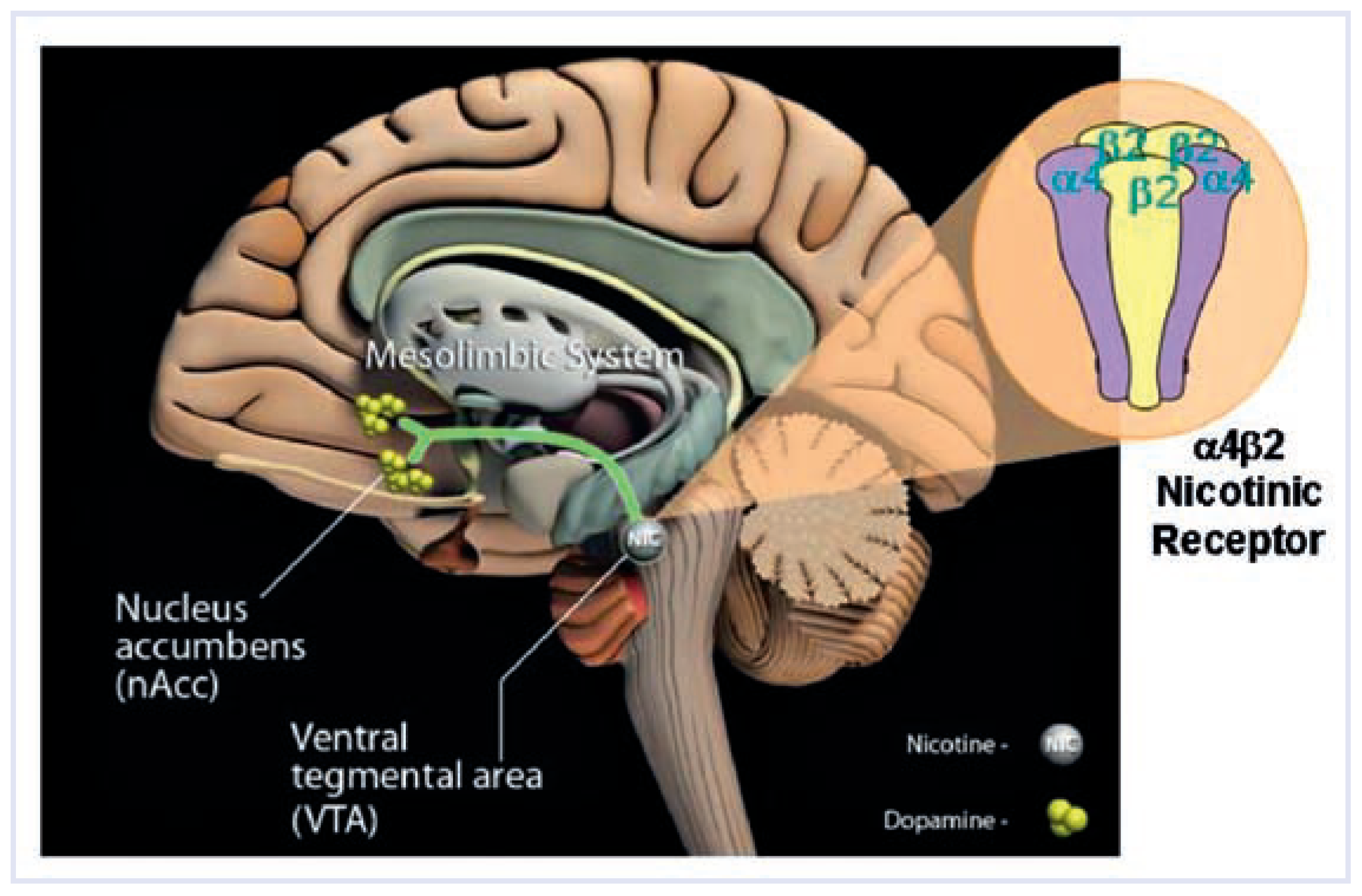
Zentrale nAChR, welche durch den endogenen Liganden Acetylcholin eine schnelle synaptische Übertragung ermöglichen, sind zu einem Hauptziel in der pharmakologischen Therapie von Schmerzen, Kognition, Schizophrenie und Nikotinabhängigkeit geworden.
Die Aktivierung des nAChR-Subtyps α
4β
2 mit Nikotin erhöht die Dopaminfreisetzung im Nucleus accumbens und präfrontalen Cortex, ein biochemischer Mechanismus, der bei diversen suchterregenden Substanzen zum Tragen kommt. Die stimulierende Wirkung von Nikotin wie auch die Entstehung von Entzugssymptomen wird auf die veränderte Dopaminproduktion im mesolimbischen System zurückgeführt (
Figure 1). Mit ihrer grossen Affinität für Nikotin bieten α
4β
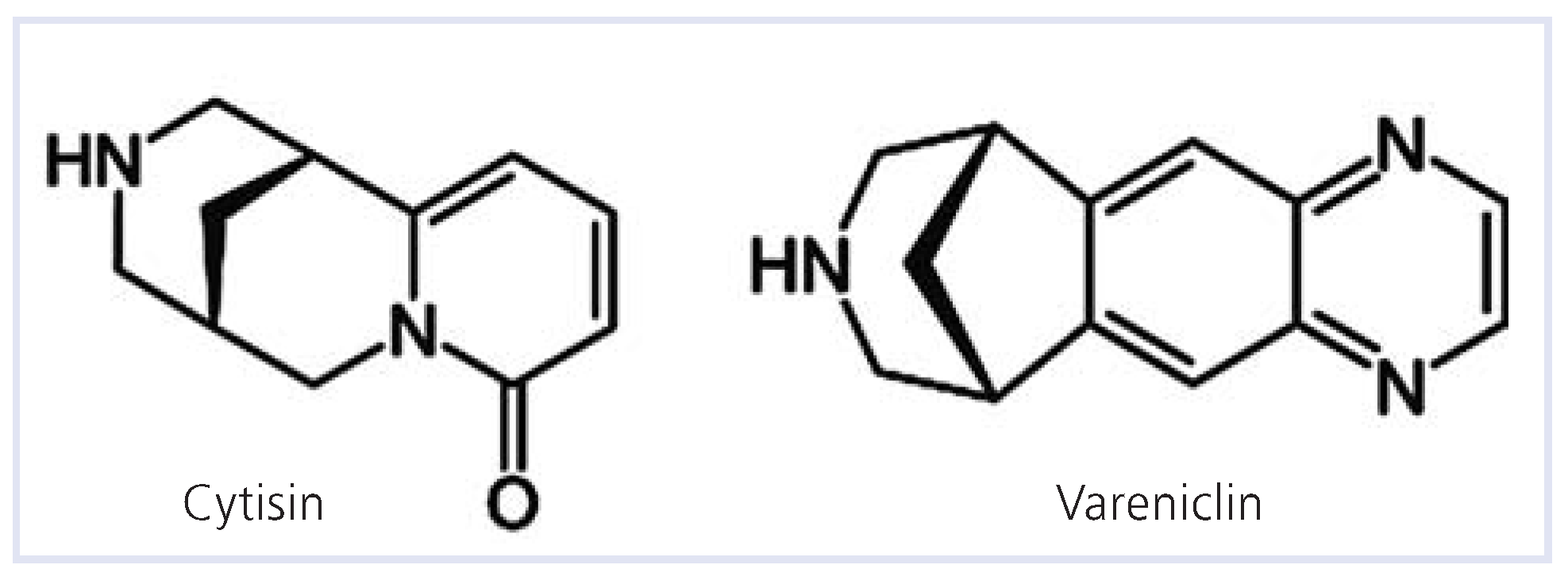
2-nAChR ein attraktives pharmakologisches Ziel zur Behandlung der Nikotinsucht. Cytisin, ein Chinolizidin-Alkaloid, kommt in der Strauchart Goldregen vor und wirkt dort als Insektizid. Seit der Durchführung mehrerer Studien in den sechziger Jahren wurde Cytisin vor allem in Osteuropa zur Unterstützung bei der Rauchentwöhnung eingesetzt. Papke konnte zeigen [
7], dass Cytisin eine p artiell agonistische und antagonistische Wirkung am α
4β
2-nAChR entfaltet. Mit analoger chemischer Wirkung wie Cytisin, aber mit verbesserten pharmakologischen Eigenschaften, konnte das neue spezifisch wirkende Vareniclin entwickelt werden [
8] (
Figure 2). Die als Tartrat vorhandene Substanz wirkt auch kombiniert, agonistisch durch kompetitive und hoch selektive Bindung am nAChRSubtyp α
4β
2 sowie antagonistisch durch Verdrängung von Nikotin an der Bindungsstelle. Diese Wirkungsweise liess sich elektrophysiologisch in vitro und neurochemisch in vivo dokumentieren. Der duale Mechanismus bringt einen therapeutischen Vorteil, indem eine überschiessende Nikotinrezeptor-Aktivierung und damit die mesolimbische Dopaminstimulation, welcher die Verstärkung (Reinforcement) und verspürte Belohnung nach dem Rauchen zugrunde liegt, abgeschwächt werden. Vareniclin wird nach oraler Einnahme fast vollständig resorbiert, maximale Plasmaspiegel werden nach 3–4 Stunden gemessen. Eine gleichzeitige Nahrungsaufnahme hat wenig Einfluss auf die systemische Verfügbarkeit, die Proteinbindung im Plasma ist gering. Die Eliminations-Halbwertszeit beträgt ca. 24 Stunden. Ein Steady-state der Plasmaspiegel wird bei regelmässiger Verabreichung nach etwa 4 Tagen erreicht [
9]. Vareniclin unterliegt einem minimalen Metabolismus und wird zum grössten Teil (92%) unverändert ausgeschieden. Bei moderater Niereninsuffizienz (Kreatinin-Clearance 30–50 mL/min) ist mit 1,5-facher und bei schwerer Niereninsuffizienz (Kreatinin-Clearance <30 mL/min) mit 2,1-facher PlasmaKonzentration zu rechnen. Bei mehreren nachgewiesenen Metaboliten ist im Einzelnen unbekannt, ob und wie stark diese pharmakologisch aktiv sind. Zu Interaktionen von Vareniclin ist nur wenig bekannt. Geprüft mit Digoxin, Warfarin, transdermalem Nikotin, Bupropion und Metformin konnte keine MedikamentenInteraktion festgestellt werden. Nach Angaben der Herstellerfirma verzögert jedoch Cimetidin durch Hemmung des Transporters für organische Kationen (OCT2) die renale Elimination von Vareniclin. Ferner konnte kein Einfluss auf das hepatische ZytochromP450-System nachgewiesen werden, was bei der Elimination von Vareniclin auch keine wesentliche Rolle spielt. Die S icherheit und Wirksamkeit von Vareniclin in Kombination mit anderen Therapien zur Rauchentwöhnung wurden nicht systematisch untersucht. Die Pharmakokinetik von Bupropion wird durch Vareniclin nicht beeinflusst. Die gleichzeitige Anwendung einer Nikotinersatztherapie führt zu geringem Blutdruckabfall und vor allem gehäuft zu gastrointestinalen Nebenwirkungen [
10].
Klinische Anwendung
In zwei Phase-II-Studien mit insgesamt 1285 Probanden liess sich eine optimale Dosierung von 1 mg Vareniclin zweimal täglich über 12 Wochen ermitteln. Im Verträglichkeitstest konnten durch ein Auftitrieren während einer Woche von 1 × 0.5mg auf 2 × 1 mg täglich gegenüber einem Therapiestart mit 2 mg Vareniclin täglich vor allem die häufigen gastrointestinalen Nebenwirkungen reduziert werden. Unter Anwendung von Vareniclin konnte eine signifikant bessere Nikotinabstinenz im Vergleich zu Plazebo innerhalb eines Jahres gefunden werden [
11,
12]. In den zwei grössten identisch konzipierten Phase-III-Studien mit 2045 Probanden und Vareniclin 2 × 1 mg täglich während 12 Wochen im Vergleich mit Bupropion 2 × 150 mg täglich und Plazebo war die Abstinenzrate von Nikotin nach 3 und 12 Monaten für beide Prüfsubstanzen im Vergleich zu Plazebo signifikant höher [
13,
14]. Vareniclin war Bupropion in beiden Untersuchungen jedoch nur während der ersten 3 Monate statistisch überlegen. Bei vergleichbarer Studiengrösse hat nach 12 Monaten nur in einer Studie [
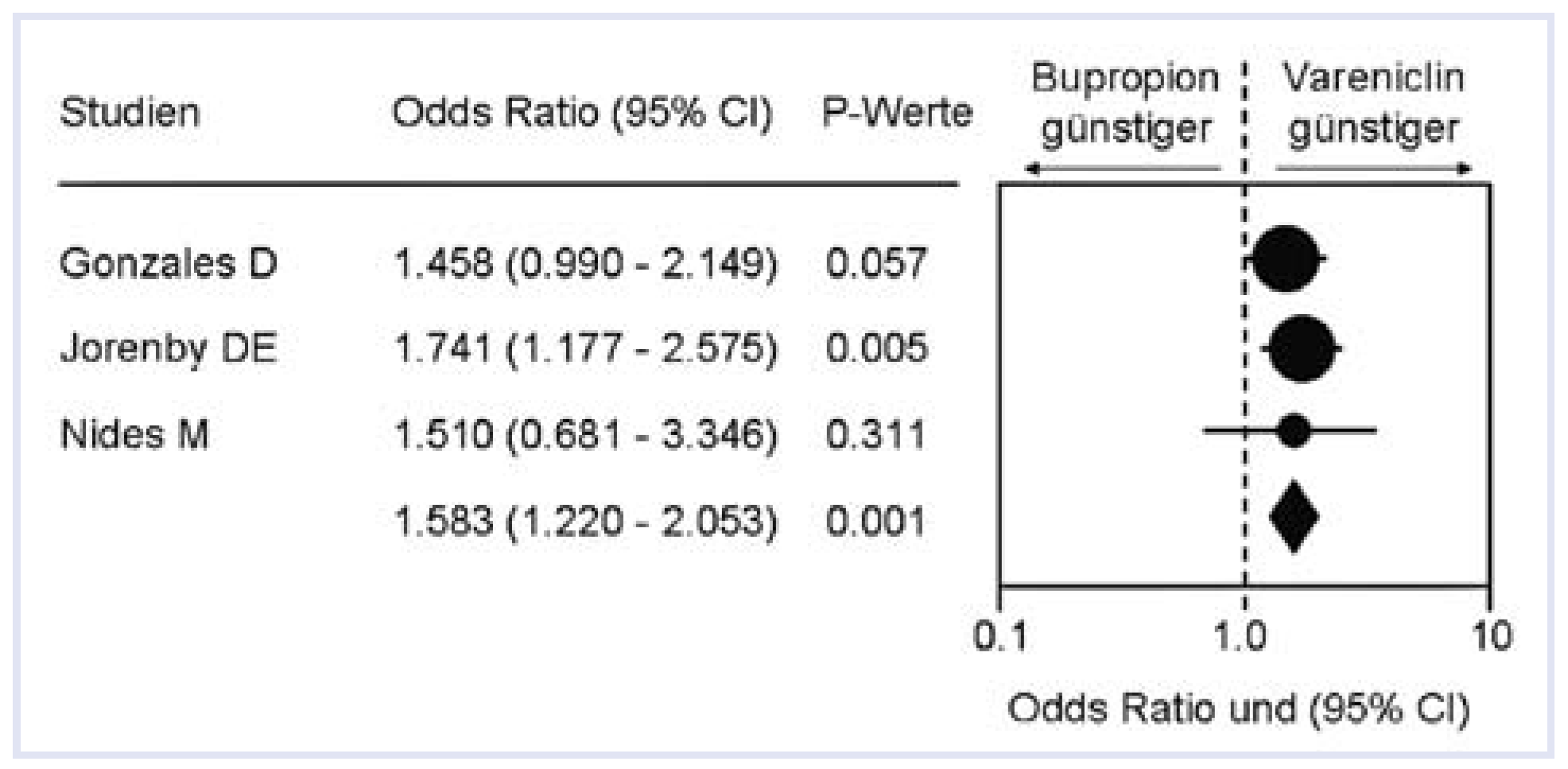
14] die Abstinenzrate nach Behandlung mit Vareniclin signifikant besser als unter Bupropion abgeschnitten. Abgeschwächt werden die Studienergebnisse durch die hohe Abbruchrate bis zum Studienende, wodurch nach einem Jahr nur noch 61% der Studienpopulation analysiert wurden. Lediglich aufgrund der Daten von Jorenby [
14] erreichte eine Metaanalyse der vorhandenen Studien zum direkten Vergleich einen signifikanten Vorteil von Vareniclin für die 12-monatige Nikotinabstinenz [
15,
16] (
Figure 3).
Im direkten Vergleich wurde Vareniclin (konstante Dosis mit 1 mg 2 × täglich während 12 Wochen) bei 746 Rauchern mit einer transdermalen Nikotinersatztherapie (mit üblicher sukzessiver Dosisreduktion innert 10 Wochen) nach 12 Wochen und nach einem Jahr verglichen [
17]. Gegen Ende der jeweils dreimonatigen Behandlungsphase war die Abstinenzrate unter Vareniclin signifikant höher, nach einem Jahr aber nicht mehr statistisch unterschiedlich. Infolge vorzeitigen Studienabbruchs konnten als limitierender Faktor lediglich 64% der Teilnehmer bis ans Studienende beobachtet werden. Folgen des Rauchstopps wie Craving und allgemeine Entzugssymptomatik sowie das Vergnügen beim Weiterrauchen waren unter Vareniclin weniger ausgeprägt, Nebenwirkungen wie Nausea, Schlaflosigkeit oder Kopfschmerzen jedoch verstärkt. In der Vareniclin-Gruppe wurde zudem von einem Patienten mit Suizidgedanken berichtet.
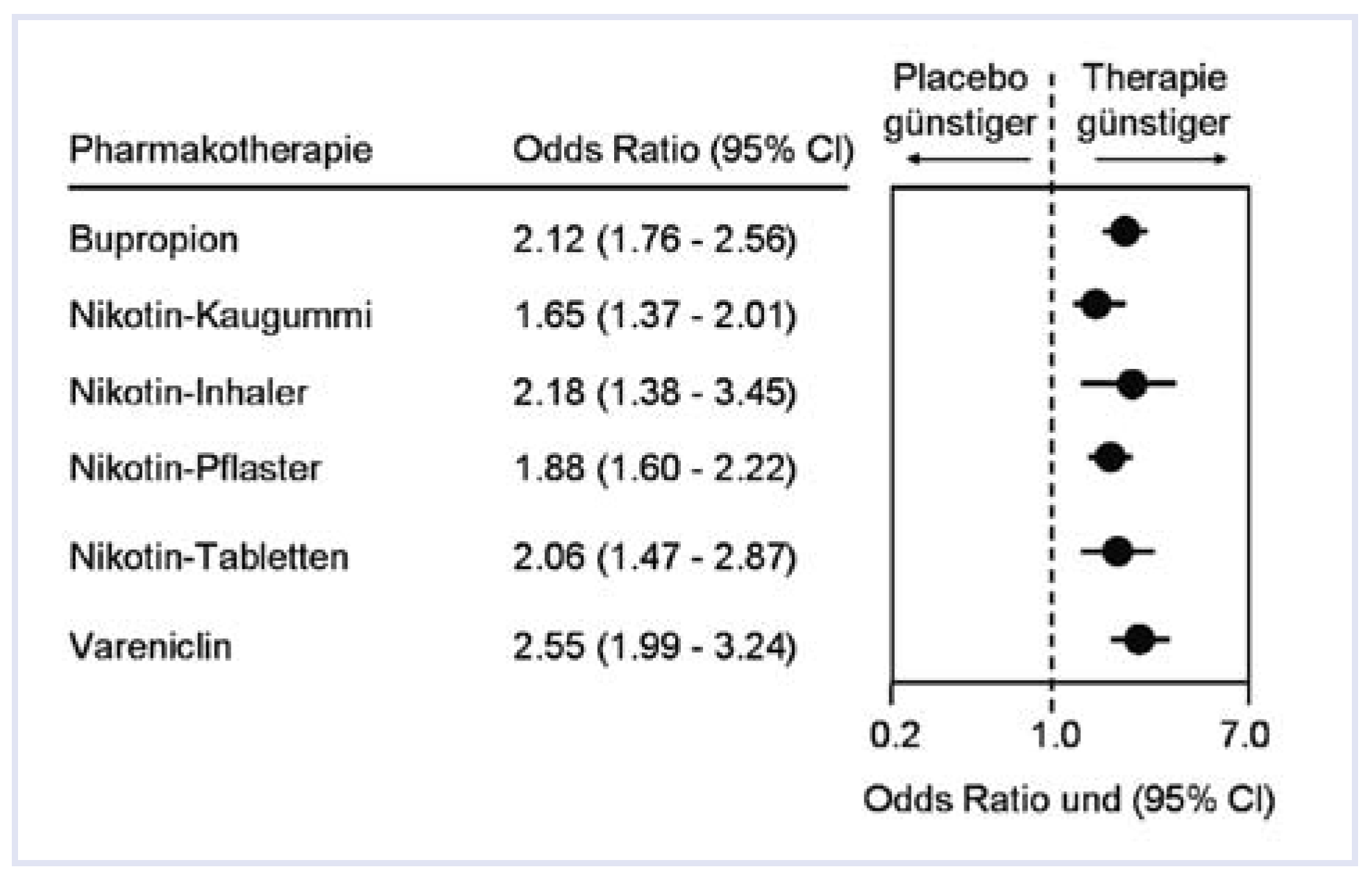
In neusten Analysen gepoolter Daten für eine pharmakologische Unterstützung zur Rauchabstinenz waren alle gängigen Therapieformen wirksamer als Plazebo, allen voran Vareniclin. Die Resultate von Bupropion und Nikotinersatztherapien wurden für die Therapiedauer, Dosierung und konstantes versus ausschleichendes Regime korrigiert [
18] (
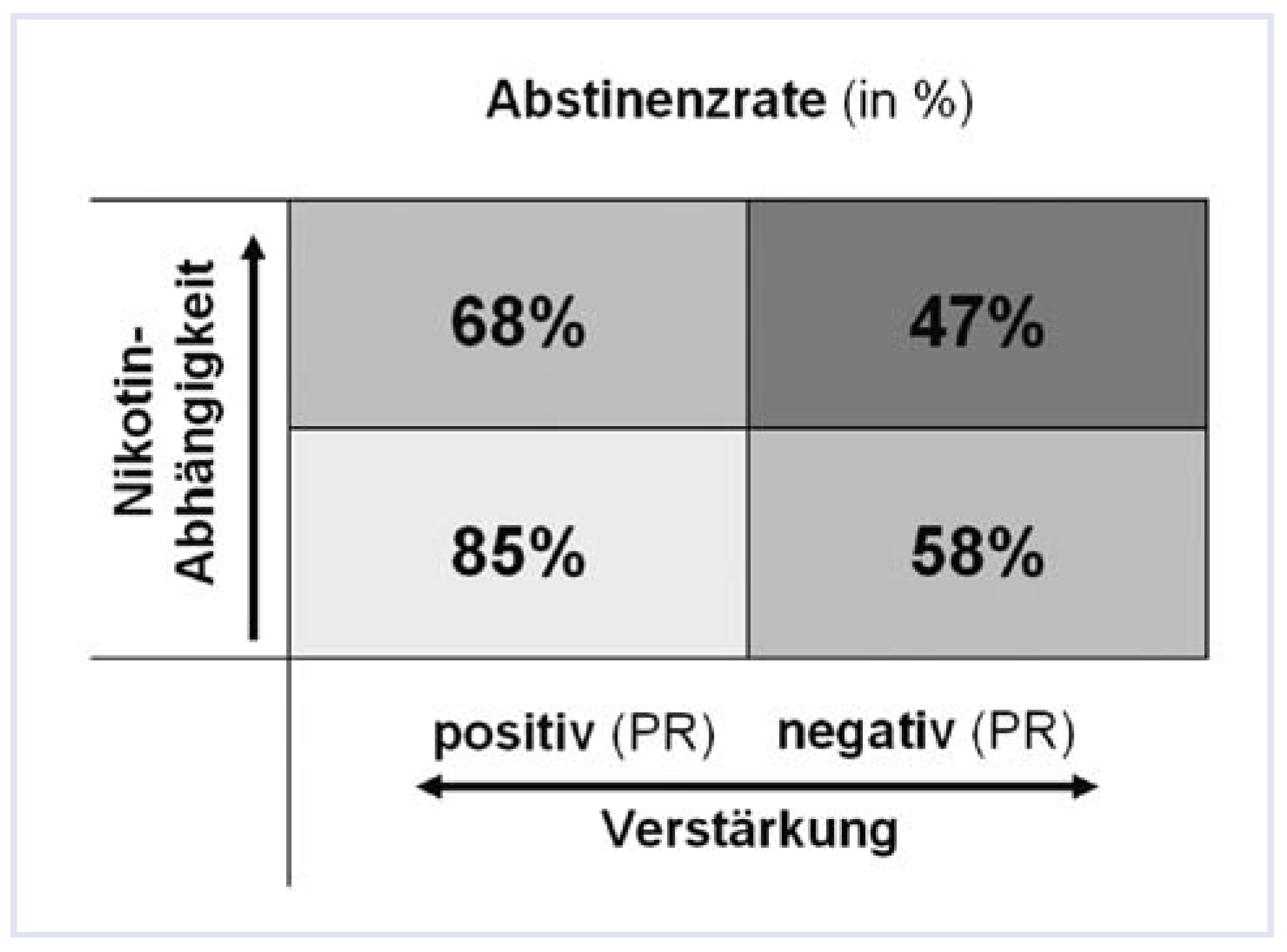
Figure 4). Der Erfolg einer anhaltenden Nikotinabstinenz ist unter anderem auch abhängig vom Schweregrad der Nikotinabhängigkeit sowie vom Phänomen einer eher positiven oder negativen Verstärkung des Nikotineffektes. In einem Kollektiv von Rauchern, anhand des Fagerström-Tests für Nikotinabhängigkeit (FTND) unterteilt in Kategorien mit geringer, mittlerer und hoher Abhängigkeit, konnte für alle Schweregrade eine Wirksamkeit belegt werden, wobei mit steigendem Abhängigkeitsgrad der Nutzen von Vareniclin tendenziell abgenommen hat [
19]. Bei dominierend positiver Verstärkung (durch Nikotin vermehrte Wachsamkeit, Verbesserung von Kognition, Stimmung usw.) liegt die Abstinenzrate höher als bei negativer Verstärkung (durch Nikotin Verminderung der Entzugssymptomatik wie Unruhe, Irritierbarkeit, Ängstlichkeit, Schlaflosigkeit, Craving usw.) [
20]. Aufgrund dieser Zusammenhänge postuliert Fagerström, dass Vareniclin mit seiner dualen, partiell agonistischen und antagonistischen Wirkung beim Nikotinstopp beide Formen der Verstärkung (Reinforcement) beeinflusst und deshalb eine höhere Erfolgsrate aufweist [
21] (
Figure 5).
Unerwünschte Wirkungen und Sicherheit
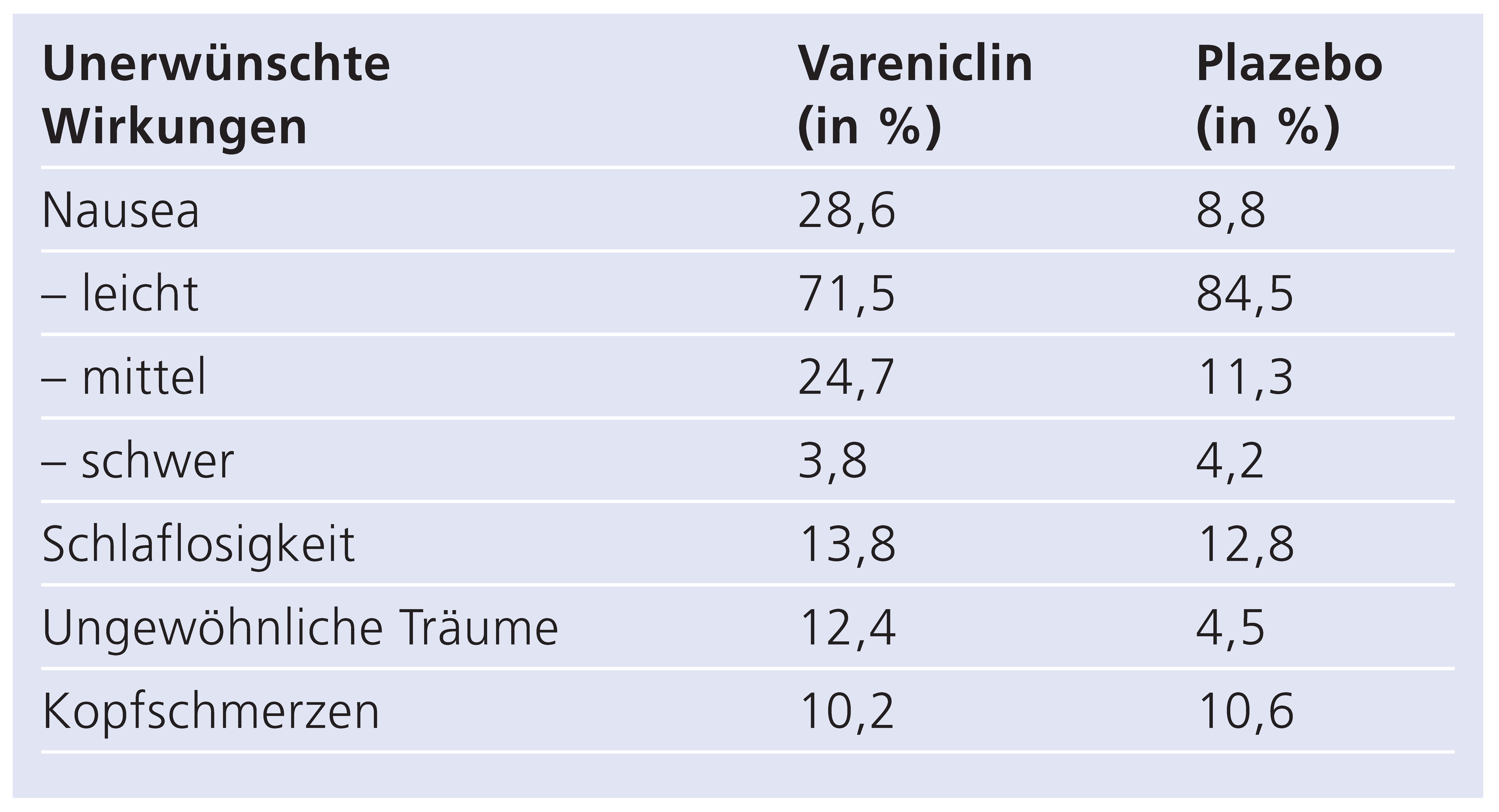
In der Sicherheitsprüfung der gepoolten Daten aus den bereits erwähnten beiden Phase-III-Studien [
13,
14] sind als häufigste Nebenwirkungen unter Vareniclin dosisabhängig bei rund 29% Nausea, bei 14% Schlafl osigkeit und bei 10% Kopfschmerzen aufgetreten. Dabei war unter Vareniclin Nausea häufiger als unter Bupropion (10%) oder unter Plazebo (9%). Die Abbruchrate wegen mehrheitlich milder oder selten mässig ausgeprägter Nausea fiel hingegen gering aus mit 3% bei Vareniclin, 1% bei Bupropion und <1% bei Plazebo (
Table 1). Die Übelkeit war um die zweite Woche herum am stärksten und hat im Verlauf der weiteren Behandlung abgenommen oder ist verschwunden. Insgesamt waren Therapieabbrüche aber am häufigsten unter Bupropion (14%), gefolgt von Vareniclin (10%) und Plazebo (8%) [
22]. Unter Vareniclin war die Gewichtszunahme ähnlich wie in der Plazebogruppe. Seltenere unerwünschte Wirkungen sind Obstipation, Flatulenz, Mundtrockenheit, Nasen-Rachen-Ent- zündungen, Schwindel, Unruhe und Ängste.
Vor allem in den USA wurden kürzlich Berichte bekannt über depressive Stimmungslage, Agitation, auffällige Verhaltensänderungen, Suizidgedanken und Suizid bei Patienten, welche mit Vareniclin versucht hatten, das Rauchen aufzugeben.
Das Aufhören mit Rauchen mit oder ohne medikamentöse(r) Unterstützung kann von Nikotinentzugssymptomen und Verschlechterung einer psychiatrischen Grunderkrankung begleitet sein. Die Rolle von Vareniclin in solchen Fällen ist unbekannt.
Im Februar 2008 erliess die FDA Warnungen vor ernsthaften neuropsychiatrischen Komplikationen unter Vareniclin beziehungsweise möglicher Verschlechterung schizo-affektiver und manisch-depressiver Erkrankungen. Ergänzend wurden im Mai 2008 Empfehlungen für eine vorsichtige Therapie mit Vareniclin publiziert [
23].
Analog zu den Behörden in den USA wurde im Dezember 2007 in Europa durch die EMEA (European Agency for the Evaluation of Medicinal Products) vor diesen r isikoreichen Nebenwirkungen gewarnt und eine e ntsprechende Anpassung der Produkteinformation von Vareniclin bewirkt [
24].
Seit der Einführung von Vareniclin 2006 wurden in der Schweiz weniger als 50 medikamentenassoziierte Ereignisse gemeldet, davon bloss in weniger als 20% mit psychischen Symptomen, jedoch wurde nie von Suizidgedanken berichtet. Als Konsequenz der internationalen Warnungen informierte die Swissmedic im April 2008 über das Risiko möglicher ernsthafter neuropsychiatrischer Komplikationen oder einer Aggravation vorbestehender psychiatrischer Erkrankungen unter der Therapie mit Vareniclin.
Therapieempfehlungen
Vareniclin (in der Schweiz und Europa erhältlich als Champix
®) steht als nicht kassenzulässige Tabletten zu 0,5 mg und 1 mg zur Verfügung. Ein Behandlungsbeginn wird 1–2 Wochen vor dem geplanten Rauchstopp empfohlen. Wegen der zu erwartenden Übelkeit soll Vareniclin einschleichend dosiert werden: 3 Tage mit 1 × 0.5 mg täglich, 4 Tage 2 × 0.5 mg täglich und erst danach 2 × 1 mg täglich. Eine sogenannte «Initialpackung» (11 Tabletten zu 0,5 mg und 14 Tabletten zu 1 mg) reicht so für die ersten zwei Behandlungswochen. Eine reichliche Flüssigkeitszufuhr zusammen mit der Tabletteneinnahme soll mithelfen, dass weniger Übelkeit entsteht. Bei schlechter Verträglichkeit kann die Dosis längerfristig auf 2 × 0.5 mg täglich reduziert werden. Personen, die nach 12 Wochen Behandlung nicht mehr rauchen, können zur Verbes- serung einer langfristigen Abstinenz nochmals weitere 12 Wochen behandelt werden [
25]. Sicherheitsdaten liegen bis zu einer Behandlungsdauer von einem Jahr vor [
26].
Bei Patienten mit schwerer Niereninsuffizienz (geschätzte Kreatinin-Clearance <30 mL/min) beträgt die empfohlene Dosis 1 × 1 mg täglich. Aufgrund ungenügender klinischer Erfahrungen wird bei Jugendlichen Vareniclin nicht empfohlen. Auch ohne tierexperimentellen Nachweis einer teratogenen Wirkung (Kategorie C) sollte angesichts der Nutzen-Risiko-Abwägung Vareniclin sowohl in der Schwangerschaft als auch in der Stillzeit nicht angewandt werden. Aufgrund möglicher Nebenwirkungen wie Schläfrigkeit und Schwindel wird vom Hersteller die Einnahme von Vareniclin bei potentiell gefährlichen Tätigkeiten (z.B. Bedienung komplizierter Maschinen oder Verkehrsmittel) nicht empfohlen [
27,
28]. Droht aufgrund früherer Erfahrungen durch den Nikotinstopp eine störende Gewichtszunahme, kann mit Bupropion eher eine Gewichtskontrolle erreicht werden als mit Vareniclin, das häufig auch zu einer Appetitsteigerung führt. Aufgrund der unterschiedlichen und zum Teil konkurrenzierenden Wirkmechanismen scheint eine Kombination von Vareniclin mit Nikotinersatzprodukten weniger sinnvoll. Dazu wurden auch keine Untersuchungen zur Sicherheit und Wirksamkeit durchgeführt. Unabhängig vom Einsatz von Vareniclin sollten jedoch die physiologischen Veränderungen verbunden mit dem Rauchstopp hinsichtlich Pharmakokinetik und Pharmakodynamik berücksichtigt werden, so zum Beispiel Dosisanpassungen bei Theophyllin, Kumarin und Insulin.
Schlussfolgerungen
Vareniclin ist ein Medikament zur Unterstützung der Rauchentwöhnung der neusten Generation. Der natürlichen Substanz Cytisin nachempfunden, bindet Vareniclin-Tartrat an gleicher Stelle wie Nikotin an den spezifischen zentralen nikotinergen Acetylcholin-Rezeptoren (nAChR) vom Subtyp α4β2. Das neue Medikament greift damit in die mesolimbische Dopaminregulation ein, welche für die stimulierende Wirkung beim Nikotinkonsum, aber auch für die Entzugssymptomatik verantwortlich ist. Die von der Herstellerfirma durchgeführten Phase-III-Studien weisen darauf hin, dass Vareniclin die Entwöhnung vom Rauchen wirksamer unterstützen kann als das bisher zu diesem Zweck eingesetzte Bupropion oder Nikotinersatzprodukte. Gegenüber Plazebo erhöht Vareniclin die Chance für eine Abstinenz nach einem Jahr um etwa das Dreifache. Im direkten Vergleich ist Vareniclin sowohl Bupropion als auch einem Nikotinersatz überlegen, wobei nach einem Jahr die statistische Signifikanz abnimmt. Ein positiver Langzeiteffekt muss erst noch belegt werden. Die bessere Wirksamkeit könnte durch den partiell agonistischen und antagonistischen Wirkmechanismus begründet werden.
Präliminäre Daten weisen darauf hin, dass die Abstinenzrate des Tabakkonsums vom Schweregrad der Nikotinabhängigkeit wie auch von individuellen Faktoren wie der Neigung zu positiver oder negativer Verstärkung (Reinforcement) abhängig ist. Die weitere Erforschung solcher Zusammenhänge könnte helfen, die Effizienz und Individualisierung von Rauchentwöhnungsprogrammen zu verbessern. Bei unterstützendem Einsatz von Medikamenten zum Nikotinstopp ist zu bedenken, dass die meisten Rauchenden mehr als einen Anlauf für eine anhaltende Abstinenz benötigen. Trotz intensiver Unterstützung ist der Erfolg für eine langfristige Rauchfreiheit eher gering, die Abstinenzrate liegt in den Studien nach einem Jahr unter 25%.
Indem zahlreiche Raucher im Verlauf häufig pulmonale und/oder kardiovaskuläre Komplikationen erleiden, hat der Rauchstopp auch eine wichtige Bedeutung in der Sekundärprävention. Gerade bei solchen Patienten soll bei Bedarf eine medikamentöse Unterstützung zur Rauchentwöhnung eingesetzt werden können. Bei geringem Interaktionspotential und guter Wirksamkeit kann Vareniclin unter Berücksichtigung allgemeiner pharmakologischer Regeln auch einer etablierten Polymedikation beigefügt werden.
Gegenüber Bupropion und der Nikotinersatztherapie treten unter Vareniclin jedoch häufiger vor allem gastrointestinale Nebenwirkungen auf. Nachteilig ist auch, dass nach dem Rauchstopp mit Vareniclin eine Gewichtszunahme nicht zu bremsen ist. Die Kombination von Vareniclin mit Nikotinersatzprodukten ist bei mangelnder Dokumentation eines zusätzlichen Nutzens und bei Ausprägung der Nebenwirkungen nicht empfohlen. Aufgrund der Einschlusskriterien von bisher durchgeführten Studien dürfen die Ergebnisse nicht ohne weiteres auf jugendliche Rauchende übertragen werden. Bei Personen mit vorbestehender Depression oder anderen psychiatrischen Erkrankungen ist beim Einsatz von Vareniclin wegen möglicher Krankheitsaggravation und potentiellem Suizidrisiko Vorsicht geboten. Die kürzlichen Warnungen der amerikanischen und europäischen Behörden über neuropsychiatrische Symptome unter der Therapie machen präzise Sicherheitsanalysen dringend notwendig. Vareniclin scheint zwar aufgrund der aktuellen Datenlage für die Unterstützung eines geplanten Rauchstopps am effektivsten, beim therapeutischen Einsatz ist jedoch auf Begleiterscheinungen und Nebenwirkungen zu achten. In der Behandlung zur Rauchentwöhnung haben die bisherigen Medikamente wie Bupropion und Nikotinersatzprodukte nach wie vor einen wichtigen Stellenwert. Nebst der medikamentösen Unterstützung bleibt eine begleitende Beratung elementarer Bestandteil zum Erreichen einer erfolgreichen Nikotinabstinenz.