Summary
The selective inhibitor of sinus node If current ivabradine: a new therapeutic approach to ischaemic heart disease
Coronary artery diseases remain the major cause of morbidity and mortality, and affect public health of industrialised countries. Chronic elevated heart rate is a predictive factor for mortality in patients with coronary disease but also in the general population. It is not known whether reduction of heart rate per se can improve outcome of patients with coronary disease. After acute myocardial infarction, several studies with betablockers suggest that a reduced heart rate might be beneficial. However, beta-blockers may be contraindicated in some patients or poorly tolerated. Similarly, lowering heart rate with amiodarone or calcium antagonists is associated with modest event-rate reduction and only in selected patients. The new selective inhibitor of the sinus node If current, ivabradine, looks promising in terms of reducing myocardial ischaemia. The exclusive reduction of heart rate provides comparable efficacy to existing treatments. Ivabradine is very well tolerated and is licensed in Switzerland and Europe for use in stable angina.
Key words: cardiopathy; heart frequency; ivabradine
Introduction
Le rythme cardiaque sinusal «normal» se situe entre 60 et 100 battements par minute (bpm). De nombreuses évidences cliniques démontrent qu’une élévation de la fréquence cardiaque (FC) au repos est associée à un plus grand risque d’événements cardiovasculaires et à une plus forte mortalité [1, 2]. Les événements cardiovasculaires augmentent lorsque la fréquence cardiaque est supérieure à 70 bpm. Une ré-cente méta-analyse de plusieurs études randomisées a permis de confirmer ce concept [3]. L’une des premières études à avoir démontré qu’une fréquence cardiaque élevée est de mauvais pronostic est la British Regional Heart Study [4]. L’étude a inclus 8000 hommes âgés de 40 à 59 ans, en prévention primaire et secondaire, avec un suivi prospectif pendant huit ans. En prévention primaire, il a été noté une forte corrélation positive entre la fréquence cardiaque au repos et la survenue d’événements ischémiques (fatals et non-fatals), et ceci indépendamment de la pré-sence de facteurs de risque cardiovasculaire tels que la tension artérielle ou une hypercholestérolémie. Les risques cardiovasculaires étaient particulièrement élevés chez les individus dont la FC était ≥90 bpm, avec un risque de mort subite cinq fois plus élevé que chez les individus dont la FC était <60 bpm. Cette association entre FC élevée et événements cardiovasculaires ischémiques a également été retrouvée en prévention secondaire, mais avec un effet moins important. Des résultats similaires ont été retrouvés dans une étude allemande [5], avec une association FC/événements ischémiques moins marquée pour les femmes. De façon intéressante, les habitants de l’ancienne République Démocratique Allemande ont une FC supérieure d’environ 3–5 bpm ce qui pourrait expliquer en partie la différence d’espérance de vie entre les deux parties du pays. Toujours dans cette étude, il n’a pas été montré de relation significative entre une élévation de la FC et la survenue d’un cancer.

Une étude plus récente a été menée à Paris auprès de 5713 hommes actifs asymptomatiques, sans maladie cardiovasculaire décelable avec un suivi par tests d’effort progressif standards sur une période de 23 ans [6]. Les résultats ont démontré que le risque de mort subite et d’infarctus aigu du myocarde était augmenté chez les individus dont la FC était >75 bpm au repos (risque relatif 3,92), ainsi que si l’augmentation de la FC induite par l’effort était <89 bpm pendant l’exercice (risque relatif 6,18), et lorsque la diminution de FC à l’arrêt de l’effort était <25 bpm (risque relatif 2,20) (fig. 1). Ces données sont fondamentales car elles dé-montrent l’importance non seulement de la FC de base, mais aussi des variations anormales de la FC pendant l’exercice (mauvaise adaptation chronotropique) et immédiatement après l’exercice chez des hommes en prévention primaire. Toutes ces données cliniques suggèrent qu’une tachycardie au repos est un facteur prédictif puissant et indépendant de morbi-mortalité cardiovasculaire, et plaident fortement pour une meilleure considération de la fré-quence cardiaque dans les différents schémas d’évaluation du risque cardiovasculaire [7].
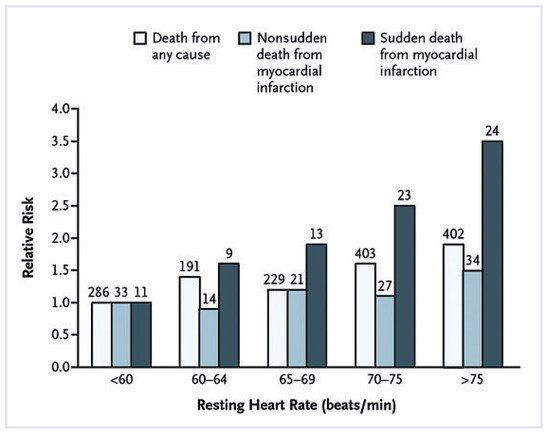
Figure 1.
Risques relatifs de mortalité toute cause et de mort subite et non subite par infarctus du myocarde selon les quintiles de la fréquence cardiaque au repos. Le quintile le plus bas (groupe de référence) était composé d’individus dont la fréquence cardiaque au repos était <60 bpm (d’après [6]).
Fréquence Cardiaque et Risque Cardiovasculaire
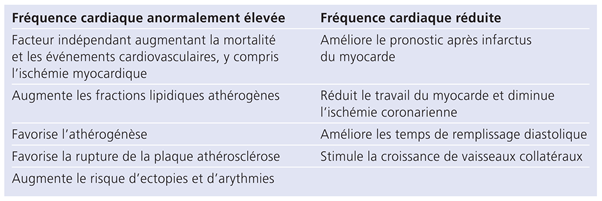
Comment une élévation de la FC peut influencer le risque de maladie cardiovasculaire? Plusieurs hypothèses ont été proposées (tab. 1). Une tachycardie augmente les besoins et la consommation myocardiques d’oxygène (MVO2), augmentant ainsi la charge cardiaque, en même temps qu’elle réduit la perfusion myocardique (en abrégeant la diastole). Ceci peut favoriser une ischémie myocardique et accroître le risque d’infarctus aigu du myocarde. La majorité des ischémies cardiaques mise en évidence lors d’examens d’enregistrement de 24 heures (Holter) sont associées à des élé-vations de la FC. Dans des modèles animaux, il a bien été démontré qu’une élévation de la fréquence cardiaque favorise le développement de l’athérogénèse et que ceci peut être ralenti par une réduction de la FC. Les forces hémodynamiques jouent certainement un rôle crucial dans la pathogénèse de la rupture de plaque d’athérosclérose. Des études angiographiques menées chez l’homme ont montré qu’une augmentation de la masse musculaire du ventricule gauche et une élévation de la fréquence cardiaque étaient associées à une plus haute incidence de rupture de plaques dans les artères coronaires [8]. D’autre part, il a été démontré récemment chez des individus d’âge moyen en bonne santé qu’une augmentation et une variabilité ré-duite de la FC sont associées à une élévation du taux sanguin de protéine C-réactive (CRP) et du nombre de leucocytes circulants [9]. Cette inflammation subclinique, couplée à un déséquilibre neurovégétatif, augmente certainement le risque de rupture de plaques athéroscléreuses et donc d’événements cardiovasculaires. Pour terminer, certaines études cliniques ont dé-montré une association positive entre la FC moyenne et le développement de contractions ventriculaires pré-maturées (extrasystoles), caractérisé par une augmentation des épisodes de tachycardie. La tachycardie est associée à une hausse de l’activité sympathique, susceptible de réduire le seuil de fibrillation ventriculaire.

Tableau 1.
Effets indésirables d’une fréquence cardiaque élevée et effets bénéfiques d’une réduction de la fréquence cardiaque.
Médicaments Ralentissant la Fréquence Cardiaque
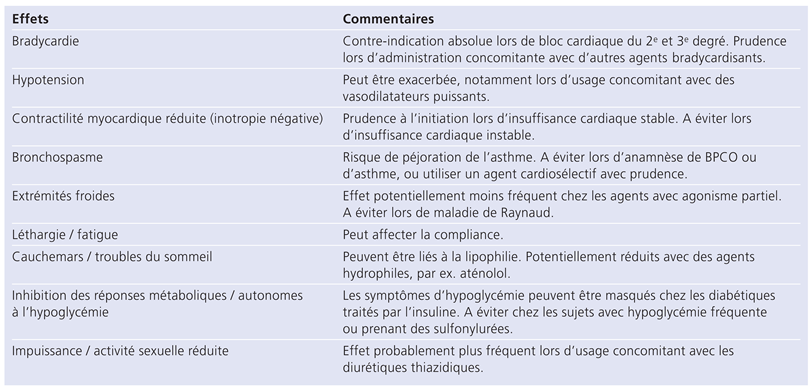
Puisqu’une tachycardie au repos augmente certainement le risque cardiovasculaire, il semble fort probable qu’un ralentissement de cette tachycardie aurait des effets bénéfiques. Chez des patients connus pour une coronaropathie sévère, une bradycardie est associée à la croissance de vaisseaux collatéraux [10]. Les médicaments avec un effet bradycardisant pourraient ainsi jouer un rôle en favorisant la croissance de vaisseaux collatéraux chez les patients avec athérosclérose coronarienne. Par ailleurs, les médicaments qui ralentissent la FC peuvent aussi réduire l’ischémie myocardique et ainsi les événements cardiovasculaires. Ceci a notamment été bien démontré pour les bêtabloquants chez les patients après un infarctus aigu du myocarde. Une méta-analyse de 11 études prospectives en double aveugle testant l’efficacité des bêtabloquants chez des patients après un infarctus a montré que, indépendamment du bêtabloquant utilisé, la diminution de la FC était directement corrélée à une diminution de la mortalité. Plus la FC était abaissée, plus grandes étaient les chances de survies [3,11]. En diminuant la FC et en abaissant la tension artérielle, les bêtabloquants réduisent les besoins d’oxygène du myocarde et augmentent le débit sanguin coronaire vers les régions ischémiques. Cependant, le ralentissement de la fréquence cardiaque obtenue avec les bêtabloquants ne permet pas de tirer tout le bénéfice qui pourrait être espéré par l’allongement de la durée de la diastole, et ceci en raison de l’action lusitrope négative des bêtabloquants. Pour terminer, environ 20% des patients ne répondent pas aux bêtabloquants ou sont intolérants (broncho-pneumopathie chronique obstructive, facteurs de risque coexistants) (tab. 2), de sorte que d’autres traitements bradycardisants doivent être utilisés chez ces patients [12].

Tableau 2.
Effets susceptibles de limiter ou de contre-indiquer l’utilisation des bêtabloquants (d’après [12]).
Les antagonistes du calcium qui ralentissent la FC, tels que le diltiazem et le vérapamil, sont des options possibles. Cependant, certaines études cliniques ont dé-montré que ces médicaments pouvaient augmenter l’incidence d’événements cardiovasculaires chez des patients souffrant d’insuffisance cardiaque et, à l’instar des bêtabloquants, les antagonistes du calcium sont également mal tolérés par certains patients. Un autre choix récemment disponible est l’ivabradine, un nouvel inhibiteur sélectif du courant ionique If, un courant «pacemaker» primaire du nœud sino-auriculaire.
Le courant «Pacemaker» If
La FC est contrôlée par le nœud sinusal, siège de l’activité «pacemaker» du myocarde. Des petits courants ioniques qui contrôlent le nœud sino-auriculaire, l’un des plus importants est le courant entrant If qui est activé par hyperpolarisation à partir d’un seuil d’environ –50 mV (il est pleinement activé vers –110 mV) et contribue ainsi à la dépolarisation diastolique (fig. 2). Le courant If joue un rôle-clé dans la régulation de la fréquence cardiaque. Les canaux f contrôlent la FC en participant à la génération de l’activité spontanée des cellules «pacemaker». Par conséquent, toute substance qui agit sur le courant If a un effet sur la FC: les médicaments qui inhibent le courant entrant If ralentissent la FC [13].
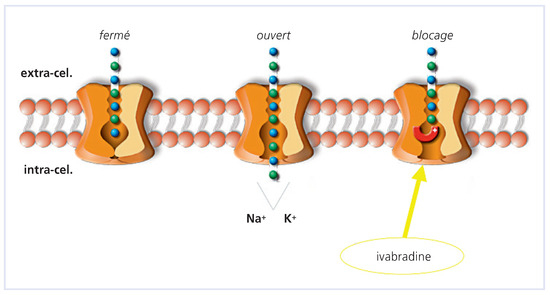
Figure 2.
Le courant If est un déterminant majeur de la pente de dépolarisation diastolique qui contrôle la fréquence des potentiels d’action et, de ce fait, la fréquence cardiaque. L’inhibition sélective du courant If par l’ivabradine permet une réduction exclusive de la fréquence cardiaque.
Mode D’action et Profil Clinique de L’ivabradine
L’ivabradine inhibe sélectivement le courant entrant If et diminue ainsi la pente de dépolarisation diastolique entre deux battements cardiaques (fig. 2), ce qui aboutit à un ralentissement de la FC. Cette action est très spécifique et a pour seul résultat une réduction de la FC sans les conséquences inotropes négatives d’autres médicaments bradycardisants tels que les bêtabloquants, et sans influence sur la tension artérielle [14] contrairement aux antagonistes du calcium et bêtabloquants. Les effets cardiaques de l’ivabradine sont spé-cifiques au nœud sinusal et n’ont aucun effet sur les temps de conduction intra-auriculaire, auriculo-ventriculaire ou intraventriculaire. Son action de ralentissement de la FC a pour effet de diminuer les besoins et la consommation d’oxygène du myocarde et permet ainsi d’augmenter la quantité d’oxygène disponible dans les tissus. Contrairement aux bêtabloquants (même cardiosélectifs), l’ivabradine n’induit pas de vasoconstriction coronaire à l’effort [15]. L’absence d’effet inotrope négatif se traduit par un maintien de la capacité du débit cardiaque à l’effort [16]. Il a également été dé-montré un effet bénéfique sur la fonction systolique avec diminution de la contraction post-systolique [17]. En résumé, l’ivabradine diminue la FC tout en permettant une augmentation des apports en oxygène, une meilleure adaptation à l’effort, et ceci sans répercussion sur la pression artérielle.
L’Agence européenne pour l’évaluation des médicaments (EMEA) a approuvé l’emploi de l’ivabradine pour le traitement symptomatique de l’angor chronique chez les patients ayant un rythme sinusal normal et présentant une contre-indication ou une intolérance aux bêtabloquants. Initialement lancé au RoyaumeUni début 2006, le médicament commence à être disponible sur d’autres marchés européens. Récemment, SwissMedic a également autorisé l’utilisation de l’ivabradine pour les mêmes indications médicales mentionnées ci-dessus. Plusieurs études cliniques ont montré que l’ivabradine réduisait efficacement la fréquence cardiaque avec une ampleur similaire au repos et à l’effort maximal, soit d’environ 10 à 15 bpm [18,19]. Ces effets sont obtenus dès 2 semaines de traitement et persistent à plus long terme, sans risque de bradycardie sévère ni d’arrêt sinusal. Par contre, l’ivabradine est contre-indiquée chez les patients souffrant de bradycardie (FC inférieure à 60 bpm), de bloc cardiaque ou d’autres arythmies, y compris la fibrillation auriculaire. D’autres contre-indications concernent l’hypotension artérielle sévère, l’insuffisance hépatique, l’angor instable, l’insuffisance cardiaque à un stade avancé, l’utilisation concomitante de médicaments produisant un allongement de l’intervalle QT, ainsi que des inhibiteurs ou inducteurs du cytochrome CYP3A4 (voir ci-dessous). La co-administration d’ivabradine et d’un antagoniste du calcium ralentissant la FC (diltiazem ou vérapamil) est déconseillée. Un arrêt brusque du traitement ne provoque pas de phénomène de rebond, contrairement aux bêtabloquants, et il n’a pas été observé d’échappement thérapeutique lors de l’utilisation prolongée d’ivabradine.
L’ivabradine est prise oralement deux fois par jour. Le médicament est éliminé avec une demi-vie plasmatique effective de 11 heures. L’ivabradine est rapidement et presque complètement absorbée après administration orale; à jeun, le pic de concentration plasmatique est atteint en 1 heure environ, si bien que le médicament est pris avec les repas dans le but de réduire la variabilité intraindividuelle. L’ivabradine est liée à raison d’environ 70% aux protéines plasmatiques; elle est fortement métabolisée par le foie et par l’intestin, par un processus oxydatif impliquant le cytochrome P 450 3A4 (CYP3A4). Les inhibiteurs du CYP3A4 tels que les antifongiques azolés ou les antibiotiques de la classe des macrolides (par ex. érythromycine) figurent au nombre des substances dont la coadministration avec l’ivabradine est contre-indiquée. L’exposition à l’ivabradine peut être doublée après coadministration avec du jus de grapefruit; on restreindra donc la consommation de jus de grapefruit pendant le traitement. Des inducteurs du CYP3A4 tels que la rifampicine et la phénytoïne, peuvent diminuer l’exposition à l’ivabradine et l’activité du médicament. L’ivabradine ne présente pas d’interaction cliniquement significative avec l’aspirine (ni avec d’autres antiplaquettaires), les statines, la warfarine, la digoxine, les inhibiteurs de la pompe à protons et les inhibiteurs de l’enzyme de conversion de l’angiotensine. L’ivabradine peut également être utilisée en association avec les antagonistes du calcium dérivés de la dihydropyridine, mais non avec le diltiazem ou le vérapamil. L’ivabradine est «neutre» du point de vue de ses effets sur le métabolisme et n’affecte pas les taux de lipides plasmatiques ni le métabolisme de glucose chez les patients diabétiques. L’ivabradine est disponible en deux dosages: 5,0 mg et 7,5 mg, et tous les deux doivent être pris deux fois par jour. Chez les patients >75 ans, il est recommandé de débuter le traitement par une dose initiale plus faible (2,5 mg d’ivabradine deux fois par jour) avant d’augmenter progressivement la posologie.
Etudes Cliniques Avec L’ivabradine
L’ivabradine a fait l’objet d’un vaste programme d’essais cliniques. L’ivabradine (2,5, 5,0 et 10 mg) et un placebo ont été comparés dans une étude incluant 360 patients souffrant d’angor stable et soumis à un test d’effort [18]. L’ivabradine a réduit la FC de manière dose-dépendante et a amélioré la tolérance à l’effort et le délai d’apparition d’une ischémie cardiaque par rapport au placebo. Les épisodes d’angine de poitrine et l’utilisation de dérivés nitrés d’action courte ont également été réduits sous traitement d’ivabradine.
L’étude INITIATIVE [20], menée pendant 4 mois, a été conçue pour vérifier la non-infériorité de l’efficacité anti-angoreuse et anti-ischémique de l’ivabradine par rapport à l’aténolol. Plus de 900 patients souffrant de cardiopathie coronarienne ont été randomisés dans trois groupes, et ont été investigués par tests d’effort. Dans les deux groupes ivabradine, la dose initiale de 5 mg deux fois par jour pendant 4 semaines a été augmentée ensuite à 7,5 mg ou à 10 mg deux fois par jour pendant 12 semaines supplémentaires. Dans le groupe aténolol, les patients ont reçu une dose de 50 mg 1 fois par jour pendant 4 semaines, dose qui a été augmentée à 100 mg par jour durant la période d’étude. Il convient de préciser que la dose maximale d’ivabradine recommandée en clinique est de 7,5 mg deux fois par jour.
L’étude a clairement démontré que l’ivabradine est au moins aussi efficace que l’aténolol sur tous les paramètres du test d’effort. L’ivabradine a nettement augmenté (environ 90 secondes par rapport à 78,8 secondes pour le groupe aténolol), la durée totale d’effort dans les deux groupes après un mois et quatre mois de traitement. De même, le délai de survenue d’un angor limitant, le délai d’apparition des symptômes d’angor et le délai d’apparition d’un sous-décalage de 1 mm du segment ST ont été significativement améliorés. Le nombre de crises d’angor a aussi été significativement réduit, tout comme la consommation de dérivés nitrés à courte durée d’action, et ce dans tous les groupes de traitement. Dans cette étude, l’ivabradine a été bien tolérée. Des symptômes visuels légers (voir ci-dessous) sont apparus plus souvent dans le groupe ivabradine, mais la plupart se sont résolus d’eux-mêmes pendant le traitement, et seuls cinq patients (trois dans le groupe ayant reçu la dose de 10 mg) ont abandonné l’étude à cause de tels effets.
La prévalence de l’angor stable augmente avec l’âge; trois quarts des patients ont >65 ans. Une analyse plus poussée de l’étude INITIATIVE a confirmé que les bénéfices constatés de l’ivabradine étaient maintenus chez les personnes âgées, comme c’est le cas dans l’ensemble de la population étudiée, alors qu’ils tendaient à se perdre avec le traitement d’aténolol, quand bien même la non-infériorité statistique de l’ivabradine par rapport à l’aténolol est restée dans les limites d’équivalence.
Par ailleurs, une autre étude clinique a montré pour l’ivabradine une efficacité anti-angineuse et antiischémique équivalente à celle de l’amlodipine [21]. D’autres études ont examiné plus spécifiquement les effets de l’ivabradine sur la fonction myocardique. Ces investigations ont permis de confirmer que l’ivabradine préservait la répolarisation ventriculaire, la contractilité myocardique et la conduction auriculo-ventriculaire [22,23]. Une diminution de la variabilité de la FC est un marqueur sensible de mauvais pronostic. Une étude contrôlée en double aveugle sur trois mois [24] chez 319 patients souffrant d’angine chronique stable et surveillés par ECG Holter a montré que, par rapport à l’amlodipine, l’ivabradine augmente significativement la variabilité de la FC. Des études à plus large échelle sont nécessaires afin de confirmer que ce béné-fice se traduit par une diminution des événements cardiovasculaires. De la même manière, comparée à l’até-nolol, la durée de remplissage diastolique est significativement augmentée (19%) avec l’ivabradine [25].
La réduction de la fonction ventriculaire gauche est un autre marqueur sensible de mauvais pronostic. Plusieurs études cliniques ont démontré les effets béné-fiques d’une réduction de la FC par un traitement bê-tabloquant chez les patients souffrants d’insuffisance cardiaque [26]. Des études d’observation suggèrent que seule une minorité de patients insuffisants cardiaques reçoivent un traitement bêtabloquant, et ceci principalement en raison d’intolérances médicamenteuses. Ainsi, l’inhibition des canaux f pourrait constituer une alternative thérapeutique prometteuse chez ces patients. Dans un modèle d’insuffisance cardiaque congestive chez le rat, Mulder et al. [27] ont montrés que la réduction de la FC à long terme par un traitement d’ivabradine améliore la fonction ventriculaire gauche et augmente le volume d’éjection, tout en pré-servant le débit cardiaque. Actuellement, l’ivabradine n’est autorisée en Suisse et en Europe que pour le traitement de l’angor, et son utilisation est contre-indiquée chez les patients souffrant d’une insuffisance cardiaque de classe fonctionnelle NYHA III et IV.
Lors du récent congrès de l’European Society of Cardiology (Munich 30 août au 3 septembre 2008), les résultats de l’étude BEAUTIFUL (morBidity-mortality EvAlUaTion of the IF inhibitor ivabradine in patients with CAD and left ventricULar dysfunction) ont été présentés et publié le jour même dans le Lancet [28]. L’étude a porté sur 10917 patients, inclus dans 781 centres, à travers 33 pays dans le monde. Les patients inclus avaient une maladie coronaire documentée, un âge moyen de 65 ans, une fraction d’éjection moyenne de 32% et une fréquence cardiaque moyenne de 71 bpm. Dans la population globale, il n’a pas été noté de ré-duction du critère primaire de jugement (décès cardiovasculaires, hospitalisations pour infarctus aigu et hospitalisations pour insuffisance cardiaque) sous ivabradine versus placebo. Cependant, des résultats très encourageants pour l’ivabradine ont été notés chez les patients ayant une fréquence cardiaque supérieure à 70 bpm, avec notamment une réduction de 36% (p = 0,001) des infarctus du myocarde fatals ou non et une réduction des revascularisations coronaires de 30% (p = 0,016). Ces résultats sont encourageants car c’est la première fois qu’on montre une diminution des évé-nements coronaires sous ivabradine chez des patients recevant le traitement médical recommandé. En effet il est important de noter que ces patients recevaient l’ensemble des traitements ayant démontré une diminution de la morbi-mortalité, notamment les antiagré-gants (94%), les IEC ou ARAII (91%), les bêtabloquants (87%) et les statines (76%).
Par ailleurs, cette étude a également confirmé le rôle pronostique de la fréquence cardiaque en comparant, chez les patients recevant un placebo, ceux ayant une fréquence cardiaque ≥70 bpm, à ceux ayant une fréquence inférieure à 70 bpm (fig. 3) [29]. Les patients avec une fréquence cardiaque ≥70 bpm ont, à deux ans de suivi, une augmentation de 34% de la mortalité cardiovasculaire (p = 0,0041), de 53% des hospitalisations pour insuffisance cardiaque (p <0,0001), et de 46% des hospitalisations pour infarctus du myocarde (p = 0,0066). Cette étude a également confirmé la bonne tolérance du traitement par ivabradine dans cette large population mondiale. Il n’a pas été décrit de différence entre les deux groupes pour les événements indésirables majeurs ayant nécessité un arrêt du traitement.
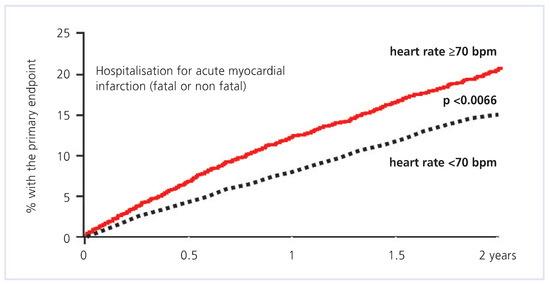
Figure 3.
Relation entre la fréquence cardiaque (> ou < que 70 bpm) et le pourcentage d’événements cardiovasculaires (mortalité cardiovasculaire, hospitalisation pour infarctus aigu du myocarde [fatal ou non-fatal], hospitalisation pour insuffisance cardiaque) dans le groupe de patients traités par placebo dans l’étude BEAUTIFUL (d’après [29]).
Tolérance et Effets Indésirables
Les données d’études cliniques sur l’ivabradine sont très abondantes et incluent quelque 10000 patients. Le médicament est généralement bien toléré. L’effet indé-sirable le plus fréquemment rapporté, qui touche environ 14% de patients, consiste en des troubles visuels transitoires de type phénomènes lumineux ou «phosphènes», avec des flashs brillants dans une zone limitée du champ visuel, le plus souvent déclenchés par des variations subites de l’intensité lumineuse. Ceci est dû à l’effet de l’ivabradine sur les canaux rétiniens h, similaires aux canaux f cardiaques. Dans la grande majorité des cas (80%), ces phénomènes disparaissent spontanément au cours du traitement. Ils sont toujours réversibles à l’arrêt du traitement et ne sont associés à aucun effet ophtalmologique durable. Moins de 1% des patients ont nécessité un arrêt du traitement en raison de troubles visuels. On peut noter que dans l’étude BEAUTIFUL qui a inclus 10 917 patients, 0,5% des patients du groupe ivabradine se sont plaints de tels symptômes visuels. D’autres effets indésirables incluent la bradycardie, qui touche environ 3% des patients.
Conclusion
Il semble de plus en plus évident qu’une fréquence élevée au repos est un facteur indépendant de risque cardiovasculaire, et qu’une réduction de la fréquence cardiaque est bénéfique. Il est par conséquent utile et fondamental de mesurer le pouls du patient lors de tout examen physique. Des études ayant testé un traitement de bêtabloquants chez des patients après un infarctus aigu du myocarde semblent indiquer que ce serait le cas. Cependant, les bêtabloquants sont parfois mal tolérés ou même contre-indiqués. De la même manière, les antagonistes du calcium qui abaissent la fréquence cardiaque sont associés à une modeste ré-duction de l’incidence d’événements, et chez certains patients seulement. La nouvelle classe d’inhibiteurs sé-lectifs du courant If sinusal semble prometteuse dans son efficacité à réduire l’ischémie myocardique, et l’ivabradine repré-sente ainsi une nouvelle option thé-rapeutique pour le nombre significatif de patients avec angor stable chez lesquels un traitement de bê-tabloquants est mal toléré ou contre-indiqué. Le mode d’action de l’ivabradine consiste à réduire exclusivement la fréquence cardiaque par inhibition sélective du courant If sinusal, ce qui permet de procurer une efficacité antiangineuse similaire à celle des traitements existants. L’ivabradine est bien tolérée et possède un profil acceptable d’effets indésirables. Développée initialement et autorisée actuellement pour le traitement de l’angor stable, l’ivabradine a certainement le potentiel d’être utilisée dans d’autres indications cardiaques dans le futur.
Il semble de plus en plus évident qu’une fréquence élevée au repos est un facteur indépendant de risque cardiovasculaire, et qu’une réduction de la fréquence cardiaque est bénéfique. Il est par conséquent utile et fondamental de mesurer le pouls du patient lors de tout examen physique. Des études ayant testé un traitement avec bêtabloquants chez des patients après un infarctus aigu du myocarde semblent indiquer que la ré-duction de la fréquence cardiaque en soi peut améliorer le pronostic cardiovasculaire. Cela a été également le cas avec l’ivabradine chez les patients coronariens avec dysfonction ventriculaire gauche et fréquence cardiaque ≥70 bpm.
References
- Cook, S.; Togni, M.; Schaub, M.C. , et al. High heart rate: a cardiovascular risk factor? Eur Heart J. 2006, 27, 2387–2393. [Google Scholar]
- Purcell, H. Is heart rate a prognostic factor for cardiovascular disease? Dialogues in Cardiovasc Med. 2001, 6, 32–36. [Google Scholar]
- Cucherat, M. Quantitative relationship between resting heart rate reduction and magnitude of clinical benefits in post-myocardial infarction: a meta-regression of randomized trials. Eur Heart J. 2007, 28, 3012–3019. [Google Scholar] [CrossRef]
- ShaperAG; Wannamethee, G. ; MacFarlane, P.W., et al. Heart rate, ischaemic heart disease, and sudden cardiac death in middle-aged British men. Heart. 1993, 70, 49–55. [Google Scholar] [CrossRef]
- Mensink, G.B.M.; Hoffmeister, H. The relationship between resting heart rate and all-cause, cardiovascular and cancer mortality. Eur Heart J. 1997, 18, 1404–1410. [Google Scholar] [CrossRef]
- Jouven, X.; Empana, J.P.; Schwartz, P.J. , et al. Heart-rate profile during exercise as a predictor of sudden death. New Engl J Med. 2005, 352, 1951–1958. [Google Scholar] [CrossRef]
- Fox, K. , et al. Resting heart rate in cardiovascular disease. J Am Coll Cardiol. 2007, 50, 823–830. [Google Scholar] [CrossRef] [PubMed]
- Heidland, U.E.; Strauer, B.E. Left ventricular muscle mass and elevated heart rate are associated with coronary plaque disruption. Circulation. 2001, 104, 1477–1482. [Google Scholar] [CrossRef]
- Sajadieh, A.; Nielsen, O.W.; Rasmussen, V. , et al. Increased heart rate and reduced heart-rate variability are associated with subclinical inflammation in middle-aged and elderly subjects with no apparent heart disease. Eur Heart J. 2004, 25, 363–370. [Google Scholar] [CrossRef]
- Patel, S.R.; Breall, J.A.; Diver, D.J. , et al. Bradycardia is associated with development of coronary collateral vessels in humans. Cor Art Dis. 2000, 11, 467–472. [Google Scholar] [CrossRef] [PubMed]
- Kjekshus, J.K. Importance of heart rate in determining beta-blocker efficacy in acute long-term myocardial intervention trials. Am J Cardiol. 1986, 57, 43–49F. [Google Scholar] [CrossRef] [PubMed]
- Purcell, H.; Fox, K. Selective and specific If inhibition: new perspectives. Medicographia. 2005, 27, 51–55. [Google Scholar]
- DiFrancesco, D.; Camm, J.A. Heart rate lowering by specific and selective If current inhibition with ivabradine. Drugs 2004, 64, 1757–1765. [Google Scholar] [CrossRef]
- Manz, M. A single intravenous dose of ivabradine, a novel If inhibitor, lowers heart rate but does not depress left ventricular function in patients with left ventricular dysfunction. Cardiology. 2003, 100, 149–155. [Google Scholar] [CrossRef]
- Monnet, X.; Colin, P.; Ghaleh, B.; Hittinger, L.; Giudicelli, J.F.; Berdeaux, A. Effects of heart rate reduction with ivabradine on exercise-induced myocardial ischemia and stunning. J Pharmacol Exp Ther. 2001, 299, 1133–1139. [Google Scholar] [CrossRef]
- Vilaine, J.P.; Bidouard, J.P.; Lesage, L.; Reure, H.; Péglion, J.L. Anti-ischemic effects of ivabradine, a selective heart rate-reducing agent, in exerciceinduced myocardial ischemia in pigs. J Cardiovasc Pharmacol. 2003, 42, 688–696. [Google Scholar] [CrossRef] [PubMed]
- Lucats, L.; Ghaleh, B.; Monnet, X.; Colin, P. ; BizeABerdeauxA. Conversion of post-systolic wall thickening into ejectional thickening by selective heart rate reducing during myocardial stunning. Eur Heart J. 2007, 28, 872–879. [Google Scholar] [CrossRef]
- Borer, J.S.; Fox, K.; Jaillon, P. , et al. Ivabradine Investigators Group. Antianginal and anti-ischemic effects of ivabradine an If inhibitor in stable angina: a randomized, double-blind, multicentered, placebo-controlled trial. Circulation. 2003, 107, 817–823. [Google Scholar] [CrossRef]
- Lopez-Bescos, L.; Filipova, S.; Martos, R. , et al. Long-term safety and antianginal efficacy of the If current inhibitor ivabradine in patients with chronic stable angina.Aone-year randomized double-blind multicentre trial. Eur Heart J. 2004, 25, 876. [Google Scholar]
- Tardif, J.C.; Ford, I.; Tendera, M. , et al. for the INITIATIVE Investigators. Efficacy of ivabradine, a new selective If inhibitor, compared with atenolol in patients with chronic stable angina. Eur Heart J. 2005, 26, 2529–2536. [Google Scholar] [CrossRef]
- Ruzyllo, W.; Ford, I.; Tendera, M. , et al. Antianginal and antiischemic effects of the If current inhibitor ivabradine compared to amlodipine as monotherapies in patients with chronic stable angina. A randomized controlled double-blind trial. Eur Heart J. 2004, 25, 878. [Google Scholar]
- Camm, A.J.; Lau, C. Electrophysiological effects of a single intravenous administration of ivabradine in adults with normal baseline electrophysiology. Drugs RD. 2003, 4, 83–89. [Google Scholar] [CrossRef]
- Savelieva, I.; Camm, A.J. Absence of direct effects of the If current blocker ivabradine on ventricular repolarisation: analysis based on a population heart rate correction formula. JAm Coll Cardiol. 2005.Abstract 1023–272.
- Camm, A.J.; Le Heuzey, J.Y.; Jern, S. Ivabradine significantly increases heart rate variability compared with amlodipine in patients with chronic stable angina: a 3-month randomized double-blind controlled study. , 2006. Presentation at World Congress of Cardiology, Barcelona; 2006. [Google Scholar]
- Colin PGhaleh, B.; Monnet, X. , et al, Contributions of heart rate and contractility to myocardial oxygen balance during exercise. Am J Physiol Heart Circ Physiol. 2003, 284, H676–H682. [Google Scholar] [CrossRef] [PubMed]
- Fonarow, G.C. A review of evidence-based beta-blockers in special populations with heart failure. Rev Cardiovasc Med. 2008, 9, 84–95. [Google Scholar] [PubMed]
- Mulder, P.; Barbier, S.; Chagraoul, A. , et al. Long-term heart rate reduction induced by the selective If current inhibitor ivabradine improves left ventricular function and intrinsic myocardial structure in congestive heart failure. Circulation. 2004, 109, 1674–1679. [Google Scholar] [CrossRef]
- Fox, K.; Ford, I.; Steg, P.G.; Tendera, M.; Ferrari, R.; BEAUTIFUL Investigators. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet. 2008, 372, 807–816. [Google Scholar] [CrossRef] [PubMed]
- Fox, K.; Ford, I.; Steg, P.G.; Tendera, M.; Robertson, M.; Ferrari, R.; BEAUTIFUL investigators. Heart rate as a prognostic risk factor in patients with coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a subgroup analysis of a randomised controlled trial. Lancet. 2008, 372, 817–821. [Google Scholar] [CrossRef]
© 2009 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.